Кремний, германий, олово, свинец.pptx
- Количество слайдов: 18

Кремний

«Свободный кремний можно получить прокаливанием с магнием мелкого белого песка, который представляет собой диоксид кремния: При этом образуется бурый порошок аморфного кремния. » В промышленности кремний технической чистоты получают, восстанавливая расплав Si. O 2 коксом при температуре около 1800 °C в рудотермических печах шахтного типа. Чистота полученного таким образом кремния может достигать 99, 9 % (основные примеси — углерод, металлы). Химические свойства. Для атомов кремния является характерным состояние sp 3 -гибридизации орбиталей. В связи с гибридизацией чистый кристаллический кремний образует алмазоподобную решётку, в которой кремний четырёхвалентен. В соединениях кремний обычно также проявляет себя как четырёхвалентный элемент со степенью окисления +4 или − 4. Встречаются двухвалентные соединения кремния, например, оксид кремния (II) Si. O. С водородом кремний непосредственно не реагирует, соединения кремния с водородом — силаны с общей формулой Sin. H 2 n+2 — получают косвенным путем. Моносилан Si. H 4 (его часто называют просто силаном) выделяется при взаимодействии силицидов металлов с растворами кислот, например: Ca 2 Si + 4 HCl → 2 Ca. Cl 2 + Si. H 4↑.

Применение в энергетике: 1. Для создания солнечный батарей. 2. Сверхчистый кремний преимущественно используется для производства одиночных электронных приборов (нелинейные пассивные элементы электрических схем) и однокристальных микросхем. Чистый кремний, отходы сверхчистого кремния, очищенный металлургический кремний в виде кристаллического кремния являются основным сырьевым материалом для солнечной энергетики. Монокристаллический кремний — помимо электроники и солнечной энергетики используется для изготовления зеркал газовых лазеров. Соединения металлов с кремнием — силициды — являются широко употребляемыми в промышленности (например, электронной и атомной) материалами с широким спектром полезных химических, электрических и ядерных свойств (устойчивость к окислению, нейтронам и др. ). Силициды ряда элементов являются важными термоэлектрическими материалами.

Германий

Германий встречается в виде примеси к полиметаллическим, никелевым, вольфрамовым рудам, а также в силикатах. В результате сложных и трудоёмких операций по обогащению руды и её концентрированию германий выделяют в виде оксида Ge. O 2, который восстанавливают водородом при 600 °C до простого вещества: Ge. O 2 + 2 H 2 = Ge + 2 H 2 O. В промышленного практике Германий получают преимущественно из побочных продуктов переработки руд цветных металлов (цинковой обманки, цинково-медно-свинцовых полиметаллических концентратов), содержащих 0, 0010, 1% Германия Химические свойства. В химические соединениях Германий обычно проявляет валентности 2 и 4, причем более стабильны соединения 4 -валентного Германия. При комнатной температуре Германий устойчив к действию воздуха, воды, растворам щелочей и разбавленных соляной и серной кислот, но легко растворяется в царской водке и в щелочном растворе перекиси водорода. Азотной кислотой медленно окисляется. При нагревании на воздухе до 500 -700°С Германий окисляется до оксидов Ge. O и Ge. O 2. Оксид Германия (IV) - белый порошок с tпл 1116°C; растворимость в воде 4, 3 г/л (20°С). По химическиv свойствам амфотерна, растворяется в щелочах и с трудом в минеральных кислотах. Получается прокаливанием гидратного осадка (Ge. O 3·n. H 2 O), выделяемого при гидролизе тетрахлорида Ge. Cl 4. Сплавлением Ge. O 2 с других оксидами могут быть получены производные германиевой кислоты - германаты металлов (Li 2 Ge. O 3, Na 2 Ge. O 3 и другие) - твердые вещества с высокими температурами плавления.

Применение в энергетике: 1. Германий используется в производстве полупроводниковых приборов: транзисторов и диодов. 2. Теллурид германия применяется как стабильный термоэлектрический материал и компонент термоэлектрических сплавов (термо. ЭДС 50 мк. В/К).

Олово

Концентраты, содержащие 50 -70% Олова, обжигают для удаления серы, очищают от железа действием НCl. Если же присутствуют примеси вольфрамита (Fe, Mn)WO 4 и шеелита Ca. WO 4, концентрат обрабатывают НCl; образовавшуюся WO 3·H 2 O извлекают с помощью NH 4 OH. Плавкой концентратов с углем в электрических или пламенных печах получают черновое Олово (94 -98% Sn), содержащее примеси Cu, Pb, Fe, As, Sb, Bi. При выпуске из печей черновое Олово фильтруют при температуре 500 -600 °С через кокс или центрифугируют, отделяя этим основную массу железа. Остаток Fe и Cu удаляют вмешиванием в жидкий металл элементарной серы; примеси всплывают в виде твердых сульфидов, которые снимают с поверхности Олова. От мышьяка и сурьмы Олово рафинируют аналогично - вмешиванием алюминия, от свинца - с помощью Sn. Cl 2. Иногда Bi и Рb испаряют в вакууме. Электролитическое рафинирование и зонную перекристаллизацию применяют сравнительно редко для получения особо чистого Олова. Около 50% всего производимого Олова составляет вторичный металл; его получают из отходов белой жести, лома и различных сплавов. Химические свойства. В соответствии с конфигурацией внешних электронов атома 5 s 25 р2 Олово имеет две степени окисления: +2 и +4; последняя более устойчива; соединения Sn (II) - сильные восстановители. Сухим и влажным воздухом при температуре до 100 °С Олово практически не окисляется: его предохраняет тонкая, прочная и плотная пленка Sn. O 2.

Холодная (0°С) разбавленная азотная кислота действует на Олово по реакции: 4 Sn + 10 HNO 3 = 4 Sn(NO 3)2 + NH 4 NO 3 + 3 H 2 O. При нагревании с концентрированной HNO 3 (плотность 1, 2 -1, 42 г/мл) Олово окисляется с образованием осадка метаоловянной кислоты H 2 Sn. O 3, степень гидротации которой переменна: 3 Sn + 4 HNO 3 + n H 2 O = 3 H 2 Sn. O 3·n. H 2 O + 4 NO. При нагревании Олова в концентрированных растворах щелочей выделяется водород и образуется гексагидростаниат: Sn + 2 KOH + 4 H 2 O = K 2[Sn(OH)6] + 2 H 2. Кислород воздуха пассивирует Олово, оставляя на его поверхности пленку Sn. O 2 Применение в энергетике: Олово применяется также в химических источниках тока в качестве анодного материала, например: марганцевооловянный элемент, окисно-ртутно-оловянный элемент. Перспективно использование олова в свинцово-оловянном аккумуляторе; так, например, при равном напряжении, по сравнению со свинцовым аккумулятором свинцовооловянный аккумулятор обладает в 2, 5 раза большей емкостью и в 5 раз большей энергоплотностью на единицу объёма, внутреннее сопротивление его значительно ниже.

Свинец

Сульфидные полиметаллические руды являются основным источником свинца. В них содержится от 1 до 5% этого металла. Процесс добычи начинается с концентрации руды до 40 – 75%, после чего ее обжигают, и происходит восстановление свинца коксом и оксидом углерода. Но в состав полученного свинца входит довольно большое количество примесей. Меди, сурьмы, мышьяка, алюминия, олова, висмута и даже золота и серебра содержится в нем от 3 до 7%. Требуются продолжительные и трудные операции, чтобы их удалить. Либо, если это выгодно с точки зрения экономики, происходит их выделение. При очищении свинца может быть использован метод электрохимического рафинирования. Водный раствор фторосиликата используется в качестве электролита. В результате чего свинец остается на катоде, а остальные примеси скапливаются в анодном шламе, из которого при необходимости их потом выделяют. Химические свойства. По химическим свойствам свинец – малоактивный металл: в электрохимическом ряду напряжений он стоит непосредственно перед водородом. Поэтому свинец легко вытесняется другими металлами из растворов его солей. Если опустить в подкисленный раствор ацетата свинца цинковую палочку, свинец выделяется на ней в виде пушистого налета из мелких кристалликов, имеющего старинного название «сатурнова дерева» . Наиболее типична для свинца степень окисления +2.

Разбавленной азотной кислотой свинец легко окисляется: Pb + 4 HNO 3 = Pb(NO 3)2 + 2 NO 2 + H 2 O Растворимость свинца в органических кислотах могло раньше приводить к отравлениям, если пищу готовили в посуде, луженной или паянной свинцовым припоем. Растворимые соли свинца (нитрат и ацетат) в воде гидролизуются: Pb(NO 3)2 + H 2 O = Pb(OH)NO 3 + HNO 3 Органические производные свинца – бесцветные очень ядовитые жидкости. Один из методов их синтеза – действие алкилгалогенидов на сплав свинца с натрием: 4 C 2 H 5 Cl + 4 Pb. Na = (C 2 H 5)4 Pb + 4 Na. Cl + 3 Pb Применение в энергетике. Фторид свинца самостоятельно, а также совместно с фторидом висмута, меди, серебра применяется в качестве катодного материала в химических источниках тока. Хлорид свинца Pb. Cl 2 в качестве катодного материала в резервных источниках тока.

Поли-N-винилпирролидон. Поли-N-винилпирролидон является наиболее известным представителем карбоцепных полимеров, имеющих поли-N-виниламидную структуру. Этот полимер занимает особое место среди большого круга водорастворимых полимеров разнообразного строения из-за широкого применения в различных областях науки, техники и медицины. Поли-N-винилпирролидон в водном растворе обладает высокой комплексообразующей способностью к молекулам самого различного происхождения. Этот полимер характеризуется весьма низкой токсичностью и биологической совместимостью. Классификация полимеров: К первому классу можно отнести весьма обширную группу карбоцепных полимеров. В них макромолекулы наделены своеобразным скелетом, который выстроен непосредственно из атомов углерода. Второй класс состоит из группы гетероцепных полимеров. Здесь макромолекулы, находящиеся в основной цепи, наряду с атомами углерода содержат и гетероатомы, такие как сера, азот, кислород. Третий класс полимеров включает в себя высокомолекулярные соединения, для которых характерна сопряженная система связей. Сюда относят полиацетилены, полиоксадиазолы, полифенилены, а также другие соединения. Состоят такие полимеры из самых различных элементов, способных образовывать координационные связи.
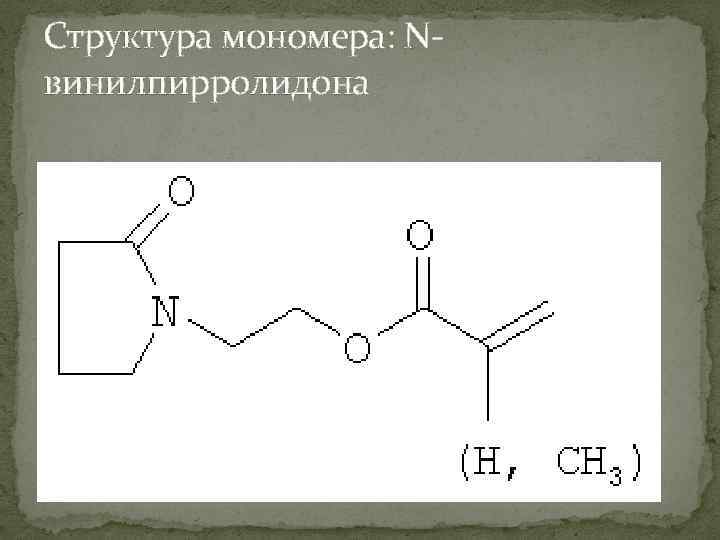
Структура мономера: Nвинилпирролидона

Области и условия эксплуатации. Поли-N-винилпирролидон нашел широкое применение в различных областях, в первую очередь в медицине, где он используется в качестве компонентов различных лекарственных систем, в частности, в качестве компонента кровезаменителей, носителя различных лекарственных веществ, компонента лекарственных форм, средства, способствующего криосохранности органов и тканей и т. д. Это определяется комплексом специфических свойств этого полимера, в частности, растворимостью в воде и широком круге органических растворителей, способностью к комплексованию с веществами различного химического строения, высоким уровнем биосовместимости. В то же время актуальной проблемой является расширение возможности применения поли-N-винилпирролидона за счет его модификации путем введения дополнительных функциональных групп. Одним из путей модификации является введение в него боковых аминокислотных фрагментов.
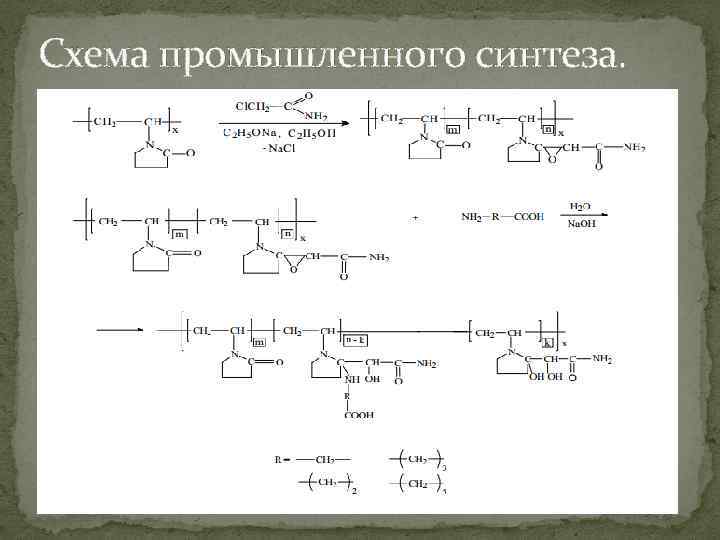
Схема промышленного синтеза.

ПОЛИМЕРАНАЛОГИЧНЫЕ ПРЕВРАЩЕНИЯ, хим. реакции функц. групп макромолекул или отдельных атомов основной цепи, в ходе которых длина и строение скелета цепи сохраняются, но изменяются состав и строение боковых групп. Реакц. способность функц. групп макромолекул в полимераналогичные превращения, в соответствии с допущением Флори, не зависит от длины цепи, с которой эта группа связана, и во многих случаях не отличается от реакц. способности соответствующих низко-мол. аналогов. Однако во многих полимераналогичные превращения длинноцепочечная природа реагента обусловливает ряд специфич. особенностей. Так, при полимераналогичные превращения в разб. растворах молекулы растворителя и низкомол. реагента могут неравномерно распределяться между макромол. клубками и остальной частью раствора вследствие избират. сорбции и сольватации. Такой клубок можно рассматривать как микрореактор, локальная концентрация реагента в котором существенно отличается от средней концентрации в растворе. В силу такого концентра ц. эффекта кинетич. Закономерности полимераналогичные превращения и такой же реакции низкомол. аналога будут различны. Стабилизация полимеров – это совокупность методов, которые позволяют подготовить полимерные материалы для длительного хранения или переработки.

Старение полимеров, необратимое изменение свойств полимеров под действием тепла, кислорода, солнечного света, озона, ионизирующих излучений и др. Термопластичность появляется из-за линейного строения молекул и слабого межмолекулярного взаимодействия. Множество термопластов смогут растворяться в соответствующих растворителях. Термореактивными называются материалы и вещества, переход которых из жидкого в твердое состояние необратим. Молекулярная структура при этом не претерпевает изменений, но линейные молекулы образуют целые пространственные сетки, и получаются гигантские макромолекулы.
Кремний, германий, олово, свинец.pptx