2011_inorg_medbiol_10.ppt
- Количество слайдов: 28
 Кремний ПОЛУПРОВОДНИК, МАТЕРИАЛ 20 ВЕКА Si. O 2 +2 C = 2 CO + Si (1900 o. C) Si. Cl 4 г + 2 H 2 г = Siтв. + 4 HClг Получение монокристаллического Si Метод Чохральского 99, 9999% 1
Кремний ПОЛУПРОВОДНИК, МАТЕРИАЛ 20 ВЕКА Si. O 2 +2 C = 2 CO + Si (1900 o. C) Si. Cl 4 г + 2 H 2 г = Siтв. + 4 HClг Получение монокристаллического Si Метод Чохральского 99, 9999% 1
 Кремний Аморфный кремний более реакционноспособен, чем кристаллический Si + O 2 = Si. O 2 (при Т) Si + 2 Cl 2 = Si. Cl 4 (при Т) Si + C = Si. C (2000 o. C) карбид кремния 2 Si + N 2 = 2 Si. N (+ Si 3 N 4) (2000 o. C) 3 Si + 4 HNO 3 + 18 HF = 3 H 2[Si. F 6] + 4 NO + 8 H 2 O Si + 2 KOH +H 2 O = K 2 Si. O 3 + 2 H 2 Si + Mg = Mg 2 Si (+Mgx. Siy) - силициды 2
Кремний Аморфный кремний более реакционноспособен, чем кристаллический Si + O 2 = Si. O 2 (при Т) Si + 2 Cl 2 = Si. Cl 4 (при Т) Si + C = Si. C (2000 o. C) карбид кремния 2 Si + N 2 = 2 Si. N (+ Si 3 N 4) (2000 o. C) 3 Si + 4 HNO 3 + 18 HF = 3 H 2[Si. F 6] + 4 NO + 8 H 2 O Si + 2 KOH +H 2 O = K 2 Si. O 3 + 2 H 2 Si + Mg = Mg 2 Si (+Mgx. Siy) - силициды 2
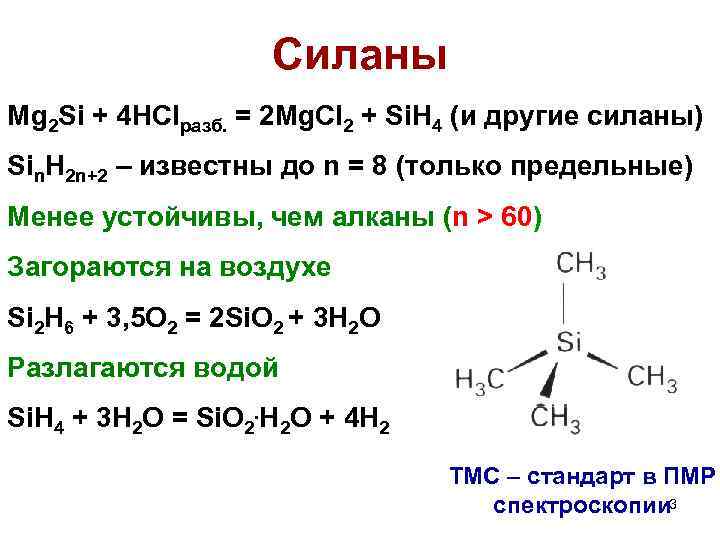 Cиланы Mg 2 Si + 4 HClразб. = 2 Mg. Cl 2 + Si. H 4 (и другие силаны) Sin. H 2 n+2 – известны до n = 8 (только предельные) Менее устойчивы, чем алканы (n > 60) Загораются на воздухе Si 2 H 6 + 3, 5 O 2 = 2 Si. O 2 + 3 H 2 O Разлагаются водой Si. H 4 + 3 H 2 O = Si. O 2. H 2 O + 4 H 2 ТМС – стандарт в ПМР спектроскопии 3
Cиланы Mg 2 Si + 4 HClразб. = 2 Mg. Cl 2 + Si. H 4 (и другие силаны) Sin. H 2 n+2 – известны до n = 8 (только предельные) Менее устойчивы, чем алканы (n > 60) Загораются на воздухе Si 2 H 6 + 3, 5 O 2 = 2 Si. O 2 + 3 H 2 O Разлагаются водой Si. H 4 + 3 H 2 O = Si. O 2. H 2 O + 4 H 2 ТМС – стандарт в ПМР спектроскопии 3
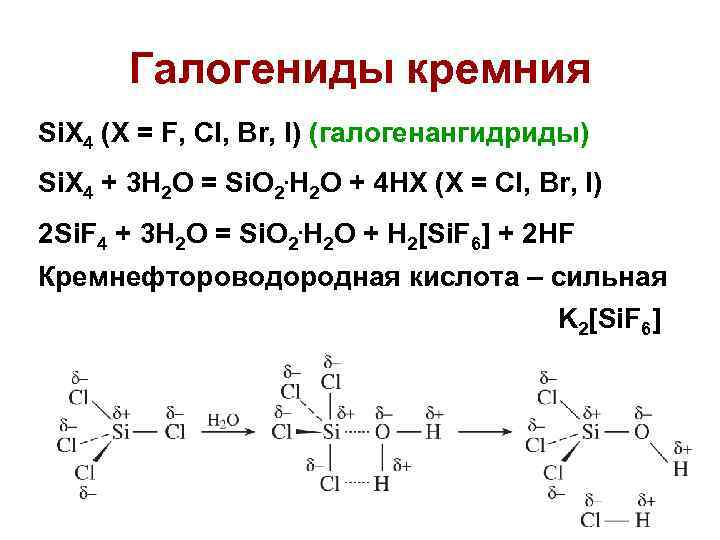 Галогениды кремния Si. X 4 (X = F, Cl, Br, I) (галогенангидриды) Si. X 4 + 3 H 2 O = Si. O 2. H 2 O + 4 HX (X = Cl, Br, I) 2 Si. F 4 + 3 H 2 O = Si. O 2. H 2 O + H 2[Si. F 6] + 2 HF Кремнефтороводородная кислота – сильная K 2[Si. F 6] 4
Галогениды кремния Si. X 4 (X = F, Cl, Br, I) (галогенангидриды) Si. X 4 + 3 H 2 O = Si. O 2. H 2 O + 4 HX (X = Cl, Br, I) 2 Si. F 4 + 3 H 2 O = Si. O 2. H 2 O + H 2[Si. F 6] + 2 HF Кремнефтороводородная кислота – сильная K 2[Si. F 6] 4
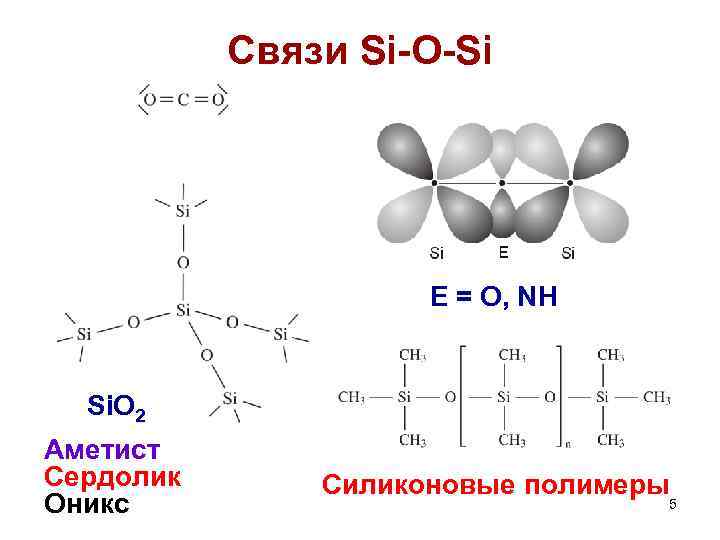 Связи Si-O-Si E = O, NH Si. O 2 Аметист Сердолик Оникс Cиликоновые полимеры 5
Связи Si-O-Si E = O, NH Si. O 2 Аметист Сердолик Оникс Cиликоновые полимеры 5
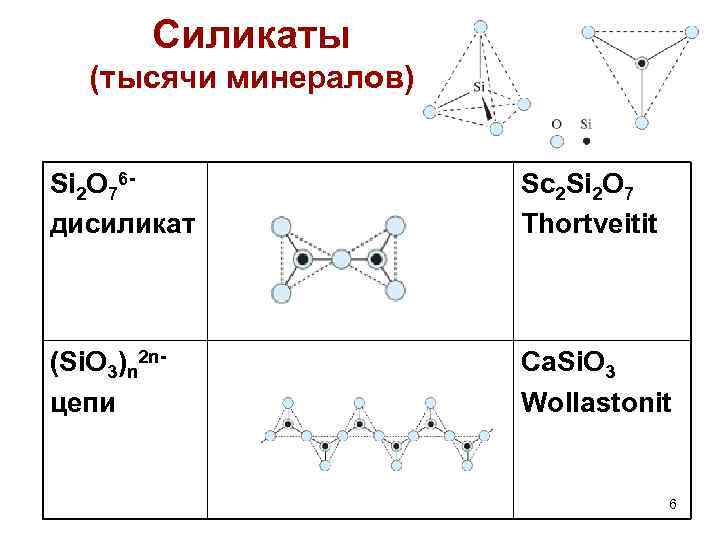 Силикаты (тысячи минералов) Si 2 O 76 дисиликат Sc 2 Si 2 O 7 Thortveitit (Si. O 3)n 2 nцепи Ca. Si. O 3 Wollastonit 6
Силикаты (тысячи минералов) Si 2 O 76 дисиликат Sc 2 Si 2 O 7 Thortveitit (Si. O 3)n 2 nцепи Ca. Si. O 3 Wollastonit 6
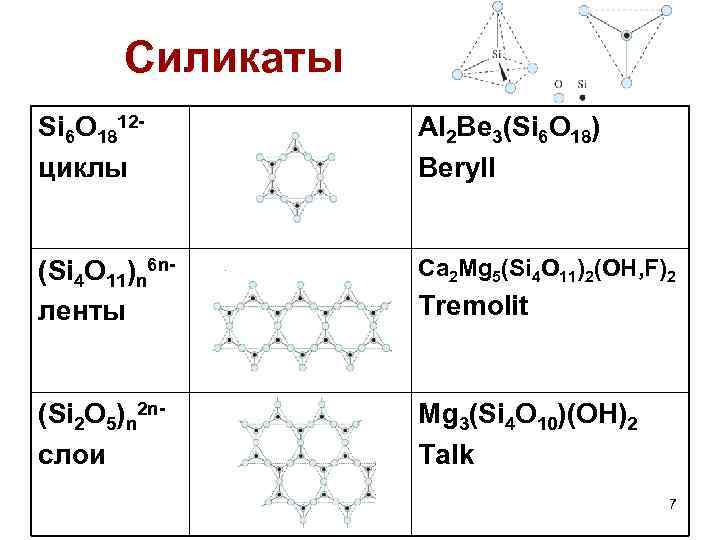 Силикаты Si 6 O 1812 циклы Al 2 Be 3(Si 6 O 18) Beryll (Si 4 O 11)n 6 nленты Ca 2 Mg 5(Si 4 O 11)2(OH, F)2 (Si 2 O 5)n 2 nслои Mg 3(Si 4 O 10)(OH)2 Talk Tremolit 7
Силикаты Si 6 O 1812 циклы Al 2 Be 3(Si 6 O 18) Beryll (Si 4 O 11)n 6 nленты Ca 2 Mg 5(Si 4 O 11)2(OH, F)2 (Si 2 O 5)n 2 nслои Mg 3(Si 4 O 10)(OH)2 Talk Tremolit 7
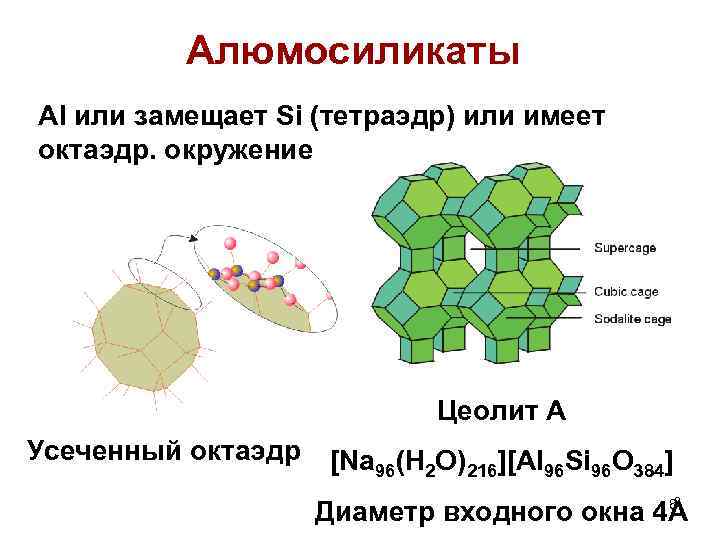 Алюмосиликаты Al или замещает Si (тетраэдр) или имеет октаэдр. окружение Цеолит А Усеченный октаэдр [Na 96(H 2 O)216][Al 96 Si 96 O 384] 8 Диаметр входного окна 4Å
Алюмосиликаты Al или замещает Si (тетраэдр) или имеет октаэдр. окружение Цеолит А Усеченный октаэдр [Na 96(H 2 O)216][Al 96 Si 96 O 384] 8 Диаметр входного окна 4Å
![Алюмосиликаты Цеолит Х [Na 58(H 2 O)240][Al 58 Si 134 O 384] Диаметр входного Алюмосиликаты Цеолит Х [Na 58(H 2 O)240][Al 58 Si 134 O 384] Диаметр входного](https://present5.com/presentation/181398164_157984003/image-9.jpg) Алюмосиликаты Цеолит Х [Na 58(H 2 O)240][Al 58 Si 134 O 384] Диаметр входного окна 8Å ПРИМЕНЕНИЕ 1) Ионный обмен 2) Разделение молекул 3) Катализ 4) Ship in the Bottle 9
Алюмосиликаты Цеолит Х [Na 58(H 2 O)240][Al 58 Si 134 O 384] Диаметр входного окна 8Å ПРИМЕНЕНИЕ 1) Ионный обмен 2) Разделение молекул 3) Катализ 4) Ship in the Bottle 9
 Si. O 2: 1)Н/р в воде, минеральных кислотах, растворах щелочей 2)Si. O 2 + 6 HF = H 2[Si. F 6] + 2 H 2 O 3)Si. O 2 + 2 Na. OHтв. = Na 2 Si. O 3 + H 2 O (сплавление) КРЕМНИЕВЫЕ К-ТЫ: мета H 2 Si. O 3, орто H 4 Si. O 4 Слабее угольной p. Ka 1 = 10, p. Ka 2 = 13 10
Si. O 2: 1)Н/р в воде, минеральных кислотах, растворах щелочей 2)Si. O 2 + 6 HF = H 2[Si. F 6] + 2 H 2 O 3)Si. O 2 + 2 Na. OHтв. = Na 2 Si. O 3 + H 2 O (сплавление) КРЕМНИЕВЫЕ К-ТЫ: мета H 2 Si. O 3, орто H 4 Si. O 4 Слабее угольной p. Ka 1 = 10, p. Ka 2 = 13 10
 Кремневые кислоты Получение: действие минеральных к-т на р -ры силикатов; гидролиз галогенидов. Na 2 Si. O 3 + HCl x. Si. O 2. y. H 2 O + Na. Cl (гель) Высушивание – силикагель (адсорбент) Соли: растворимые в воде - K 2 Si. O 3, Na 2 Si. O 3 (жидкое стекло, клей). нерастворимые в воде – ПРИРОДНЫЕ СИЛИКАТЫ. Гидролиз: Si. O 32 - + H 2 O = HSi. O 3 - + OHдисиликат -H 2 O Si 2 O 52 - 11
Кремневые кислоты Получение: действие минеральных к-т на р -ры силикатов; гидролиз галогенидов. Na 2 Si. O 3 + HCl x. Si. O 2. y. H 2 O + Na. Cl (гель) Высушивание – силикагель (адсорбент) Соли: растворимые в воде - K 2 Si. O 3, Na 2 Si. O 3 (жидкое стекло, клей). нерастворимые в воде – ПРИРОДНЫЕ СИЛИКАТЫ. Гидролиз: Si. O 32 - + H 2 O = HSi. O 3 - + OHдисиликат -H 2 O Si 2 O 52 - 11
 Ge, Sn, Pb Увеличение металлических свойств в в ряду Ge-Sn-Pb Простые вещества: 1)Ge – структура алмаза, по свойствам похож на Si, полупроводник 2)Sn - , , . Переход --- ускоряется при низкой Т ( «оловянная чума» ) 3)Pb – металл, кристалл. решетка кубическая гранецентрированная 12
Ge, Sn, Pb Увеличение металлических свойств в в ряду Ge-Sn-Pb Простые вещества: 1)Ge – структура алмаза, по свойствам похож на Si, полупроводник 2)Sn - , , . Переход --- ускоряется при низкой Т ( «оловянная чума» ) 3)Pb – металл, кристалл. решетка кубическая гранецентрированная 12
 Ge, Sn, Pb С кислотами неокислителями: Ge нет реакции. Sn + 2 HCl = Sn. Cl 2 + H 2 (Pb в HClконц) C кислотами окислителями: M + HNO 3 разб. = М(NO 3)2 + NO + H 2 O (M=Sn, Pb) M + 4 HNO 3 конц. = H 2 MO 3 +4 NO 2 + H 2 O (M = Ge, Sn ( x. Sn. O 2 y. H 2 O -оловянная кислота)) M + 4 H 2 SO 4 конц. = M(SO 4)2 + 2 SO 2 + 4 H 2 O (M = Ge, Sn) 13
Ge, Sn, Pb С кислотами неокислителями: Ge нет реакции. Sn + 2 HCl = Sn. Cl 2 + H 2 (Pb в HClконц) C кислотами окислителями: M + HNO 3 разб. = М(NO 3)2 + NO + H 2 O (M=Sn, Pb) M + 4 HNO 3 конц. = H 2 MO 3 +4 NO 2 + H 2 O (M = Ge, Sn ( x. Sn. O 2 y. H 2 O -оловянная кислота)) M + 4 H 2 SO 4 конц. = M(SO 4)2 + 2 SO 2 + 4 H 2 O (M = Ge, Sn) 13
 Ge, Sn, Pb Pb + 3 H 2 SO 4 конц. = Pb(HSO 4)2 + SO 2 + 2 H 2 O С щелочами: Ge – нет реакции, Sn + KOH + 2 H 2 O = K[Sn(OH)3] + H 2 в избытке щелочи K 4[Sn(OH)6] 14
Ge, Sn, Pb Pb + 3 H 2 SO 4 конц. = Pb(HSO 4)2 + SO 2 + 2 H 2 O С щелочами: Ge – нет реакции, Sn + KOH + 2 H 2 O = K[Sn(OH)3] + H 2 в избытке щелочи K 4[Sn(OH)6] 14
 Соединения Ge, Sn, Pb с H Mg 2 Ge +4 HCl = 2 Mg. Cl 2 + Ge. H 4 – герман Германоводороды Gen. H 2 n+2 (n< 10) Sn. Cl 4 + Li[Al. H 4] = Sn. H 4 + Li. Cl + Al. Cl 3 Pb. H 4 – плюмбан, крайне неустойчив, получают небольшие к-ва при действии HCl на сплав Pb и Mg. Тетраэтилсвинец Pb(C 2 H 5)4 – устойчив. Устойчивость ЭН 4 уменьшается в ряду C, Si, Ge, Sn, Pb ЭН 4 = Э + 2 Н 2 (при нагревании) 15
Соединения Ge, Sn, Pb с H Mg 2 Ge +4 HCl = 2 Mg. Cl 2 + Ge. H 4 – герман Германоводороды Gen. H 2 n+2 (n< 10) Sn. Cl 4 + Li[Al. H 4] = Sn. H 4 + Li. Cl + Al. Cl 3 Pb. H 4 – плюмбан, крайне неустойчив, получают небольшие к-ва при действии HCl на сплав Pb и Mg. Тетраэтилсвинец Pb(C 2 H 5)4 – устойчив. Устойчивость ЭН 4 уменьшается в ряду C, Si, Ge, Sn, Pb ЭН 4 = Э + 2 Н 2 (при нагревании) 15
 ЭО 2 (Э = Ge, Sn, Pb) Цвет Раств. в воде Свойства Ge. O 2 Белый Sn. O 2 Белый Слабо р. Н<7 нет Pb. O 2 Коричневый нет Амфотерный Не окислит. Амфотерный ОКИСЛИТЕЛЬ Ge. O 2 + 4 HCl конц. = Ge. Cl 4 + 2 H 2 O Ge. O 2 + 2 Na. OH р-р + 2 H 2 O =Na 2[Ge(OH)6] Ge. O 2 + 2 Na. OH расплав = Na 2 Ge. O 3 + H 2 O 16
ЭО 2 (Э = Ge, Sn, Pb) Цвет Раств. в воде Свойства Ge. O 2 Белый Sn. O 2 Белый Слабо р. Н<7 нет Pb. O 2 Коричневый нет Амфотерный Не окислит. Амфотерный ОКИСЛИТЕЛЬ Ge. O 2 + 4 HCl конц. = Ge. Cl 4 + 2 H 2 O Ge. O 2 + 2 Na. OH р-р + 2 H 2 O =Na 2[Ge(OH)6] Ge. O 2 + 2 Na. OH расплав = Na 2 Ge. O 3 + H 2 O 16
 Кислоты Э 4+ (Э = Ge, Sn) x. ЭО 2. y. H 2 O – неопределенный состав. Растворы Ge. O 2 в воде, очень слабая кислота p. Ka =10 Оловянные кислоты и - формы Sn 4+ + 4 NH 3 + 4 H 2 O = Sn(OH)4↓ +4 NH 4+ Sn. Cl 4 + 4 H 2 O = Sn(OH)4 ↓ + 4 HCl Sn + 4 HNO 3 конц = H 2 Sn. O 3↓ + 4 NO 2 + H 2 O 17
Кислоты Э 4+ (Э = Ge, Sn) x. ЭО 2. y. H 2 O – неопределенный состав. Растворы Ge. O 2 в воде, очень слабая кислота p. Ka =10 Оловянные кислоты и - формы Sn 4+ + 4 NH 3 + 4 H 2 O = Sn(OH)4↓ +4 NH 4+ Sn. Cl 4 + 4 H 2 O = Sn(OH)4 ↓ + 4 HCl Sn + 4 HNO 3 конц = H 2 Sn. O 3↓ + 4 NO 2 + H 2 O 17
 Оловянные кислоты x. Sn. О 2. y. H 2 O : y x, растворима в к-тах и щелочах : y < x, НЕ растворима в к-тах и щелочах Sn(OH)4 + 2 H 2 SO 4 разб. = Sn(SO 4)2 + 4 H 2 O Sn(OH)4 + 2 KOHр-р = K 2[Sn(OH)6] Старение оловянных кислот: ---> 18
Оловянные кислоты x. Sn. О 2. y. H 2 O : y x, растворима в к-тах и щелочах : y < x, НЕ растворима в к-тах и щелочах Sn(OH)4 + 2 H 2 SO 4 разб. = Sn(SO 4)2 + 4 H 2 O Sn(OH)4 + 2 KOHр-р = K 2[Sn(OH)6] Старение оловянных кислот: ---> 18
 Соединения Pb 4+ Pb(OAc)2 + Ca. OCl 2 + H 2 O = Pb. O 2↓+ Ca. Cl 2 + 2 HOAc Pb. O 2 + H 2 SO 4 конц. = Pb(SO 4)2 + 2 H 2 O (Гидролиз!) Сильный окислитель: Pb. O 2 + 4 HCl = Pb. Cl 2 + 2 H 2 O Плюмбаты: Pb. O 2 тв + Ca. O тв = Ca. Pb. O 3 (мета) Ca 2 Pb. O 4 (орто) В растворах [Pb(OH)6]2 - 19
Соединения Pb 4+ Pb(OAc)2 + Ca. OCl 2 + H 2 O = Pb. O 2↓+ Ca. Cl 2 + 2 HOAc Pb. O 2 + H 2 SO 4 конц. = Pb(SO 4)2 + 2 H 2 O (Гидролиз!) Сильный окислитель: Pb. O 2 + 4 HCl = Pb. Cl 2 + 2 H 2 O Плюмбаты: Pb. O 2 тв + Ca. O тв = Ca. Pb. O 3 (мета) Ca 2 Pb. O 4 (орто) В растворах [Pb(OH)6]2 - 19
 Соединения Pb 4+ Галогениды: только Pb. F 4 (крист. ), Pb. Cl 4 желтая жидкость [Pb. X 6]2 - - гексагалогеноплюмбаты (X =Cl, Br, I), K 2[Pb. Cl 6] устойчив до 200 о. С • Комплексообразование стабилизирует высшие степени окисления 20
Соединения Pb 4+ Галогениды: только Pb. F 4 (крист. ), Pb. Cl 4 желтая жидкость [Pb. X 6]2 - - гексагалогеноплюмбаты (X =Cl, Br, I), K 2[Pb. Cl 6] устойчив до 200 о. С • Комплексообразование стабилизирует высшие степени окисления 20
 Свинцовый сурик 6 Pb. O + O 2 = 2 Pb 3 O 4 (400 -500 o. C) – краснооранжевый Pb. II 2 Pb. IVO 4 2 Pb 3 O 4 = 6 Pb. O + O 2 (>500 o. C) желтый Pb 3 O 4 + 4 HNO 3 р-р = Pb. O 2↓ + 2 Pb(NO 3)2 + 2 H 2 O 21
Свинцовый сурик 6 Pb. O + O 2 = 2 Pb 3 O 4 (400 -500 o. C) – краснооранжевый Pb. II 2 Pb. IVO 4 2 Pb 3 O 4 = 6 Pb. O + O 2 (>500 o. C) желтый Pb 3 O 4 + 4 HNO 3 р-р = Pb. O 2↓ + 2 Pb(NO 3)2 + 2 H 2 O 21
 Соединения Э 2+ (Э = Ge, Sn, Pb) • Уменьшение восстановительных свойств в ряду Ge-Sn-Pb (для Э 2+) • Соединения Sn 2+ - удобные мягкие восстановители • ЭО и Э(ОН)2 – амфотерные, но с преобладанием основных свойств • Для ЭО и Э(ОН)2 основные св-ва в ряду Ge-Sn-Pb увеличиваются 22
Соединения Э 2+ (Э = Ge, Sn, Pb) • Уменьшение восстановительных свойств в ряду Ge-Sn-Pb (для Э 2+) • Соединения Sn 2+ - удобные мягкие восстановители • ЭО и Э(ОН)2 – амфотерные, но с преобладанием основных свойств • Для ЭО и Э(ОН)2 основные св-ва в ряду Ge-Sn-Pb увеличиваются 22
 Соединения Sn 2+ Sn(OH)2 = Sn. O + H 2 O (при Т) Сине-черный Sn(OH)2 + H 2 SO 4 = Sn. SO 4 + 2 H 2 O Sn(OH)2 + Na. OH = Na[Sn(OH)3], известны [Sn(OH)n](n-2)- n = 3 - 6 Диспропорционирование при нагревании 2 Na[Sn. II(OH)3] = Sn 0 + Na 2[Sn. IV(OH)6] 23
Соединения Sn 2+ Sn(OH)2 = Sn. O + H 2 O (при Т) Сине-черный Sn(OH)2 + H 2 SO 4 = Sn. SO 4 + 2 H 2 O Sn(OH)2 + Na. OH = Na[Sn(OH)3], известны [Sn(OH)n](n-2)- n = 3 - 6 Диспропорционирование при нагревании 2 Na[Sn. II(OH)3] = Sn 0 + Na 2[Sn. IV(OH)6] 23
 Соединения Sn 2+ Растворимые соли Sn. X 2: X = Cl, Br, J, NO 3, 1/2 SO 4 Гидролиз: Sn 2+ + H 2 O = Sn(OH)+ + H+ Комплексообразование: Sn. Cl 2 + Cl- = [Sn. Cl 3]Пирамидальное строение, донор эл. пары [Pt. Cl 3(Sn. Cl 3)]2 -, [Pt. Cl 2(Sn. Cl 3)2]2 - и другие 24
Соединения Sn 2+ Растворимые соли Sn. X 2: X = Cl, Br, J, NO 3, 1/2 SO 4 Гидролиз: Sn 2+ + H 2 O = Sn(OH)+ + H+ Комплексообразование: Sn. Cl 2 + Cl- = [Sn. Cl 3]Пирамидальное строение, донор эл. пары [Pt. Cl 3(Sn. Cl 3)]2 -, [Pt. Cl 2(Sn. Cl 3)2]2 - и другие 24
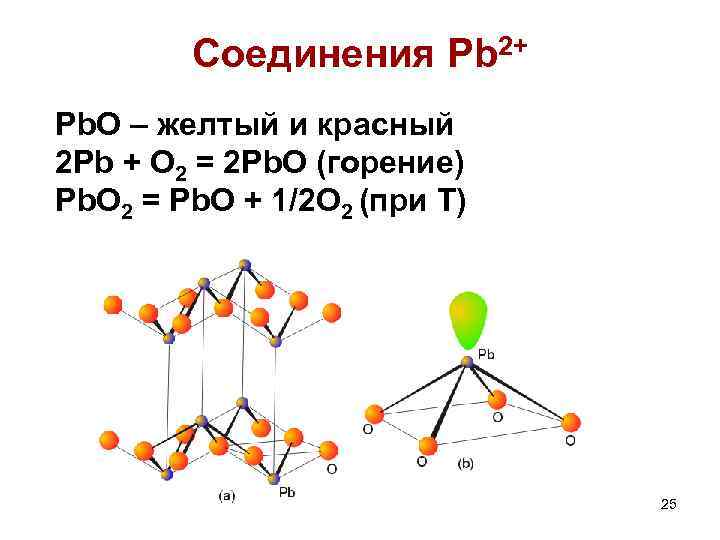 Соединения Pb 2+ Pb. O – желтый и красный 2 Pb + O 2 = 2 Pb. O (горение) Pb. O 2 = Pb. O + 1/2 O 2 (при Т) 25
Соединения Pb 2+ Pb. O – желтый и красный 2 Pb + O 2 = 2 Pb. O (горение) Pb. O 2 = Pb. O + 1/2 O 2 (при Т) 25
 Соединения Pb 2+ Pb. O + 2 Ac. OH = Pb(OAc)2 + H 2 O Pb(OH)2 + 2 HCl = Pb. Cl 2 + 2 H 2 O Pb(OH)2 + 2 Na. OH = Na 2[Pb(OH)4] Pb(NO 3)2, Pb(OAc)2 свинцовый сахар – растворимы в воде Не растворимые в воде соли Pb. X 2 (X = F-, Cl-, Br-, J-, 1/2 SO 42 - , 1/2 S 2 -, 1/2 СО 32 - ) 26
Соединения Pb 2+ Pb. O + 2 Ac. OH = Pb(OAc)2 + H 2 O Pb(OH)2 + 2 HCl = Pb. Cl 2 + 2 H 2 O Pb(OH)2 + 2 Na. OH = Na 2[Pb(OH)4] Pb(NO 3)2, Pb(OAc)2 свинцовый сахар – растворимы в воде Не растворимые в воде соли Pb. X 2 (X = F-, Cl-, Br-, J-, 1/2 SO 42 - , 1/2 S 2 -, 1/2 СО 32 - ) 26
 Примеры Ox-Red Sn 2+ - удобный мягкий восстановитель 2 Mn. O 4 - + 5 Sn 2+ + 16 H+ = 2 Mn 2+ +5 Sn 4+ + 8 H 2 O 2 Mn. O 4 - + [Sn(OH)3]- + 3 OH- = 2 Mn. O 42 - + [Sn(OH)6]2 Pb. O 2 сильный окислитель, особенно в кислой среде 5 Pb. O 2 + 2 Mn 2+ +4 H+ = 5 Pb 2+ + 2 Mn. O 4 - + 2 H 2 O 4 Pb. O 2 тв + H 2 S газ = Pb. SO 4 + 3 Pb. O + H 2 O (воспламенение) 27
Примеры Ox-Red Sn 2+ - удобный мягкий восстановитель 2 Mn. O 4 - + 5 Sn 2+ + 16 H+ = 2 Mn 2+ +5 Sn 4+ + 8 H 2 O 2 Mn. O 4 - + [Sn(OH)3]- + 3 OH- = 2 Mn. O 42 - + [Sn(OH)6]2 Pb. O 2 сильный окислитель, особенно в кислой среде 5 Pb. O 2 + 2 Mn 2+ +4 H+ = 5 Pb 2+ + 2 Mn. O 4 - + 2 H 2 O 4 Pb. O 2 тв + H 2 S газ = Pb. SO 4 + 3 Pb. O + H 2 O (воспламенение) 27
 Сульфиды и тиосоли Ge. S, Sn. S, Pb. S – не обладают кислотными св-вами и не реагируют с Na 2 S НО!!! ЭIIS + Na 2 S 2 = Na 2 ЭIVS 3 (Э = Ge, Sn) Ge. S 2, Sn. S 2 – обладают кислотными свойствами Sn. S 2 + Na 2 S = Na 2 Sn. S 3 тиостаннат Na 2 Sn. S 3 + 2 HCl = Sn. S 2↓ + H 2 S + 2 Na. Cl Pb. S 2 - дисульфид Pb. II(S 2) 28
Сульфиды и тиосоли Ge. S, Sn. S, Pb. S – не обладают кислотными св-вами и не реагируют с Na 2 S НО!!! ЭIIS + Na 2 S 2 = Na 2 ЭIVS 3 (Э = Ge, Sn) Ge. S 2, Sn. S 2 – обладают кислотными свойствами Sn. S 2 + Na 2 S = Na 2 Sn. S 3 тиостаннат Na 2 Sn. S 3 + 2 HCl = Sn. S 2↓ + H 2 S + 2 Na. Cl Pb. S 2 - дисульфид Pb. II(S 2) 28


