 Кремний и его соединения
Кремний и его соединения
 План 1. История открытия. 2. Положения в периодической таблице 3. Состав атома 4. Строение атомов 5. Окислительно-восстановительные свойства соединений кремния 6. Физические свойства и аллотропные видоизменения 7. Распространение в природе 8. Получение 9. Химические свойства 10. Применение 11. Соединения кремния
План 1. История открытия. 2. Положения в периодической таблице 3. Состав атома 4. Строение атомов 5. Окислительно-восстановительные свойства соединений кремния 6. Физические свойства и аллотропные видоизменения 7. Распространение в природе 8. Получение 9. Химические свойства 10. Применение 11. Соединения кремния
 Историческая справка. Соединения Кремния, широко распространенные на земле, были известны человеку с каменного века. Использование каменных орудий для труда и охоты продолжалось несколько тысячелетий. Применение соединений Кремния, связанное с их переработкой, - изготовление стекла - началось около 3000 лет до н. э. (в Древнем Египте). Раньше других известное соединение Кремния - оксид Si. O 2 (кремнезем). В 18 веке кремнезем считали простым телом и относили к "землям" (что и отражено в его названии). В чистом виде он был впервые выделен в 1811 году французскими учёными Жозефом Луи Гей-Люссаком и Луи Жаком Тенаром. Русское название «кремний» введено в 1834 году российским химиком Германом Ивановичем Гессом. В переводе c др. -греч. κρημνός — «утёс, гора» .
Историческая справка. Соединения Кремния, широко распространенные на земле, были известны человеку с каменного века. Использование каменных орудий для труда и охоты продолжалось несколько тысячелетий. Применение соединений Кремния, связанное с их переработкой, - изготовление стекла - началось около 3000 лет до н. э. (в Древнем Египте). Раньше других известное соединение Кремния - оксид Si. O 2 (кремнезем). В 18 веке кремнезем считали простым телом и относили к "землям" (что и отражено в его названии). В чистом виде он был впервые выделен в 1811 году французскими учёными Жозефом Луи Гей-Люссаком и Луи Жаком Тенаром. Русское название «кремний» введено в 1834 году российским химиком Германом Ивановичем Гессом. В переводе c др. -греч. κρημνός — «утёс, гора» .
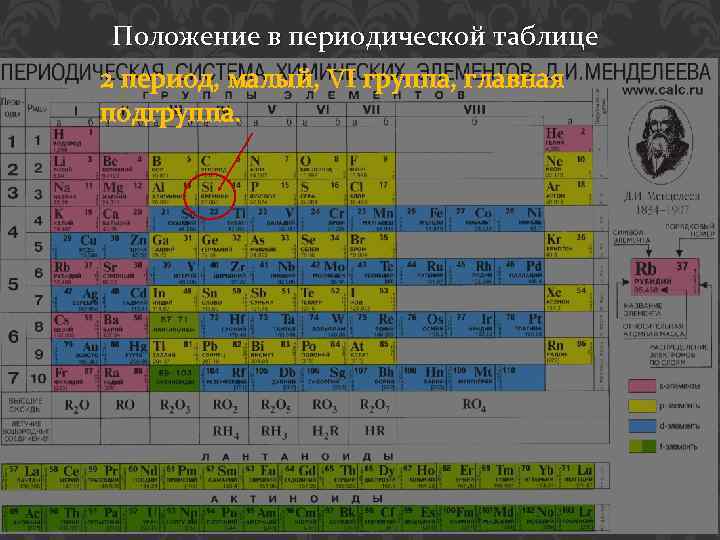 Положение в периодической таблице 2 период, малый, VI группа, главная подгруппа.
Положение в периодической таблице 2 период, малый, VI группа, главная подгруппа.
 Состав атома Кремний имеет атомный номер 14 и атомную массу 28. Количество электронов – 14, протонов – 14, нейронов – 14.
Состав атома Кремний имеет атомный номер 14 и атомную массу 28. Количество электронов – 14, протонов – 14, нейронов – 14.
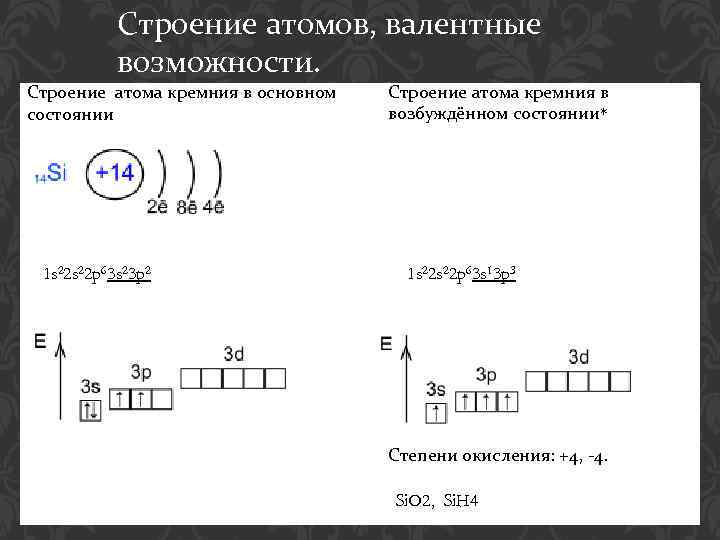 Строение атомов, валентные возможности. Строение атома кремния в основном состоянии 1 s 22 p 63 s 23 p 2 Строение атома кремния в возбуждённом состоянии* 1 s 22 p 63 s 13 p 3 Степени окисления: +4, -4. Si. O 2, Si. H 4
Строение атомов, валентные возможности. Строение атома кремния в основном состоянии 1 s 22 p 63 s 23 p 2 Строение атома кремния в возбуждённом состоянии* 1 s 22 p 63 s 13 p 3 Степени окисления: +4, -4. Si. O 2, Si. H 4
 Окислительно-восстановительные свойства соединений кремния Si 0 по отношению к металлам окислитель – Si-4 Si 0 по отношению к неметаллам восстановитель – Si+2, Si+4
Окислительно-восстановительные свойства соединений кремния Si 0 по отношению к металлам окислитель – Si-4 Si 0 по отношению к неметаллам восстановитель – Si+2, Si+4
 Физические свойства и аллотропные видоизменения
Физические свойства и аллотропные видоизменения
 – тёмно-серое вещество с металлическим блеском, большая твёрдость, хрупок, полупроводник; ρ = 2, 33 г/см 3, t°пл. =1415°C; t°кип. = 2680°C. Имеет алмазоподобную структуру и образует прочные ковалентные связи. Инертен. - бурый порошок, гигроскопичен, алмазоподобная структура, ρ = 2 г/см 3, более реакционноспособен.
– тёмно-серое вещество с металлическим блеском, большая твёрдость, хрупок, полупроводник; ρ = 2, 33 г/см 3, t°пл. =1415°C; t°кип. = 2680°C. Имеет алмазоподобную структуру и образует прочные ковалентные связи. Инертен. - бурый порошок, гигроскопичен, алмазоподобная структура, ρ = 2 г/см 3, более реакционноспособен.
 Распространение в природе В свободном состоянии не встречается. В связанном состоянии: По распространенности в земной коре Кремний - второй элемент, его среднее содержание в литосфере 29, 5%. В земной коре Кремний играет такую же первостепенную роль, как углерод в животном и растительном мире. Для геохимии Кремния важна исключительно прочная связь его с кислородом. Около 12% литосферы составляет кремнезем Si. O 2 в форме минерала кварца и его разновидностей. 75% литосферы слагают различные силикаты и алюмосиликаты (полевые шпаты, слюды, амфиболы и т. д. ). При высоких температурах и большом давлении растворимость Si. O 2 повышается. Возможна его миграция и с водяным паром, поэтому для пегматитов гидротермальных жил характерны значительные концентрации кварца, с которым нередко связаны и рудные элементы (золото-кварцевые, кварцевокасситеритовые и других жилы)
Распространение в природе В свободном состоянии не встречается. В связанном состоянии: По распространенности в земной коре Кремний - второй элемент, его среднее содержание в литосфере 29, 5%. В земной коре Кремний играет такую же первостепенную роль, как углерод в животном и растительном мире. Для геохимии Кремния важна исключительно прочная связь его с кислородом. Около 12% литосферы составляет кремнезем Si. O 2 в форме минерала кварца и его разновидностей. 75% литосферы слагают различные силикаты и алюмосиликаты (полевые шпаты, слюды, амфиболы и т. д. ). При высоких температурах и большом давлении растворимость Si. O 2 повышается. Возможна его миграция и с водяным паром, поэтому для пегматитов гидротермальных жил характерны значительные концентрации кварца, с которым нередко связаны и рудные элементы (золото-кварцевые, кварцевокасситеритовые и других жилы)
 Получение кремния Промышленность – нагревание угля с песком: 2 C + Si. O 2 t˚→ Si + 2 CO Лаборатория– нагревание песка с магнием: 2 Mg + Si. O 2 t˚→ Si + 2 Mg. O
Получение кремния Промышленность – нагревание угля с песком: 2 C + Si. O 2 t˚→ Si + 2 CO Лаборатория– нагревание песка с магнием: 2 Mg + Si. O 2 t˚→ Si + 2 Mg. O
 Химические свойства. Типичный неметалл, инертен. Как восстановитель: 1) С кислородом Si 0 + O 2 t˚→ Si+4 O 2 2) С фтором (без нагревания) Si 0 + 2 F 2 → Si. F 4 3) С углеродом Si 0 + C t˚→ Si+4 C (Si. C - карборунд - твёрдый; используется для точки и шлифовки) 4) С водородом не взаимодействует. Силан (Si. H 4) получают разложением силицидов металлов кислотой: Mg 2 Si + 2 H 2 SO 4 → Si. H 4 + 2 Mg. SO 4 5) С кислотами не реагирует (только с плавиковой кислотой Si+4 HF=Si. F 4+2 H 2) Растворяется только в смеси азотной и плавиковой кислот: 3 Si + 4 HNO 3 + 18 HF → 3 H 2[Si. F 6] + 4 NO + 8 HO 2 6) Со щелочами (при нагревании): Si 0 + 2 Na. OH + H 2 O t˚→ Na 2 Si+4 O 3+ 2 H 2 Как окислитель: 7) С металлами (образуются силициды): Si 0 + 2 Mg t˚→ Mg 2 Si-4
Химические свойства. Типичный неметалл, инертен. Как восстановитель: 1) С кислородом Si 0 + O 2 t˚→ Si+4 O 2 2) С фтором (без нагревания) Si 0 + 2 F 2 → Si. F 4 3) С углеродом Si 0 + C t˚→ Si+4 C (Si. C - карборунд - твёрдый; используется для точки и шлифовки) 4) С водородом не взаимодействует. Силан (Si. H 4) получают разложением силицидов металлов кислотой: Mg 2 Si + 2 H 2 SO 4 → Si. H 4 + 2 Mg. SO 4 5) С кислотами не реагирует (только с плавиковой кислотой Si+4 HF=Si. F 4+2 H 2) Растворяется только в смеси азотной и плавиковой кислот: 3 Si + 4 HNO 3 + 18 HF → 3 H 2[Si. F 6] + 4 NO + 8 HO 2 6) Со щелочами (при нагревании): Si 0 + 2 Na. OH + H 2 O t˚→ Na 2 Si+4 O 3+ 2 H 2 Как окислитель: 7) С металлами (образуются силициды): Si 0 + 2 Mg t˚→ Mg 2 Si-4
 Применение Кремний широко используется в электронике как полупроводник. Добавки кремния к сплавам повышают их коррозионную стойкость. Силикаты, алюмосиликаты и кремнезем – основное сырье для производства стекла и керамики, а также для строительной промышленности
Применение Кремний широко используется в электронике как полупроводник. Добавки кремния к сплавам повышают их коррозионную стойкость. Силикаты, алюмосиликаты и кремнезем – основное сырье для производства стекла и керамики, а также для строительной промышленности






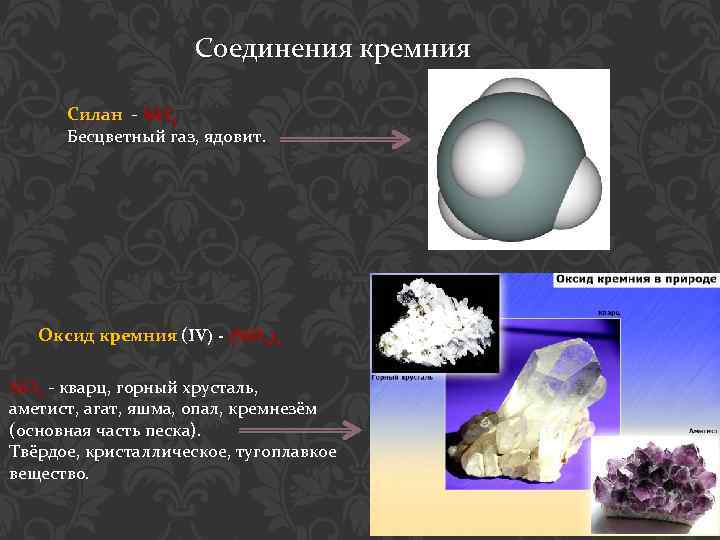 Соединения кремния Силан - Si. H 4 Бесцветный газ, ядовит. Оксид кремния (IV) - (Si. O 2)n Si. O 2 - кварц, горный хрусталь, аметист, агат, яшма, опал, кремнезём (основная часть песка). Твёрдое, кристаллическое, тугоплавкое вещество.
Соединения кремния Силан - Si. H 4 Бесцветный газ, ядовит. Оксид кремния (IV) - (Si. O 2)n Si. O 2 - кварц, горный хрусталь, аметист, агат, яшма, опал, кремнезём (основная часть песка). Твёрдое, кристаллическое, тугоплавкое вещество.



