краун-эфиры.ppt
- Количество слайдов: 11
 Краун-эфиры Выполнена: студенткой 4 курса 43 -й группы очного отделения Град Татьяной Проверена: канд. хим. наук, доцент кафедры химии и МПХ С. П. Шалыгин
Краун-эфиры Выполнена: студенткой 4 курса 43 -й группы очного отделения Град Татьяной Проверена: канд. хим. наук, доцент кафедры химии и МПХ С. П. Шалыгин
 Краун-эфиры (краун-соединения) — макрогетероциклические соединения, содержащие в своих циклах более 11 атомов, из которых не менее четырёх — гетероатомы, которые связаны между собой этиленовыми мостиками. Как правило, гетероатомом является атом кислорода. Если один или несколько атомов кислорода заменены атомами азота или серы, то соответствующие соединения называются соответственно азакраун- или тиакраун-эфирами. Если краун-эфиры конденсированы с бензольными или циклогексановыми кольцами, то они относятся к бензокраун- или циклогексанкраун-эфирам. Получены краун-эфиры, содержащие в цикле атомы P, Si, As, а также амидные, сложноэфирные и некоторые другие функциональные группы.
Краун-эфиры (краун-соединения) — макрогетероциклические соединения, содержащие в своих циклах более 11 атомов, из которых не менее четырёх — гетероатомы, которые связаны между собой этиленовыми мостиками. Как правило, гетероатомом является атом кислорода. Если один или несколько атомов кислорода заменены атомами азота или серы, то соответствующие соединения называются соответственно азакраун- или тиакраун-эфирами. Если краун-эфиры конденсированы с бензольными или циклогексановыми кольцами, то они относятся к бензокраун- или циклогексанкраун-эфирам. Получены краун-эфиры, содержащие в цикле атомы P, Si, As, а также амидные, сложноэфирные и некоторые другие функциональные группы.
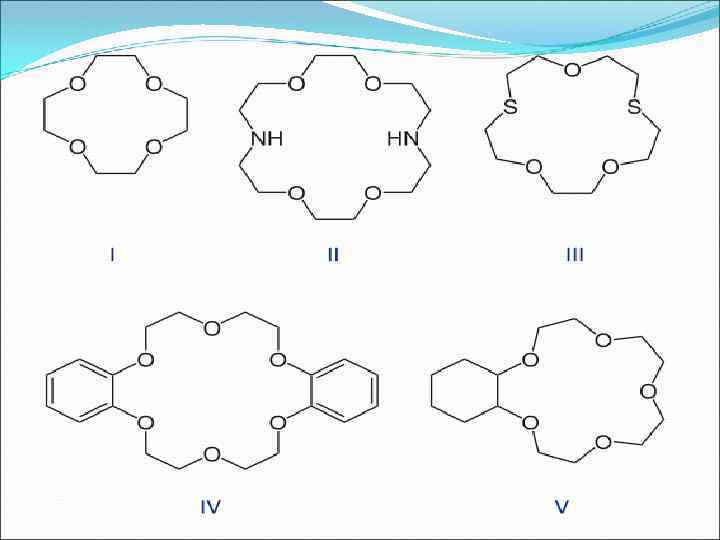
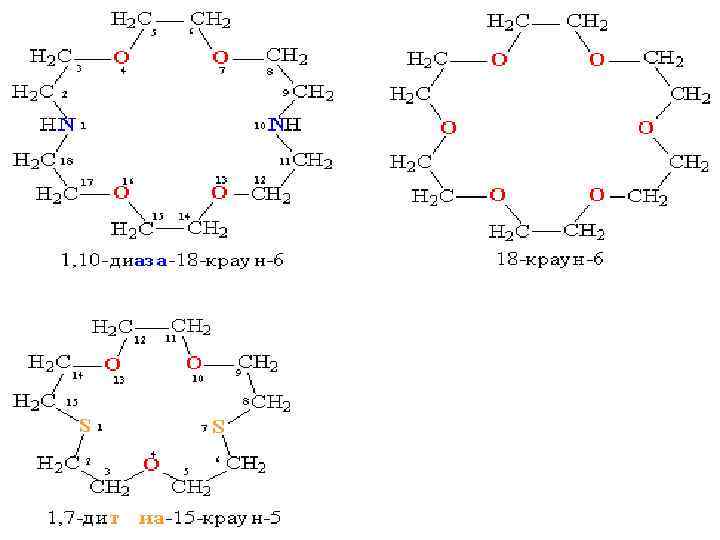
 Номенклатура В тривиальных названиях краун-эфиров общее число атомов в цикле и число гетероатомов обозначают цифрами, которые ставят перед и после слова «краун» . Согласно ИЮПАК краун-эфиры представляются как производные циклических углеводородов: формула I — 12 -краун-4; (1, 4, 7, 10 -тетраоксациклододекан) формула II — 1, 10 -диаза-18 -краун-6; (1, 4, 10, 13 -тетраокса 7, 16 -диазациклооктадекан) формула III — 1, 7 -дитиа-15 -краун-5 формула IV — дибензо-18 -краун-6 формула V — циклогексано-15 -краун-5
Номенклатура В тривиальных названиях краун-эфиров общее число атомов в цикле и число гетероатомов обозначают цифрами, которые ставят перед и после слова «краун» . Согласно ИЮПАК краун-эфиры представляются как производные циклических углеводородов: формула I — 12 -краун-4; (1, 4, 7, 10 -тетраоксациклододекан) формула II — 1, 10 -диаза-18 -краун-6; (1, 4, 10, 13 -тетраокса 7, 16 -диазациклооктадекан) формула III — 1, 7 -дитиа-15 -краун-5 формула IV — дибензо-18 -краун-6 формула V — циклогексано-15 -краун-5
 Свойства Краун-эфиры являются вязкими жидкостями или кристаллическими веществами, хорошо растворимыми в большинстве органических растворителей и плохо растворимыми в воде. Их химические свойства зависят от природы гетероатомов и функциональных групп в цикле. Краун-эфиры образуют устойчивые липофильные комплексы с катионами металлов, особенно щелочных и щелочноземельных. При этом катион металла включается во внутримолекулярную полость краун-эфира и удерживается благодаря ион-дипольному взаимодействию с гетероатомами. Наиболее устойчивы такие комплексы, у которых размер иона металла близок к размеру полости молекулы краун-эфира. Комплексы, в отличие от образующих их неорганических солей, часто растворимы в органических растворителях, что позволяет создать гомогенную среду для многих химических реакций (например, как окислитель используется раствор перманганата калия в бензоле в присутствии краун-эфиров "пурпурный бензол"). За счет высокой стабильности комплексного иона возможно существование таких необычных соединений щелочных металлов как алкалиды и электриды.
Свойства Краун-эфиры являются вязкими жидкостями или кристаллическими веществами, хорошо растворимыми в большинстве органических растворителей и плохо растворимыми в воде. Их химические свойства зависят от природы гетероатомов и функциональных групп в цикле. Краун-эфиры образуют устойчивые липофильные комплексы с катионами металлов, особенно щелочных и щелочноземельных. При этом катион металла включается во внутримолекулярную полость краун-эфира и удерживается благодаря ион-дипольному взаимодействию с гетероатомами. Наиболее устойчивы такие комплексы, у которых размер иона металла близок к размеру полости молекулы краун-эфира. Комплексы, в отличие от образующих их неорганических солей, часто растворимы в органических растворителях, что позволяет создать гомогенную среду для многих химических реакций (например, как окислитель используется раствор перманганата калия в бензоле в присутствии краун-эфиров "пурпурный бензол"). За счет высокой стабильности комплексного иона возможно существование таких необычных соединений щелочных металлов как алкалиды и электриды.
 Получение Краун-эфиры получают конденсацией дигалогеналканов или диэфиров птолуолсульфокислоты с полиэтиленгликолями в тетрагидрофуране, 1, 4 диоксане, диметоксиэтане, диметилсульфоксиде, трет-бутаноле в присутствии оснований (гидриды, гидроксиды, карбонаты); внутримолекулярной циклизацией монотозилатов полиэтиленгликолей в диоксане, диглиме или тетрагидрофуране в присутствии гидроксидов щелочных металлов, а также циклоолигомеризацией этиленоксида в присутствии BF 3 и борофторидов щелочных и щелочноземельных металлов. Азакраун-эфиры получают ацилированием ди- или полиаминов с частично защищёнными аминогруппами хлорангидридами дикарбоновых кислот с последующим восстановлением образующихся макроциклических диамидов; алкилированием дитозилдиаминов дигалогенпроизводными или дитозилатами гликолей в присутствии гидридов или гидроксидов щелочных металлов. Тиакраун-эфиры получают из тиааналогов полиэтиленгликолей аналогично обычным краун-эфирам или алкилированием дитиолов дигалогенидами или дитозилатами в присутствии оснований.
Получение Краун-эфиры получают конденсацией дигалогеналканов или диэфиров птолуолсульфокислоты с полиэтиленгликолями в тетрагидрофуране, 1, 4 диоксане, диметоксиэтане, диметилсульфоксиде, трет-бутаноле в присутствии оснований (гидриды, гидроксиды, карбонаты); внутримолекулярной циклизацией монотозилатов полиэтиленгликолей в диоксане, диглиме или тетрагидрофуране в присутствии гидроксидов щелочных металлов, а также циклоолигомеризацией этиленоксида в присутствии BF 3 и борофторидов щелочных и щелочноземельных металлов. Азакраун-эфиры получают ацилированием ди- или полиаминов с частично защищёнными аминогруппами хлорангидридами дикарбоновых кислот с последующим восстановлением образующихся макроциклических диамидов; алкилированием дитозилдиаминов дигалогенпроизводными или дитозилатами гликолей в присутствии гидридов или гидроксидов щелочных металлов. Тиакраун-эфиры получают из тиааналогов полиэтиленгликолей аналогично обычным краун-эфирам или алкилированием дитиолов дигалогенидами или дитозилатами в присутствии оснований.
 Применение Краун-эфиры используются для концентрирования, разделения, очистки и регенерации металлов, в том числе редкоземельных; для разделения нуклидов, энантиомеров; как лекарственные препараты, антидоты, пестициды; для создания ионселективных датчиков и мембран; как катализаторы в реакциях с участием анионов. Тетразакраун эфир циклен, в котором все атомы кислорода замещены на азот[1], используется в магнитно-резонансная томографии в качестве контрастного вещества.
Применение Краун-эфиры используются для концентрирования, разделения, очистки и регенерации металлов, в том числе редкоземельных; для разделения нуклидов, энантиомеров; как лекарственные препараты, антидоты, пестициды; для создания ионселективных датчиков и мембран; как катализаторы в реакциях с участием анионов. Тетразакраун эфир циклен, в котором все атомы кислорода замещены на азот[1], используется в магнитно-резонансная томографии в качестве контрастного вещества.
 Краун-эфиры открыли новые горизонты в синтетической органической химии, с их помощью оказалось возможным вводить в растворенном виде (т. е. гомогенно), неорганические реагенты в органическую среду. Например, широко применяемый окислитель перманганат калия KMn. O 4 практически нерастворим в органических растворителях, но в присутствии 18 -краун-6 он легко растворяется в бензоле, приобретая при этом высокую окисляющую способность. Причина в том, что в водном растворе анионы Mn. O 4–, осуществляющие окисление, окружены водной сольватной оболочкой, а в бензольном растворе они как бы обнажены и потому высокоактивны.
Краун-эфиры открыли новые горизонты в синтетической органической химии, с их помощью оказалось возможным вводить в растворенном виде (т. е. гомогенно), неорганические реагенты в органическую среду. Например, широко применяемый окислитель перманганат калия KMn. O 4 практически нерастворим в органических растворителях, но в присутствии 18 -краун-6 он легко растворяется в бензоле, приобретая при этом высокую окисляющую способность. Причина в том, что в водном растворе анионы Mn. O 4–, осуществляющие окисление, окружены водной сольватной оболочкой, а в бензольном растворе они как бы обнажены и потому высокоактивны.
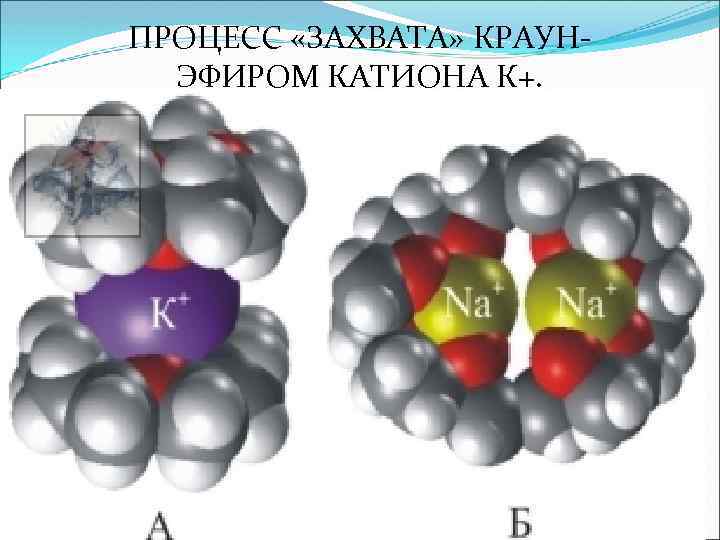 ПРОЦЕСС «ЗАХВАТА» КРАУНЭФИРОМ КАТИОНА К+.
ПРОЦЕСС «ЗАХВАТА» КРАУНЭФИРОМ КАТИОНА К+.
 У краун-эфиров склонность к «захвату» катионов выражена настолько сильно, что даже если катион не соответствует по размеру внутренней полости цикла, то все равно оказываются возможными варианты, при которых катион все же удерживаеся. Например, если катион по размеру много больше внутренней полости, то он может окружить себя двумя молекулами краун-эфира, образуя подобие бутерброда (рис. 4 А) если же ситуация обратная, то внутрь молекулы краун-эфира может поместиться два катиона (рис. 4 Б).
У краун-эфиров склонность к «захвату» катионов выражена настолько сильно, что даже если катион не соответствует по размеру внутренней полости цикла, то все равно оказываются возможными варианты, при которых катион все же удерживаеся. Например, если катион по размеру много больше внутренней полости, то он может окружить себя двумя молекулами краун-эфира, образуя подобие бутерброда (рис. 4 А) если же ситуация обратная, то внутрь молекулы краун-эфира может поместиться два катиона (рис. 4 Б).


