лекция Галогены.pptx
- Количество слайдов: 100
 Красноярский государственный аграрный университет ОСНОВЫ НЕОРГАНИЧЕСКОЙ ХИМИИ Лекции для студентов 1 курса Лектор д. т. н. Ступко Татьяна Владиславовна
Красноярский государственный аграрный университет ОСНОВЫ НЕОРГАНИЧЕСКОЙ ХИМИИ Лекции для студентов 1 курса Лектор д. т. н. Ступко Татьяна Владиславовна
 ГАЛОГЕНЫ Лекция № 2
ГАЛОГЕНЫ Лекция № 2
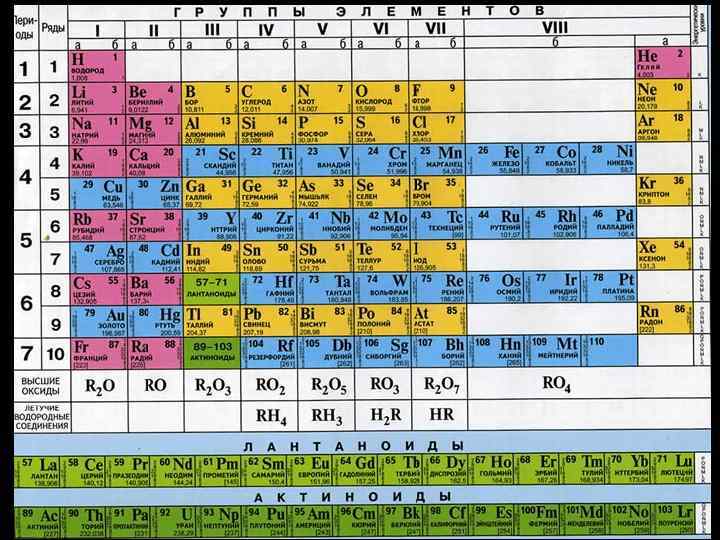
 План: 1. Строение атомов галогенов 2. Распространенность в природе 3. Открытие 4. Физические свойства 5. Химические свойства простых веществ 6. Свойства галогеноводородов 7. Свойства кислородсодержащих соединений галогенов 8. Получение 9. Применение 10. Токсикология
План: 1. Строение атомов галогенов 2. Распространенность в природе 3. Открытие 4. Физические свойства 5. Химические свойства простых веществ 6. Свойства галогеноводородов 7. Свойства кислородсодержащих соединений галогенов 8. Получение 9. Применение 10. Токсикология

 Галогены – элементы VII A группы по -гречески солероды F – фтор - разрушающий (fluorine – текучий) Cl хлор – желто-зеленый (Chlorine) Br бром –от др. -греч. βρῶμος — зловоние. I иод – от греч. iodes - фиолетовый; At астат - светящийся
Галогены – элементы VII A группы по -гречески солероды F – фтор - разрушающий (fluorine – текучий) Cl хлор – желто-зеленый (Chlorine) Br бром –от др. -греч. βρῶμος — зловоние. I иод – от греч. iodes - фиолетовый; At астат - светящийся
 Строение атомов Электронная формула валентного уровня ‑ ns 2 np 5 F 1 s 22 p 5 Cl 1 s 22 p 6 3 s 23 p 5 Br 1 s 22 p 63 s 23 p 6 4 s 2 3 d 104 p 5 I 1 s 22 p 63 s 23 p 6 4 s 2 3 d 104 p 6 5 s 2 4 d 10 5 p 5 At 1 s 22 p 63 s 23 p 6 4 s 2 3 d 104 p 6 5 s 2 4 d 10 5 p 6 6 s 24 f 145 d 106 p 5
Строение атомов Электронная формула валентного уровня ‑ ns 2 np 5 F 1 s 22 p 5 Cl 1 s 22 p 6 3 s 23 p 5 Br 1 s 22 p 63 s 23 p 6 4 s 2 3 d 104 p 5 I 1 s 22 p 63 s 23 p 6 4 s 2 3 d 104 p 6 5 s 2 4 d 10 5 p 5 At 1 s 22 p 63 s 23 p 6 4 s 2 3 d 104 p 6 5 s 2 4 d 10 5 p 6 6 s 24 f 145 d 106 p 5
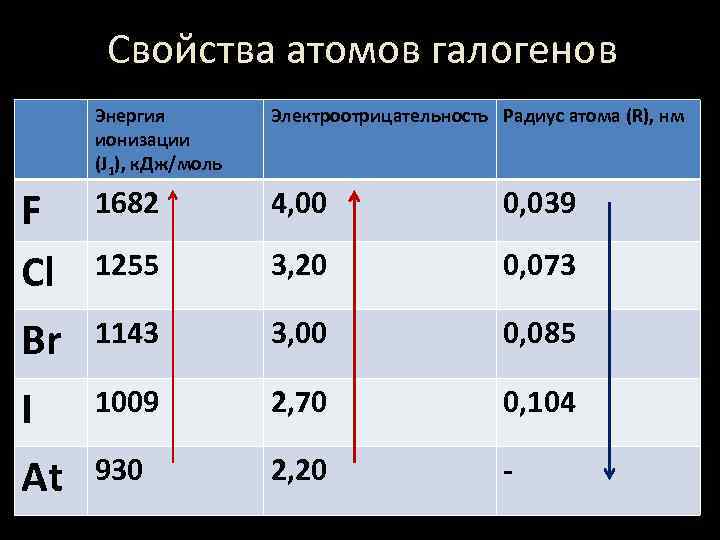 Свойства атомов галогенов Энергия ионизации (J 1), к. Дж/моль Электроотрицательность Радиус атома (R), нм F Cl 1682 4, 00 0, 039 1255 3, 20 0, 073 Br 1143 3, 00 0, 085 I 1009 2, 70 0, 104 At 930 2, 20 -
Свойства атомов галогенов Энергия ионизации (J 1), к. Дж/моль Электроотрицательность Радиус атома (R), нм F Cl 1682 4, 00 0, 039 1255 3, 20 0, 073 Br 1143 3, 00 0, 085 I 1009 2, 70 0, 104 At 930 2, 20 -
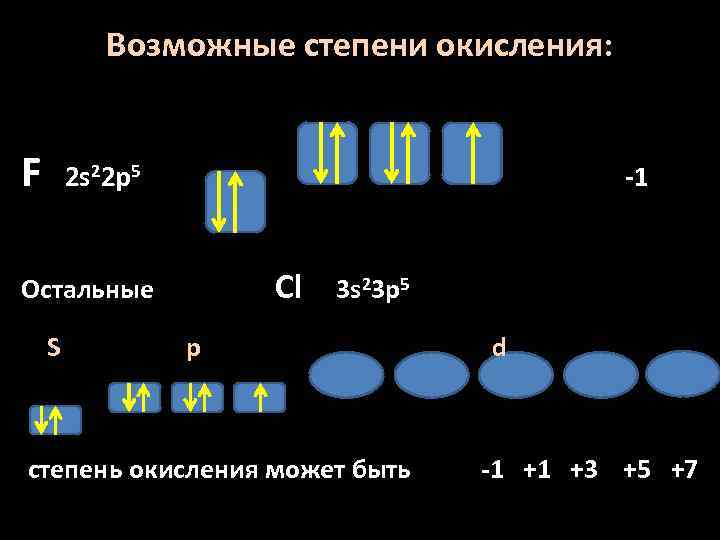 Возможные степени окисления: F 2 s 22 p 5 -1 Cl Остальные S 3 s 23 p 5 p степень окисления может быть d -1 +1 +3 +5 +7
Возможные степени окисления: F 2 s 22 p 5 -1 Cl Остальные S 3 s 23 p 5 p степень окисления может быть d -1 +1 +3 +5 +7
 Нахождение в природе В природе встречаются в виде солей. кларк, мас. % F Cl Br 0, 03 0, 045 2. 10 -4 I At 4. 10 -5 следы
Нахождение в природе В природе встречаются в виде солей. кларк, мас. % F Cl Br 0, 03 0, 045 2. 10 -4 I At 4. 10 -5 следы
 Фтор входит в состав минералов: флюорит Cа. F 2 (плавиковый шпат)
Фтор входит в состав минералов: флюорит Cа. F 2 (плавиковый шпат)
![Криолит (ледяной камень) Na 3[Al. F 6] Фторапатит 3 Сa 3(PO 4)2 Ca. F Криолит (ледяной камень) Na 3[Al. F 6] Фторапатит 3 Сa 3(PO 4)2 Ca. F](https://present5.com/presentation/1/142141705_155042697.pdf-img/142141705_155042697.pdf-12.jpg) Криолит (ледяной камень) Na 3[Al. F 6] Фторапатит 3 Сa 3(PO 4)2 Ca. F 2
Криолит (ледяной камень) Na 3[Al. F 6] Фторапатит 3 Сa 3(PO 4)2 Ca. F 2
 Хлор входит в состав солей в виде минералов или растворенных в воде мирового океана В воде океанов 2, 5% Na. Cl Галит или каменная соль
Хлор входит в состав солей в виде минералов или растворенных в воде мирового океана В воде океанов 2, 5% Na. Cl Галит или каменная соль
 Cильвин - KCl
Cильвин - KCl
 Карналлит – KCl. Mg. Cl 2. 6 H 2 O Каинит KCl. Mg. SO 4. 3 H 2 O
Карналлит – KCl. Mg. Cl 2. 6 H 2 O Каинит KCl. Mg. SO 4. 3 H 2 O
 Бром и иод в виде Na. Br, KBr и Na. I, КI - в морской воде, водорослях В живом организме Na. Cl плазма крови, HCl - желудочный сок, I - гормоны щитовидной железы, F – эмаль зубов
Бром и иод в виде Na. Br, KBr и Na. I, КI - в морской воде, водорослях В живом организме Na. Cl плазма крови, HCl - желудочный сок, I - гормоны щитовидной железы, F – эмаль зубов
 История открытия • • Фтор открыл А. Муассан в 1886 г. Хлор - открыт К. Шееле в 1774 г. Бром - открыт Ж. Баларом в 1826 г. Йод - открыт Б. Куртуа в 1811 г.
История открытия • • Фтор открыл А. Муассан в 1886 г. Хлор - открыт К. Шееле в 1774 г. Бром - открыт Ж. Баларом в 1826 г. Йод - открыт Б. Куртуа в 1811 г.
 Свойства простых веществ
Свойства простых веществ
 Молекулы галогенов двухатомны. Кратность связи равна 1. F 2 Энергия связи Гал-Гал, к. Дж/моль Cl 2 Br 2 I 2 159 243 193 151 Eсв изменяется F 2< Cl 2 > Br 2 > I 2
Молекулы галогенов двухатомны. Кратность связи равна 1. F 2 Энергия связи Гал-Гал, к. Дж/моль Cl 2 Br 2 I 2 159 243 193 151 Eсв изменяется F 2< Cl 2 > Br 2 > I 2
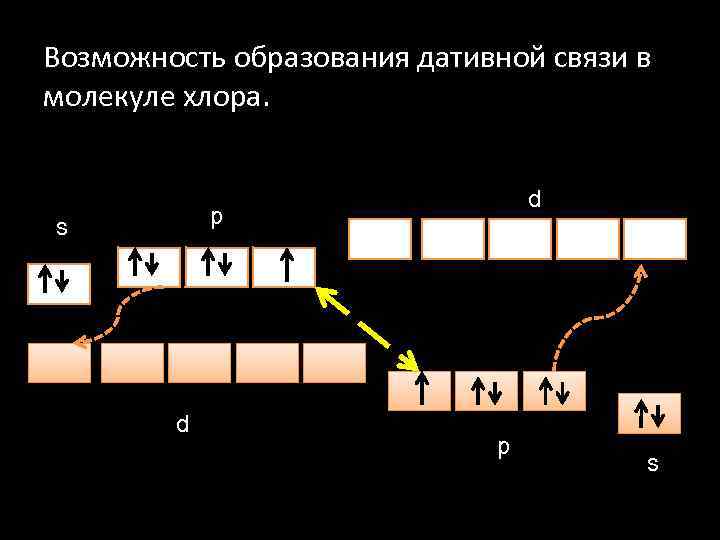 Возможность образования дативной связи в молекуле хлора. d p s
Возможность образования дативной связи в молекуле хлора. d p s
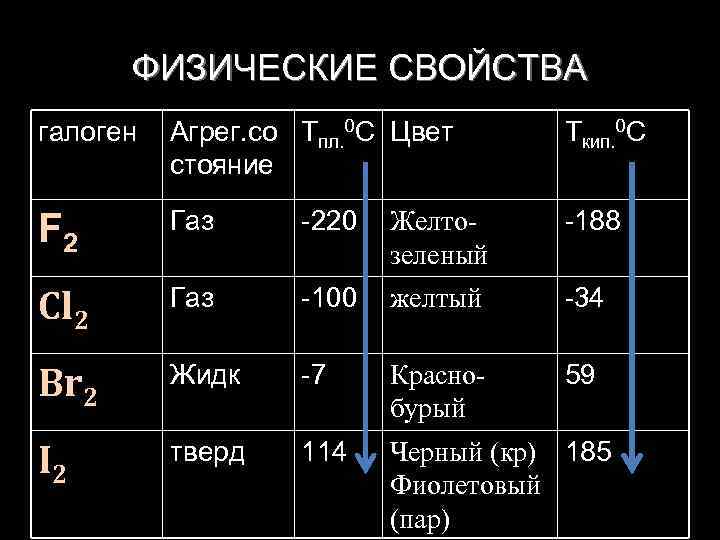 ФИЗИЧЕСКИЕ СВОЙСТВА галоген Агрег. со Тпл. 0 С Цвет стояние Ткип. 0 С F 2 Газ -220 Желтозеленый -188 Cl 2 Газ -100 желтый -34 Br 2 Жидк -7 Краснобурый 59 I 2 тверд 114 Черный (кр) 185 Фиолетовый (пар)
ФИЗИЧЕСКИЕ СВОЙСТВА галоген Агрег. со Тпл. 0 С Цвет стояние Ткип. 0 С F 2 Газ -220 Желтозеленый -188 Cl 2 Газ -100 желтый -34 Br 2 Жидк -7 Краснобурый 59 I 2 тверд 114 Черный (кр) 185 Фиолетовый (пар)
 Хлор в газообразном и твердом состоянии
Хлор в газообразном и твердом состоянии
 Бром жидкий, газообразный и твердый
Бром жидкий, газообразный и твердый
 Иод твердый и пары
Иод твердый и пары
 Астат
Астат
 Химические свойства простых веществ Фтор взаимодействует со всеми элементами, даже с инертными газами (с Xe, Kr, Rn). В фторе горят S, P. Si: H 2+F 2 = 2 HF (взрыв) S+3 F 2 SF 6 2 Р+5 F 2 2 PF 5
Химические свойства простых веществ Фтор взаимодействует со всеми элементами, даже с инертными газами (с Xe, Kr, Rn). В фторе горят S, P. Si: H 2+F 2 = 2 HF (взрыв) S+3 F 2 SF 6 2 Р+5 F 2 2 PF 5
 Металлы окисляются фтором до высшей степени окисления: 2 Na + F 2 = 2 Na. F(взрыв) Ni + F 2 = Ni. F 2 (прочная пленка) 2 Au + 3 F 2 = 2 Au. F 3 (при нагревании)
Металлы окисляются фтором до высшей степени окисления: 2 Na + F 2 = 2 Na. F(взрыв) Ni + F 2 = Ni. F 2 (прочная пленка) 2 Au + 3 F 2 = 2 Au. F 3 (при нагревании)
 • Взаимодействует с оксидом кремния Si. O 2 + 2 F 2 = Si. F 4 + O 2 • Взаимодействуя с кислородом, образует фторид кислорода 2 F 2 + O 2 = 2 OF 2 • Взаимодействует с инертными газами (кроме He и Ne) Хе+ 2 F 2 = Xe. F 4
• Взаимодействует с оксидом кремния Si. O 2 + 2 F 2 = Si. F 4 + O 2 • Взаимодействуя с кислородом, образует фторид кислорода 2 F 2 + O 2 = 2 OF 2 • Взаимодействует с инертными газами (кроме He и Ne) Хе+ 2 F 2 = Xe. F 4
 Фтор разлагает воду при любой температуре F 2 + 2 H 2 O(лед) = Н 2 + 2 HОF (фтороксигенат водорода) 2 F 2 + H 2 O(ж) = OF 2 +2 HF 2 F 2 + 2 H 2 O(пар) = 4 HF +O 2
Фтор разлагает воду при любой температуре F 2 + 2 H 2 O(лед) = Н 2 + 2 HОF (фтороксигенат водорода) 2 F 2 + H 2 O(ж) = OF 2 +2 HF 2 F 2 + 2 H 2 O(пар) = 4 HF +O 2
 Хлор менее химически активен чем F 2, но и его окислительная активность чрезвычайно велика, он соединяется почти со всеми металлами (иногда лишь в присутствии следов воды или при нагревании) и со всеми неметаллами, кроме С, N 2 и O 2. Cl 2 + K = 2 KCl
Хлор менее химически активен чем F 2, но и его окислительная активность чрезвычайно велика, он соединяется почти со всеми металлами (иногда лишь в присутствии следов воды или при нагревании) и со всеми неметаллами, кроме С, N 2 и O 2. Cl 2 + K = 2 KCl
 При полном отсутствии влаги хлор не действует на железо. Это и позволяет хранить его в стальных баллонах. Однако наличие следов воды протекает реакция: 2 Fe+3 Cl 2 =2 Fe. Cl 3
При полном отсутствии влаги хлор не действует на железо. Это и позволяет хранить его в стальных баллонах. Однако наличие следов воды протекает реакция: 2 Fe+3 Cl 2 =2 Fe. Cl 3
 В жестких условиях хлор окисляет ксенон, образуя Хе. Сl 2 и Хе. Сl 4 Многие органические вещества сгорают в хлоре: Взаимодействие хлора со скипидаром
В жестких условиях хлор окисляет ксенон, образуя Хе. Сl 2 и Хе. Сl 4 Многие органические вещества сгорают в хлоре: Взаимодействие хлора со скипидаром
 Хлор растворяется в воде, а при Т<100 C из насыщенного раствора Cl 2 выпадают зеленовато-желтые кристаллы Cl 2. H 2 О Растворяясь в воде частично реагирует с водой: На холоду Cl 2 + H 2 O = HCl + HCl. O При об. у. 3 Cl 2 + 3 H 2 O = 5 HCl + HCl. O 3
Хлор растворяется в воде, а при Т<100 C из насыщенного раствора Cl 2 выпадают зеленовато-желтые кристаллы Cl 2. H 2 О Растворяясь в воде частично реагирует с водой: На холоду Cl 2 + H 2 O = HCl + HCl. O При об. у. 3 Cl 2 + 3 H 2 O = 5 HCl + HCl. O 3
 Взаимодействует с щелочами: Сl 2 + 2 КОН = КСl. О+ КСl + Н 2 О
Взаимодействует с щелочами: Сl 2 + 2 КОН = КСl. О+ КСl + Н 2 О
 Реагируя с оксидами металлов хлор образует хлориды и оксохлориды металлов: 2 Mg. O+2 Cl 2 =2 Mg. Cl 2 +O 2 ( при 1000 C) 2 W 2 O 5 + 4 Cl 2 = 4 WO 2 Cl 2 + O 2 Восстановительные свойства проявляет только при взаимодействии с фтором: 3 F 2 + Cl 2 = 2 Cl. F 3
Реагируя с оксидами металлов хлор образует хлориды и оксохлориды металлов: 2 Mg. O+2 Cl 2 =2 Mg. Cl 2 +O 2 ( при 1000 C) 2 W 2 O 5 + 4 Cl 2 = 4 WO 2 Cl 2 + O 2 Восстановительные свойства проявляет только при взаимодействии с фтором: 3 F 2 + Cl 2 = 2 Cl. F 3
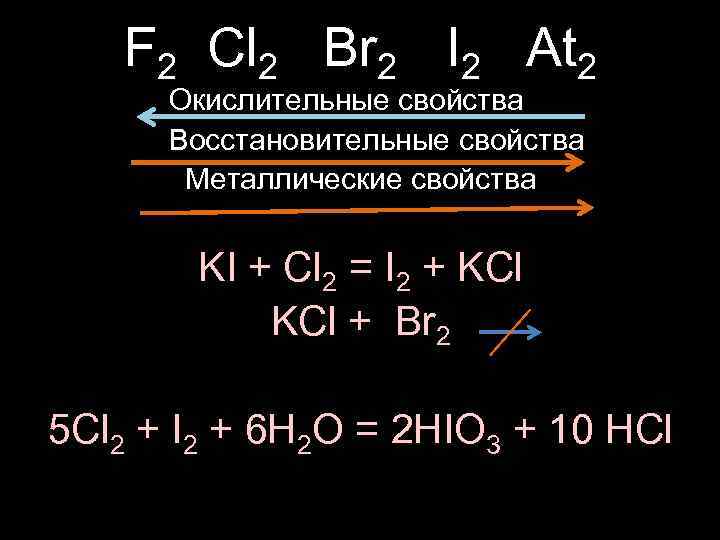 F 2 Cl 2 Br 2 I 2 At 2 Окислительные свойства Восстановительные свойства Металлические свойства KI + Cl 2 = I 2 + KCl + Br 2 5 Cl 2 + I 2 + 6 H 2 O = 2 HIO 3 + 10 HCl
F 2 Cl 2 Br 2 I 2 At 2 Окислительные свойства Восстановительные свойства Металлические свойства KI + Cl 2 = I 2 + KCl + Br 2 5 Cl 2 + I 2 + 6 H 2 O = 2 HIO 3 + 10 HCl
 •
•
 Жидкий бром часто реагирует активнее, чем хлор, (высокая концентрация). Br 2+ S + 4 H 2 O = 6 HBr + H 2 SO 4 C водой бром взаимодействует незначительно, хотя в ней растворяется (раствор брома в воде называется бромная вода).
Жидкий бром часто реагирует активнее, чем хлор, (высокая концентрация). Br 2+ S + 4 H 2 O = 6 HBr + H 2 SO 4 C водой бром взаимодействует незначительно, хотя в ней растворяется (раствор брома в воде называется бромная вода).
 •
•
 •
•
 СОЕДИНЕНИЯ ГАЛОГЕНОВ
СОЕДИНЕНИЯ ГАЛОГЕНОВ
 ГАЛОГЕНОВОДОРОДЫ
ГАЛОГЕНОВОДОРОДЫ
 Свойства связи HF HCl HBr HI Длина связи, нм 0, 092 0, 128 0, 141 0, 161 Энергия, к. Дж/моль 565 431 364 297 Дипольный момент, Д 1, 86 1, 11 0, 79 0, 38 Уменьшается прочность молекул и их полярность
Свойства связи HF HCl HBr HI Длина связи, нм 0, 092 0, 128 0, 141 0, 161 Энергия, к. Дж/моль 565 431 364 297 Дипольный момент, Д 1, 86 1, 11 0, 79 0, 38 Уменьшается прочность молекул и их полярность
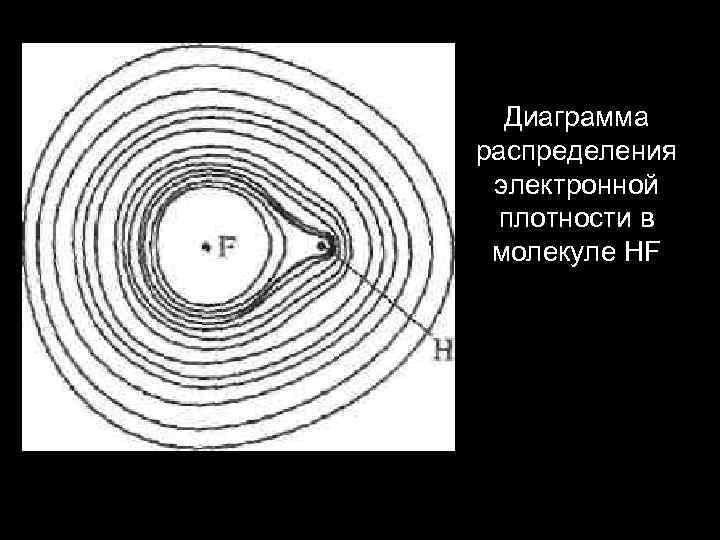 Диаграмма распределения электронной плотности в молекуле HF
Диаграмма распределения электронной плотности в молекуле HF
 Физические свойства галогеноводородов газы, с резким удушающим запахом, бесцветные, хорошо растворимые в воде свойство HF HCl HBr HI т. кип. , С +19, 5 -85 -67 -35 т. плавл. . , С -83 -114 -87 -51 С ростом массы и размера молекул увеличиваются межмолекулярные взаимодействия, и следовательно, повышаются температуры кипения и плавления. HCl HBr HI В ряду: Исключение составляет фтороводород Почему?
Физические свойства галогеноводородов газы, с резким удушающим запахом, бесцветные, хорошо растворимые в воде свойство HF HCl HBr HI т. кип. , С +19, 5 -85 -67 -35 т. плавл. . , С -83 -114 -87 -51 С ростом массы и размера молекул увеличиваются межмолекулярные взаимодействия, и следовательно, повышаются температуры кипения и плавления. HCl HBr HI В ряду: Исключение составляет фтороводород Почему?
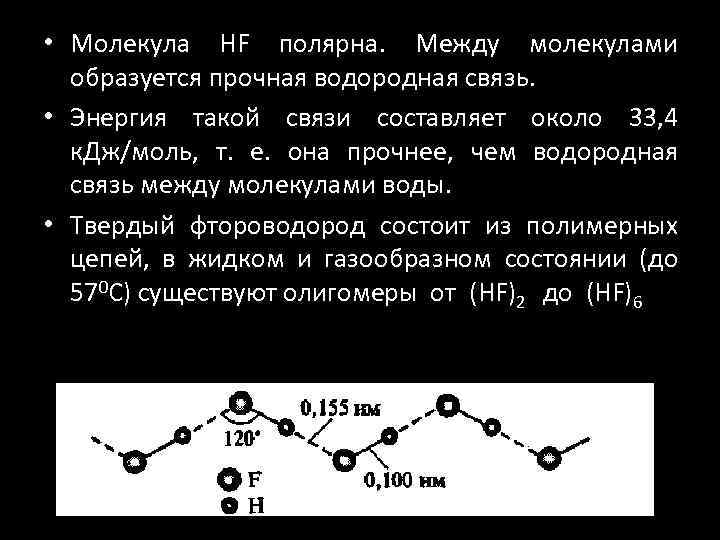 • Молекула HF полярна. Между молекулами образуется прочная водородная связь. • Энергия такой связи составляет около 33, 4 к. Дж/моль, т. е. она прочнее, чем водородная связь между молекулами воды. • Твердый фтороводород состоит из полимерных цепей, в жидком и газообразном состоянии (до 570 С) существуют олигомеры от (HF)2 до (HF)6
• Молекула HF полярна. Между молекулами образуется прочная водородная связь. • Энергия такой связи составляет около 33, 4 к. Дж/моль, т. е. она прочнее, чем водородная связь между молекулами воды. • Твердый фтороводород состоит из полимерных цепей, в жидком и газообразном состоянии (до 570 С) существуют олигомеры от (HF)2 до (HF)6
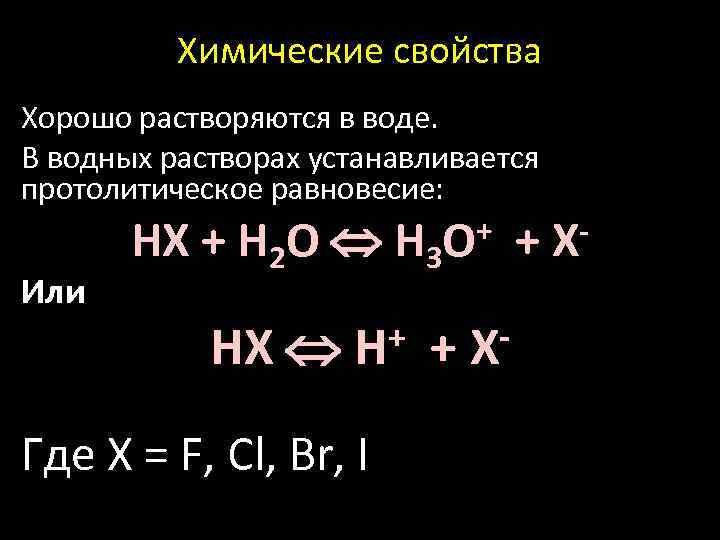 Химические свойства Xорошо растворяются в воде. В водных растворах устанавливается протолитическое равновесие: HX + H 2 O H 3 O+ + X- Или + HX H Где Х = F, Cl, Br, I +X
Химические свойства Xорошо растворяются в воде. В водных растворах устанавливается протолитическое равновесие: HX + H 2 O H 3 O+ + X- Или + HX H Где Х = F, Cl, Br, I +X
 Растворы галогеноводородов – кислоты. HF p. Ka= -lg. Ka Ka HCl HBr HI 3, 2 6, 3. 10 -4 -9, 0 -11, 2 -12, 4 109 HF – HCl – HBr - HI Сила кислот
Растворы галогеноводородов – кислоты. HF p. Ka= -lg. Ka Ka HCl HBr HI 3, 2 6, 3. 10 -4 -9, 0 -11, 2 -12, 4 109 HF – HCl – HBr - HI Сила кислот
 •
•
 Химическая активность фтороводорода сильно зависит от присутствия воды: сухой HF не действует на металлы и оксиды, но вода, является катализатором процесса, например: Ca. O +2 HF = Ca. F 2 + H 2 O (автокатализ)
Химическая активность фтороводорода сильно зависит от присутствия воды: сухой HF не действует на металлы и оксиды, но вода, является катализатором процесса, например: Ca. O +2 HF = Ca. F 2 + H 2 O (автокатализ)
 Особенностью фтороводорода и плавиковой кислоты является способность взаимодействовать с материалами, содержащими оксид кремния (IV) — Si. O 2 (стекла). Si. O 2 + 4 НF = Si. F 4 + 2 Н 2 O 1670 г. немецкий художник Швангард – метод «травления» стекла
Особенностью фтороводорода и плавиковой кислоты является способность взаимодействовать с материалами, содержащими оксид кремния (IV) — Si. O 2 (стекла). Si. O 2 + 4 НF = Si. F 4 + 2 Н 2 O 1670 г. немецкий художник Швангард – метод «травления» стекла
 Галогенводородные кислоты проявляют все свойства, характерные для кислот: взаимодействуют с металлами, основными оксидами, основаниями, солями слабых кислот. Fe + HCl = Fe. Cl 2 + H 2
Галогенводородные кислоты проявляют все свойства, характерные для кислот: взаимодействуют с металлами, основными оксидами, основаниями, солями слабых кислот. Fe + HCl = Fe. Cl 2 + H 2
 Все галогеноводороды – восстановители. HF HCl HBr HI Восстановительная активность Стандартные потенциалы 1/2 Х 2 + е = Х- F +2, 82 Cl +1, 36 Br +1, 06 I +0, 53
Все галогеноводороды – восстановители. HF HCl HBr HI Восстановительная активность Стандартные потенциалы 1/2 Х 2 + е = Х- F +2, 82 Cl +1, 36 Br +1, 06 I +0, 53
 HF и HCl с концентрированной H 2 SO 4 не взаимодействует , но HBr и HI ею окисляются: 2 HBr + H 2 SO 4 (конц. ) =Br 2+SO 2 + 2 H 2 O 8 HI+ H 2 SO 4 (конц. ) =4 I 2 + H 2 S + 4 H 2 O
HF и HCl с концентрированной H 2 SO 4 не взаимодействует , но HBr и HI ею окисляются: 2 HBr + H 2 SO 4 (конц. ) =Br 2+SO 2 + 2 H 2 O 8 HI+ H 2 SO 4 (конц. ) =4 I 2 + H 2 S + 4 H 2 O
 Получение галогеноводородов 1. Прямой синтез из элементов Фтор с водородом реагирует со взрывом, что затрудняет синтез Хлороводород в промышленности получают сжиганием хлора и водорода: H 2 + Cl 2 = 2 HCl Бром и иод с водородом реагируют обратимо, выход продукта мал H 2 + Br 2 ↔ 2 HBr
Получение галогеноводородов 1. Прямой синтез из элементов Фтор с водородом реагирует со взрывом, что затрудняет синтез Хлороводород в промышленности получают сжиганием хлора и водорода: H 2 + Cl 2 = 2 HCl Бром и иод с водородом реагируют обратимо, выход продукта мал H 2 + Br 2 ↔ 2 HBr
 2. Вытеснение НХ из их солей Ca. F 2 + H 2 SO 4 = Ca. SO 4 + HF↑ (70 -85%) Na. Cl + H 2 SO 4 = Na. HSO 4 + HCl↑ (70 -85%) Дале при нагревании более 5300 С Na. HSO 4+ Na. Cl = Na 2 SO 4 + HCl↑ Промышленный и лабораторный способ
2. Вытеснение НХ из их солей Ca. F 2 + H 2 SO 4 = Ca. SO 4 + HF↑ (70 -85%) Na. Cl + H 2 SO 4 = Na. HSO 4 + HCl↑ (70 -85%) Дале при нагревании более 5300 С Na. HSO 4+ Na. Cl = Na 2 SO 4 + HCl↑ Промышленный и лабораторный способ
 •
•
 3. Гидролиз галогенидов неметаллов Si. Cl 4 + 3 H 2 O = H 2 Si. O 3 + 4 HCl↑ PBr 3 +3 H 2 O = H 3 PO 3 + 3 HBr↑ 2 P(красный) + I 2 +6 H 2 O = H 3 PO 3 + 3 HI↑
3. Гидролиз галогенидов неметаллов Si. Cl 4 + 3 H 2 O = H 2 Si. O 3 + 4 HCl↑ PBr 3 +3 H 2 O = H 3 PO 3 + 3 HBr↑ 2 P(красный) + I 2 +6 H 2 O = H 3 PO 3 + 3 HI↑
 Галогениды металлов Галогениды щелочных и щелочноземельных металлов – ионные соединения, остальные ковалентные с большой долей полярности.
Галогениды металлов Галогениды щелочных и щелочноземельных металлов – ионные соединения, остальные ковалентные с большой долей полярности.
 Соли фтористоводородной кислоты называются фториды. Большинство их малорастворимы в воде — из производных наиболее обычных металлов хорошо растворяются: Nа. F, КF, Ag. F, Al. F 3, Нg. F 2. Фториды в водных растворах гидролизуются по схеме: 2 Na. F + H 2 O= Na. HF 2 + Na. OH Все соли плавиковой кислоты ядовиты.
Соли фтористоводородной кислоты называются фториды. Большинство их малорастворимы в воде — из производных наиболее обычных металлов хорошо растворяются: Nа. F, КF, Ag. F, Al. F 3, Нg. F 2. Фториды в водных растворах гидролизуются по схеме: 2 Na. F + H 2 O= Na. HF 2 + Na. OH Все соли плавиковой кислоты ядовиты.
 Соли соляной кислоты называются хлориды. Большинство их хорошо растворимо в воде. Из производных наиболее обычных металлов труднорастворимы хлориды серебра и свинца.
Соли соляной кислоты называются хлориды. Большинство их хорошо растворимо в воде. Из производных наиболее обычных металлов труднорастворимы хлориды серебра и свинца.
 Соли бромоводородной кислоты - бромиды, иодоводородной — иодиды. Растворимость бромидов и иодидов в большинстве случаев подобна растворимости соответствующих хлоридов.
Соли бромоводородной кислоты - бромиды, иодоводородной — иодиды. Растворимость бромидов и иодидов в большинстве случаев подобна растворимости соответствующих хлоридов.
 Интергалогенидные соединения Галогены реагируют друг с другом, при этом менее электроотрицательный элемент приобретает положительную степень окисления, более электроотрицательный - отрицательную. • Cl. F, Cl. F 3 • Br. F, Br. F 3, Br. F 5, Br. Cl • IF 7 , ICl 3, ICl 5, ICl 7; .
Интергалогенидные соединения Галогены реагируют друг с другом, при этом менее электроотрицательный элемент приобретает положительную степень окисления, более электроотрицательный - отрицательную. • Cl. F, Cl. F 3 • Br. F, Br. F 3, Br. F 5, Br. Cl • IF 7 , ICl 3, ICl 5, ICl 7; .
 Интергалогениды в воде подвергаются полному гидролизу: ICl 5 + H 2 O HIO 3 + HCl С солями галогенов образуют комплексные соединения. ICl 3 + KCl KICl 4
Интергалогениды в воде подвергаются полному гидролизу: ICl 5 + H 2 O HIO 3 + HCl С солями галогенов образуют комплексные соединения. ICl 3 + KCl KICl 4
 Соединения галогенов с кислородом
Соединения галогенов с кислородом
 • Фторид кислорода OF 2
• Фторид кислорода OF 2
 Соединения хлора со ст. ок. +1 Cl 2 O оксид хлора (I) газ желто-бурый с неприятным резким запахом. tкип=+2, 2 о. С. (жидкий взрывается) Cl 2 O непосредственно не получается. 3 Hg. O+2 Cl 2 = Hg 3 O 2 Cl 2 + Cl 2 O неустойчив: об. у. Cl 2 O Сl 2 + Cl. O 2
Соединения хлора со ст. ок. +1 Cl 2 O оксид хлора (I) газ желто-бурый с неприятным резким запахом. tкип=+2, 2 о. С. (жидкий взрывается) Cl 2 O непосредственно не получается. 3 Hg. O+2 Cl 2 = Hg 3 O 2 Cl 2 + Cl 2 O неустойчив: об. у. Cl 2 O Сl 2 + Cl. O 2
 Очень сильный окислитель, при контакте с восстановителем, взрывается: 3 Cl 2 O + 10 NH 3 = 2 N 2 + 6 NH 4 Cl + 3 H 2 O Хорошо растворяется в воде: Cl 2 O + H 2 O = 2 HCl. O
Очень сильный окислитель, при контакте с восстановителем, взрывается: 3 Cl 2 O + 10 NH 3 = 2 N 2 + 6 NH 4 Cl + 3 H 2 O Хорошо растворяется в воде: Cl 2 O + H 2 O = 2 HCl. O
 Хлорноватистая кислота HCl. O Слабая (Кдис=4. 10 -8) , неустойчивая, существует только в разб. растворах. HCl. O HCl +O 2 (свет) Получается: Сl 2 + Н 2 О НСl + НСl. О Cоли – гипохлориты – более устойчивы
Хлорноватистая кислота HCl. O Слабая (Кдис=4. 10 -8) , неустойчивая, существует только в разб. растворах. HCl. O HCl +O 2 (свет) Получается: Сl 2 + Н 2 О НСl + НСl. О Cоли – гипохлориты – более устойчивы
 Гипохлориты При взаимодействии хлора с Са(ОН)2 “гашёной известью” — образуется гипохлорит-хлорид кальция – «хлорная известь» : Сl 2 + Са(ОН)2 = Сl Са ОCl + H 2 O Сильный окислитель – отбеливающее и дезинфицирующее действие.
Гипохлориты При взаимодействии хлора с Са(ОН)2 “гашёной известью” — образуется гипохлорит-хлорид кальция – «хлорная известь» : Сl 2 + Са(ОН)2 = Сl Са ОCl + H 2 O Сильный окислитель – отбеливающее и дезинфицирующее действие.
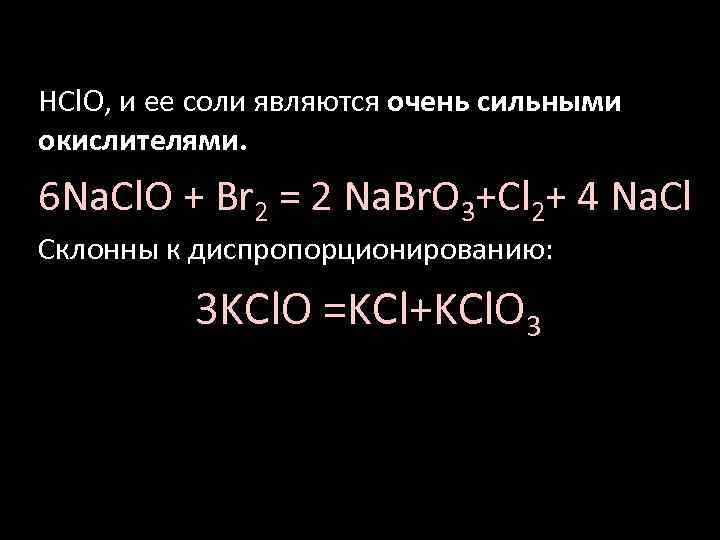 HСl. O, и ее соли являются очень сильными окислителями. 6 Na. Cl. O + Br 2 = 2 Na. Br. O 3+Cl 2+ 4 Na. Cl Склонны к диспропорционированию: 3 KCl. O =KCl+KCl. O 3
HСl. O, и ее соли являются очень сильными окислителями. 6 Na. Cl. O + Br 2 = 2 Na. Br. O 3+Cl 2+ 4 Na. Cl Склонны к диспропорционированию: 3 KCl. O =KCl+KCl. O 3
 Соединения Br (+1) и I (+1) Br 2 O I 2 O Ж. кр. Т. Сер Все неустойчивы. Разлагаются. Кислотные Сильные окислители. Иод в неводном растворе (эфир) проявляет металлические свойства, образуя соли I+1 I 2 + Ag. NO 3 = Ag. I + INO 3 нитрат иода
Соединения Br (+1) и I (+1) Br 2 O I 2 O Ж. кр. Т. Сер Все неустойчивы. Разлагаются. Кислотные Сильные окислители. Иод в неводном растворе (эфир) проявляет металлические свойства, образуя соли I+1 I 2 + Ag. NO 3 = Ag. I + INO 3 нитрат иода
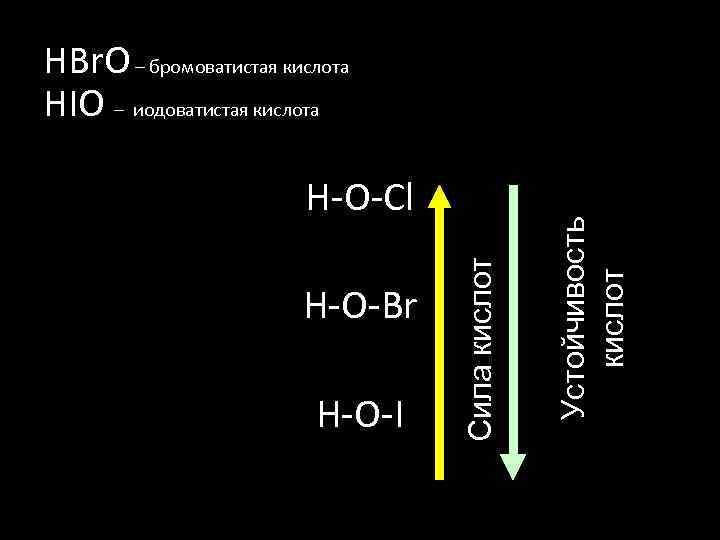 H-O-Br H-O-I Сила кислот H-O-Cl Устойчивость кислот HBr. O – бромоватистая кислота HIO – иодоватистая кислота
H-O-Br H-O-I Сила кислот H-O-Cl Устойчивость кислот HBr. O – бромоватистая кислота HIO – иодоватистая кислота
 Соединения хлора, брома и иода в ст. ок. +3 (Сl 2 O 3) неизвестен HCl. O 2 – хлористая кислота Даже в водном растворе разлагается 4 HCl. O 2=2 Сl. O 2 +HCl. O 3+HCl+H 2 O Получение: 2 HCl. O = HCl + HCl. O 2 (холод) Ba(Cl. O 2)2 + H 2 SO 4(разб) = Ba. SO 4 + 2 HCl. O 2
Соединения хлора, брома и иода в ст. ок. +3 (Сl 2 O 3) неизвестен HCl. O 2 – хлористая кислота Даже в водном растворе разлагается 4 HCl. O 2=2 Сl. O 2 +HCl. O 3+HCl+H 2 O Получение: 2 HCl. O = HCl + HCl. O 2 (холод) Ba(Cl. O 2)2 + H 2 SO 4(разб) = Ba. SO 4 + 2 HCl. O 2
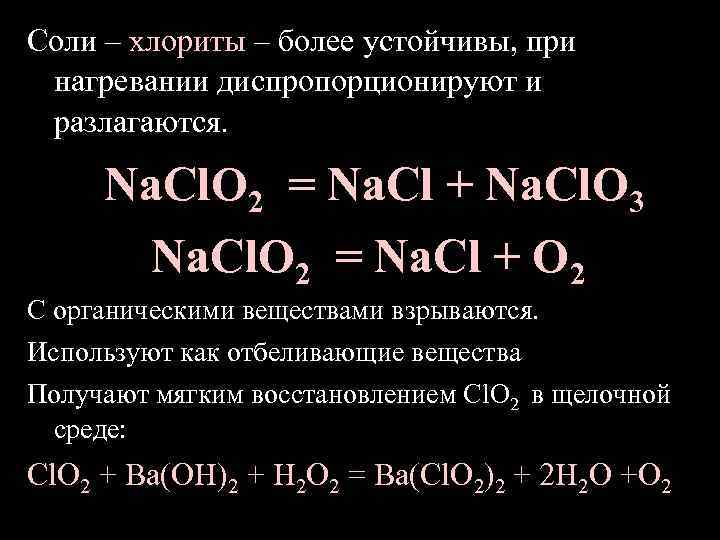 Соли – хлориты – более устойчивы, при нагревании диспропорционируют и разлагаются. Na. Cl. O 2 = Na. Cl + Na. Cl. O 3 Na. Cl. O 2 = Na. Cl + O 2 С органическими веществами взрываются. Используют как отбеливающие вещества Получают мягким восстановлением Сl. O 2 в щелочной среде: Сl. O 2 + Ba(OH)2 + H 2 O 2 = Ba(Cl. O 2)2 + 2 H 2 O +O 2
Соли – хлориты – более устойчивы, при нагревании диспропорционируют и разлагаются. Na. Cl. O 2 = Na. Cl + Na. Cl. O 3 Na. Cl. O 2 = Na. Cl + O 2 С органическими веществами взрываются. Используют как отбеливающие вещества Получают мягким восстановлением Сl. O 2 в щелочной среде: Сl. O 2 + Ba(OH)2 + H 2 O 2 = Ba(Cl. O 2)2 + 2 H 2 O +O 2
 •
•
 Оксид хлора (IV) Cl. O 2 желтый газ, единственный оксид хлора, который получают в промышленном масштабе Na. Cl. O 3 +SO 2 + H 2 SO 4 (разб) = 2 Na. HSO 4 + 2 Cl. O 2 Полученный оксид хлора (IV) смешивают с азотом, для предотвращения взрыва. Очень сильный окислитель Pb. O+2 Cl. O 2+2 Na. OH=Pb. O 2+2 Na. Cl. O 2+H 2 O Используется как отбеливатель и для обеззараживания воды.
Оксид хлора (IV) Cl. O 2 желтый газ, единственный оксид хлора, который получают в промышленном масштабе Na. Cl. O 3 +SO 2 + H 2 SO 4 (разб) = 2 Na. HSO 4 + 2 Cl. O 2 Полученный оксид хлора (IV) смешивают с азотом, для предотвращения взрыва. Очень сильный окислитель Pb. O+2 Cl. O 2+2 Na. OH=Pb. O 2+2 Na. Cl. O 2+H 2 O Используется как отбеливатель и для обеззараживания воды.
 Соединения Cl (+5) (Сl 2 O 5) неизвестен HCl. O 3 – хлорноватая кислота. Более устойчива, чем хлорнованистая и хлористая, можно получить растворы до 30%. По силе как HNO 3 Получение: Ba(Cl. O 3)2 +H 2 SO 4(конц)=Ba. SO 4+2 HCl. O 3
Соединения Cl (+5) (Сl 2 O 5) неизвестен HCl. O 3 – хлорноватая кислота. Более устойчива, чем хлорнованистая и хлористая, можно получить растворы до 30%. По силе как HNO 3 Получение: Ba(Cl. O 3)2 +H 2 SO 4(конц)=Ba. SO 4+2 HCl. O 3
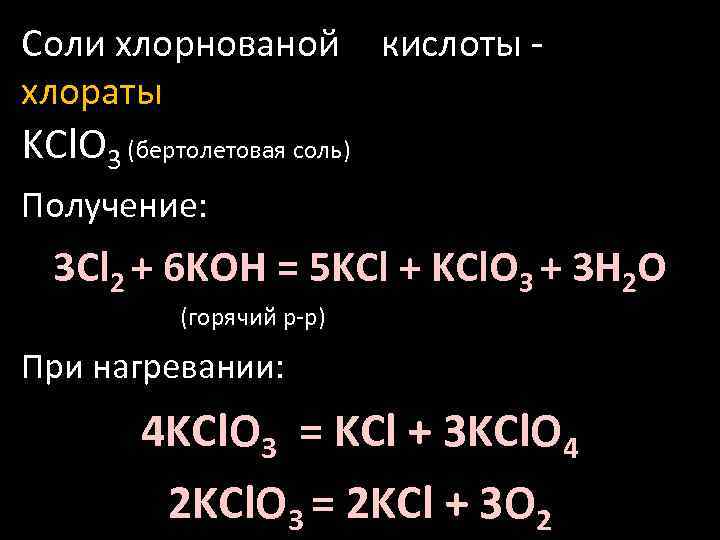 Соли хлорнованой хлораты кислоты - KCl. O 3 (бертолетовая соль) Получение: 3 Cl 2 + 6 KOH = 5 KCl + KCl. O 3 + 3 H 2 O (горячий р-р) При нагревании: 4 KCl. O 3 = KCl + 3 KCl. O 4 2 KCl. O 3 = 2 KCl + 3 O 2
Соли хлорнованой хлораты кислоты - KCl. O 3 (бертолетовая соль) Получение: 3 Cl 2 + 6 KOH = 5 KCl + KCl. O 3 + 3 H 2 O (горячий р-р) При нагревании: 4 KCl. O 3 = KCl + 3 KCl. O 4 2 KCl. O 3 = 2 KCl + 3 O 2
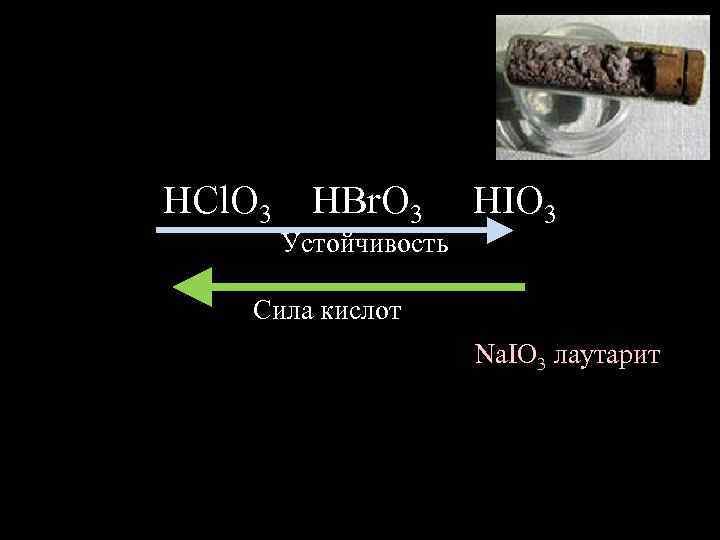 HCl. O 3 HBr. O 3 Устойчивость HIO 3 Сила кислот Na. IO 3 лаутарит
HCl. O 3 HBr. O 3 Устойчивость HIO 3 Сила кислот Na. IO 3 лаутарит
 Соединения Cl (+6) Cl 2 O 6 темно-красная жидкость, взрывается
Соединения Cl (+6) Cl 2 O 6 темно-красная жидкость, взрывается
 Соединения Сl (+7) Cl 2 O 7 б/ц жидкость неустойчив 2 Cl 2 O 7 = 2 Cl 2 +7 O 2 ( со взрывом при 1200 С) Получают 2 HCl. O 4 + Р 2 О 5 = Сl 2 O 7 + 2 HPO 3
Соединения Сl (+7) Cl 2 O 7 б/ц жидкость неустойчив 2 Cl 2 O 7 = 2 Cl 2 +7 O 2 ( со взрывом при 1200 С) Получают 2 HCl. O 4 + Р 2 О 5 = Сl 2 O 7 + 2 HPO 3
 HCl. O 4 –хлорная кислота. Очень сильная При хранении конц. краснеет, взрыв. 2 HCl. O 4 = 4 Сl. O 2 +3 O 2 +2 H 2 O
HCl. O 4 –хлорная кислота. Очень сильная При хранении конц. краснеет, взрыв. 2 HCl. O 4 = 4 Сl. O 2 +3 O 2 +2 H 2 O
 Соли хлорной кислоты – перхлораты. Перхлораты тяжелых металлов взрываются, щелочных - устойчивы
Соли хлорной кислоты – перхлораты. Перхлораты тяжелых металлов взрываются, щелочных - устойчивы
 Соединения Br (+7) и I (+7) H 5 IO 6 ортоиодная кислота H 3 IO 5 мезоиодная HIO 4 метоиодная Полимеризуется в растворах 3 H 5 IO 6 = H 7 I 3 O 14 +4 H 2 O Соли - периодаты KIO 3 +Cl 2 +6 KOH=K 5 IO 6 +2 KCl+3 H 2 O
Соединения Br (+7) и I (+7) H 5 IO 6 ортоиодная кислота H 3 IO 5 мезоиодная HIO 4 метоиодная Полимеризуется в растворах 3 H 5 IO 6 = H 7 I 3 O 14 +4 H 2 O Соли - периодаты KIO 3 +Cl 2 +6 KOH=K 5 IO 6 +2 KCl+3 H 2 O
 Сравнительная характеристика кислородсодержащих соединений Cl. O- Cl. O 2 - Cl. O 3 - Cl. O 4 Гипохлорит хлорат пехлорат ОКИСЛИТЕЛЬНАЯ СПОСОБНОСТЬ
Сравнительная характеристика кислородсодержащих соединений Cl. O- Cl. O 2 - Cl. O 3 - Cl. O 4 Гипохлорит хлорат пехлорат ОКИСЛИТЕЛЬНАЯ СПОСОБНОСТЬ
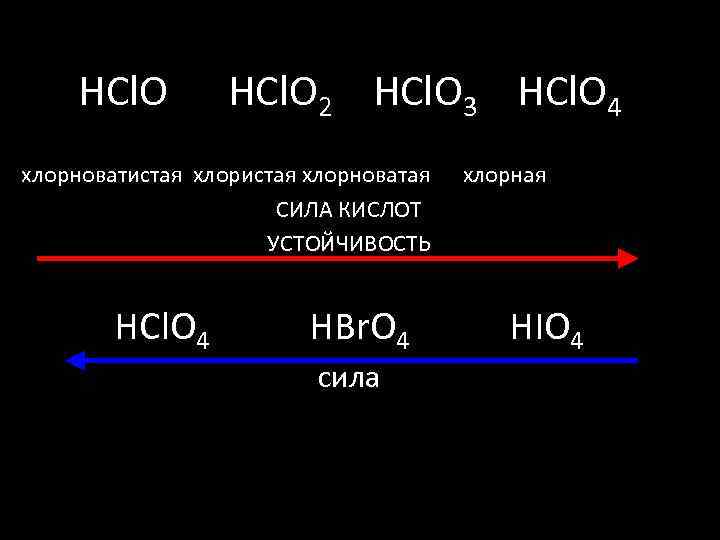 HCl. O 2 HCl. O 3 HCl. O 4 хлорноватистая хлорноватая хлорная СИЛА КИСЛОТ УСТОЙЧИВОСТЬ HCl. O 4 HBr. O 4 HIO 4 сила
HCl. O 2 HCl. O 3 HCl. O 4 хлорноватистая хлорноватая хлорная СИЛА КИСЛОТ УСТОЙЧИВОСТЬ HCl. O 4 HBr. O 4 HIO 4 сила
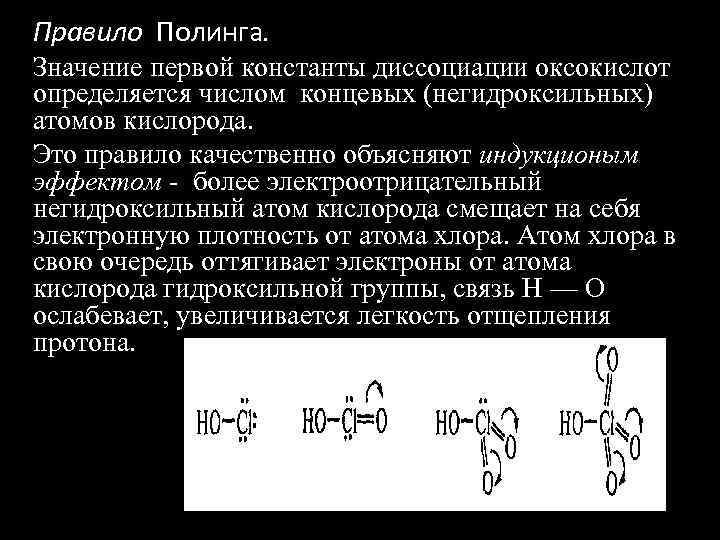 Правило Полинга. Значение первой константы диссоциации оксокислот определяется числом концевых (негидроксильных) атомов кислорода. Это правило качественно объясняют индукционым эффектом - более электроотрицательный негидроксильный атом кислорода смещает на себя электронную плотность от атома хлора. Атом хлора в свою очередь оттягивает электроны от атома кислорода гидроксильной группы, связь Н — О ослабевает, увеличивается легкость отщепления протона.
Правило Полинга. Значение первой константы диссоциации оксокислот определяется числом концевых (негидроксильных) атомов кислорода. Это правило качественно объясняют индукционым эффектом - более электроотрицательный негидроксильный атом кислорода смещает на себя электронную плотность от атома хлора. Атом хлора в свою очередь оттягивает электроны от атома кислорода гидроксильной группы, связь Н — О ослабевает, увеличивается легкость отщепления протона.
 Получение галогенов Фтор получают электролизом расплава флюорита Ca. F 2. Для понижения температуры плавления добавляют HF. Материалом для электролизера служат медь, никель и сталь. Стенки электролизера прокладывают плотной пленкой фторида. Катодное и анодное пространство разделяют, чтоб предотвратить взрыв смеси фтора с водородом. Ю выделяющимся на катоде.
Получение галогенов Фтор получают электролизом расплава флюорита Ca. F 2. Для понижения температуры плавления добавляют HF. Материалом для электролизера служат медь, никель и сталь. Стенки электролизера прокладывают плотной пленкой фторида. Катодное и анодное пространство разделяют, чтоб предотвратить взрыв смеси фтора с водородом. Ю выделяющимся на катоде.
 •
•
 Бром, содержащийся в морской воде и буровых водах в виде бромидов получают действием хлора при р. Н=3, 5 2 Na. Br + Cl 2 = 2 Na. Cl + Br 2 Иод аналогично получают из морской воды, буровых вод и золы водорослей
Бром, содержащийся в морской воде и буровых водах в виде бромидов получают действием хлора при р. Н=3, 5 2 Na. Br + Cl 2 = 2 Na. Cl + Br 2 Иод аналогично получают из морской воды, буровых вод и золы водорослей
 Применение Мировое производство фтора измеряется тысячами тонн в год. Примерно половина этого количества расходуется на перевод урана в гексафторид, который затем разделяют на изотопы. Фтор применяют для получения фторорганических материалов: фторопластов, световодов для опто-электроники, высокотемпературных ионных проводников.
Применение Мировое производство фтора измеряется тысячами тонн в год. Примерно половина этого количества расходуется на перевод урана в гексафторид, который затем разделяют на изотопы. Фтор применяют для получения фторорганических материалов: фторопластов, световодов для опто-электроники, высокотемпературных ионных проводников.
 Безводный НF используется главным образом при органических синтезах, а плавиковая кислота — для получения фторидов, травления стекла, удаления песка с металлического лития, при анализах минералов. Широкое применение находят также некоторые фториды
Безводный НF используется главным образом при органических синтезах, а плавиковая кислота — для получения фторидов, травления стекла, удаления песка с металлического лития, при анализах минералов. Широкое применение находят также некоторые фториды
 • Ежегодно в мире производится около 50 млн тонн хлора, который используется в качестве сильного и недорогого окислителя при отбеливании целлюлозы, в органическом синтезе, при обеззараживании питьевой воды, а также для получения красителей, фотоматериалов и лекарств. • Ежегодное мировое потребление соляной кислоты исчисляется миллионами тонн. Широкое практическое применение находят также многие ее соли.
• Ежегодно в мире производится около 50 млн тонн хлора, который используется в качестве сильного и недорогого окислителя при отбеливании целлюлозы, в органическом синтезе, при обеззараживании питьевой воды, а также для получения красителей, фотоматериалов и лекарств. • Ежегодное мировое потребление соляной кислоты исчисляется миллионами тонн. Широкое практическое применение находят также многие ее соли.
 • Бром является сырьем для синтеза броморганических веществ, а также бромоводорода, бромидов и броматов. • Основное применение иода и его соединений связано с фармацевтической промышленностью, медициной и фотографией.
• Бром является сырьем для синтеза броморганических веществ, а также бромоводорода, бромидов и броматов. • Основное применение иода и его соединений связано с фармацевтической промышленностью, медициной и фотографией.
 Токсикология Галогены принадлежат к токсичным веществам. Жидкие галогены обладают сильным кожепоражающим действием, а газообразные — вызывают даже в очень небольших концентрациях воспаление органов дыхания.
Токсикология Галогены принадлежат к токсичным веществам. Жидкие галогены обладают сильным кожепоражающим действием, а газообразные — вызывают даже в очень небольших концентрациях воспаление органов дыхания.
 Фториды металлов — протоплазматические яды, действующие в основном на ферменты. Хроническое отравление фторидами может быть вызвано как повышенным их содержанием в питьевой воде, так и вдыханием их с воздухом в виде пыли. В результате подобного отравления наблюдается разрушение зубной эмали и существенно увеличивается хрупкость костей. ПДК связанного фтора в воздухе производственных помещений = 5. 10 4 мг/л.
Фториды металлов — протоплазматические яды, действующие в основном на ферменты. Хроническое отравление фторидами может быть вызвано как повышенным их содержанием в питьевой воде, так и вдыханием их с воздухом в виде пыли. В результате подобного отравления наблюдается разрушение зубной эмали и существенно увеличивается хрупкость костей. ПДК связанного фтора в воздухе производственных помещений = 5. 10 4 мг/л.
 • Оксиды галогенов и интергалогениды — высокотоксичные вещества. • Хлораты щелочных металлов относят к кровяным ядам, вызывающим распад эритроцитов • Предельно допустимой концентрацией хлористого водорода в воздухе производственных , помещений считается 0, 005 мг/л. Наличие уже 0, 05 мг/л быстро вызывает раздражение в носу и гортани, колотье в груди, хрипоту и ощущение удушья.
• Оксиды галогенов и интергалогениды — высокотоксичные вещества. • Хлораты щелочных металлов относят к кровяным ядам, вызывающим распад эритроцитов • Предельно допустимой концентрацией хлористого водорода в воздухе производственных , помещений считается 0, 005 мг/л. Наличие уже 0, 05 мг/л быстро вызывает раздражение в носу и гортани, колотье в груди, хрипоту и ощущение удушья.
 По токсическому действию паров бром похож на хлор. Чрезмерное накопление, бромидов в организме способствует появлению кожных сыпей.
По токсическому действию паров бром похож на хлор. Чрезмерное накопление, бромидов в организме способствует появлению кожных сыпей.
 Соединения иода играют важную роль в регулировании обмена веществ. У животных организмов иод накапливается главным образом в щитовидной железе. Тело человека содержит около 25 мг иода, из которых примерно 15 мг находится в щитовидной железе. Недостаток иода служит причиной заболеваний щитовидной железы. Избыточное поступление иода в организм вызывает насморк, кожные сыпи и т. д. , исчезающие при прекращении приема иода.
Соединения иода играют важную роль в регулировании обмена веществ. У животных организмов иод накапливается главным образом в щитовидной железе. Тело человека содержит около 25 мг иода, из которых примерно 15 мг находится в щитовидной железе. Недостаток иода служит причиной заболеваний щитовидной железы. Избыточное поступление иода в организм вызывает насморк, кожные сыпи и т. д. , исчезающие при прекращении приема иода.


