24_Ковалентная связь.ppt
- Количество слайдов: 26

Ковалентная связь Лекция 24 по курсу «Общая химия»

Что такое ковалентная связь? Связь посредством образования общей электронной пары (пар). Откуда берутся электроны – неважно! Г. Н. Льюис Бывает полярная и неполярная +–Cl – – обозначение полярности H Полярность связи определяется ЭО атомов, образующих ее! (подробнее см. предыдущую лекцию)
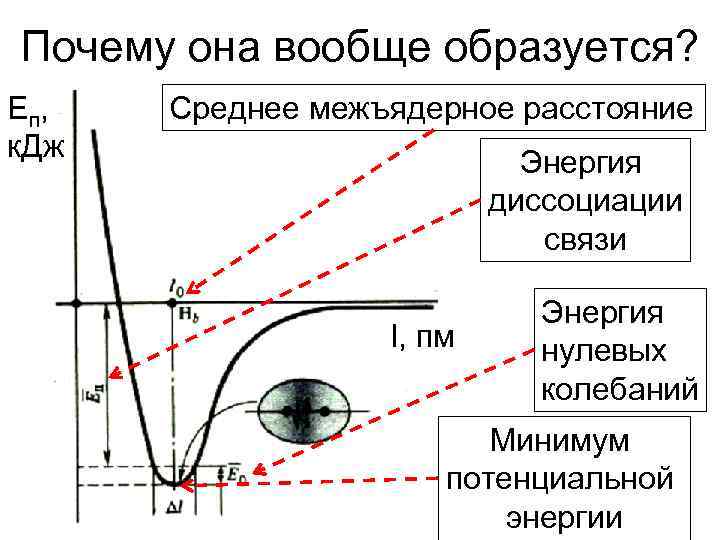
Почему она вообще образуется? E п, к. Дж Среднее межъядерное расстояние Энергия диссоциации связи l, пм Энергия нулевых колебаний Минимум потенциальной энергии

Механизмы образования ковалентной связи H + Cl H: Cl (или H–Cl) Обменный механизм H 3 N: + + H H 3 +: H N (или NH 4 +) Донорно-акцепторный механизм Все 4 связи в ионе NH 4+ неразличимы! Донорно-акцепторная – не особый вид связи, а особый способ ее образования!

Метод валентных связей 1. Причина связи – электростатическое взаимодействие ядер и электронов. 2. Связь образуется парой электронов с антипараллельными (противоположного знака) спинами. 3. Общая электронная пара принадлежит двум атомам одновременно. 4. Прочность связи пропорциональна степени перекрывания (наложения друг на друга) электронных облаков.
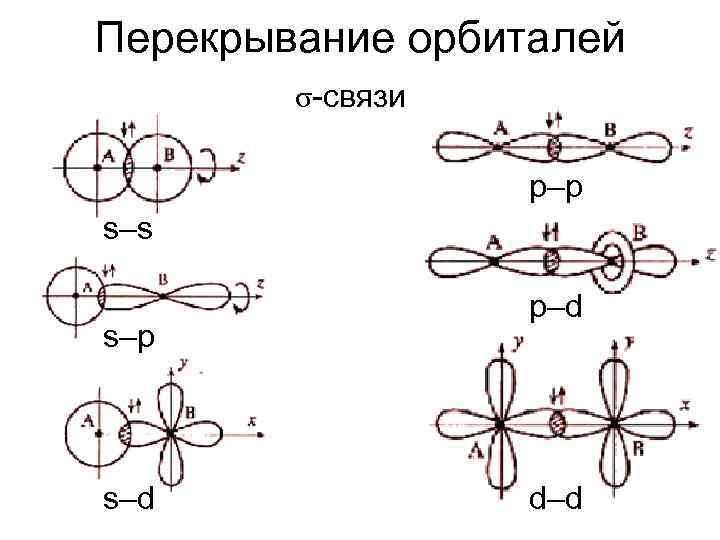
Перекрывание орбиталей σ-связи p–p s–s s–p s–d p–d d–d
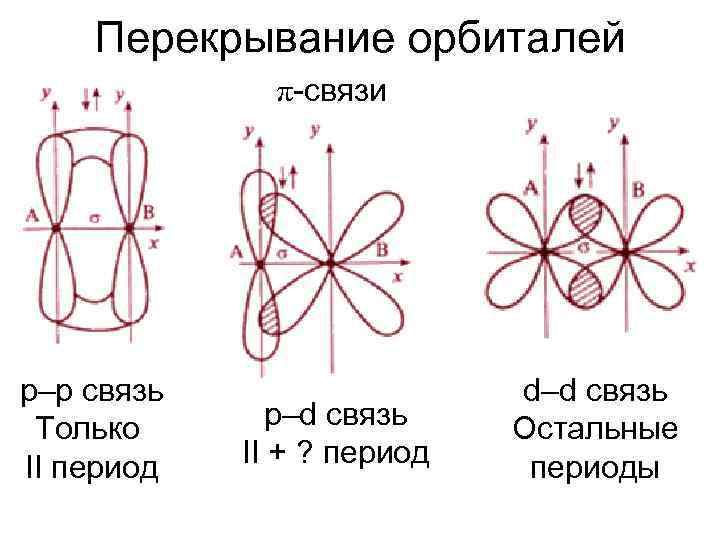
Перекрывание орбиталей π-связи p–p связь Только II период p–d связь II + ? период d–d связь Остальные периоды
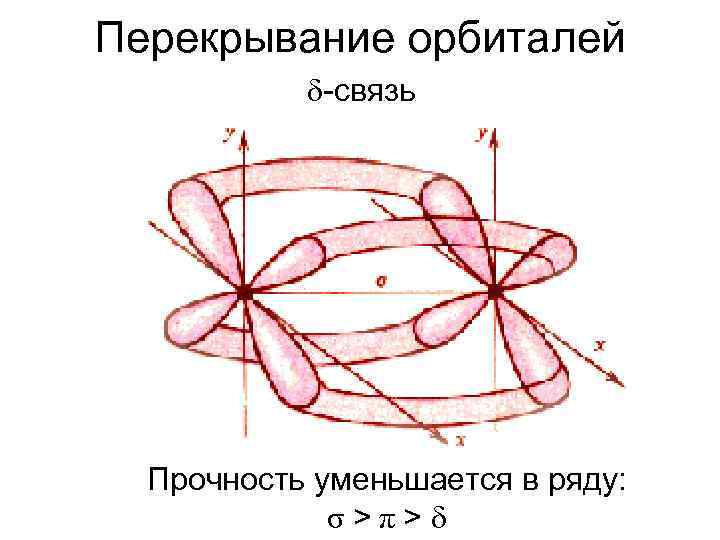
Перекрывание орбиталей -связь Прочность уменьшается в ряду: σ>π>
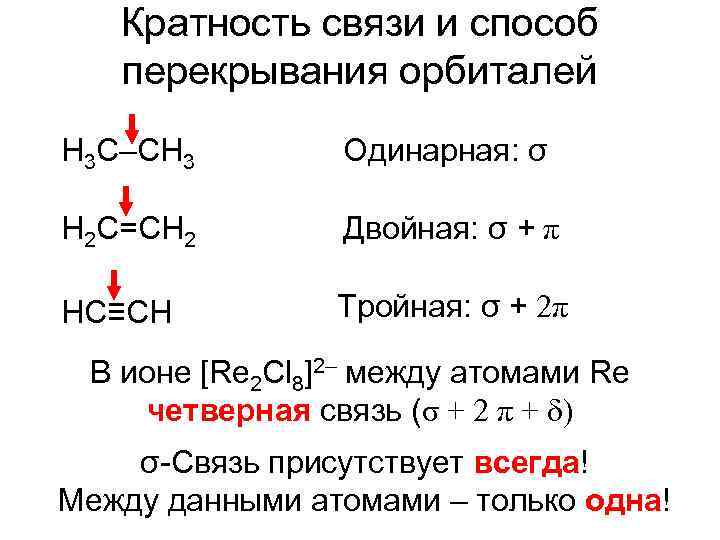
Кратность связи и способ перекрывания орбиталей H 3 C–CH 3 Одинарная: σ H 2 C=CH 2 Двойная: σ + π HC≡CH Тройная: σ + 2π В ионе [Re 2 Cl 8]2– между атомами Re четверная связь (σ + 2 π + ) σ-Связь присутствует всегда! Между данными атомами – только одна!
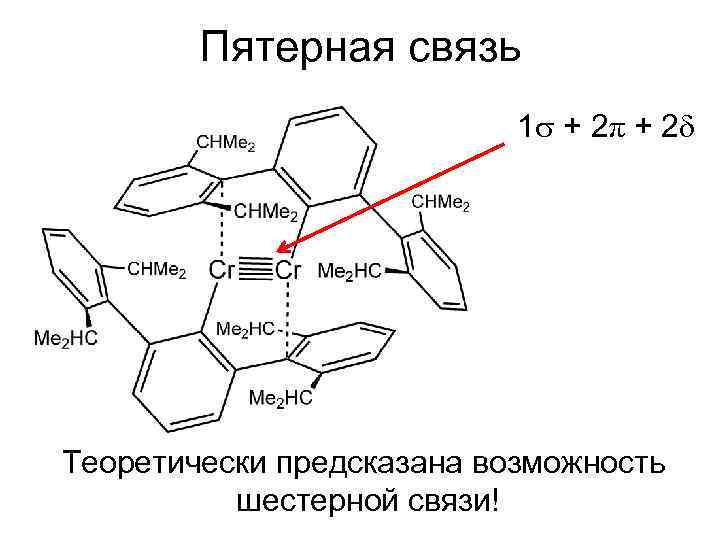
Пятерная связь 1 + 2π + 2 Теоретически предсказана возможность шестерной связи!
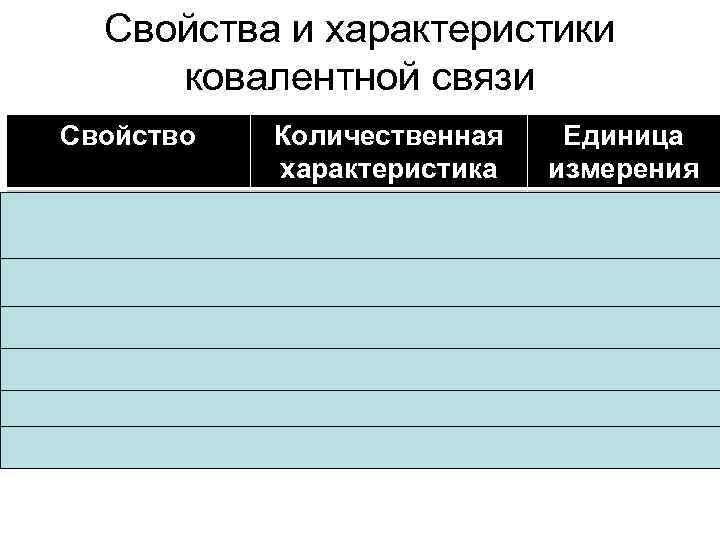
Свойства и характеристики ковалентной связи Свойство Количественная характеристика Длина Межъядерное расстояние Прочность Энергия связи Направленность Валентный угол Насыщаемость Валентность Полярность Дипольный момент Поляризуемость Единица измерения нм к. Дж/моль градус – Кл м м 3

Длина связи Связь Длина (пм) С−С 154 С−О 143 С=С 133 С=О 123 С≡С 131 С≡O 113 Чем больше кратность, тем короче (Верно только для однотипных связей!!!)
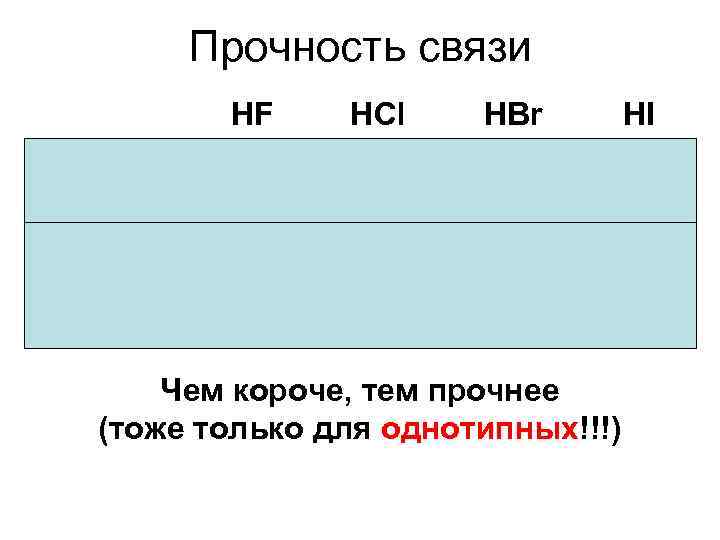
Прочность связи HF Длина связи, пм Энергия связи, к. Дж/моль HCl HBr HI 92 128 141 160 565 431 364 217 Чем короче, тем прочнее (тоже только для однотипных!!!)

Энергия связи и энтальпия образования молекулы 2 Н 2 О = 2 Н 2 + О 2; ΔH = 484 к. Дж/моль Н 2 = 2 Н; ΔH = 432 к. Дж/моль О 2 = 2 О; ΔH = 494 к. Дж/моль В двух молекулах воды содержится 4 связи. Энергия связи O–H равна: Е(ОН) = (2. 432 + 494 + 484)/4 = 460, 5 к. Дж/моль Можно и наоборот: по энергиям связей оценить ΔH реакции Е(I–I) = 151 к. Дж/моль, Е(H–I) = 298 к. Дж/моль Рассчитайте тепловой эффект образования HI
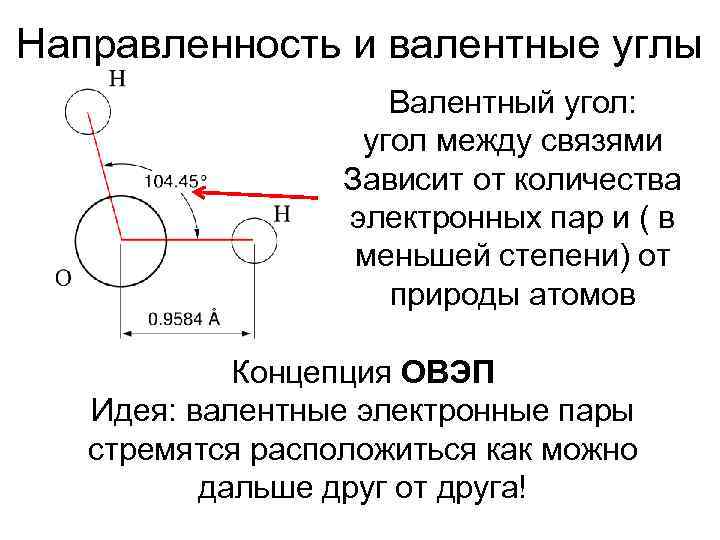
Направленность и валентные углы Валентный угол: угол между связями Зависит от количества электронных пар и ( в меньшей степени) от природы атомов Концепция ОВЭП Идея: валентные электронные пары стремятся расположиться как можно дальше друг от друга!
Геометрия молекул по Гиллеспи Тип Форма молекулы Расположение электронов Геометрия Примеры AX 1 En Двухатомная HF, O 2 AX 2 E 0 Линейная Be. Cl 2, Hg. Cl 2, CO 2 AX 2 E 1 Угловая NO 2−, SO 2, O 3 AX 2 E 2 Угловая H 2 O, OF 2
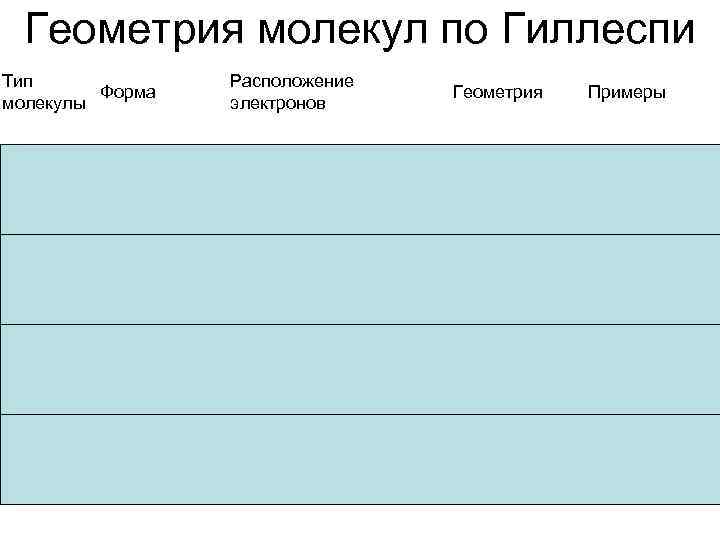
Геометрия молекул по Гиллеспи Тип Форма молекулы Расположение электронов Геометрия Примеры Линейная Xe. F 2, I 3− AX 3 E 0 Треугольная BF 3, CO 32−, NO 3−, SO 3 AX 3 E 1 Тригональная пирамида NH 3, PCl 3 AX 3 E 2 Т-образная Cl. F 3, Br. F 3 AX 2 E 3

Геометрия молекул по Гиллеспи AX 4 E 0 Тетраэдрическая CH 4, PO 43−, SO 42−, Cl. O 4− AX 4 E 1 «Качели» SF 4 AX 4 E 2 Квадратная Xe. F 4 AX 5 E 0 Тригональная бипирамида PCl 5

Геометрия молекул по Гиллеспи AX 5 E 1 Квадратная пирамида Cl. F 5, Br. F 5 AX 6 E 0 Октаэдр SF 6 AX 6 E 1 Пентагональная пирамида Xe. F 6 AX 7 E 0 Пентагональная бипирамида IF 7
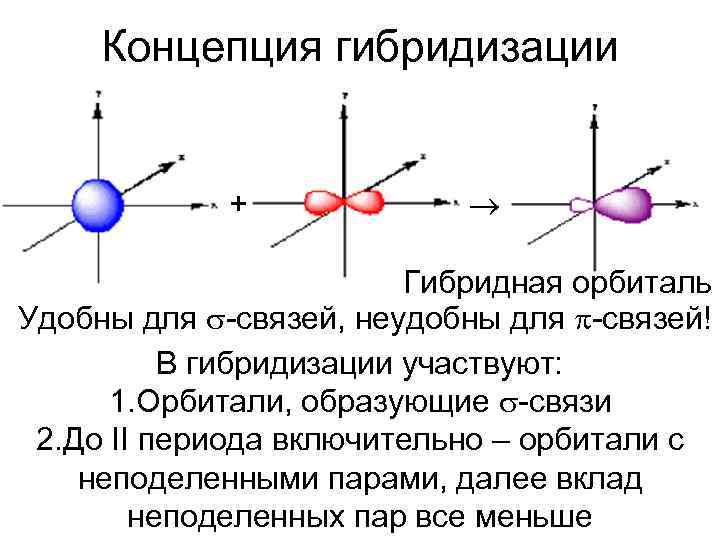
Концепция гибридизации + Гибридная орбиталь Удобны для -связей, неудобны для -связей! В гибридизации участвуют: 1. Орбитали, образующие -связи 2. До II периода включительно – орбитали с неподеленными парами, далее вклад неподеленных пар все меньше
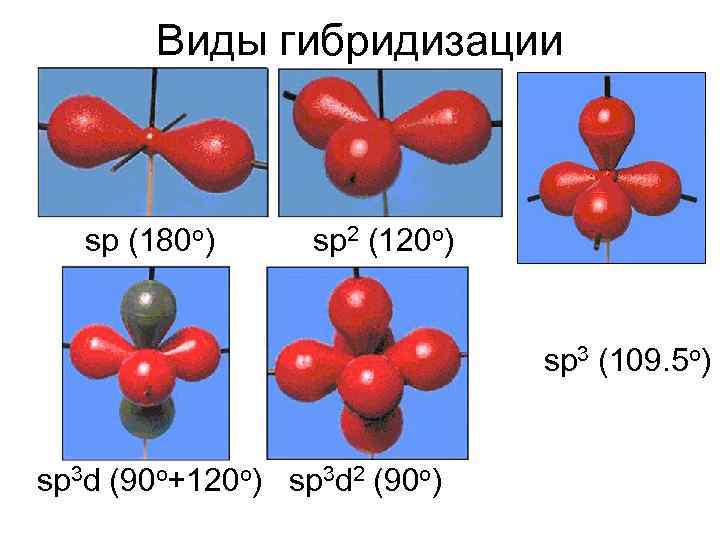
Виды гибридизации sp (180 o) sp 2 (120 o) sp 3 (109. 5 o) sp 3 d (90 o+120 o) sp 3 d 2 (90 o)
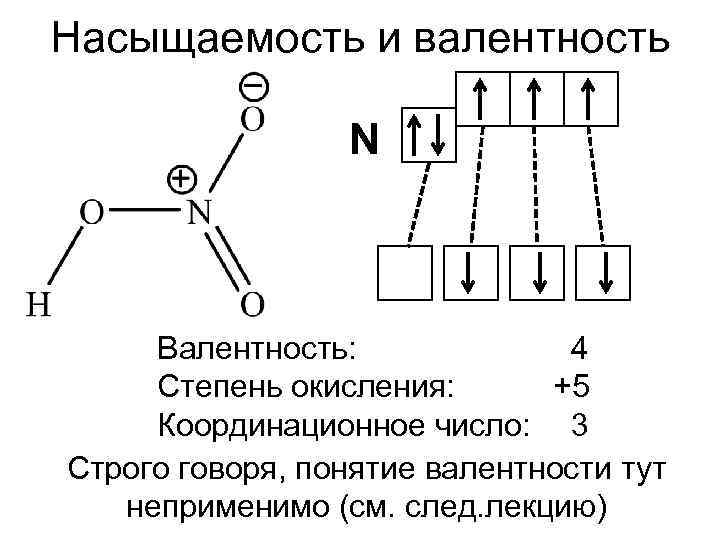
Насыщаемость и валентность N Валентность: 4 Степень окисления: +5 Координационное число: 3 Строго говоря, понятие валентности тут неприменимо (см. след. лекцию)

Дипольный момент Произведение абсолютной величины точечного заряда на расстояние между этими зарядами: μ = q l Единица измерения по системе СИ: Кл м П. Дебай Часто выражают в дебаях: 1 Д = 3, 336 10– 30 Кл м
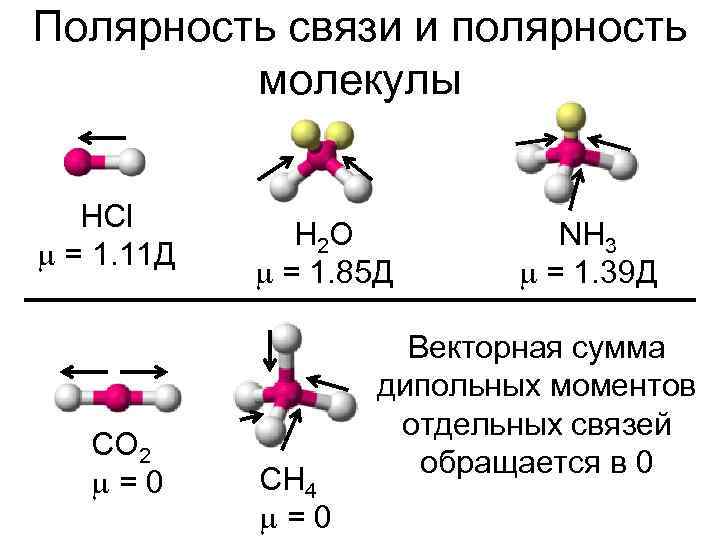
Полярность связи и полярность молекулы HCl = 1. 11 Д CO 2 =0 H 2 O = 1. 85 Д CH 4 =0 NH 3 = 1. 39 Д Векторная сумма дипольных моментов отдельных связей обращается в 0

Поляризуемость Способность частиц приобретать или изменять дипольный момент под действием электрического поля Индуцированный дипольный момент Напряженность электрического поля = E Поляризуемость

Особенности поляризуемости • Увеличивается с ростом радиуса частицы; • Чем > поляризуемость связи, тем легче ее разрыв по ионному типу; • Аддитивная величина! (поляризуемость молекулы равна сумме поляризуемостей атомов или групп в ее составе) 1 2 1 < 2 C–I > C–Cl CH 4 = C + 4 H
24_Ковалентная связь.ppt