Коррозия, методы защиты от коррозии.pptx
- Количество слайдов: 30
 КОРРОЗИЯ, МЕТОДЫ ЗАЩИТЫ ОТ КОРРОЗИИ
КОРРОЗИЯ, МЕТОДЫ ЗАЩИТЫ ОТ КОРРОЗИИ
 Определение коррозии Коррозией называют процесс самопроизвольного разрушения металлов при их контакте с окружающей средой. Коррозия является процессом перехода из металлического состояния в ионное. Она сопровождается уменьшением свободной энергии (металлическое состояние имеет больший запас энергии относительно ионного) Коррозия термодинамически возможный процесс
Определение коррозии Коррозией называют процесс самопроизвольного разрушения металлов при их контакте с окружающей средой. Коррозия является процессом перехода из металлического состояния в ионное. Она сопровождается уменьшением свободной энергии (металлическое состояние имеет больший запас энергии относительно ионного) Коррозия термодинамически возможный процесс
 Виды коррозии Химическая – взаимодействие металлов с сухими газами или жидкостями, не проводящими электрический ток Электрохимическая коррозия – разрушение металла при контакте с электролитом с возникновением в системе электрического тока Подземная коррозия – почвенная и коррозия блуждающими токами (электрокоррозия)
Виды коррозии Химическая – взаимодействие металлов с сухими газами или жидкостями, не проводящими электрический ток Электрохимическая коррозия – разрушение металла при контакте с электролитом с возникновением в системе электрического тока Подземная коррозия – почвенная и коррозия блуждающими токами (электрокоррозия)
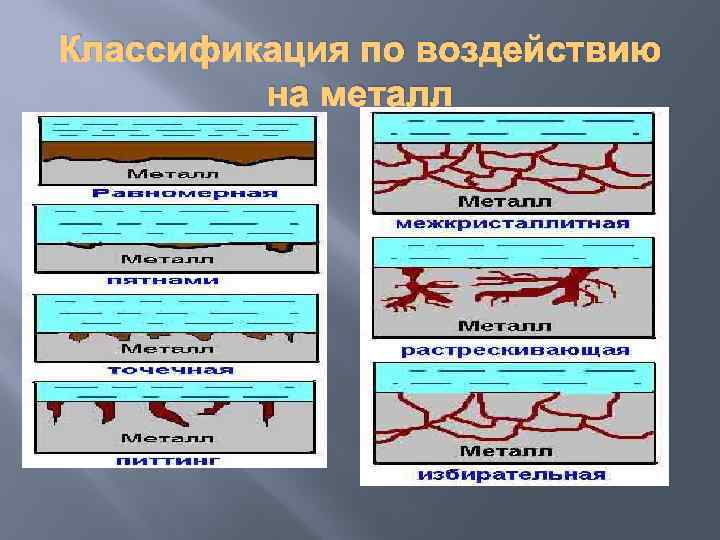 Классификация по воздействию на металл
Классификация по воздействию на металл
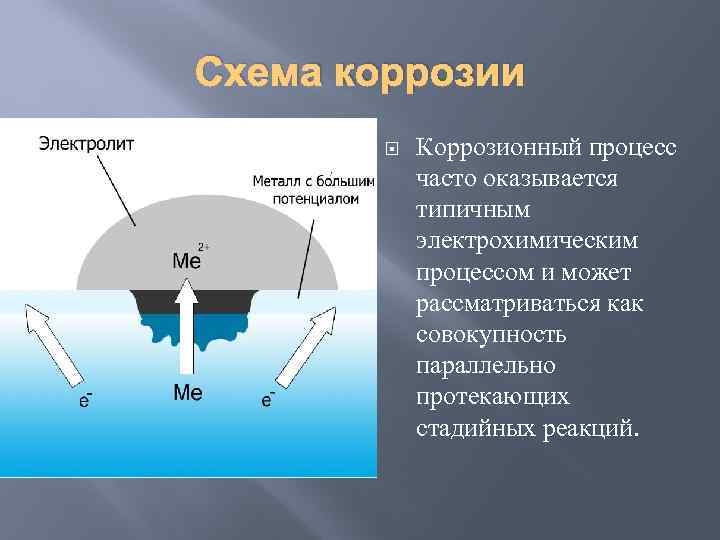 Схема коррозии Коррозионный процесс часто оказывается типичным электрохимическим процессом и может рассматриваться как совокупность параллельно протекающих стадийных реакций.
Схема коррозии Коррозионный процесс часто оказывается типичным электрохимическим процессом и может рассматриваться как совокупность параллельно протекающих стадийных реакций.
 Механизм поляризации цинка в соляной кислоте
Механизм поляризации цинка в соляной кислоте
 Скорость растворения цинка
Скорость растворения цинка
 Стационарный потенциал
Стационарный потенциал
 Различия между стационарным и равновесным потенциалом РАВНОВЕСНЫЙ равенство скоростей реакций с участием окисленной и восстановленной форм одного и того же вещества состав фаз постоянен не зависит от состояния поверхности электрода от природы материала электрода, если он непосредственно не участвует в установлении равновесия СТАЦИОНАРНЫЙ равенство суммарных скоростей катодных и анодных реакций для нескольких различных систем. Химический состав системы постепенно изменяется. Потенциал должен меняться во времени. зависит от всех факторов, которые влияют на скорость электродных процессов. стационарные потенциалы часто плохо воспроизводимы
Различия между стационарным и равновесным потенциалом РАВНОВЕСНЫЙ равенство скоростей реакций с участием окисленной и восстановленной форм одного и того же вещества состав фаз постоянен не зависит от состояния поверхности электрода от природы материала электрода, если он непосредственно не участвует в установлении равновесия СТАЦИОНАРНЫЙ равенство суммарных скоростей катодных и анодных реакций для нескольких различных систем. Химический состав системы постепенно изменяется. Потенциал должен меняться во времени. зависит от всех факторов, которые влияют на скорость электродных процессов. стационарные потенциалы часто плохо воспроизводимы
 Метод определения стационарного потенциала и тока саморастворения Координаты точки пересечения поляризационных кривых, соответствующих эффективным скоростям растворения металла (–i 1) и выделения водорода (i 2), отвечают lg ic и Еc.
Метод определения стационарного потенциала и тока саморастворения Координаты точки пересечения поляризационных кривых, соответствующих эффективным скоростям растворения металла (–i 1) и выделения водорода (i 2), отвечают lg ic и Еc.
 коррозией с кислородной деполяризацией.
коррозией с кислородной деполяризацией.
 Общее условие саморастворения металлов имеет вид: Me E p < Ox Ep , где Ox E p— равновесный потенциал сопряженного электрохимического процесса с участием окислителя Ох.
Общее условие саморастворения металлов имеет вид: Me E p < Ox Ep , где Ox E p— равновесный потенциал сопряженного электрохимического процесса с участием окислителя Ох.
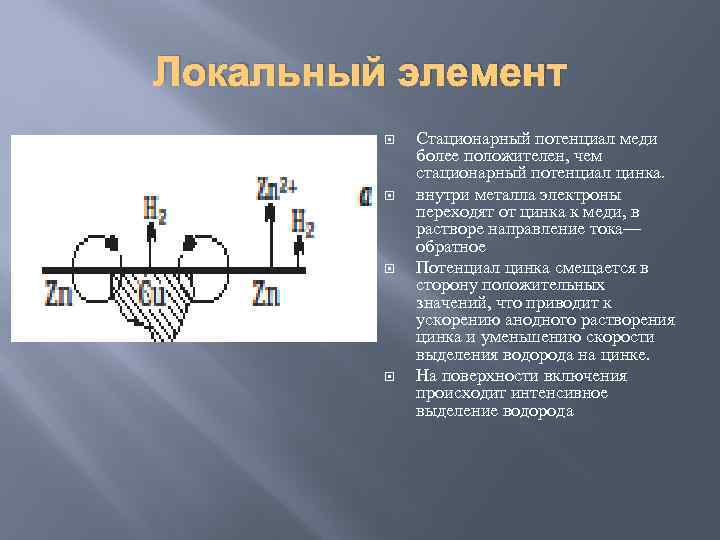 Локальный элемент Стационарный потенциал меди более положителен, чем стационарный потенциал цинка. внутри металла электроны переходят от цинка к меди, в растворе направление тока— обратное Потенциал цинка смещается в сторону положительных значений, что приводит к ускорению анодного растворения цинка и уменьшению скорости выделения водорода на цинке. На поверхности включения происходит интенсивное выделение водорода
Локальный элемент Стационарный потенциал меди более положителен, чем стационарный потенциал цинка. внутри металла электроны переходят от цинка к меди, в растворе направление тока— обратное Потенциал цинка смещается в сторону положительных значений, что приводит к ускорению анодного растворения цинка и уменьшению скорости выделения водорода на цинке. На поверхности включения происходит интенсивное выделение водорода
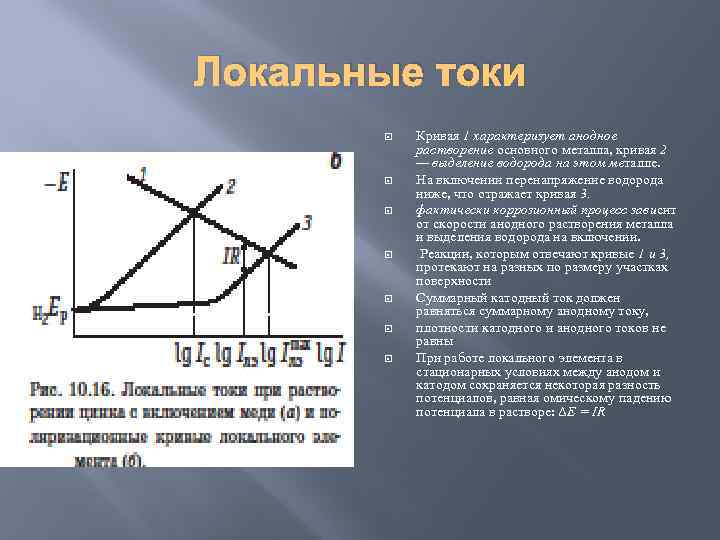 Локальные токи Кривая 1 характеризует анодное растворение основного металла, кривая 2 — выделение водорода на этом металле. На включении перенапряжение водорода ниже, что отражает кривая 3. фактически коррозионный процесс зависит от скорости анодного растворения металла и выделения водорода на включении. Реакции, которым отвечают кривые 1 и 3, протекают на разных по размеру участках поверхности Суммарный катодный ток должен равняться суммарному анодному току, плотности катодного и анодного токов не равны При работе локального элемента в стационарных условиях между анодом и катодом сохраняется некоторая разность потенциалов, равная омическому падению потенциала в растворе: ΔE = IR
Локальные токи Кривая 1 характеризует анодное растворение основного металла, кривая 2 — выделение водорода на этом металле. На включении перенапряжение водорода ниже, что отражает кривая 3. фактически коррозионный процесс зависит от скорости анодного растворения металла и выделения водорода на включении. Реакции, которым отвечают кривые 1 и 3, протекают на разных по размеру участках поверхности Суммарный катодный ток должен равняться суммарному анодному току, плотности катодного и анодного токов не равны При работе локального элемента в стационарных условиях между анодом и катодом сохраняется некоторая разность потенциалов, равная омическому падению потенциала в растворе: ΔE = IR
 Снижение скорости коррозии Повышение чистоты индивидуального металла — один из путей снижения скорости его коррозии. при создании металлических конструкций из различных металлов (или сплавов) следует учитывать возникновение между металлами электрических токов, которые могут привести к разрушению отдельных частей конструкций
Снижение скорости коррозии Повышение чистоты индивидуального металла — один из путей снижения скорости его коррозии. при создании металлических конструкций из различных металлов (или сплавов) следует учитывать возникновение между металлами электрических токов, которые могут привести к разрушению отдельных частей конструкций
 Катодная защита - заключается в том, что защищаемая конструкция "А", находящаяся в среде электролита (например, в почвенной воде), присоединяется к катоду (отрицательно заряженный электрод) источника электричества. Защищаемая конструкция становится катодом. В ту же агрессивную среду помещают кусок старого металла (рельс или балка), присоединяемый к аноду внешего источника электричества. В процессе коррозии этот кусок старого металла становится анодом и разрушается
Катодная защита - заключается в том, что защищаемая конструкция "А", находящаяся в среде электролита (например, в почвенной воде), присоединяется к катоду (отрицательно заряженный электрод) источника электричества. Защищаемая конструкция становится катодом. В ту же агрессивную среду помещают кусок старого металла (рельс или балка), присоединяемый к аноду внешего источника электричества. В процессе коррозии этот кусок старого металла становится анодом и разрушается
 Протекторная защита -отличается от катодной защиты тем, что для её осуществления используется специальный анод - протектор, в качестве которого применяют металл более активный, чем металл защищаемой конструкции (алюминий, цинк). Протектор соединяют с защищаемой конструкцией проводником электрического тока. В процессе коррозии протектор служит анодом (положительно заряженный электрод) и разрушается, тем самым предохраняя от разрушения нашу охраняемую конструкцию.
Протекторная защита -отличается от катодной защиты тем, что для её осуществления используется специальный анод - протектор, в качестве которого применяют металл более активный, чем металл защищаемой конструкции (алюминий, цинк). Протектор соединяют с защищаемой конструкцией проводником электрического тока. В процессе коррозии протектор служит анодом (положительно заряженный электрод) и разрушается, тем самым предохраняя от разрушения нашу охраняемую конструкцию.
 процесс повреждения металлических защитных покрытий. 1. Если металл покрыт менее активным металлом. Например, олово (Sn) хорошо покрывает железо (Fe) и достаточно стойко против действия разбавленных кислот. В случае повреждения такого покрытия возникает гальваническая пара, в которой электроны переходят от железа к олову, то есть анод - железо (оно растворяется и разрушается), а катод - олово (остаётся без изменений).
процесс повреждения металлических защитных покрытий. 1. Если металл покрыт менее активным металлом. Например, олово (Sn) хорошо покрывает железо (Fe) и достаточно стойко против действия разбавленных кислот. В случае повреждения такого покрытия возникает гальваническая пара, в которой электроны переходят от железа к олову, то есть анод - железо (оно растворяется и разрушается), а катод - олово (остаётся без изменений).
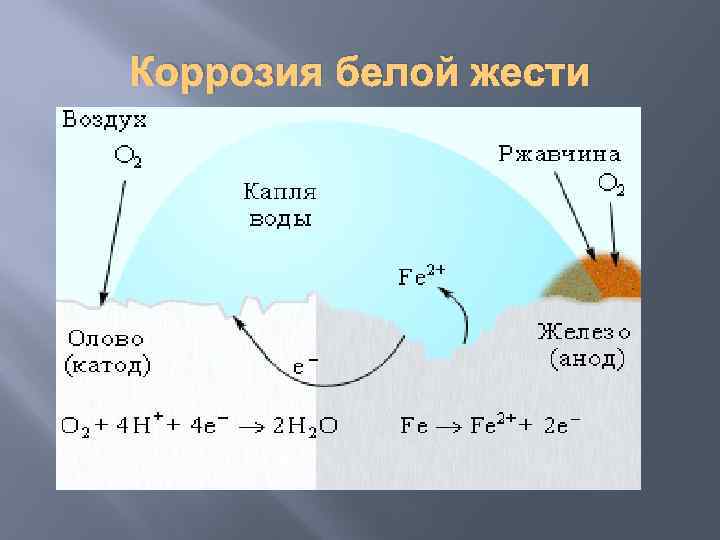 Коррозия белой жести
Коррозия белой жести
 . Если металл покрытия более активный, чем защищаемый металл. Например, покрытия железа (Fe) цинком (Zn). При механическом повреждении цинкового покрытия возникает гальвангическая пара, в которой железо служит катодом (не растворяется), а цинк - анодом. В этом случае железо не будет разрушаться до тех пор, пока не разрушится весь цинк. Из этих случаев можно сделать вывод, что более надёжное защитное покрытие то, что из металла более активного, чем защищаемый металл.
. Если металл покрытия более активный, чем защищаемый металл. Например, покрытия железа (Fe) цинком (Zn). При механическом повреждении цинкового покрытия возникает гальвангическая пара, в которой железо служит катодом (не растворяется), а цинк - анодом. В этом случае железо не будет разрушаться до тех пор, пока не разрушится весь цинк. Из этих случаев можно сделать вывод, что более надёжное защитное покрытие то, что из металла более активного, чем защищаемый металл.
 Пассивация по достижении определенного значения потенциала скорость анодного растворения металла резко падает. Металл переходит в так называемое пассивное состояние, характеризуемое незначительными скоростями растворения
Пассивация по достижении определенного значения потенциала скорость анодного растворения металла резко падает. Металл переходит в так называемое пассивное состояние, характеризуемое незначительными скоростями растворения
 Анодная защита сдвинуть потенциал металла в область пассивности при помощи так называемой анодной защиты металлов. Для этого прибегают к анодной поляризации металла от внешнего источника тока. Анодную защиту осуществляют также, напыляя более благородный металл на защищаемый, используя благородные металлы в качестве легирующих добавок или протекторов. В результате основной металл поляризуется анодно и переходит в пассивное состояние. Переход в пассивное состояние может быть вызван присутствием в растворе окислителей, например кислорода и др.
Анодная защита сдвинуть потенциал металла в область пассивности при помощи так называемой анодной защиты металлов. Для этого прибегают к анодной поляризации металла от внешнего источника тока. Анодную защиту осуществляют также, напыляя более благородный металл на защищаемый, используя благородные металлы в качестве легирующих добавок или протекторов. В результате основной металл поляризуется анодно и переходит в пассивное состояние. Переход в пассивное состояние может быть вызван присутствием в растворе окислителей, например кислорода и др.
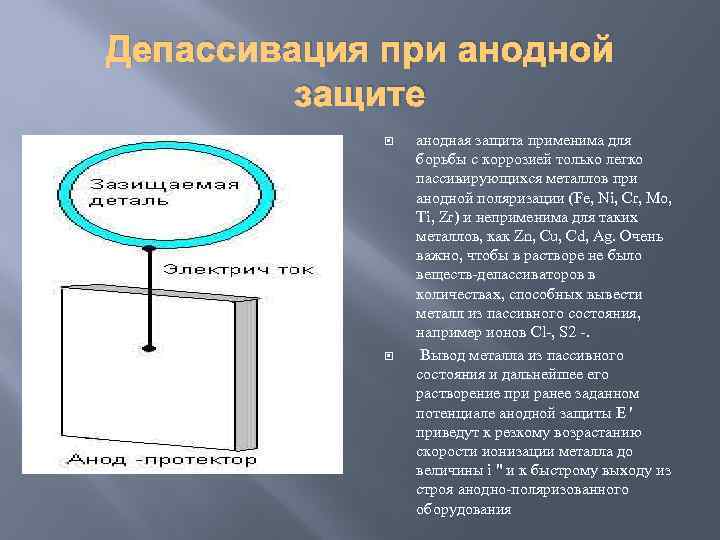 Депассивация при анодной защите анодная защита применима для борьбы с коррозией только легко пассивирующихся металлов при анодной поляризации (Fe, Ni, Cr, Mo, Ti, Zr) и неприменима для таких металлов, как Zn, Cu, Cd, Ag. Очень важно, чтобы в растворе не было веществ-депассиваторов в количествах, способных вывести металл из пассивного состояния, например ионов Cl-, S 2 -. Вывод металла из пассивного состояния и дальнейшее его растворение при ранее заданном потенциале анодной защиты E ' приведут к резкому возрастанию скорости ионизации металла до величины i " и к быстрому выходу из строя анодно-поляризованного оборудования
Депассивация при анодной защите анодная защита применима для борьбы с коррозией только легко пассивирующихся металлов при анодной поляризации (Fe, Ni, Cr, Mo, Ti, Zr) и неприменима для таких металлов, как Zn, Cu, Cd, Ag. Очень важно, чтобы в растворе не было веществ-депассиваторов в количествах, способных вывести металл из пассивного состояния, например ионов Cl-, S 2 -. Вывод металла из пассивного состояния и дальнейшее его растворение при ранее заданном потенциале анодной защиты E ' приведут к резкому возрастанию скорости ионизации металла до величины i " и к быстрому выходу из строя анодно-поляризованного оборудования
 ПРИНЦИП ИНГИБИТОРНОЙ ЗАЩИТЫ введение в агрессивную среду специально подобранных соединений - ингибиторов. Ингибиторы коррозии - это органические и неорганические вещества, присутствие которых в небольших количествах резко снижает скорость растворения металла и уменьшает его возможные вредные последствия. Метод ингибирования, как правило, отличается высокой экономичностью, легкостью производственного внедрения без изменения ранее принятого технологического режима, обычно не предусматривает для своей реализации специального дополнительного оборудования.
ПРИНЦИП ИНГИБИТОРНОЙ ЗАЩИТЫ введение в агрессивную среду специально подобранных соединений - ингибиторов. Ингибиторы коррозии - это органические и неорганические вещества, присутствие которых в небольших количествах резко снижает скорость растворения металла и уменьшает его возможные вредные последствия. Метод ингибирования, как правило, отличается высокой экономичностью, легкостью производственного внедрения без изменения ранее принятого технологического режима, обычно не предусматривает для своей реализации специального дополнительного оборудования.
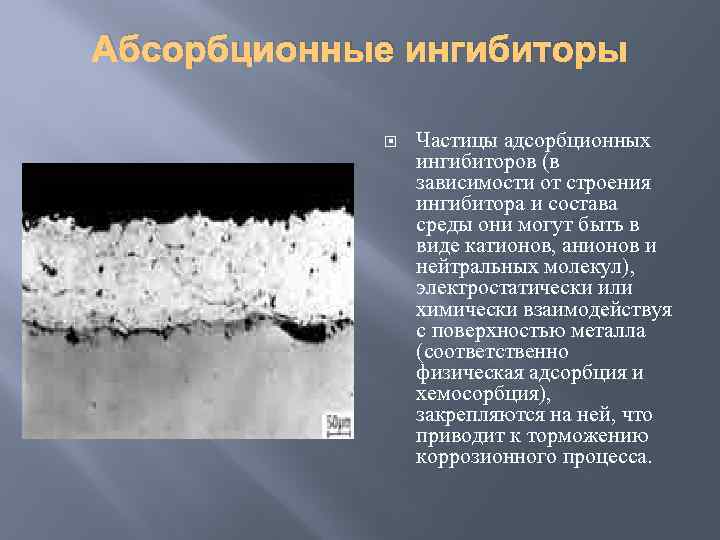 Абсорбционные ингибиторы Частицы адсорбционных ингибиторов (в зависимости от строения ингибитора и состава среды они могут быть в виде катионов, анионов и нейтральных молекул), электростатически или химически взаимодействуя с поверхностью металла (соответственно физическая адсорбция и хемосорбция), закрепляются на ней, что приводит к торможению коррозионного процесса.
Абсорбционные ингибиторы Частицы адсорбционных ингибиторов (в зависимости от строения ингибитора и состава среды они могут быть в виде катионов, анионов и нейтральных молекул), электростатически или химически взаимодействуя с поверхностью металла (соответственно физическая адсорбция и хемосорбция), закрепляются на ней, что приводит к торможению коррозионного процесса.
 Как правило, в качестве эффективных адсорбционных ингибиторов выступают соединения, имеющие в своем составе гетероатомы N, P, S, O, Si, через которые и осуществляется связь молекул ингибитора с поверхностью металла. К настоящему времени известны десятки индивидуальных веществ и смесей на их основе как эффективные замедлители коррозии. Они выявлены эмпирическим путем на основе прямых коррозионных испытаний.
Как правило, в качестве эффективных адсорбционных ингибиторов выступают соединения, имеющие в своем составе гетероатомы N, P, S, O, Si, через которые и осуществляется связь молекул ингибитора с поверхностью металла. К настоящему времени известны десятки индивидуальных веществ и смесей на их основе как эффективные замедлители коррозии. Они выявлены эмпирическим путем на основе прямых коррозионных испытаний.
 Пассивационные ингибиторы Эти ингибиторы вызывают формирование на поверхности металла защитной пленки и способствуют переходу металла в пассивное состояние. При этом имеет место сдвиг потенциала металла в положительную сторону. Наиболее широко ингибиторы-пассиваторы применяются для борьбы с коррозией в нейтральных или близких к ним средах, где коррозия протекает преимущественно с кислородной деполяризацией. Механизм действия пассиваторов различен и в значительной степени определяется их химическим составом и строением.
Пассивационные ингибиторы Эти ингибиторы вызывают формирование на поверхности металла защитной пленки и способствуют переходу металла в пассивное состояние. При этом имеет место сдвиг потенциала металла в положительную сторону. Наиболее широко ингибиторы-пассиваторы применяются для борьбы с коррозией в нейтральных или близких к ним средах, где коррозия протекает преимущественно с кислородной деполяризацией. Механизм действия пассиваторов различен и в значительной степени определяется их химическим составом и строением.
 Коррозия блуждающими токами Блуждающие токи возникают вследствие утечки из электрических цепей части тока в почву или водные растворы, где они попадают на металлические конструкции. В местах выхода тока из этих конструкций вновь в почву или воду возникает анодное растворение металла или, как принято обычно говорить, коррозия под действием блуждающих токов. Такие зоны разрушения металлов под действием блуждающих токов особенно часто наблюдаются в районах наземного электрического транспорта (трамвайные линии, железнодорожный транспорт на электрической тяге)
Коррозия блуждающими токами Блуждающие токи возникают вследствие утечки из электрических цепей части тока в почву или водные растворы, где они попадают на металлические конструкции. В местах выхода тока из этих конструкций вновь в почву или воду возникает анодное растворение металла или, как принято обычно говорить, коррозия под действием блуждающих токов. Такие зоны разрушения металлов под действием блуждающих токов особенно часто наблюдаются в районах наземного электрического транспорта (трамвайные линии, железнодорожный транспорт на электрической тяге)
 Электродренаж К электрохимическим методам борьбы с коррозией можно отнести и защиту от разрушения конструкций блуждающими токами – электродренаж соединение металлическим проводником участка A' конструкции A, с которого стекает блуждающий ток, с рельсом B При большом расстоянии между A' и B, когда электродренаж, описанный выше, трудно реализовать, то рядом с A закапывают дополнительный чугунный анод C, который соединяют с A' металлическим проводником. В этом случае под действием блуждающего тока растворяется именно анод C, и коррозия основной конструкции в зоне A' будет полностью прекращена.
Электродренаж К электрохимическим методам борьбы с коррозией можно отнести и защиту от разрушения конструкций блуждающими токами – электродренаж соединение металлическим проводником участка A' конструкции A, с которого стекает блуждающий ток, с рельсом B При большом расстоянии между A' и B, когда электродренаж, описанный выше, трудно реализовать, то рядом с A закапывают дополнительный чугунный анод C, который соединяют с A' металлическим проводником. В этом случае под действием блуждающего тока растворяется именно анод C, и коррозия основной конструкции в зоне A' будет полностью прекращена.
 Блуждающие токи растворяют металл на анодных участках в соответствии с законом Фарадея. Эти токи могут достигать несколько ампер, что должно приводить к большим коррозионным разрушениям. Например, прохождение анодного тока в течение одного года силой в 1 А вызовет растворение железа - 9, 1 кг, цинка - 10, 7, свинца - 33, 4 кг.
Блуждающие токи растворяют металл на анодных участках в соответствии с законом Фарадея. Эти токи могут достигать несколько ампер, что должно приводить к большим коррозионным разрушениям. Например, прохождение анодного тока в течение одного года силой в 1 А вызовет растворение железа - 9, 1 кг, цинка - 10, 7, свинца - 33, 4 кг.


