Коррозия.ppt
- Количество слайдов: 35
 Коррозия металлов
Коррозия металлов
 СОДЕРЖАНИЕ Основные понятия Виды коррозии Скорость коррозии Химическая коррозия Электрохимическая коррозия Анодный процесс Катодный процесс Деполяризаторы Коррозия с водородной деполяризацией Коррозия с кислородной деполяризацией Поляризация электродных процессов Пассивация Литература
СОДЕРЖАНИЕ Основные понятия Виды коррозии Скорость коррозии Химическая коррозия Электрохимическая коррозия Анодный процесс Катодный процесс Деполяризаторы Коррозия с водородной деполяризацией Коррозия с кислородной деполяризацией Поляризация электродных процессов Пассивация Литература

 Основные понятия содержание Коррозия металлов - самопроизвольное разрушение металлов и сплавов в результате химического и электрохимического взаимодействия с агрессивной средой.
Основные понятия содержание Коррозия металлов - самопроизвольное разрушение металлов и сплавов в результате химического и электрохимического взаимодействия с агрессивной средой.
 Виды коррозии содержание q Атмосферная коррозия – коррозия металлов в естественных атмосферных условиях (около 80% металлических конструкций эксплуатируются в атмосфере воздуха). q Коррозия в электролитах (солевая, кислотная, щелочная) – коррозия металлов в проводящих электрический ток средах. q Грунтовая (почвенная) коррозия –коррозия металлов в почвах и грунтах. q Контактная коррозия – электрохимическая коррозия, вызванная контактом металлов, имеющих разные электродные потенциалы в данной коррозионной среде. q Коррозия под напряжением – коррозия металла при одновременном воздействии коррозионной среды и постоянных или переменных механических напряжений (статических или меняющихся по величине и знаку). q Коррозия при трении (фретинг-коррозия) – при одновременном воздействии коррозионной среды и сил трения. q Коррозия при кавитации – коррозия при ударном воздействии коррозионной среды. q Электрокоррозия – коррозия под действием токов рассеивания (блуждающих токов) и тока от внешних источников. q Щелевая коррозия – коррозия, протекающая в узких щелях и зазорах между двумя металлами или в местах неплотного контакта металла с неметаллическим коррозионно- инертным материалом.
Виды коррозии содержание q Атмосферная коррозия – коррозия металлов в естественных атмосферных условиях (около 80% металлических конструкций эксплуатируются в атмосфере воздуха). q Коррозия в электролитах (солевая, кислотная, щелочная) – коррозия металлов в проводящих электрический ток средах. q Грунтовая (почвенная) коррозия –коррозия металлов в почвах и грунтах. q Контактная коррозия – электрохимическая коррозия, вызванная контактом металлов, имеющих разные электродные потенциалы в данной коррозионной среде. q Коррозия под напряжением – коррозия металла при одновременном воздействии коррозионной среды и постоянных или переменных механических напряжений (статических или меняющихся по величине и знаку). q Коррозия при трении (фретинг-коррозия) – при одновременном воздействии коррозионной среды и сил трения. q Коррозия при кавитации – коррозия при ударном воздействии коррозионной среды. q Электрокоррозия – коррозия под действием токов рассеивания (блуждающих токов) и тока от внешних источников. q Щелевая коррозия – коррозия, протекающая в узких щелях и зазорах между двумя металлами или в местах неплотного контакта металла с неметаллическим коррозионно- инертным материалом.


 Химическая коррозия содержание Это взаимодействие металлов с коррозионной средой, при котором окисление металла и восстановление окислительного компонента коррозионной среды протекает без пространственного разделения процессов окисления и восстановления: восстановления n. Me + m/2 O 2 = Men. Om
Химическая коррозия содержание Это взаимодействие металлов с коррозионной средой, при котором окисление металла и восстановление окислительного компонента коррозионной среды протекает без пространственного разделения процессов окисления и восстановления: восстановления n. Me + m/2 O 2 = Men. Om



 Виды коррозии Сплошная (общая) q Равномерная коррозия q Неравномерная коррозия q Избирательная коррозия Местная (локальная коррозия) q Коррозия пятнами q Коррозия язвами q Точечная коррозия (питтинг) q Межкристаллитная коррозия q Коррозионное растрескивание содержание
Виды коррозии Сплошная (общая) q Равномерная коррозия q Неравномерная коррозия q Избирательная коррозия Местная (локальная коррозия) q Коррозия пятнами q Коррозия язвами q Точечная коррозия (питтинг) q Межкристаллитная коррозия q Коррозионное растрескивание содержание
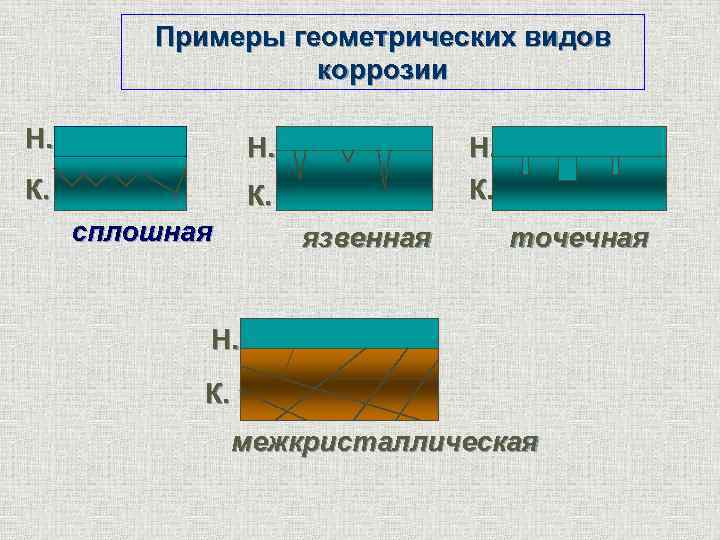 Примеры геометрических видов коррозии Н. К. сплошная Н. К. язвенная точечная Н. К. межкристаллическая
Примеры геометрических видов коррозии Н. К. сплошная Н. К. язвенная точечная Н. К. межкристаллическая
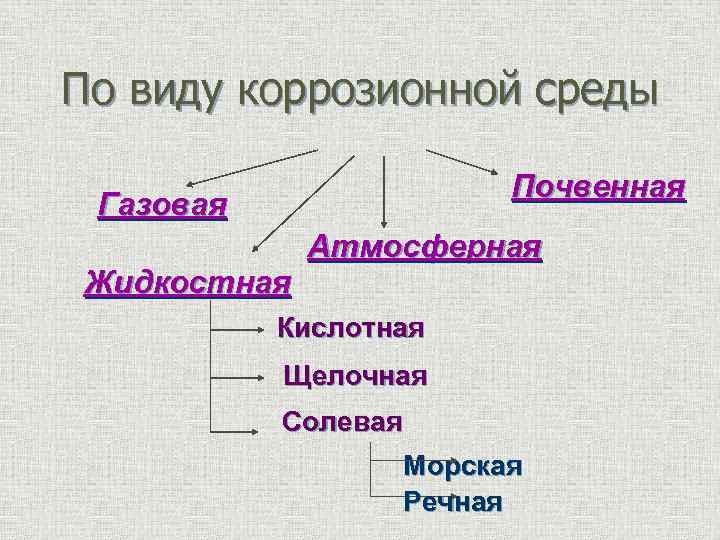 По виду коррозионной среды Почвенная Газовая Жидкостная Атмосферная Кислотная Щелочная Солевая Морская Речная
По виду коррозионной среды Почвенная Газовая Жидкостная Атмосферная Кислотная Щелочная Солевая Морская Речная
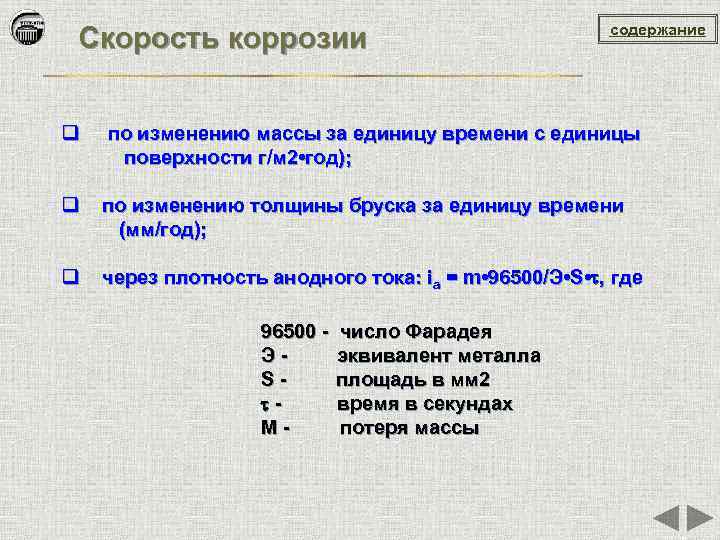 Скорость коррозии содержание q по изменению массы за единицу времени с единицы поверхности г/м 2 • год); q по изменению толщины бруска за единицу времени (мм/год); q через плотность анодного тока: ia = m • 96500/Э • S • , где 96500 - число Фарадея Э - эквивалент металла S - площадь в мм 2 - время в секундах M - потеря массы
Скорость коррозии содержание q по изменению массы за единицу времени с единицы поверхности г/м 2 • год); q по изменению толщины бруска за единицу времени (мм/год); q через плотность анодного тока: ia = m • 96500/Э • S • , где 96500 - число Фарадея Э - эквивалент металла S - площадь в мм 2 - время в секундах M - потеря массы
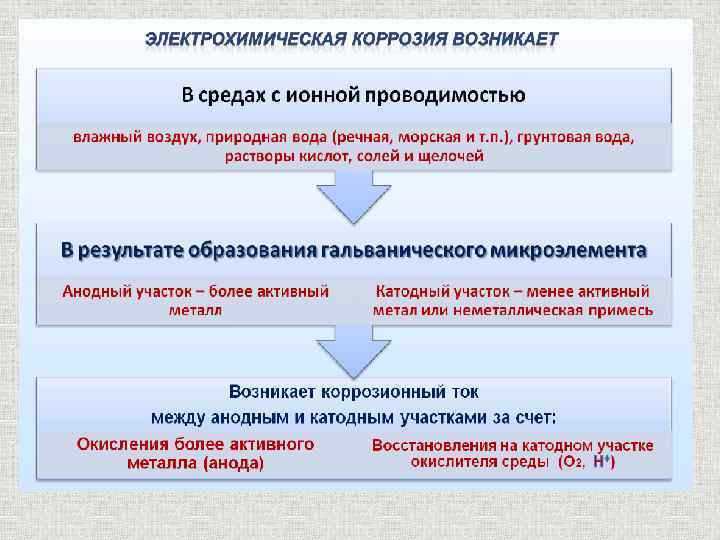
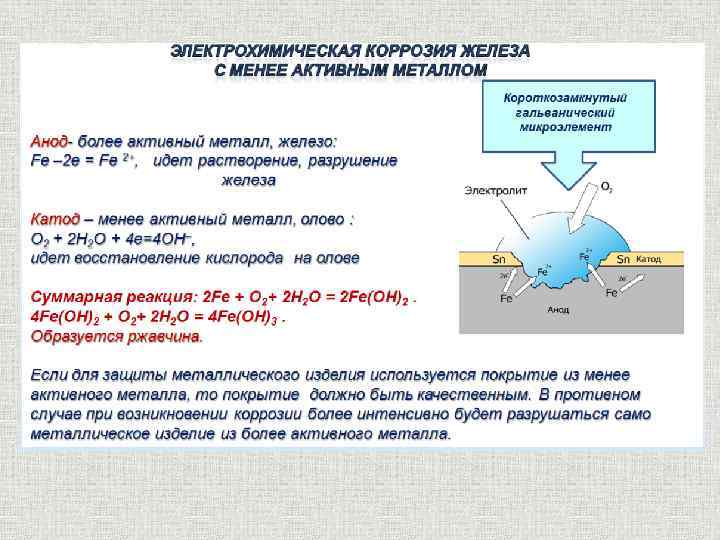
 Электрохимическая коррозия содержание Это самопроизвольное разрушение металлов в присутствии электролитически проводящих сред (раствор или расплав электролита), при котором окисление (ионизация) металла и восстановление окислительного компонента коррозионной среды пространственно разделены и представляют собой различные стадии сопряженного процесса окисления-восстановления Me - ne = Men+ Анодный процесс Ox + ne = Red Катодный процесс
Электрохимическая коррозия содержание Это самопроизвольное разрушение металлов в присутствии электролитически проводящих сред (раствор или расплав электролита), при котором окисление (ионизация) металла и восстановление окислительного компонента коррозионной среды пространственно разделены и представляют собой различные стадии сопряженного процесса окисления-восстановления Me - ne = Men+ Анодный процесс Ox + ne = Red Катодный процесс
 Электрохимическая коррозия содержание
Электрохимическая коррозия содержание
 Электрохимическая коррозия содержание Причины электрохимической гетерогенности q Контакт двух и более металлов с различными потенциалами q Контакт металла с различными средами q Наличие на поверхности металла оксидных пленок q Структурная неоднородность металла q Неоднородность внутренних напряжений в металле q Разность температур на различных участках металла
Электрохимическая коррозия содержание Причины электрохимической гетерогенности q Контакт двух и более металлов с различными потенциалами q Контакт металла с различными средами q Наличие на поверхности металла оксидных пленок q Структурная неоднородность металла q Неоднородность внутренних напряжений в металле q Разность температур на различных участках металла
 Анодный процесс содержание Me - ne = Men+ Gо = – Еоn. F G <0, когда E > 0 Самопроизвольный процесс
Анодный процесс содержание Me - ne = Men+ Gо = – Еоn. F G <0, когда E > 0 Самопроизвольный процесс
 Катодный процесс содержание Уравнения катодного процесса в отсутствие растворенного кислорода (с водородной деполяризацией) в присутствии растворенного кислорода (с кислородной деполяризацией) кислая среда (1) нейтральная и щелочная среда (2) (3) (4)
Катодный процесс содержание Уравнения катодного процесса в отсутствие растворенного кислорода (с водородной деполяризацией) в присутствии растворенного кислорода (с кислородной деполяризацией) кислая среда (1) нейтральная и щелочная среда (2) (3) (4)
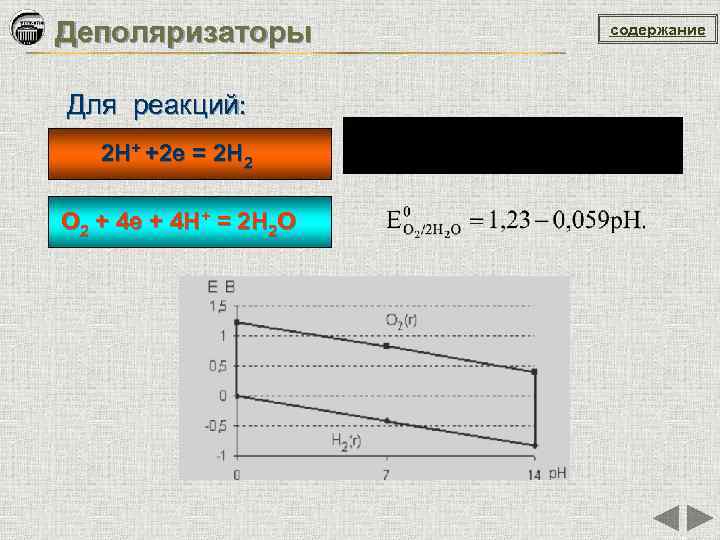 Деполяризаторы Для реакций: 2 H+ +2 e = 2 H 2 O 2 + 4 e + 4 H+ = 2 H 2 O содержание
Деполяризаторы Для реакций: 2 H+ +2 e = 2 H 2 O 2 + 4 e + 4 H+ = 2 H 2 O содержание

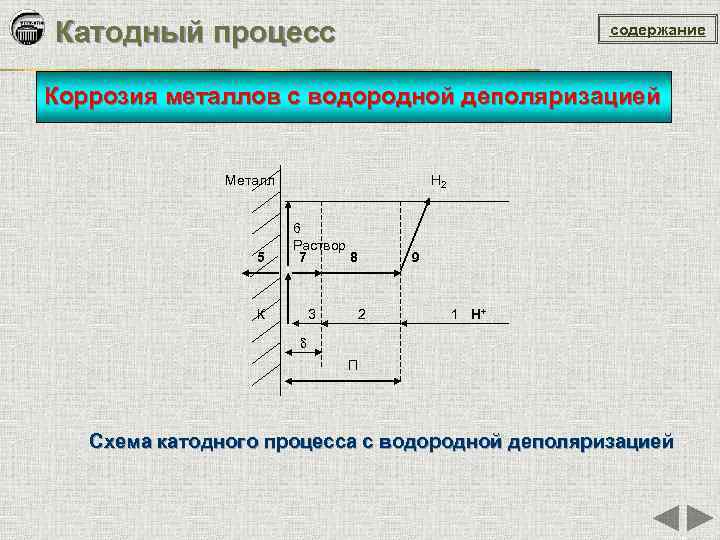 Катодный процесс содержание Коррозия металлов с водородной деполяризацией Металл Н 2 6 Раствор 5 7 8 9 К 3 2 1 H+ δ П Схема катодного процесса с водородной деполяризацией
Катодный процесс содержание Коррозия металлов с водородной деполяризацией Металл Н 2 6 Раствор 5 7 8 9 К 3 2 1 H+ δ П Схема катодного процесса с водородной деполяризацией
 Катодный процесс содержание Коррозия металлов с водородной деполяризацией = - 0, 059 р. Н Для кислой среды Для нейтральной среды Для щелочной среды Коррозия с водородной деполяризацией возможна, если:
Катодный процесс содержание Коррозия металлов с водородной деполяризацией = - 0, 059 р. Н Для кислой среды Для нейтральной среды Для щелочной среды Коррозия с водородной деполяризацией возможна, если:
 Катодный процесс содержание Коррозия металлов с водородной деполяризацией протекает в следующих условиях: q для большинства металлов в растворах кислот q для активных металлов в нейтральных растворах q для амфотерных металлов в растворах щелочей
Катодный процесс содержание Коррозия металлов с водородной деполяризацией протекает в следующих условиях: q для большинства металлов в растворах кислот q для активных металлов в нейтральных растворах q для амфотерных металлов в растворах щелочей
 Катодный процесс содержание Коррозия металлов с кислородной деполяризацией Металл O 2 6 2 5 К 4 δ 3 П Схема катодного процесса с кислородной деполяризацией
Катодный процесс содержание Коррозия металлов с кислородной деполяризацией Металл O 2 6 2 5 К 4 δ 3 П Схема катодного процесса с кислородной деполяризацией
 Катодный процесс содержание Коррозия металлов с кислородной деполяризацией Для кислой среды Для нейтральной среды Для щелочной среды Коррозия с кислородной деполяризацией возможна, если:
Катодный процесс содержание Коррозия металлов с кислородной деполяризацией Для кислой среды Для нейтральной среды Для щелочной среды Коррозия с кислородной деполяризацией возможна, если:
 Поляризация электродных процессов Изменение потенциала электрода при прохождении тока называется поляризацией: ΔЕ = Еi – EР где ΔЕ – поляризация; Еi - потенциал электрода под током; ЕР – равновесный потенциал содержание
Поляризация электродных процессов Изменение потенциала электрода при прохождении тока называется поляризацией: ΔЕ = Еi – EР где ΔЕ – поляризация; Еi - потенциал электрода под током; ЕР – равновесный потенциал содержание

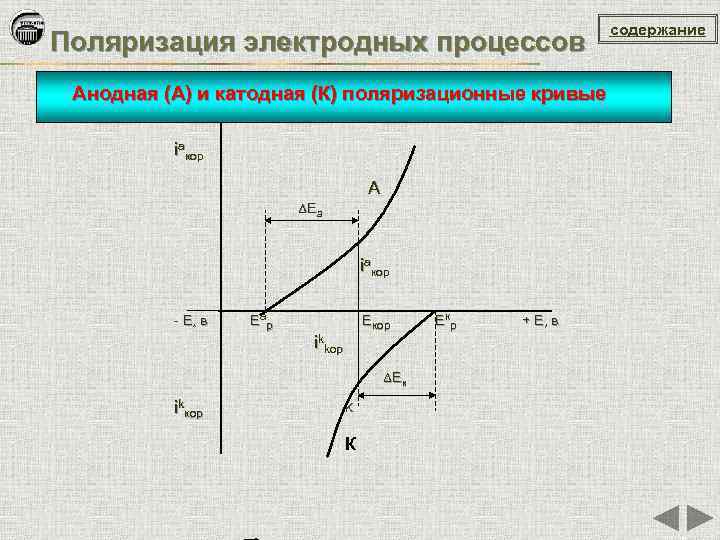 Поляризация электродных процессов Анодная (А) и катодная (К) поляризационные кривые iaкор A ΔЕ а iaкор - Е, в Е ар Екор ikkop ΔЕ к ikкор K К Е кр + Е, в содержание
Поляризация электродных процессов Анодная (А) и катодная (К) поляризационные кривые iaкор A ΔЕ а iaкор - Е, в Е ар Екор ikkop ΔЕ к ikкор K К Е кр + Е, в содержание
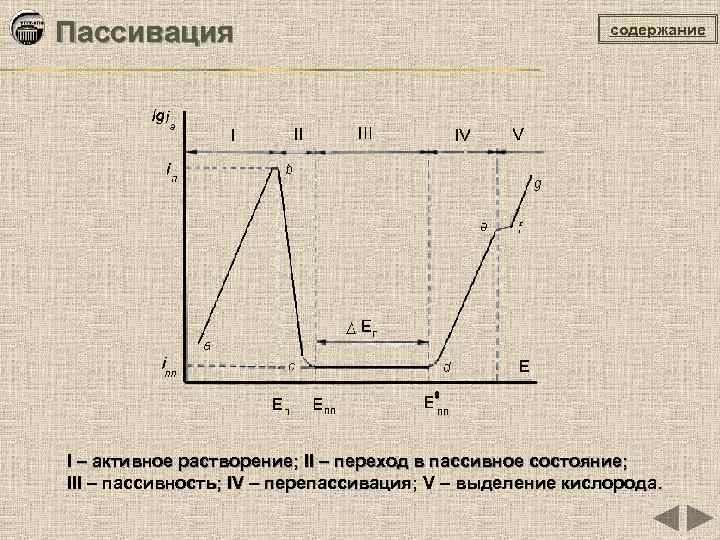 Пассивация содержание I – активное растворение; II – переход в пассивное состояние; III – пассивность; IV – перепассивация; V – выделение кислорода.
Пассивация содержание I – активное растворение; II – переход в пассивное состояние; III – пассивность; IV – перепассивация; V – выделение кислорода.
 Выводы и заключения n содержание Электрохимическая коррозия протекает через сопряженные процессы анодного растворения металла и катодного восстановления окислителя.
Выводы и заключения n содержание Электрохимическая коррозия протекает через сопряженные процессы анодного растворения металла и катодного восстановления окислителя.
 Список литературы n n n содержание 1. Ахметов Н. С. Общая и неорганическая химия. М. : Высшая школа. 2002. 2. О. М. Полторак, Л. М. Ковба. «Физико-химические основы неорганической химии» . М. : МГУ, 1994. 3. В. И. Горшков, И. А. Кузнецов. «Физическая химия» . М. : МГУ, 1993. 4. А. Джонсон. Термодинамические аспекты в курсе неорганической химии. М. : Мир. 1985. 5. Анорганикум. Под ред. Л. Кольдица. М. Мир. 1984. Т. 1. 6. Хьюи Дж. Неорганическая химия. Строение вещества и реакционная способность. М. , Химия, 1987. 7. Фичини Ж. , Ламброзо-Бадер Н. , Депезе Ж. -К. Основы физической химии. М. Мир. 1972. стр. 276 -283. 8. Дж. Кемпбел. Современная общая химия. М. : Мир. 1975 г. Т. 2. стр. 90. гл. 20. , Т 3. 9. Дикерсон Р. , Грей Г. , Хейт Дж. Основные законы химии. М. : Мир, 1982. Т. 2. 10. Б. Б. Дамаскин, О. А. Петрий. Электрохимия. М: Высшая школа, 1987. 11. CRC Hand book of Chemistry and Physics. 82 издание. 2001 -2002
Список литературы n n n содержание 1. Ахметов Н. С. Общая и неорганическая химия. М. : Высшая школа. 2002. 2. О. М. Полторак, Л. М. Ковба. «Физико-химические основы неорганической химии» . М. : МГУ, 1994. 3. В. И. Горшков, И. А. Кузнецов. «Физическая химия» . М. : МГУ, 1993. 4. А. Джонсон. Термодинамические аспекты в курсе неорганической химии. М. : Мир. 1985. 5. Анорганикум. Под ред. Л. Кольдица. М. Мир. 1984. Т. 1. 6. Хьюи Дж. Неорганическая химия. Строение вещества и реакционная способность. М. , Химия, 1987. 7. Фичини Ж. , Ламброзо-Бадер Н. , Депезе Ж. -К. Основы физической химии. М. Мир. 1972. стр. 276 -283. 8. Дж. Кемпбел. Современная общая химия. М. : Мир. 1975 г. Т. 2. стр. 90. гл. 20. , Т 3. 9. Дикерсон Р. , Грей Г. , Хейт Дж. Основные законы химии. М. : Мир, 1982. Т. 2. 10. Б. Б. Дамаскин, О. А. Петрий. Электрохимия. М: Высшая школа, 1987. 11. CRC Hand book of Chemistry and Physics. 82 издание. 2001 -2002


