Коррозия металлов.ppt
- Количество слайдов: 41
 Коррозия металлов
Коррозия металлов
 Коррозия металлов – • частный случай окислительно восстановительной реакции, окисление происходит за счет химической и электрохимической коррозии.
Коррозия металлов – • частный случай окислительно восстановительной реакции, окисление происходит за счет химической и электрохимической коррозии.
 Продукты коррозии – • оксиды, сульфаты и другие представляют собой прочные (устойчивые соединения).
Продукты коррозии – • оксиды, сульфаты и другие представляют собой прочные (устойчивые соединения).
 Распространение коррозии • Больше всего от коррозии страдает железо и его сплавы. • Коррозия распространяется не равномерно по поверхности металла, а концентрируется на отдельных участках. • В природе в чистом виде встречается золото, серебро, платина, остальные металлы в природе встречаются в соединениях с неметаллами.
Распространение коррозии • Больше всего от коррозии страдает железо и его сплавы. • Коррозия распространяется не равномерно по поверхности металла, а концентрируется на отдельных участках. • В природе в чистом виде встречается золото, серебро, платина, остальные металлы в природе встречаются в соединениях с неметаллами.
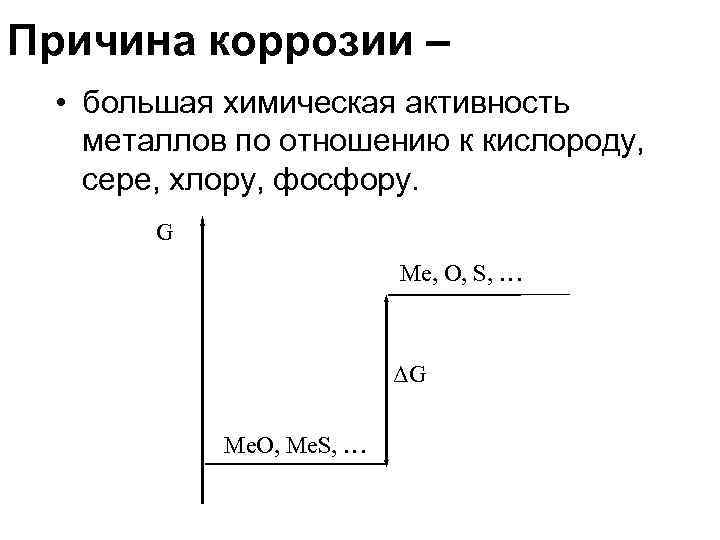 Причина коррозии – • большая химическая активность металлов по отношению к кислороду, сере, хлору, фосфору. G Me, O, S, … ΔG Me. O, Me. S, …
Причина коррозии – • большая химическая активность металлов по отношению к кислороду, сере, хлору, фосфору. G Me, O, S, … ΔG Me. O, Me. S, …
 Ряд устойчивости металлов • В воздушной атмосфере: Fe>Al>Cu>Ag>Au. • Коррозия сильно зависит от p. H среды.
Ряд устойчивости металлов • В воздушной атмосфере: Fe>Al>Cu>Ag>Au. • Коррозия сильно зависит от p. H среды.
 Классификация коррозии металлов по механизму процесса. Можно выделить три механизма коррозии: • Химическая; • Электрохимическая; • Биохимическая.
Классификация коррозии металлов по механизму процесса. Можно выделить три механизма коррозии: • Химическая; • Электрохимическая; • Биохимическая.
 I. Химическая коррозия. • Химическая коррозия развивается в средах неспособных проводить электрический ток.
I. Химическая коррозия. • Химическая коррозия развивается в средах неспособных проводить электрический ток.
 На скорость газовой коррозии влияют факторы: • температура, • состав газовой среды.
На скорость газовой коррозии влияют факторы: • температура, • состав газовой среды.
 Скорость химической коррозии определяется кинетическим уравнением:
Скорость химической коррозии определяется кинетическим уравнением:
 Сплошность выражается уравнением:
Сплошность выражается уравнением:
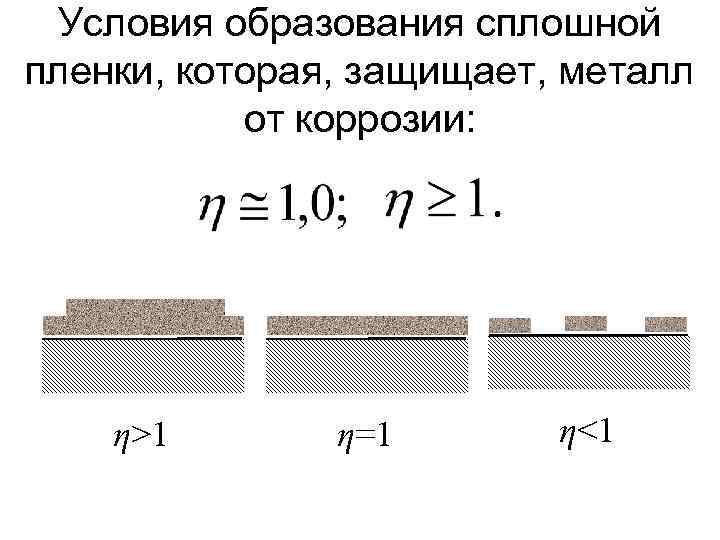 Условия образования сплошной пленки, которая, защищает, металл от коррозии: η>1 η=1 η<1
Условия образования сплошной пленки, которая, защищает, металл от коррозии: η>1 η=1 η<1
 Хорошими защитными свойствами обладают пленки на металле при условии:
Хорошими защитными свойствами обладают пленки на металле при условии:
 Продукты коррозии в системе железо – кислород распределяются следующим образом: Fe Fe. O Fe 2 O 3
Продукты коррозии в системе железо – кислород распределяются следующим образом: Fe Fe. O Fe 2 O 3
 Коррозия в неэлектролитах – разновидность химической коррозии. • Органические жидкости – неэлектролиты, не обладают электропроводностью и химическая коррозия происходит между металлом и веществами растворенными в электролите. Например, коррозионно активными элементами в нефти являются сера, H 2 S, CS 2 и другие.
Коррозия в неэлектролитах – разновидность химической коррозии. • Органические жидкости – неэлектролиты, не обладают электропроводностью и химическая коррозия происходит между металлом и веществами растворенными в электролите. Например, коррозионно активными элементами в нефти являются сера, H 2 S, CS 2 и другие.
 II. Электрохимическая коррозия. • Электрохимическая коррозия протекает в электропроводящей среде (влага), т. е. в присутствии проводников второго рода.
II. Электрохимическая коррозия. • Электрохимическая коррозия протекает в электропроводящей среде (влага), т. е. в присутствии проводников второго рода.
 Электрохимическая коррозия состоит из двух процессов: • • Анодный процесс – растворение металла с образованием гидратированных ионов металла в электролите; Катодный процесс – ассимиляция электронов, какими либо ионами (кроме ионов данного металла).
Электрохимическая коррозия состоит из двух процессов: • • Анодный процесс – растворение металла с образованием гидратированных ионов металла в электролите; Катодный процесс – ассимиляция электронов, какими либо ионами (кроме ионов данного металла).
 Термодинамически возможен процесс электрохимической коррозии, для которого соблюдается условие: • Поверхность корродирующего металла представляет собой обычно многоэлектродный слой, т. е. состоящий из нескольких (более 2 х) отличающихся друг от друга электродов. • Поверхность металла состоит из нескольких гальванических элементов.
Термодинамически возможен процесс электрохимической коррозии, для которого соблюдается условие: • Поверхность корродирующего металла представляет собой обычно многоэлектродный слой, т. е. состоящий из нескольких (более 2 х) отличающихся друг от друга электродов. • Поверхность металла состоит из нескольких гальванических элементов.
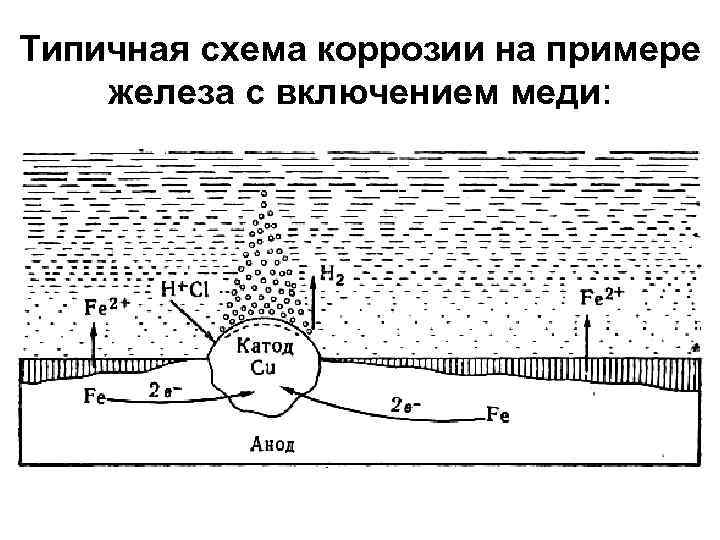 Типичная схема коррозии на примере железа с включением меди:
Типичная схема коррозии на примере железа с включением меди:
 Схема коррозии железа с включением меди В растворе электролита (НCl) : Система представляет собой гальванический элемент, во внутренней цепи которого: • железо является анодом (Е°= – 0, 44 в), • медь – катодом (Е° = +0, 337 в). • Атомы железа, передают два электрона ионам меди, переходят в раствор в виде ионов Fe 2+ и с хлорид ионами среды образуют хлорид железа (II): Fe → Fe 2+ + 2 e–; Fe 2+ + 2 Cl– ↔ Fe 2+Cl 2– • Водородные ионы движутся к катоду (к меди). Здесь они разряжаются: 2 Н+ + 2 e– → Н 2.
Схема коррозии железа с включением меди В растворе электролита (НCl) : Система представляет собой гальванический элемент, во внутренней цепи которого: • железо является анодом (Е°= – 0, 44 в), • медь – катодом (Е° = +0, 337 в). • Атомы железа, передают два электрона ионам меди, переходят в раствор в виде ионов Fe 2+ и с хлорид ионами среды образуют хлорид железа (II): Fe → Fe 2+ + 2 e–; Fe 2+ + 2 Cl– ↔ Fe 2+Cl 2– • Водородные ионы движутся к катоду (к меди). Здесь они разряжаются: 2 Н+ + 2 e– → Н 2.
 • В случае свободного доступа кислорода воздуха к катоду происходит деполяризация, и электрохимический процесс коррозии идет беспрепятственно дальше: 4 Н + О 2 → 2 Н 2 О • Если в этом гальваническом элементе вместо соляной кислоты взять раствор хлорида натрия, то на катоде, помимо водорода, образуется гидроксид натрия: 2 Na+ + 2 H 2 O + 2 e– → 2 Na. OH + H 2. • Гидроксид натрия с хлоридом железа дает гидроксид железа (II): Fe 2+ + 2 ОН– → Fe(OH)2. • Атмосферный кислород окисляет, растворенный в электролите гидроксид железа (II): 4 Fe(OH)2 + О 2 + 2 Н 2 О → 4 Fe(OH)3
• В случае свободного доступа кислорода воздуха к катоду происходит деполяризация, и электрохимический процесс коррозии идет беспрепятственно дальше: 4 Н + О 2 → 2 Н 2 О • Если в этом гальваническом элементе вместо соляной кислоты взять раствор хлорида натрия, то на катоде, помимо водорода, образуется гидроксид натрия: 2 Na+ + 2 H 2 O + 2 e– → 2 Na. OH + H 2. • Гидроксид натрия с хлоридом железа дает гидроксид железа (II): Fe 2+ + 2 ОН– → Fe(OH)2. • Атмосферный кислород окисляет, растворенный в электролите гидроксид железа (II): 4 Fe(OH)2 + О 2 + 2 Н 2 О → 4 Fe(OH)3
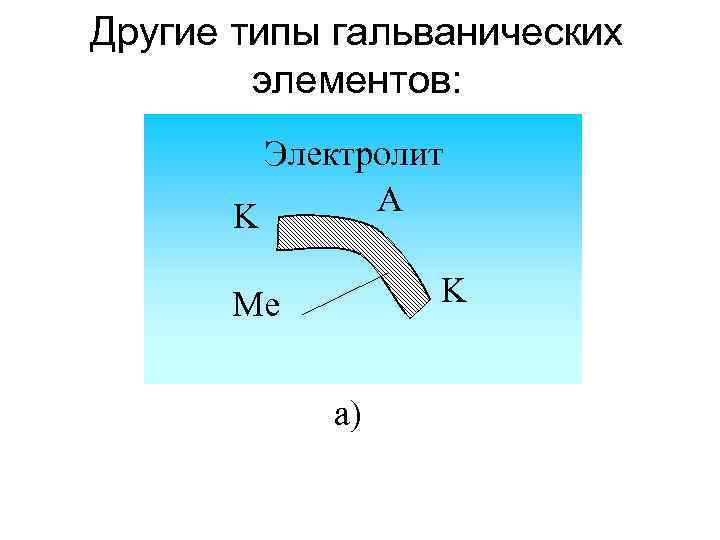 Другие типы гальванических элементов: Электролит A K K Me а)
Другие типы гальванических элементов: Электролит A K K Me а)
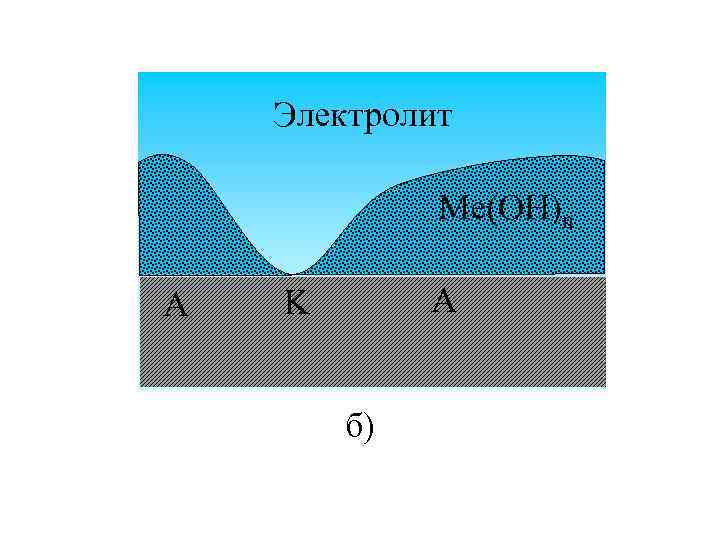 Электролит Me(OH)n A A K б)
Электролит Me(OH)n A A K б)
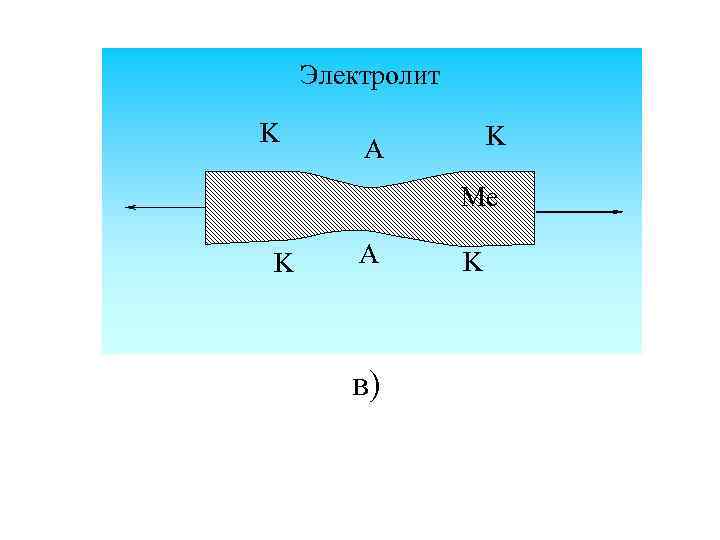 Электролит K K A Me K A в) K
Электролит K K A Me K A в) K
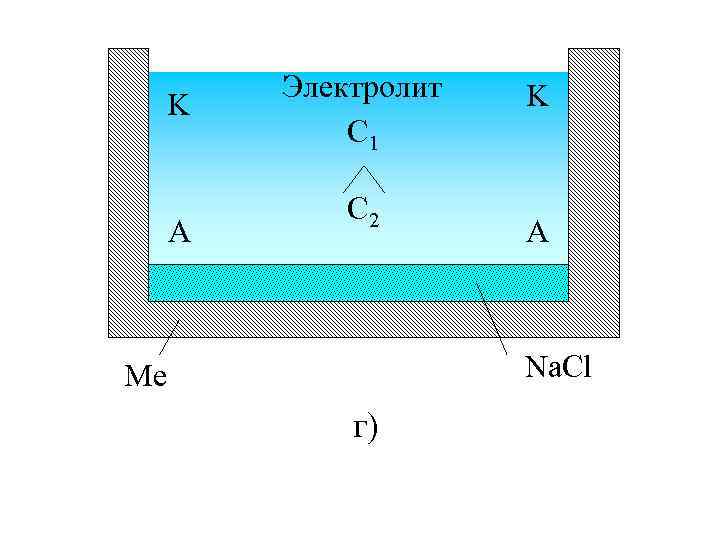 K A Электролит C 1 C 2 K A Na. Cl Me г)
K A Электролит C 1 C 2 K A Na. Cl Me г)
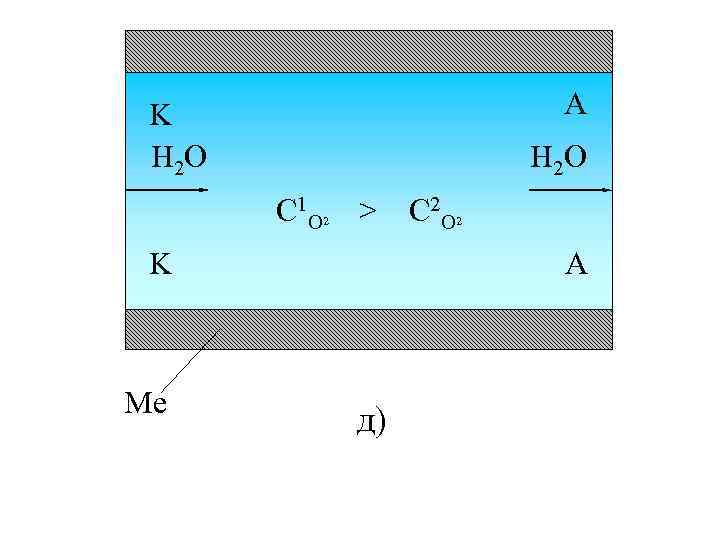 A K H 2 O C 1 O 2 > K Me C 2 O 2 A д)
A K H 2 O C 1 O 2 > K Me C 2 O 2 A д)
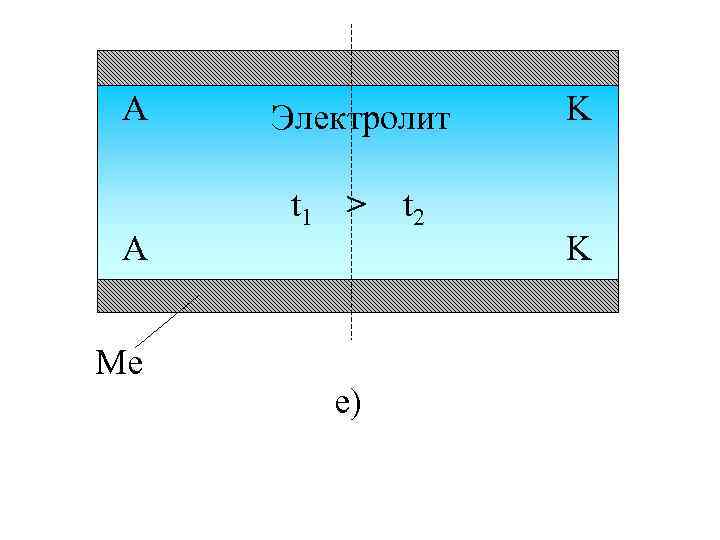 A A Me Электролит t 1 > е) t 2 K K
A A Me Электролит t 1 > е) t 2 K K
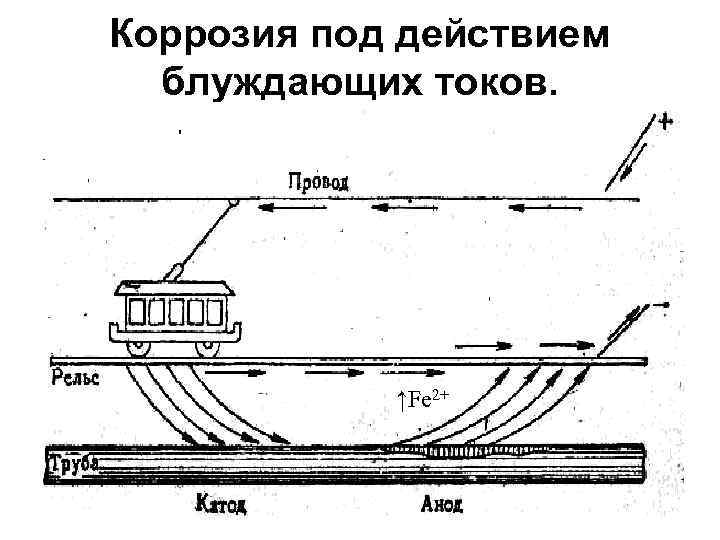 Коррозия под действием блуждающих токов. ↑Fe 2+
Коррозия под действием блуждающих токов. ↑Fe 2+
 Потеря металла Δm пропорциональна силе тока I:
Потеря металла Δm пропорциональна силе тока I:
 Скорость коррозии определяется по формуле:
Скорость коррозии определяется по формуле:
 Ускорители электрохимической коррозии. • Ускорителями или стимуляторами коррозии являются вещества, которые при введении в коррозионную среду заметно увеличивают скорость электрохимической коррозии металлов. • Анодный и катодный процессы взаимосвязаны.
Ускорители электрохимической коррозии. • Ускорителями или стимуляторами коррозии являются вещества, которые при введении в коррозионную среду заметно увеличивают скорость электрохимической коррозии металлов. • Анодный и катодный процессы взаимосвязаны.
 Анодные ускорители – вещества, увеличивающие скорость анодного процесса электрохимической коррозии металлов: • а) активные ионы (например, Сl–, Br– , I–), адсорбируясь на поверхности пассивной окисной пленки, вытесняют и замещают в ней ионы кислорода, что делает ее растворимой и приводит к образованию пор с соответствующим ускорением анодного процесса или облегчает его протекание вследствие изменения скачка потенциала в двойном слое; • б) комплексообразователи (например, NH 3, CN–) связывая ионы растворяющегося металла в слабодиссоциированные комплексы, сильно уменьшают их активность и, следовательно, понижают термодинамическую устойчивость металлов и анодную концентрационную по ляризацию.
Анодные ускорители – вещества, увеличивающие скорость анодного процесса электрохимической коррозии металлов: • а) активные ионы (например, Сl–, Br– , I–), адсорбируясь на поверхности пассивной окисной пленки, вытесняют и замещают в ней ионы кислорода, что делает ее растворимой и приводит к образованию пор с соответствующим ускорением анодного процесса или облегчает его протекание вследствие изменения скачка потенциала в двойном слое; • б) комплексообразователи (например, NH 3, CN–) связывая ионы растворяющегося металла в слабодиссоциированные комплексы, сильно уменьшают их активность и, следовательно, понижают термодинамическую устойчивость металлов и анодную концентрационную по ляризацию.
 Например, • аммиак в присутствии кислорода сильно ускоряет процесс растворения меди и медных сплавов по реакции: Cu 2+ + 4 NH 3 + ½O 2 + Н 2 О → [Cu(NH 3)4](OH)2. • цианиды вызывают быстрое растворение даже таких металлов, как серебро и золото: 2 Au 3+ + 8 KCN + 1½О 2 + 3 Н 2 О → 2 К[Аu(CN)4] + 6 КOН.
Например, • аммиак в присутствии кислорода сильно ускоряет процесс растворения меди и медных сплавов по реакции: Cu 2+ + 4 NH 3 + ½O 2 + Н 2 О → [Cu(NH 3)4](OH)2. • цианиды вызывают быстрое растворение даже таких металлов, как серебро и золото: 2 Au 3+ + 8 KCN + 1½О 2 + 3 Н 2 О → 2 К[Аu(CN)4] + 6 КOН.
 Катодные ускорители – вещества, увеличивающие скорость катодного процесса электрохимической корро зии металлов. • Катодными ускорителями являются ионы металлов с переменной валентностью (например, Fe 3+ ↔ Fe 2+, Cu 2+ → Cu+). На катоде ион с повышенной ва лентностью действует как деполяризатор: Fe 3++ e– = Fe 2+, а в растворе образовавшийся ион с пониженной валентностью вновь окисляется кислородом до высшей валентности: 2 Fe 2+ + ½О 2 + 2 Н+ → 2 Fe 3+ + Н 2 О.
Катодные ускорители – вещества, увеличивающие скорость катодного процесса электрохимической корро зии металлов. • Катодными ускорителями являются ионы металлов с переменной валентностью (например, Fe 3+ ↔ Fe 2+, Cu 2+ → Cu+). На катоде ион с повышенной ва лентностью действует как деполяризатор: Fe 3++ e– = Fe 2+, а в растворе образовавшийся ион с пониженной валентностью вновь окисляется кислородом до высшей валентности: 2 Fe 2+ + ½О 2 + 2 Н+ → 2 Fe 3+ + Н 2 О.
 Методы замедления коррозии. • Снижении агрессивности коррозионной среды; • Нанесение защитных покрытий; • Применение электрохимических методов.
Методы замедления коррозии. • Снижении агрессивности коррозионной среды; • Нанесение защитных покрытий; • Применение электрохимических методов.
 I. Метод ингибирования. • Ингибиторы это вещества, которые при введении из в коррозионную среду в незначительном количестве заметно снижают скорость электрохимической коррозии. • Ингибиторы адсорбируются на поверхности металлов и изолируют металл от агрессивной среды. • В качестве ингибиторов применяются органические вещества с дифильной структурой, например углеводороды с полярной группировкой OH–. • Ингибиторная защита сильно зависит от температуры.
I. Метод ингибирования. • Ингибиторы это вещества, которые при введении из в коррозионную среду в незначительном количестве заметно снижают скорость электрохимической коррозии. • Ингибиторы адсорбируются на поверхности металлов и изолируют металл от агрессивной среды. • В качестве ингибиторов применяются органические вещества с дифильной структурой, например углеводороды с полярной группировкой OH–. • Ингибиторная защита сильно зависит от температуры.
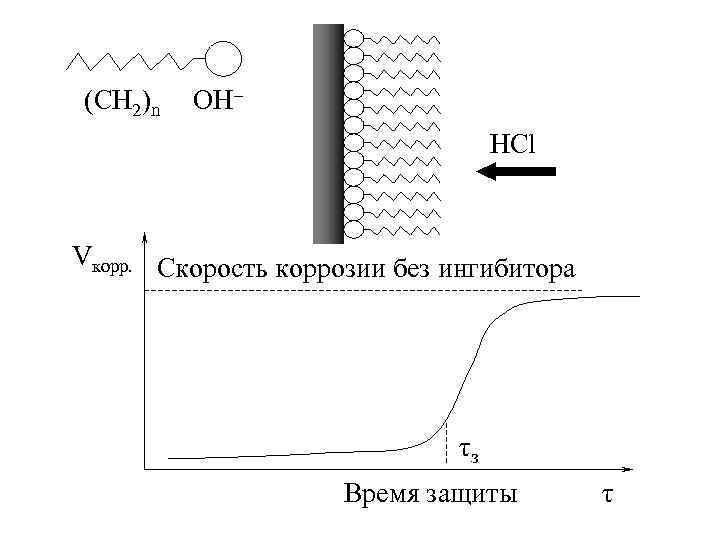 (CH 2)n OH– HCl Vкорр. Скорость коррозии без ингибитора τз Время защиты τ
(CH 2)n OH– HCl Vкорр. Скорость коррозии без ингибитора τз Время защиты τ
 II. Пассивация металлов. • Образование нерастворимых плотных пленок с хорошей адгезией. Например, взаимодействие ионов PO 43– с образованием фосфатной пленки Fe 3(PO 4)2. • Пассиваторами могут быть нитриты, хроматы.
II. Пассивация металлов. • Образование нерастворимых плотных пленок с хорошей адгезией. Например, взаимодействие ионов PO 43– с образованием фосфатной пленки Fe 3(PO 4)2. • Пассиваторами могут быть нитриты, хроматы.
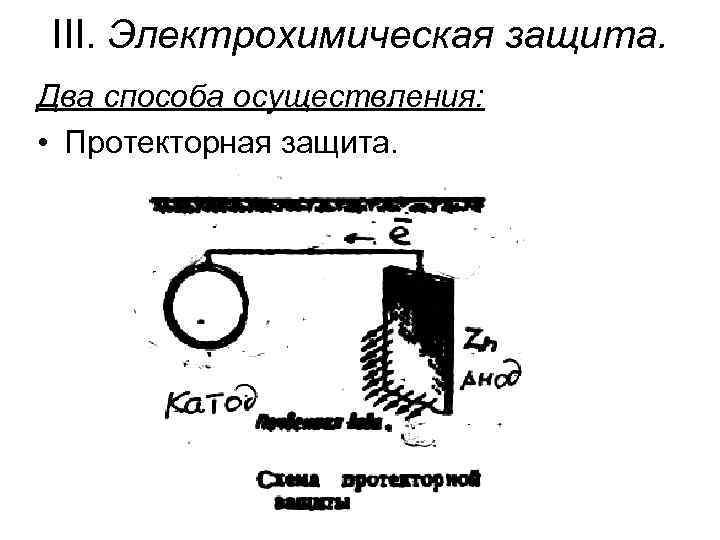 III. Электрохимическая защита. Два способа осуществления: • Протекторная защита.
III. Электрохимическая защита. Два способа осуществления: • Протекторная защита.
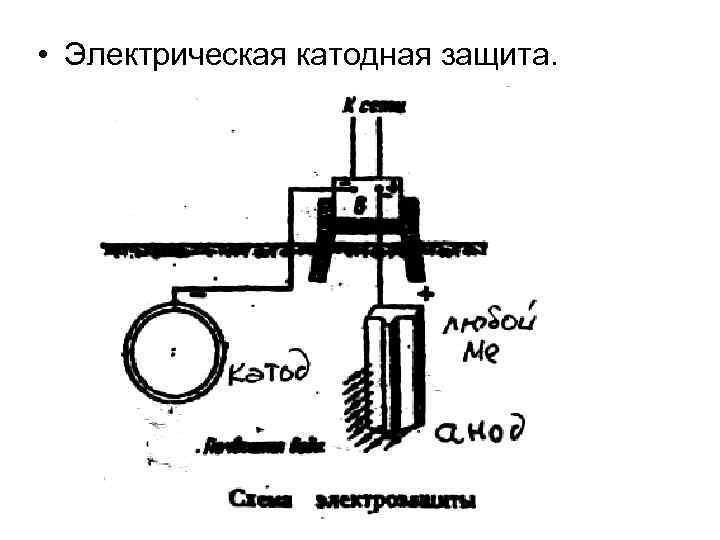 • Электрическая катодная защита.
• Электрическая катодная защита.
 III. Биохимическая коррозия. • Например, грибок Aspergill niger в процессе жизнедеятельности выделяет лимонную кислоту. • Эта кислота разъедает (корродирует) металл.
III. Биохимическая коррозия. • Например, грибок Aspergill niger в процессе жизнедеятельности выделяет лимонную кислоту. • Эта кислота разъедает (корродирует) металл.


