3.малые РНК 26 ноября 2012.ppt
- Количество слайдов: 74
 Короткие некодирующие РНК и регуляция экспрессии генов эукариот III: РНК-интерференция – пересечения и расхождения путей, связь с модификациями хроматина
Короткие некодирующие РНК и регуляция экспрессии генов эукариот III: РНК-интерференция – пересечения и расхождения путей, связь с модификациями хроматина
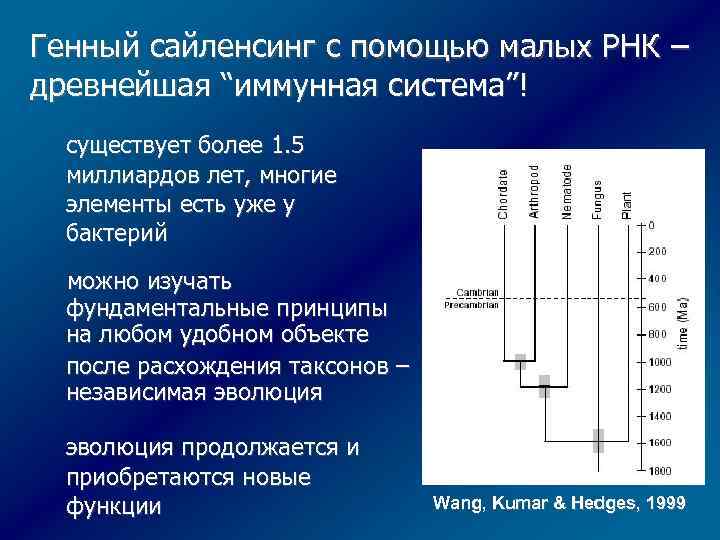 Генный сайленсинг с помощью малых РНК – древнейшая “иммунная система”! существует более 1. 5 миллиардов лет, многие элементы есть уже у бактерий можно изучать фундаментальные принципы на любом удобном объекте после расхождения таксонов – независимая эволюция продолжается и приобретаются новые функции Wang, Kumar & Hedges, 1999
Генный сайленсинг с помощью малых РНК – древнейшая “иммунная система”! существует более 1. 5 миллиардов лет, многие элементы есть уже у бактерий можно изучать фундаментальные принципы на любом удобном объекте после расхождения таксонов – независимая эволюция продолжается и приобретаются новые функции Wang, Kumar & Hedges, 1999
 Разнообразие функций малых регуляторных РНК в регуляции экспрессии генов: Защита от вирусной инфекции (прежде всего РНК-вирусы) Стабилизация генома Аттенуация экспрессии генов, например, эффекты дозовой компенсации Стабилизация/дестабилизация РНК Специфичное подавление “незаконной” экспрессии генов Синхронизированная регуляция экспрессии генов в развитии Поддержание структуры хроматина (прежде всего гетерохроматина) и ее модификации Быстрый комплексный ответ на стресс …? Очевидно, что какие-то функции возникли раньше, а какие-то – позже!
Разнообразие функций малых регуляторных РНК в регуляции экспрессии генов: Защита от вирусной инфекции (прежде всего РНК-вирусы) Стабилизация генома Аттенуация экспрессии генов, например, эффекты дозовой компенсации Стабилизация/дестабилизация РНК Специфичное подавление “незаконной” экспрессии генов Синхронизированная регуляция экспрессии генов в развитии Поддержание структуры хроматина (прежде всего гетерохроматина) и ее модификации Быстрый комплексный ответ на стресс …? Очевидно, что какие-то функции возникли раньше, а какие-то – позже!
 Зачем возник РНК-сайленсинг? Наиболее распространенное мнение – возникновение системы РНКi было вызвано необходимостью защиты генома от РНКвирусов и мобильных элементов Поддержание стабильности генома – эта функция РНКi сохранилась почти повсеместно (постепенно замещается “чисто белковыми” механизмами? ) Защита от РНК-вирусов – в чистом виде сохранилась у растений, элементы обнаружены у C. elegans, D. melanogaster и позвоночных Некоторые вирусы более патогенны для хозяев, у которых нарушена экспрессия Dicer (впервые показано для насекомых) Клетка-хозяин может использовать РНКi для уничтожения вирусной РНК или ингибирования трансляции вирусных белков 4
Зачем возник РНК-сайленсинг? Наиболее распространенное мнение – возникновение системы РНКi было вызвано необходимостью защиты генома от РНКвирусов и мобильных элементов Поддержание стабильности генома – эта функция РНКi сохранилась почти повсеместно (постепенно замещается “чисто белковыми” механизмами? ) Защита от РНК-вирусов – в чистом виде сохранилась у растений, элементы обнаружены у C. elegans, D. melanogaster и позвоночных Некоторые вирусы более патогенны для хозяев, у которых нарушена экспрессия Dicer (впервые показано для насекомых) Клетка-хозяин может использовать РНКi для уничтожения вирусной РНК или ингибирования трансляции вирусных белков 4
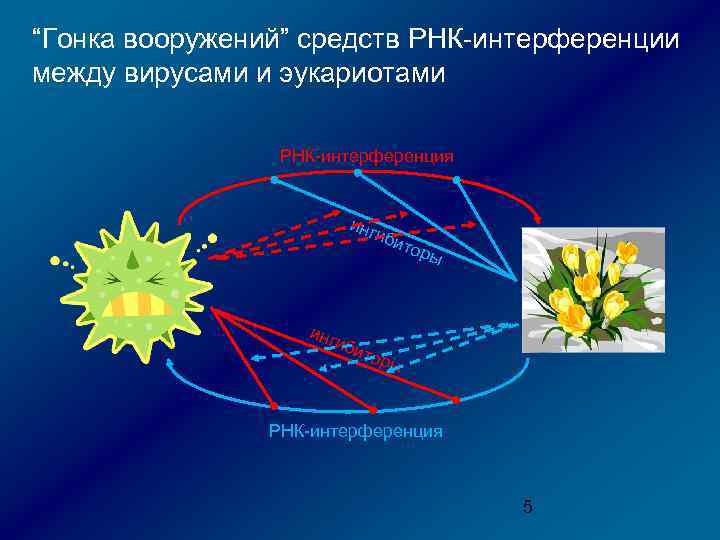 “Гонка вооружений” средств РНК-интерференции между вирусами и эукариотами РНК-интерференция инг иби т оры РНК-интерференция 5
“Гонка вооружений” средств РНК-интерференции между вирусами и эукариотами РНК-интерференция инг иби т оры РНК-интерференция 5
 Дц. РНК вирусов и вироидов может вызывать сайленсинг у растений PTSVd viroids (Wassenegger, Cell 1994) Potato Spindle Tuber Viroid • • PTSVd могут вызывать метилирование мишени около 30 пн в ДНК (Pelissier & Wassenegger, RNA, 2000) в цитоплазме, но не в ядре выявлены вироид-специфические si. РНК 25 пн (Itaya e t al. , Plant J. 2001; Denti et al. , Plant J. 2004) растения отвечают взаимностью! многие детали механизмов неизвестны… Структура вирусного супрессора si. РНК (из Vargason et al, Cell 2003) (из
Дц. РНК вирусов и вироидов может вызывать сайленсинг у растений PTSVd viroids (Wassenegger, Cell 1994) Potato Spindle Tuber Viroid • • PTSVd могут вызывать метилирование мишени около 30 пн в ДНК (Pelissier & Wassenegger, RNA, 2000) в цитоплазме, но не в ядре выявлены вироид-специфические si. РНК 25 пн (Itaya e t al. , Plant J. 2001; Denti et al. , Plant J. 2004) растения отвечают взаимностью! многие детали механизмов неизвестны… Структура вирусного супрессора si. РНК (из Vargason et al, Cell 2003) (из
 Некоторые вирусы (не только у растений!) вырабатывают белки супрессоры РНК-интерференции: HCPro у потивирусов растений (первый пример – Potato Virus Y) – подавляет образование si. РНК P 19 у Tomato Bushy Stunt Virus - связывается с si. РНК и предотвращает их включение в состав RISC В 2 у Flock House Virus – ингибитор Dicer Greasy Grouper Nervous Necrosis Virus – вырабатывает белок-ингибитор Dicer, необходимый для вирусной репликации 2 b - ингибитор системного сайленсинга у Cucumber Mosaic Virus (влияет именно на системный сайленсинг) 8600 тпн Геномы трех РНК-вирусов (с положительной цепью РНК) Обозначены участки кодирования супрессоров РНК-интерференции (черные прямоугольники), гены полимераз (белые прямоугольники), другие вирусные белки (серые прямоугольники), сайты расщепления вирусными протеазами (ромбы) и промоторы субгеномных РНК (стрелки)
Некоторые вирусы (не только у растений!) вырабатывают белки супрессоры РНК-интерференции: HCPro у потивирусов растений (первый пример – Potato Virus Y) – подавляет образование si. РНК P 19 у Tomato Bushy Stunt Virus - связывается с si. РНК и предотвращает их включение в состав RISC В 2 у Flock House Virus – ингибитор Dicer Greasy Grouper Nervous Necrosis Virus – вырабатывает белок-ингибитор Dicer, необходимый для вирусной репликации 2 b - ингибитор системного сайленсинга у Cucumber Mosaic Virus (влияет именно на системный сайленсинг) 8600 тпн Геномы трех РНК-вирусов (с положительной цепью РНК) Обозначены участки кодирования супрессоров РНК-интерференции (черные прямоугольники), гены полимераз (белые прямоугольники), другие вирусные белки (серые прямоугольники), сайты расщепления вирусными протеазами (ромбы) и промоторы субгеномных РНК (стрелки)
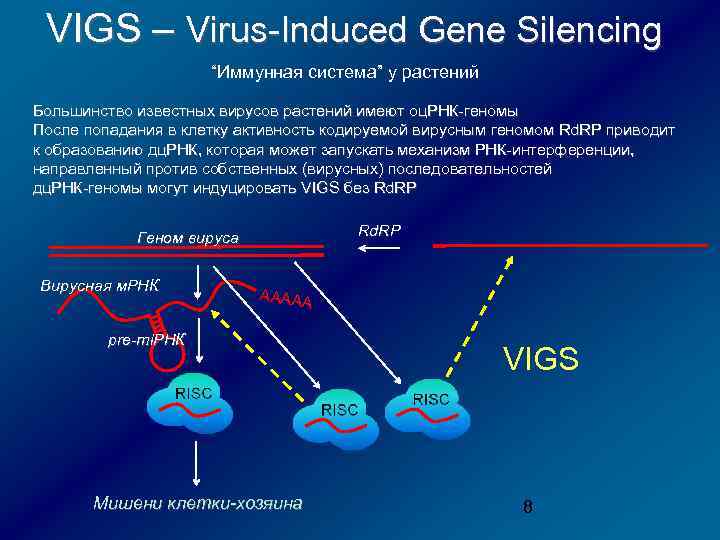 VIGS – Virus-Induced Gene Silencing “Иммунная система” у растений Большинство известных вирусов растений имеют оц. РНК-геномы После попадания в клетку активность кодируемой вирусным геномом Rd. RP приводит к образованию дц. РНК, которая может запускать механизм РНК-интерференции, направленный против собственных (вирусных) последовательностей дц. РНК-геномы могут индуцировать VIGS без Rd. RP Геном вируса Вирусная м. РНК ААААА pre-mi. РНК Мишени клетки-хозяина VIGS 8
VIGS – Virus-Induced Gene Silencing “Иммунная система” у растений Большинство известных вирусов растений имеют оц. РНК-геномы После попадания в клетку активность кодируемой вирусным геномом Rd. RP приводит к образованию дц. РНК, которая может запускать механизм РНК-интерференции, направленный против собственных (вирусных) последовательностей дц. РНК-геномы могут индуцировать VIGS без Rd. RP Геном вируса Вирусная м. РНК ААААА pre-mi. РНК Мишени клетки-хозяина VIGS 8
 Эволюция аппарата РНК-интерференции Борьба с интеграцией и незаконной транскрипцией чужеродных последовательностей (ДНК-копий вирусов и транспозонов) – древняя функция, актуальная и для бактерий! И уже у бактерий она реализована с участием коротких РНК, комплементарных мишеням Выводы, основанные на филогенетическом анализе: общий предок эукариот, скорее всего, имел ключевые компоненты системы РНКинтерференции, которые могли играть и другие роли, в частности, в функционировании аппарата неспецифической деградации РНК: как минимум один Dicer-подобный белок (подобные белки участвуют в аппарате CRISPR-интерференции) выявлены гомологи доменов РНКазы III и PAZ, но не в одном белке как минимум один белок Ago (с доменом PIWI) (Ago-белки имеются у многих бактерий и архей. Функции не определены – предполагается участие в защите от бактериофагов с расщеплением их ДНК) РНК-зависимая РНК-полимераза (имеется у многих вирусов эукариот и бактериофагов) В то же время ДНК-зависимые РНК-полимеразы эукариот в принципе способны работать с дц. РНК, воспринимая ее как дц. ДНК (пример – репликация РНК-генома HDV РНК-полимеразой II)
Эволюция аппарата РНК-интерференции Борьба с интеграцией и незаконной транскрипцией чужеродных последовательностей (ДНК-копий вирусов и транспозонов) – древняя функция, актуальная и для бактерий! И уже у бактерий она реализована с участием коротких РНК, комплементарных мишеням Выводы, основанные на филогенетическом анализе: общий предок эукариот, скорее всего, имел ключевые компоненты системы РНКинтерференции, которые могли играть и другие роли, в частности, в функционировании аппарата неспецифической деградации РНК: как минимум один Dicer-подобный белок (подобные белки участвуют в аппарате CRISPR-интерференции) выявлены гомологи доменов РНКазы III и PAZ, но не в одном белке как минимум один белок Ago (с доменом PIWI) (Ago-белки имеются у многих бактерий и архей. Функции не определены – предполагается участие в защите от бактериофагов с расщеплением их ДНК) РНК-зависимая РНК-полимераза (имеется у многих вирусов эукариот и бактериофагов) В то же время ДНК-зависимые РНК-полимеразы эукариот в принципе способны работать с дц. РНК, воспринимая ее как дц. ДНК (пример – репликация РНК-генома HDV РНК-полимеразой II)
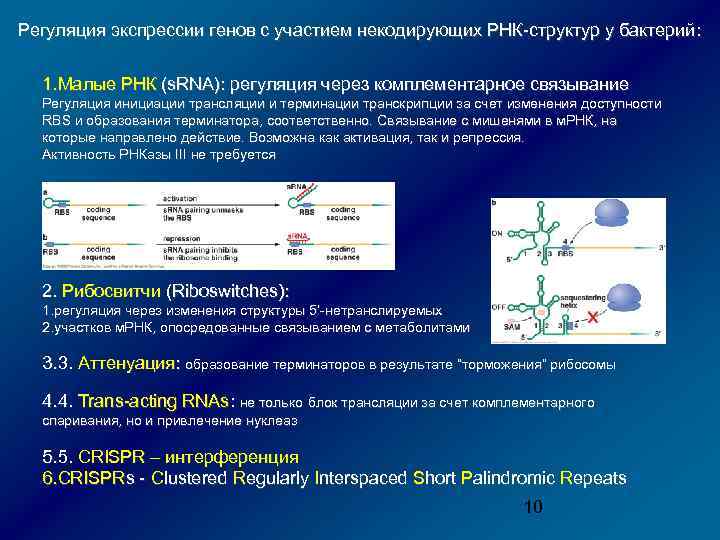 Регуляция экспрессии генов с участием некодирующих РНК-структур у бактерий: 1. Малые РНК (s. RNA): регуляция через комплементарное связывание Регуляция инициации трансляции и терминации транскрипции за счет изменения доступности RBS и образования терминатора, соответственно. Связывание с мишенями в м. РНК, на которые направлено действие. Возможна как активация, так и репрессия. Активность РНКазы III не требуется 2. Рибосвитчи (Riboswitches): 1. регуляция через изменения структуры 5’-нетранслируемых 2. участков м. РНК, опосредованные связыванием с метаболитами 3. 3. Аттенуация: образование терминаторов в результате “торможения” рибосомы 4. 4. Trans-acting RNAs: не только блок трансляции за счет комплементарного спаривания, но и привлечение нуклеаз 5. 5. CRISPR – интерференция 6. CRISPRs - Clustered Regularly Interspaced Short Palindromic Repeats 10
Регуляция экспрессии генов с участием некодирующих РНК-структур у бактерий: 1. Малые РНК (s. RNA): регуляция через комплементарное связывание Регуляция инициации трансляции и терминации транскрипции за счет изменения доступности RBS и образования терминатора, соответственно. Связывание с мишенями в м. РНК, на которые направлено действие. Возможна как активация, так и репрессия. Активность РНКазы III не требуется 2. Рибосвитчи (Riboswitches): 1. регуляция через изменения структуры 5’-нетранслируемых 2. участков м. РНК, опосредованные связыванием с метаболитами 3. 3. Аттенуация: образование терминаторов в результате “торможения” рибосомы 4. 4. Trans-acting RNAs: не только блок трансляции за счет комплементарного спаривания, но и привлечение нуклеаз 5. 5. CRISPR – интерференция 6. CRISPRs - Clustered Regularly Interspaced Short Palindromic Repeats 10
 CRISPRs - Clustered Regularly Interspaced Short Palindromic Repeats Открыты в 1987 г. у E. coli, сходные структуры выявлены в геномах многих других прокариот (все археи, половина эубактерий) Образуют массивы уникальной структуры (используются для “сполиготипирования” (spoligotyping)) Повторы 21 -47 пн, несовершенные палиндромы, разделенные уникальными “спейсерами” сходной длины, аналогичными последовательностям в геномах бактериофагов и некоторых плазмид Эти последовательности защищают бактерию от последующего заражения фагом Могут образовывать вторичные структуры
CRISPRs - Clustered Regularly Interspaced Short Palindromic Repeats Открыты в 1987 г. у E. coli, сходные структуры выявлены в геномах многих других прокариот (все археи, половина эубактерий) Образуют массивы уникальной структуры (используются для “сполиготипирования” (spoligotyping)) Повторы 21 -47 пн, несовершенные палиндромы, разделенные уникальными “спейсерами” сходной длины, аналогичными последовательностям в геномах бактериофагов и некоторых плазмид Эти последовательности защищают бактерию от последующего заражения фагом Могут образовывать вторичные структуры
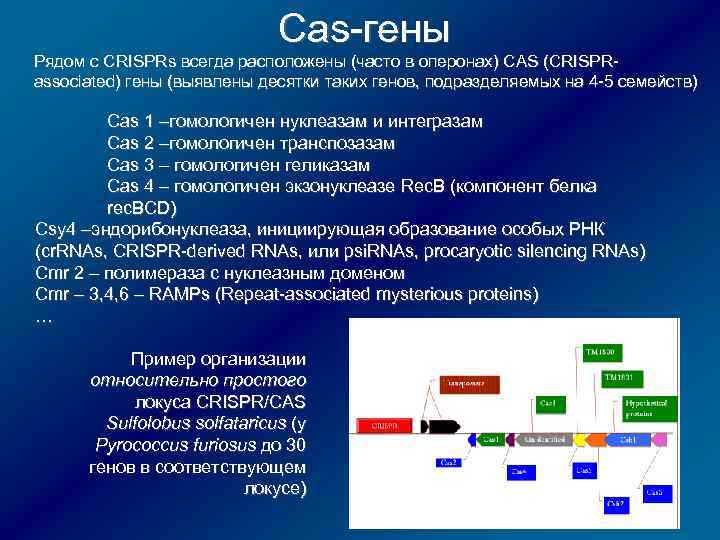 Cas-гены Рядом с CRISPRs всегда расположены (часто в оперонах) CAS (CRISPRassociated) гены (выявлены десятки таких генов, подразделяемых на 4 -5 семейств) Cas 1 –гомологичен нуклеазам и интегразам Cas 2 –гомологичен транспозазам Cas 3 – гомологичен геликазам Cas 4 – гомологичен экзонуклеазе Rec. B (компонент белка rec. BCD) Csy 4 –эндорибонуклеаза, инициирующая образование особых РНК (cr. RNAs, CRISPR-derived RNAs, или psi. RNAs, procaryotic silencing RNAs) Cmr 2 – полимераза c нуклеазным доменом Cmr – 3, 4, 6 – RAMPs (Repeat-associated mysterious proteins) … Пример организации относительно простого локуса CRISPR/CAS Sulfolobus solfataricus (у Pyrococcus furiosus до 30 генов в соответствующем локусе)
Cas-гены Рядом с CRISPRs всегда расположены (часто в оперонах) CAS (CRISPRassociated) гены (выявлены десятки таких генов, подразделяемых на 4 -5 семейств) Cas 1 –гомологичен нуклеазам и интегразам Cas 2 –гомологичен транспозазам Cas 3 – гомологичен геликазам Cas 4 – гомологичен экзонуклеазе Rec. B (компонент белка rec. BCD) Csy 4 –эндорибонуклеаза, инициирующая образование особых РНК (cr. RNAs, CRISPR-derived RNAs, или psi. RNAs, procaryotic silencing RNAs) Cmr 2 – полимераза c нуклеазным доменом Cmr – 3, 4, 6 – RAMPs (Repeat-associated mysterious proteins) … Пример организации относительно простого локуса CRISPR/CAS Sulfolobus solfataricus (у Pyrococcus furiosus до 30 генов в соответствующем локусе)
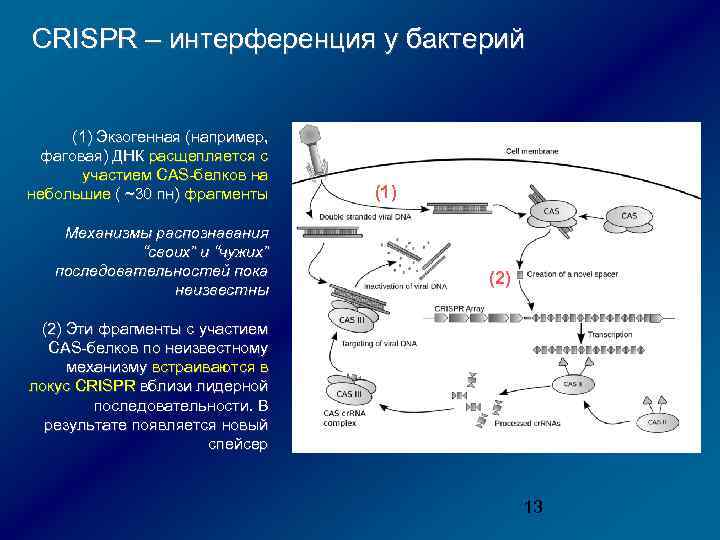 CRISPR – интерференция у бактерий (1) Экзогенная (например, фаговая) ДНК расщепляется с участием CAS-белков на небольшие ( ~30 пн) фрагменты Механизмы распознавания “своих” и “чужих” последовательностей пока неизвестны (1) (2) Эти фрагменты с участием CAS-белков по неизвестному механизму встраиваются в локус CRISPR вблизи лидерной последовательности. В результате появляется новый спейсер 13
CRISPR – интерференция у бактерий (1) Экзогенная (например, фаговая) ДНК расщепляется с участием CAS-белков на небольшие ( ~30 пн) фрагменты Механизмы распознавания “своих” и “чужих” последовательностей пока неизвестны (1) (2) Эти фрагменты с участием CAS-белков по неизвестному механизму встраиваются в локус CRISPR вблизи лидерной последовательности. В результате появляется новый спейсер 13
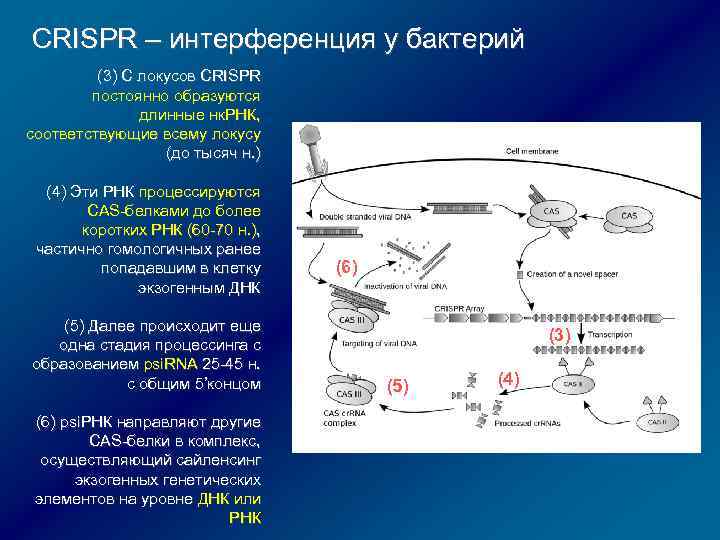 CRISPR – интерференция у бактерий (3) С локусов CRISPR постоянно образуются длинные нк. РНК, соответствующие всему локусу (до тысяч н. ) (4) Эти РНК процессируются CAS-белками до более коротких РНК (60 -70 н. ), частично гомологичных ранее попадавшим в клетку экзогенным ДНК (5) Далее происходит еще одна стадия процессинга с образованием psi. RNA 25 -45 н. с общим 5’концом (6) psi. РНК направляют другие CAS-белки в комплекс, осуществляющий сайленсинг экзогенных генетических элементов на уровне ДНК или РНК (6) (3) (5) (4)
CRISPR – интерференция у бактерий (3) С локусов CRISPR постоянно образуются длинные нк. РНК, соответствующие всему локусу (до тысяч н. ) (4) Эти РНК процессируются CAS-белками до более коротких РНК (60 -70 н. ), частично гомологичных ранее попадавшим в клетку экзогенным ДНК (5) Далее происходит еще одна стадия процессинга с образованием psi. RNA 25 -45 н. с общим 5’концом (6) psi. РНК направляют другие CAS-белки в комплекс, осуществляющий сайленсинг экзогенных генетических элементов на уровне ДНК или РНК (6) (3) (5) (4)
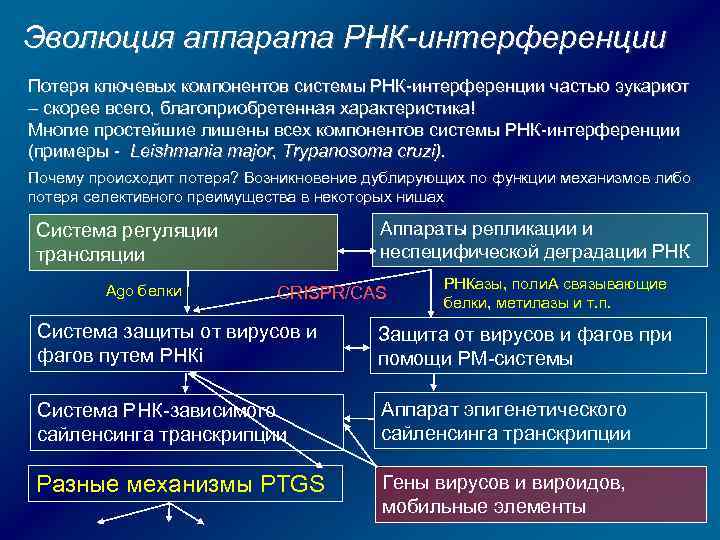 Эволюция аппарата РНК-интерференции Потеря ключевых компонентов системы РНК-интерференции частью эукариот – скорее всего, благоприобретенная характеристика! Многие простейшие лишены всех компонентов системы РНК-интерференции (примеры - Leishmania major, Trypanosoma cruzi). Почему происходит потеря? Возникновение дублирующих по функции механизмов либо потеря селективного преимущества в некоторых нишах Аппараты репликации и неспецифической деградации РНК Система регуляции трансляции Ago белки CRISPR/CAS РНКазы, поли. А связывающие белки, метилазы и т. п. Система защиты от вирусов и фагов путем РНКi Защита от вирусов и фагов при помощи РМ-системы Система РНК-зависимого сайленсинга транскрипции Аппарат эпигенетического сайленсинга транскрипции Разные механизмы PTGS Гены вирусов и вироидов, мобильные элементы
Эволюция аппарата РНК-интерференции Потеря ключевых компонентов системы РНК-интерференции частью эукариот – скорее всего, благоприобретенная характеристика! Многие простейшие лишены всех компонентов системы РНК-интерференции (примеры - Leishmania major, Trypanosoma cruzi). Почему происходит потеря? Возникновение дублирующих по функции механизмов либо потеря селективного преимущества в некоторых нишах Аппараты репликации и неспецифической деградации РНК Система регуляции трансляции Ago белки CRISPR/CAS РНКазы, поли. А связывающие белки, метилазы и т. п. Система защиты от вирусов и фагов путем РНКi Защита от вирусов и фагов при помощи РМ-системы Система РНК-зависимого сайленсинга транскрипции Аппарат эпигенетического сайленсинга транскрипции Разные механизмы PTGS Гены вирусов и вироидов, мобильные элементы
 В расходящихся ветвях “эволюционного дерева” – существенные расхождения в функционировании системы РНК-зависимого сайленсинга у Schizosaccharomyces pombe есть DCR и AGO у Saccharomyces cerevisiae – нет (зато есть HP 1) vs У S. cerevisiae вообще практически нет системы РНК-интерференции, кроме отдельных компонентов! Но: у близких родственников S. cerevisiae (Saccharomyces castellii и Candida albicans) есть РНК-сайленсинг. Введение двух белков системы РНК-интерференции (Dicer и Argonaute) от S. castellii запускает РНКинтерференцию у S. cerevisiae! (Drinnenberg et al. RNAi in Budding Yeast. Science 2009) 16
В расходящихся ветвях “эволюционного дерева” – существенные расхождения в функционировании системы РНК-зависимого сайленсинга у Schizosaccharomyces pombe есть DCR и AGO у Saccharomyces cerevisiae – нет (зато есть HP 1) vs У S. cerevisiae вообще практически нет системы РНК-интерференции, кроме отдельных компонентов! Но: у близких родственников S. cerevisiae (Saccharomyces castellii и Candida albicans) есть РНК-сайленсинг. Введение двух белков системы РНК-интерференции (Dicer и Argonaute) от S. castellii запускает РНКинтерференцию у S. cerevisiae! (Drinnenberg et al. RNAi in Budding Yeast. Science 2009) 16
 Потеря РНК-интерференции может давать преимущества Эксперимент: S. cerevisae с восстановленной способностью к РНК-интерференции быстро теряют симбиотический дц. РНК-вирус killer, который живет в их цитоплазме. Этот вирус, содержит в своем геноме ген токсичного белка и одновременно защищает клетку, в которой находится, от действия токсина. Яд выделяется дрожжами в окружающую среду и убивает те дрожжевые клетки, у которых нет такого вируса Активация РНК-интерференции разрушает дц. РНК вируса. В результате дрожжи теряют селективное преимущество и неспособны развиваться на средах, уже заселенных конкурентами, не имеющими вируса-убийцы, а также становятся беззащитными перед конкурентами, у которых такой вирус есть Клетки S. cerevisiae высевались на среду, уже покрытую слоем клетокконкурентов (не имеющих вируса-убийцы). Дикие дрожжи, имеющие вирус и лишенные системы РНКi (слева) справляются с конкурентами успешнее, чем те, в геном которых добавили два гена, необходимые для РНКi (справа). Зона истребления конкурентов выглядит как гало Drinnenberg et al. Compatibility with Killer Explains the Rise of RNAi-Deficient Fungi. Science 2011 Цитировано по: http: //elementy. ru/news/431678? page_design=print
Потеря РНК-интерференции может давать преимущества Эксперимент: S. cerevisae с восстановленной способностью к РНК-интерференции быстро теряют симбиотический дц. РНК-вирус killer, который живет в их цитоплазме. Этот вирус, содержит в своем геноме ген токсичного белка и одновременно защищает клетку, в которой находится, от действия токсина. Яд выделяется дрожжами в окружающую среду и убивает те дрожжевые клетки, у которых нет такого вируса Активация РНК-интерференции разрушает дц. РНК вируса. В результате дрожжи теряют селективное преимущество и неспособны развиваться на средах, уже заселенных конкурентами, не имеющими вируса-убийцы, а также становятся беззащитными перед конкурентами, у которых такой вирус есть Клетки S. cerevisiae высевались на среду, уже покрытую слоем клетокконкурентов (не имеющих вируса-убийцы). Дикие дрожжи, имеющие вирус и лишенные системы РНКi (слева) справляются с конкурентами успешнее, чем те, в геном которых добавили два гена, необходимые для РНКi (справа). Зона истребления конкурентов выглядит как гало Drinnenberg et al. Compatibility with Killer Explains the Rise of RNAi-Deficient Fungi. Science 2011 Цитировано по: http: //elementy. ru/news/431678? page_design=print
 Потеря РНК-интерференции может давать преимущества Целенаправленный поиск генов, необходимых для РНК-интерференции, в геномах грибов, у которых есть симбиотические вирусы-убийцы, а также поиск таких вирусов у грибов, о которых уже было известно, что РНКинтерференция у них есть: между наличием вирусов-убийц и системы РНК-интерференции существует четкая отрицательная корреляция. У всех видов, имеющих вирусов-убийц, нет РНК-интерференции. При этом близкородственные виды могут обладать РНК-интерференцией, но в этом случае у них наверняка нет вирусов-убийц Все девять случаев утраты РНК-интерференции произошли сравнительно недавно по эволюционным меркам. Если какие-то грибы и утрачивали РНК-интерференцию в более далеком прошлом, потомки этих грибов не дожили до наших дней Drinnenberg et al. Compatibility with Killer Explains the Rise of RNAi-Deficient Fungi. Science 2011 Цитировано по: http: //elementy. ru/news/431678? page_design=print
Потеря РНК-интерференции может давать преимущества Целенаправленный поиск генов, необходимых для РНК-интерференции, в геномах грибов, у которых есть симбиотические вирусы-убийцы, а также поиск таких вирусов у грибов, о которых уже было известно, что РНКинтерференция у них есть: между наличием вирусов-убийц и системы РНК-интерференции существует четкая отрицательная корреляция. У всех видов, имеющих вирусов-убийц, нет РНК-интерференции. При этом близкородственные виды могут обладать РНК-интерференцией, но в этом случае у них наверняка нет вирусов-убийц Все девять случаев утраты РНК-интерференции произошли сравнительно недавно по эволюционным меркам. Если какие-то грибы и утрачивали РНК-интерференцию в более далеком прошлом, потомки этих грибов не дожили до наших дней Drinnenberg et al. Compatibility with Killer Explains the Rise of RNAi-Deficient Fungi. Science 2011 Цитировано по: http: //elementy. ru/news/431678? page_design=print
 РНК-сайленсинг - более “молодые” функции: Время-разрешенная и тканеспецифичная регуляция экспрессии генов у организмов с билатеральной симметрией Участие в формировании и функционировании гетерохроматина Быстрый и комплексный ответ на стресс Вновь открываемые функции: следы более древних механизмов или действительно новые? 19
РНК-сайленсинг - более “молодые” функции: Время-разрешенная и тканеспецифичная регуляция экспрессии генов у организмов с билатеральной симметрией Участие в формировании и функционировании гетерохроматина Быстрый и комплексный ответ на стресс Вновь открываемые функции: следы более древних механизмов или действительно новые? 19
 Когда возникли гены микро. РНК человека? Детальный сравнительный анализ филогенетического распределения гомологов 1048 генов ми. РНК человека (www. mirbase. org, выпуск 16, 2010 г. ) среди различных организмов: 149 гомологов выявлены уже в геномах рыб Danio rerio, Oryzias latipes) 169 гомологов у истинных плацентарных (мышь, собака, лошадь, корова и др. ) 308 генов являются общими только между человеком и шимпанзе 380 генов ми. РНК (40%) специфичны только для 20 человека!
Когда возникли гены микро. РНК человека? Детальный сравнительный анализ филогенетического распределения гомологов 1048 генов ми. РНК человека (www. mirbase. org, выпуск 16, 2010 г. ) среди различных организмов: 149 гомологов выявлены уже в геномах рыб Danio rerio, Oryzias latipes) 169 гомологов у истинных плацентарных (мышь, собака, лошадь, корова и др. ) 308 генов являются общими только между человеком и шимпанзе 380 генов ми. РНК (40%) специфичны только для 20 человека!
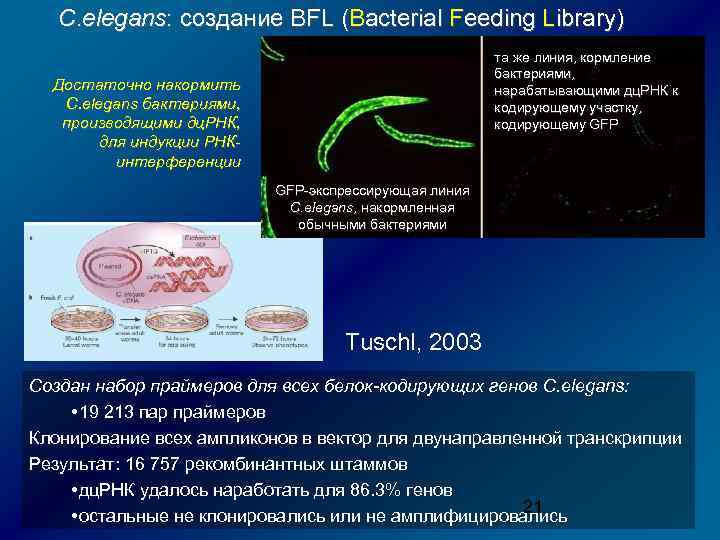 С. elegans: создание BFL (Bacterial Feeding Library) та же линия, кормление бактериями, нарабатывающими дц. РНК к кодирующему участку, кодирующему GFP Достаточно накормить C. elegans бактериями, производящими дц. РНК, для индукции РНКинтерференции GFP-экспрессирующая линия C. elegans, накормленная обычными бактериями Tuschl, 2003 Создан набор праймеров для всех белок-кодирующих генов C. elegans: • 19 213 пар праймеров Клонирование всех ампликонов в вектор для двунаправленной транскрипции Результат: 16 757 рекомбинантных штаммов • дц. РНК удалось наработать для 86. 3% генов 21 • остальные не клонировались или не амплифицировались
С. elegans: создание BFL (Bacterial Feeding Library) та же линия, кормление бактериями, нарабатывающими дц. РНК к кодирующему участку, кодирующему GFP Достаточно накормить C. elegans бактериями, производящими дц. РНК, для индукции РНКинтерференции GFP-экспрессирующая линия C. elegans, накормленная обычными бактериями Tuschl, 2003 Создан набор праймеров для всех белок-кодирующих генов C. elegans: • 19 213 пар праймеров Клонирование всех ампликонов в вектор для двунаправленной транскрипции Результат: 16 757 рекомбинантных штаммов • дц. РНК удалось наработать для 86. 3% генов 21 • остальные не клонировались или не амплифицировались
 Результаты: Только после индукции РНК-интерференции 10% генов-мишеней были получены различимые фенотипы К аберрантным фенотипам (стерильность, нарушения формирования нервной системы, дефекты эмбрионального развития и пр. ) наиболее часто приводила индукция интерференции высококонсервативных генов: гены белков, участвующих в синтезе ДНК, контроле клеточного цикла Эволюционно “молодые” гены не давали детектируемых фенотипов: много дупликаций, специализированные или избыточные функции Охарактеризованные белковые домены, синтез которых был подавлен: жизнеспособные фенотипы при подавлении более “недавних” доменов Ø домены, специфичные для животных (пример: иммуноглобулин-подобные повторы) нежизнеспособные фенотипы при подавлении более “старых” доменов Ø общие домены с растениями и низшими эукариотами Ø эволюционно консервативны, необходимы для выживания геномная кластеризация генов, нокдаун которых приводил к фенотипическим проявлениям Ø общее происхождение или регуляторные механизмы? 22
Результаты: Только после индукции РНК-интерференции 10% генов-мишеней были получены различимые фенотипы К аберрантным фенотипам (стерильность, нарушения формирования нервной системы, дефекты эмбрионального развития и пр. ) наиболее часто приводила индукция интерференции высококонсервативных генов: гены белков, участвующих в синтезе ДНК, контроле клеточного цикла Эволюционно “молодые” гены не давали детектируемых фенотипов: много дупликаций, специализированные или избыточные функции Охарактеризованные белковые домены, синтез которых был подавлен: жизнеспособные фенотипы при подавлении более “недавних” доменов Ø домены, специфичные для животных (пример: иммуноглобулин-подобные повторы) нежизнеспособные фенотипы при подавлении более “старых” доменов Ø общие домены с растениями и низшими эукариотами Ø эволюционно консервативны, необходимы для выживания геномная кластеризация генов, нокдаун которых приводил к фенотипическим проявлениям Ø общее происхождение или регуляторные механизмы? 22
 Разнообразие эффектов малых регуляторных РНК в регуляции экспрессии генов: Запуск механизма “классической” РНК-интерференции (расщепление мишени) Репрессия или активация транскрипции Репрессия или активация трансляции (на стадии инициации или элонгации) Формирование гетерохроматина или снятие гетерохроматиновых структур Редактирование, полиаденилирование, полиуридинилирование, деаденилирование РНК-мишени Индукция деградации РНК-мишени Индукция связывания РНК-мишеней в цитоплазматических гранулах …? Насколько независимы механизмы реализации тех или иных эффектов?
Разнообразие эффектов малых регуляторных РНК в регуляции экспрессии генов: Запуск механизма “классической” РНК-интерференции (расщепление мишени) Репрессия или активация транскрипции Репрессия или активация трансляции (на стадии инициации или элонгации) Формирование гетерохроматина или снятие гетерохроматиновых структур Редактирование, полиаденилирование, полиуридинилирование, деаденилирование РНК-мишени Индукция деградации РНК-мишени Индукция связывания РНК-мишеней в цитоплазматических гранулах …? Насколько независимы механизмы реализации тех или иных эффектов?
 У С. elegans впервые показано “пересечение” разных регуляторных путей, задействующих одни и те же компоненты системы РНК-зависимого сайленсинга Tabara et al. Cell (1999)
У С. elegans впервые показано “пересечение” разных регуляторных путей, задействующих одни и те же компоненты системы РНК-зависимого сайленсинга Tabara et al. Cell (1999)
 Генетический скрининг для поиска генетических факторов РНК-интерференции у C. elegans Летальность эмбрионов дикого типа (WT) и мутантов rde при введении дц. РНК к гену pos -1: все 4 rde- штамма и 2 из mut-штаммов продемонстрировали устойчивость к РНКинтерференции Продукт гена pos-1 необходим для развития эмбрионов Подавление экспрессии приводит к формированию нежизнеспособных эмбрионов У мутантов по генам системы РНК-интерференции введение дц. РНК к гену pos 1 не приводит к стерильности Так был выявлен ряд генов, необходимых для РНК-интерференции (все мутации рецессивны). Мутации некоторых из них приводили к повышению частоты транспозиций мобильных элементов, другие не приводили к таким эффектам Эти гены были разделены на две группы: • rde гены (RNAi-deficient) • mut гены (mutator)
Генетический скрининг для поиска генетических факторов РНК-интерференции у C. elegans Летальность эмбрионов дикого типа (WT) и мутантов rde при введении дц. РНК к гену pos -1: все 4 rde- штамма и 2 из mut-штаммов продемонстрировали устойчивость к РНКинтерференции Продукт гена pos-1 необходим для развития эмбрионов Подавление экспрессии приводит к формированию нежизнеспособных эмбрионов У мутантов по генам системы РНК-интерференции введение дц. РНК к гену pos 1 не приводит к стерильности Так был выявлен ряд генов, необходимых для РНК-интерференции (все мутации рецессивны). Мутации некоторых из них приводили к повышению частоты транспозиций мобильных элементов, другие не приводили к таким эффектам Эти гены были разделены на две группы: • rde гены (RNAi-deficient) • mut гены (mutator)
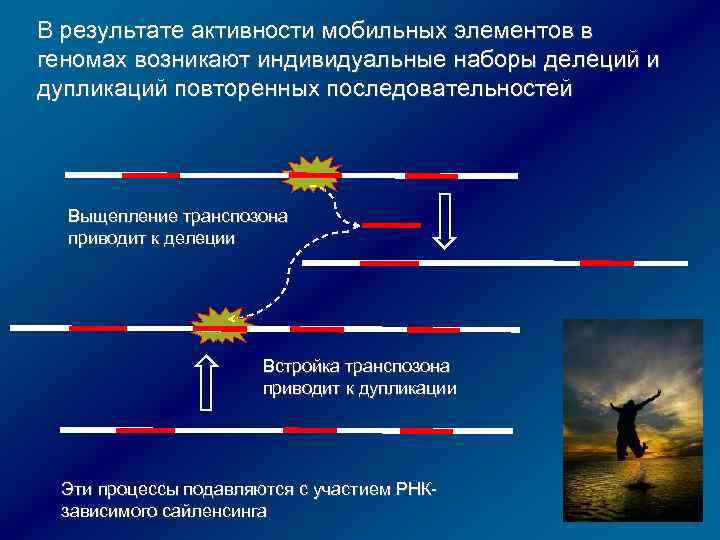 В результате активности мобильных элементов в геномах возникают индивидуальные наборы делеций и дупликаций повторенных последовательностей Выщепление транспозона приводит к делеции Встройка транспозона приводит к дупликации Эти процессы подавляются с участием РНКзависимого сайленсинга
В результате активности мобильных элементов в геномах возникают индивидуальные наборы делеций и дупликаций повторенных последовательностей Выщепление транспозона приводит к делеции Встройка транспозона приводит к дупликации Эти процессы подавляются с участием РНКзависимого сайленсинга
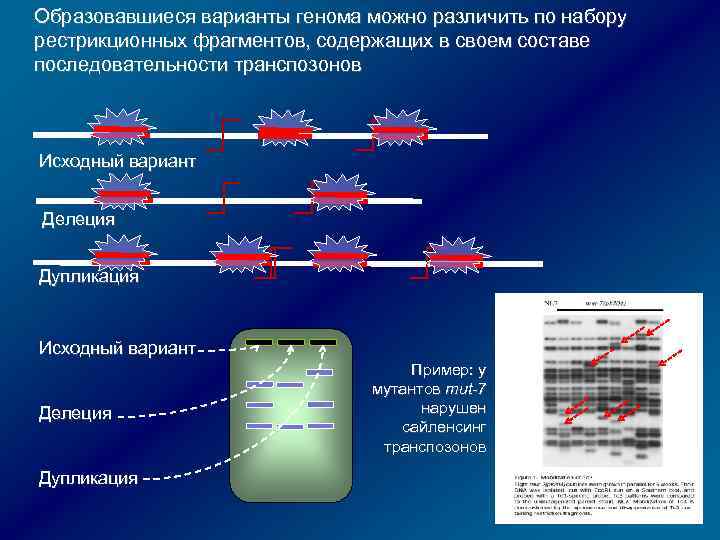 Образовавшиеся варианты генома можно различить по набору рестрикционных фрагментов, содержащих в своем составе последовательности транспозонов Исходный вариант Делеция Дупликация Пример: у мутантов mut-7 нарушен сайленсинг транспозонов
Образовавшиеся варианты генома можно различить по набору рестрикционных фрагментов, содержащих в своем составе последовательности транспозонов Исходный вариант Делеция Дупликация Пример: у мутантов mut-7 нарушен сайленсинг транспозонов
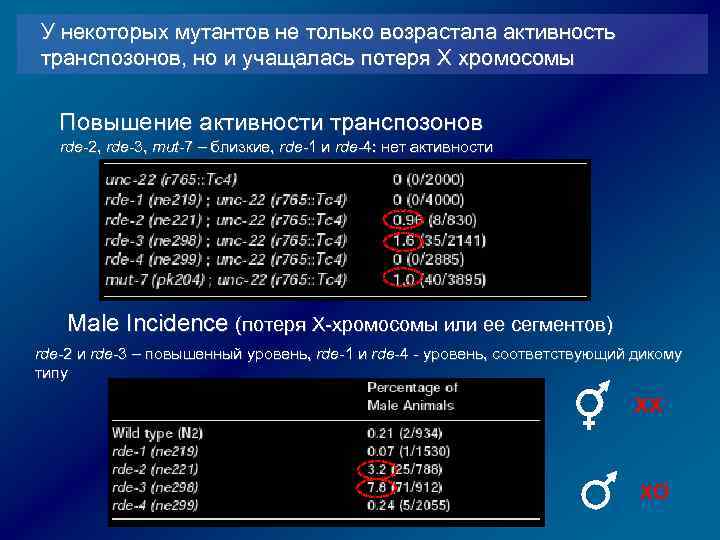 У некоторых мутантов не только возрастала активность транспозонов, но и учащалась потеря Х хромосомы Повышение активности транспозонов rde-2, rde-3, mut-7 – близкие, rde-1 и rde-4: нет активности Male Incidence (потеря Х-хромосомы или ее сегментов) rde-2 и rde-3 – повышенный уровень, rde-1 и rde-4 - уровень, соответствующий дикому типу XX XO
У некоторых мутантов не только возрастала активность транспозонов, но и учащалась потеря Х хромосомы Повышение активности транспозонов rde-2, rde-3, mut-7 – близкие, rde-1 и rde-4: нет активности Male Incidence (потеря Х-хромосомы или ее сегментов) rde-2 и rde-3 – повышенный уровень, rde-1 и rde-4 - уровень, соответствующий дикому типу XX XO
 РНК-интерференция и сайленсинг трансгенов у C. elegans Некоторые мутантные формы, устойчивые к РНК-интерференции, также дефицитны по сайленсингу трансгенов и транспозонов (примеры – mut 7, rde 2): следовательно, есть общие компоненты между этими механизмами si. РНК, комплементарные транспозонам, выявляются у особей дикого типа и мутантов rde-1, rde-4, но не у мутантов mut (pk 732 также относится к группе генов mut) Transposon silencing in the Caenorhabditis elegans germ line by natural RNAi (Sijen & Plasterk, Nature 2003) В то же время: Некоторые мутанты, дефицитные по системе сайленсинга транспозонов и трансгенов, чувствительны к РНК-интерференции Некоторые мутанты, резистентные к РНК-интерференции, демонстрируют нормальный сайленсинг транспозонов и трансгенов (пример -rde 1) Следовательно, механизмы РНК-интерференции не полностью совпадают с механизмами сайленсинга транспозонов и трансгенов!
РНК-интерференция и сайленсинг трансгенов у C. elegans Некоторые мутантные формы, устойчивые к РНК-интерференции, также дефицитны по сайленсингу трансгенов и транспозонов (примеры – mut 7, rde 2): следовательно, есть общие компоненты между этими механизмами si. РНК, комплементарные транспозонам, выявляются у особей дикого типа и мутантов rde-1, rde-4, но не у мутантов mut (pk 732 также относится к группе генов mut) Transposon silencing in the Caenorhabditis elegans germ line by natural RNAi (Sijen & Plasterk, Nature 2003) В то же время: Некоторые мутанты, дефицитные по системе сайленсинга транспозонов и трансгенов, чувствительны к РНК-интерференции Некоторые мутанты, резистентные к РНК-интерференции, демонстрируют нормальный сайленсинг транспозонов и трансгенов (пример -rde 1) Следовательно, механизмы РНК-интерференции не полностью совпадают с механизмами сайленсинга транспозонов и трансгенов!
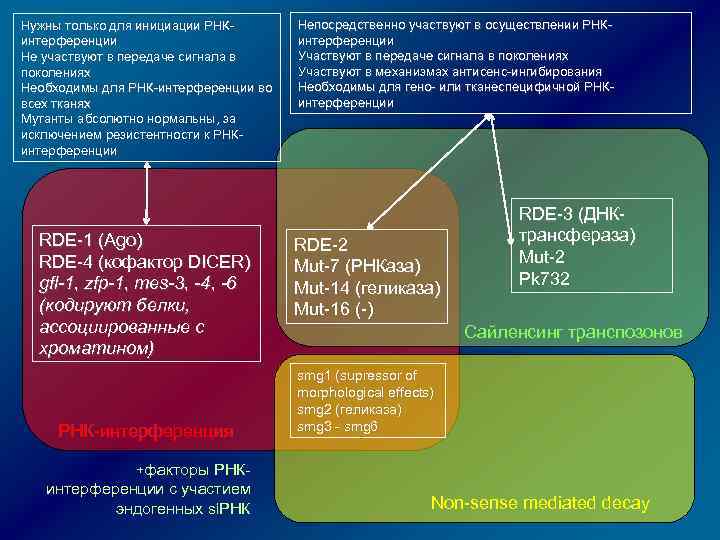 Нужны только для инициации РНКинтерференции Не участвуют в передаче сигнала в поколениях Необходимы для РНК-интерференции во всех тканях Мутанты абсолютно нормальны, за исключением резистентности к РНКинтерференции RDE-1 (Ago) RDE-4 (кофактор DICER) gfl-1, zfp-1, mes-3, -4, -6 (кодируют белки, ассоциированные с хроматином) РНК-интерференция Непосредственно участвуют в осуществлении РНКинтерференции Участвуют в передаче сигнала в поколениях Участвуют в механизмах антисенс-ингибирования Необходимы для гено- или тканеспецифичной РНКинтерференции RDE-2 Mut-7 (РНКаза) Mut-14 (геликаза) Mut-16 (-) RDE-3 (ДНКтрансфераза) Mut-2 Pk 732 Сайленсинг транспозонов smg 1 (supressor of morphological effects) smg 2 (геликаза) smg 3 - smg 6 +факторы РНК- интерференции с участием эндогенных si. РНК Non-sense mediated decay
Нужны только для инициации РНКинтерференции Не участвуют в передаче сигнала в поколениях Необходимы для РНК-интерференции во всех тканях Мутанты абсолютно нормальны, за исключением резистентности к РНКинтерференции RDE-1 (Ago) RDE-4 (кофактор DICER) gfl-1, zfp-1, mes-3, -4, -6 (кодируют белки, ассоциированные с хроматином) РНК-интерференция Непосредственно участвуют в осуществлении РНКинтерференции Участвуют в передаче сигнала в поколениях Участвуют в механизмах антисенс-ингибирования Необходимы для гено- или тканеспецифичной РНКинтерференции RDE-2 Mut-7 (РНКаза) Mut-14 (геликаза) Mut-16 (-) RDE-3 (ДНКтрансфераза) Mut-2 Pk 732 Сайленсинг транспозонов smg 1 (supressor of morphological effects) smg 2 (геликаза) smg 3 - smg 6 +факторы РНК- интерференции с участием эндогенных si. РНК Non-sense mediated decay
 Разнообразие эффектов и функций малых регуляторных РНК: Стабилизация или индукция деградации РНКмишени Регуляция экспрессии генов Индукция связывания РНК-мишеней в цитоплазматических гранулах Защита от вирусной инфекции Редактирование РНК-мишени Полиаденилирование, полиуридинилирование, деаденилирование РНК-мишени “Классическая” РНК-интерференция (расщепление РНК-мишени) Ответ на стресс Стабилизация структуры генома Репрессия или активация транскрипции Поддержание структуры хроматина (прежде всего гетерохроматина) Формирование гетерохроматина или снятие гетерохроматиновых структур Реорганизация генома Репрессия или активация трансляции РНК-интерференция также работает на транскрипционном уровне! растения, C. elegans, Drosophilia, Tetrahymena связана с перестройками хроматина метилирование ДНК и гистонов 31 элиминация ДНК из соматических макронуклеусов Ciliates
Разнообразие эффектов и функций малых регуляторных РНК: Стабилизация или индукция деградации РНКмишени Регуляция экспрессии генов Индукция связывания РНК-мишеней в цитоплазматических гранулах Защита от вирусной инфекции Редактирование РНК-мишени Полиаденилирование, полиуридинилирование, деаденилирование РНК-мишени “Классическая” РНК-интерференция (расщепление РНК-мишени) Ответ на стресс Стабилизация структуры генома Репрессия или активация транскрипции Поддержание структуры хроматина (прежде всего гетерохроматина) Формирование гетерохроматина или снятие гетерохроматиновых структур Реорганизация генома Репрессия или активация трансляции РНК-интерференция также работает на транскрипционном уровне! растения, C. elegans, Drosophilia, Tetrahymena связана с перестройками хроматина метилирование ДНК и гистонов 31 элиминация ДНК из соматических макронуклеусов Ciliates
 РНК-интерференция: связь с модификациями хроматина 32
РНК-интерференция: связь с модификациями хроматина 32
 Упаковка повторов в гетерохроматин: ØПредотвращает незаконную рекомбинацию, которая может привести к хромосомным перестройкам ØЗащищает хромосомы от активности транспозонов ØСоздает структуры, необходимые для правильного деления ØОбеспечивает реализацию пространственной информации Гетерохроматин кодирует малые (и не только малые) регуляторные РНК Эти РНК направляют модификации белков и ДНК в гетерохроматиновых повторах и мобильных элементах, гомологичных самим этим РНК (“самоубийство”) Ключевой фактор в эпигенетической регуляции экспрессии генов, стабильности хромосом и эволюции 33
Упаковка повторов в гетерохроматин: ØПредотвращает незаконную рекомбинацию, которая может привести к хромосомным перестройкам ØЗащищает хромосомы от активности транспозонов ØСоздает структуры, необходимые для правильного деления ØОбеспечивает реализацию пространственной информации Гетерохроматин кодирует малые (и не только малые) регуляторные РНК Эти РНК направляют модификации белков и ДНК в гетерохроматиновых повторах и мобильных элементах, гомологичных самим этим РНК (“самоубийство”) Ключевой фактор в эпигенетической регуляции экспрессии генов, стабильности хромосом и эволюции 33
 Транскрипционный генетический сайленсинг (TGS) не все механизмы реализуются с участием малых РНК! Homology Dependent Genetic Silencing (HDGS) или Co-transcriptional Gene Silencing (CTGS) Три вида воздействия РНК-зависимого сайленсинга на хроматин: метилирование ДНК с последующей гетерохроматинизацией формирование гетерохроматина, независимое от метилирования программируемая элиминация фрагментов ДНК 34
Транскрипционный генетический сайленсинг (TGS) не все механизмы реализуются с участием малых РНК! Homology Dependent Genetic Silencing (HDGS) или Co-transcriptional Gene Silencing (CTGS) Три вида воздействия РНК-зависимого сайленсинга на хроматин: метилирование ДНК с последующей гетерохроматинизацией формирование гетерохроматина, независимое от метилирования программируемая элиминация фрагментов ДНК 34
 РНК-зависимый сайленсинг на уровне ДНК: РНК-зависимый сайленсинг повторов (дрожжи) Сайленсинг ДНК транспозонов и трансгенов (Drosophila, растения) Дц. РНК-индуцированное метилирование ДНК (ds. RNA-induced DNA methylation) (растения) “Диминуция” хроматина в макронуклеусах (инфузории) Локальный сайленсинг хроматина, индуцируемый короткими РНК (животные и человек) Сайленсинг X-хроматина у млекопитающих через образование дуплексов Xist/Tsix (? ) Ogawa et al. , Science, 2008 и др. … 35
РНК-зависимый сайленсинг на уровне ДНК: РНК-зависимый сайленсинг повторов (дрожжи) Сайленсинг ДНК транспозонов и трансгенов (Drosophila, растения) Дц. РНК-индуцированное метилирование ДНК (ds. RNA-induced DNA methylation) (растения) “Диминуция” хроматина в макронуклеусах (инфузории) Локальный сайленсинг хроматина, индуцируемый короткими РНК (животные и человек) Сайленсинг X-хроматина у млекопитающих через образование дуплексов Xist/Tsix (? ) Ogawa et al. , Science, 2008 и др. … 35
 РНК-зависимый сайленсинг повторов у дрожжей: RITS = RNA-induced transcriptional silencing Наиболее исследован у дрожжей Schizosaccharomyces pombe, но механизм широко распространен У S. pombe нет HP 1, выключена стандартная цепочка “HDACгистонметилазы-HP 1 -ремоделлинг” Мутации генов, кодирующих факторы РНК-интерференции, могут нарушать формирование ГХ! Нарушения в организации гетерохроматина и формировании хромосомных центромер RITS - мультибелковый комплекс, активируется связыванием с mi. РНК и взаимодействует с ДНК и гистонами. Cвязывает РНК-интерференцию и аппарат формирования ГХ. Подобен комплексу RISC и может содержать общие с ним компоненты
РНК-зависимый сайленсинг повторов у дрожжей: RITS = RNA-induced transcriptional silencing Наиболее исследован у дрожжей Schizosaccharomyces pombe, но механизм широко распространен У S. pombe нет HP 1, выключена стандартная цепочка “HDACгистонметилазы-HP 1 -ремоделлинг” Мутации генов, кодирующих факторы РНК-интерференции, могут нарушать формирование ГХ! Нарушения в организации гетерохроматина и формировании хромосомных центромер RITS - мультибелковый комплекс, активируется связыванием с mi. РНК и взаимодействует с ДНК и гистонами. Cвязывает РНК-интерференцию и аппарат формирования ГХ. Подобен комплексу RISC и может содержать общие с ним компоненты
 Основные компоненты RITS: Белок (белки) Ago (содержащие домен PIWI) Сhromodomain protein Chp 1 (может связывать метилированные гистоны) Tas 3 (распознает метилирование H 3 -K 9) Дополнительно: малые РНК Малые РНК, входящие в RITS: • для образования необходим Dicer • требуются для локализации RITS в доменах гетерохроматина (распознавание мишени) • комплементарны центромерным повторам ДНК, на которых инициируется сборка гетерохроматина (heterochromatic RNAs) Ago 1
Основные компоненты RITS: Белок (белки) Ago (содержащие домен PIWI) Сhromodomain protein Chp 1 (может связывать метилированные гистоны) Tas 3 (распознает метилирование H 3 -K 9) Дополнительно: малые РНК Малые РНК, входящие в RITS: • для образования необходим Dicer • требуются для локализации RITS в доменах гетерохроматина (распознавание мишени) • комплементарны центромерным повторам ДНК, на которых инициируется сборка гетерохроматина (heterochromatic RNAs) Ago 1
 РНК-зависимый сайленсинг повторов у S. pombe: Заключается в РНК-зависимой сборке гетерохроматина Сборка происходит в результате координированных эпигенетических модификаций хроматина с участием активного (“заряженного”) RITS деацетилирование гистонов с участием белков SIR, HDAC (например, Clr 3 и Clr 6), метилирование H 3 K 9, привлечение гистон-связывающих белков (например, Swi 6) Происходит в центромерах, теломерах и локусах типа спаривания (mating-type loci) RITS направляется к специфическим участкам хромосомы для их инактивации RITS взаимодействует с РНК-полимеразным комплексом RDRC (RNA-directed RNA polymerase complex) 38
РНК-зависимый сайленсинг повторов у S. pombe: Заключается в РНК-зависимой сборке гетерохроматина Сборка происходит в результате координированных эпигенетических модификаций хроматина с участием активного (“заряженного”) RITS деацетилирование гистонов с участием белков SIR, HDAC (например, Clr 3 и Clr 6), метилирование H 3 K 9, привлечение гистон-связывающих белков (например, Swi 6) Происходит в центромерах, теломерах и локусах типа спаривания (mating-type loci) RITS направляется к специфическим участкам хромосомы для их инактивации RITS взаимодействует с РНК-полимеразным комплексом RDRC (RNA-directed RNA polymerase complex) 38
 Направляемое РНК распознавание специфических участков RITS не спаривается с ДНК хроматина непосредственно: это “непрямое спаривание” Эксперименты по иммунопреципитации РНК: RITS ассоциирует именно с некодирующими РНК, гомологичными повторам, но не с м. РНК эухроматиновых генов, цитоплазматические РНК не являются мишенями Эта ассоциация требует активности Dicer, следовательно, необходимо образование коротких дц. РНК Мишени преимущественно (если не исключительно) соответствуют продуктам транскрипции РНК-полимеразы II, с которой ассоциирует Ago 1, могут быть введены искусственно (Schramke et al. Nature 2005) Для локализации RITS на хроматине требуется метилирование H 3 -K 9 метилазой Clr 4 (стабилизирует ассоциацию RITS с хроматином за счет образования сайта связывания хромодомена в составе Chp 1)
Направляемое РНК распознавание специфических участков RITS не спаривается с ДНК хроматина непосредственно: это “непрямое спаривание” Эксперименты по иммунопреципитации РНК: RITS ассоциирует именно с некодирующими РНК, гомологичными повторам, но не с м. РНК эухроматиновых генов, цитоплазматические РНК не являются мишенями Эта ассоциация требует активности Dicer, следовательно, необходимо образование коротких дц. РНК Мишени преимущественно (если не исключительно) соответствуют продуктам транскрипции РНК-полимеразы II, с которой ассоциирует Ago 1, могут быть введены искусственно (Schramke et al. Nature 2005) Для локализации RITS на хроматине требуется метилирование H 3 -K 9 метилазой Clr 4 (стабилизирует ассоциацию RITS с хроматином за счет образования сайта связывания хромодомена в составе Chp 1)
 Направляемое РНК распознавание специфических участков Дц. РНК, соответствующая центромерам и иным повторам, может происходить из двух различных источников: (1) транскрипция смысловой и антисмысловой РНК с обеих цепей (2) синтез комплементарной РНК по РНК-матрице за счет активности РНКзависимой РНК-полимеразы (Rd. Rp) У растений Rd. Rp требуется для модификаций гистонов и ДНК, а также амплификации si. РНК У S. pombe одна Rd. Rp, Rdp 1, которая ассоциирует с центромерным гетерохроматином (у мутантов в составе RITS не обнаруживается si. РНК, он неактивен и не направляется к центромерным повторам, не образуется центромерный гетерохроматин) У млекопитающих не выявлены Rd. Rp – предполагают РНК-зависимую РНК-полимеразную активность РНК-полимеразы II У Drosophila выявлена недавно: Lipardi, Paterson, PNAS 2009 40
Направляемое РНК распознавание специфических участков Дц. РНК, соответствующая центромерам и иным повторам, может происходить из двух различных источников: (1) транскрипция смысловой и антисмысловой РНК с обеих цепей (2) синтез комплементарной РНК по РНК-матрице за счет активности РНКзависимой РНК-полимеразы (Rd. Rp) У растений Rd. Rp требуется для модификаций гистонов и ДНК, а также амплификации si. РНК У S. pombe одна Rd. Rp, Rdp 1, которая ассоциирует с центромерным гетерохроматином (у мутантов в составе RITS не обнаруживается si. РНК, он неактивен и не направляется к центромерным повторам, не образуется центромерный гетерохроматин) У млекопитающих не выявлены Rd. Rp – предполагают РНК-зависимую РНК-полимеразную активность РНК-полимеразы II У Drosophila выявлена недавно: Lipardi, Paterson, PNAS 2009 40
 Ассоциированная с хромосомой амплификация дц. РНК Rdp 1 Hrr 1 RDRC = + + Cid 12 Rdp 1 дрожжей ассоциирована с двумя другими белками: Hrr 1 – предполагаемая РНК-геликаза Cid 12 –предполагаемая поли. А полимераза RDRC и RITS физически взаимодействуют (взаимодействие требует активностей Dicer и ДНКметилазы Clr 4) Clr 4 за счет H 3 -K 9 триметилирования делает возможным связывание RITS с хроматином через спаривание хроматинового транскрипта с si. РНК, а также метилированных нуклеосом с хромодоменами Chp 1 и SWI 6 (гомологи)
Ассоциированная с хромосомой амплификация дц. РНК Rdp 1 Hrr 1 RDRC = + + Cid 12 Rdp 1 дрожжей ассоциирована с двумя другими белками: Hrr 1 – предполагаемая РНК-геликаза Cid 12 –предполагаемая поли. А полимераза RDRC и RITS физически взаимодействуют (взаимодействие требует активностей Dicer и ДНКметилазы Clr 4) Clr 4 за счет H 3 -K 9 триметилирования делает возможным связывание RITS с хроматином через спаривание хроматинового транскрипта с si. РНК, а также метилированных нуклеосом с хромодоменами Chp 1 и SWI 6 (гомологи)
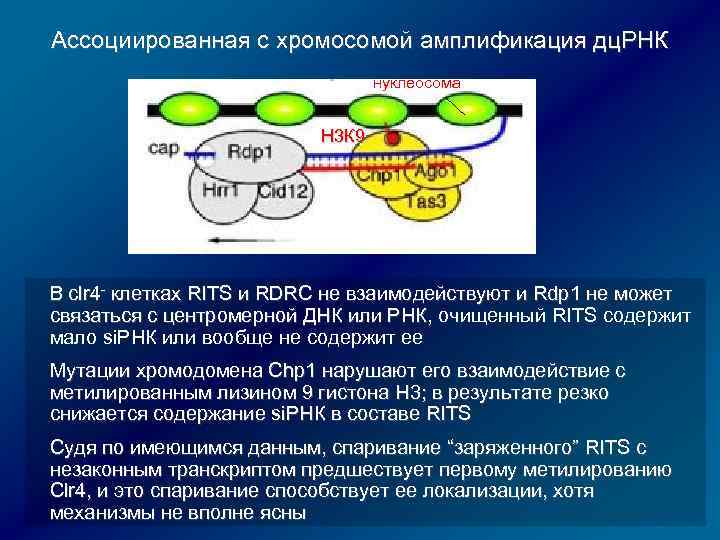 Ассоциированная с хромосомой амплификация дц. РНК нуклеосома H 3 К 9 В clr 4 - клетках RITS и RDRC не взаимодействуют и Rdp 1 не может связаться с центромерной ДНК или РНК, очищенный RITS содержит связаться с центромерной ДНК или РНК, мало si. РНК или вообще не содержит ее Мутации хромодомена Chp 1 нарушают его взаимодействие с метилированным лизином 9 гистона H 3; в результате резко снижается содержание si. РНК в составе RITS Судя по имеющимся данным, спаривание “заряженного” RITS с незаконным транскриптом предшествует первому метилированию Clr 4, и это спаривание способствует ее локализации, хотя механизмы не вполне ясны
Ассоциированная с хромосомой амплификация дц. РНК нуклеосома H 3 К 9 В clr 4 - клетках RITS и RDRC не взаимодействуют и Rdp 1 не может связаться с центромерной ДНК или РНК, очищенный RITS содержит связаться с центромерной ДНК или РНК, мало si. РНК или вообще не содержит ее Мутации хромодомена Chp 1 нарушают его взаимодействие с метилированным лизином 9 гистона H 3; в результате резко снижается содержание si. РНК в составе RITS Судя по имеющимся данным, спаривание “заряженного” RITS с незаконным транскриптом предшествует первому метилированию Clr 4, и это спаривание способствует ее локализации, хотя механизмы не вполне ясны
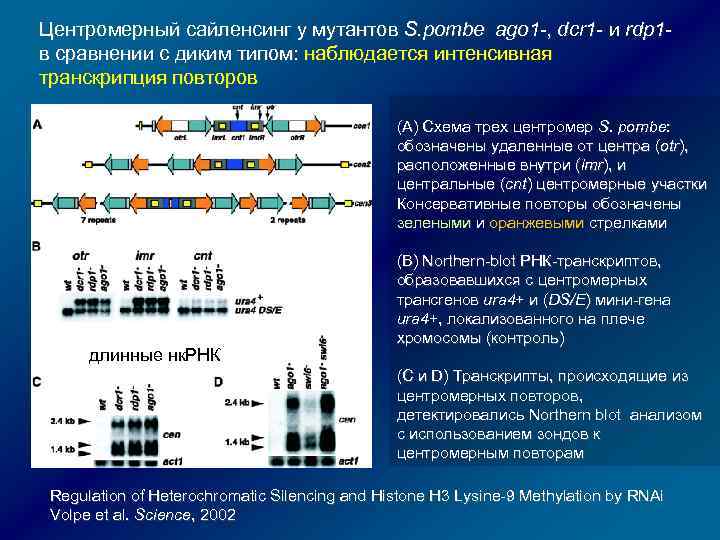 Центромерный сайленсинг у мутантов S. pombe ago 1 -, dcr 1 - и rdp 1 - в сравнении с диким типом: наблюдается интенсивная транскрипция повторов (A) Схема трех центромер S. pombe: обозначены удаленные от центра (otr), расположенные внутри (imr), и центральные (cnt) центромерные участки Консервативные повторы обозначены зелеными и оранжевыми стрелками длинные нк. РНК (B) Northern-blot РНК-транскриптов, образовавшихся с центромерных трансrенов ura 4+ и (DS/E) мини-гена ura 4+, локализованного на плече хромосомы (контроль) (C и D) Транскрипты, происходящие из центромерных повторов, детектировались Northern blot анализом с использованием зондов к центромерным повторам Regulation of Heterochromatic Silencing and Histone H 3 Lysine-9 Methylation by RNAi Volpe et al. Science, 2002
Центромерный сайленсинг у мутантов S. pombe ago 1 -, dcr 1 - и rdp 1 - в сравнении с диким типом: наблюдается интенсивная транскрипция повторов (A) Схема трех центромер S. pombe: обозначены удаленные от центра (otr), расположенные внутри (imr), и центральные (cnt) центромерные участки Консервативные повторы обозначены зелеными и оранжевыми стрелками длинные нк. РНК (B) Northern-blot РНК-транскриптов, образовавшихся с центромерных трансrенов ura 4+ и (DS/E) мини-гена ura 4+, локализованного на плече хромосомы (контроль) (C и D) Транскрипты, происходящие из центромерных повторов, детектировались Northern blot анализом с использованием зондов к центромерным повторам Regulation of Heterochromatic Silencing and Histone H 3 Lysine-9 Methylation by RNAi Volpe et al. Science, 2002
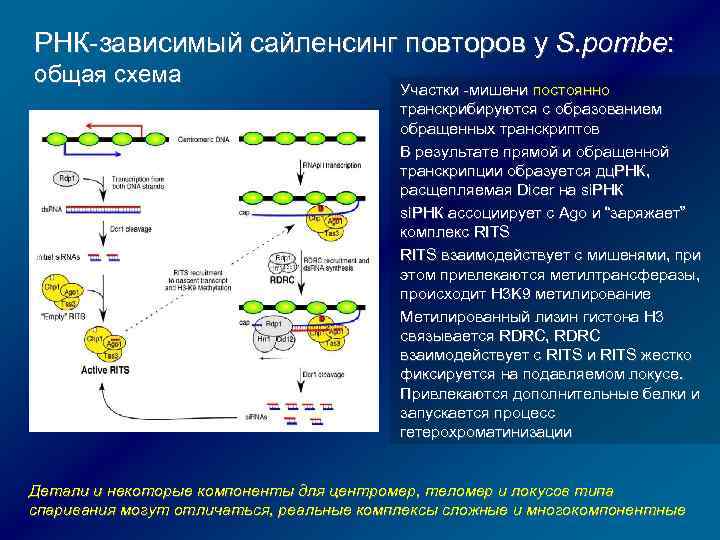 РНК-зависимый сайленсинг повторов у S. pombe: общая схема Участки -мишени постоянно транскрибируются с образованием обращенных транскриптов В результате прямой и обращенной транскрипции образуется дц. РНК, расщепляемая Dicer на si. РНК ассоциирует с Ago и “заряжает” комплекс RITS взаимодействует с мишенями, при этом привлекаются метилтрансферазы, происходит H 3 K 9 метилирование Метилированный лизин гистона H 3 связывается RDRC, RDRC взаимодействует с RITS и RITS жестко фиксируется на подавляемом локусе. Привлекаются дополнительные белки и запускается процесс гетерохроматинизации Детали и некоторые компоненты для центромер, теломер и локусов типа спаривания могут отличаться, реальные комплексы сложные и многокомпонентные
РНК-зависимый сайленсинг повторов у S. pombe: общая схема Участки -мишени постоянно транскрибируются с образованием обращенных транскриптов В результате прямой и обращенной транскрипции образуется дц. РНК, расщепляемая Dicer на si. РНК ассоциирует с Ago и “заряжает” комплекс RITS взаимодействует с мишенями, при этом привлекаются метилтрансферазы, происходит H 3 K 9 метилирование Метилированный лизин гистона H 3 связывается RDRC, RDRC взаимодействует с RITS и RITS жестко фиксируется на подавляемом локусе. Привлекаются дополнительные белки и запускается процесс гетерохроматинизации Детали и некоторые компоненты для центромер, теломер и локусов типа спаривания могут отличаться, реальные комплексы сложные и многокомпонентные
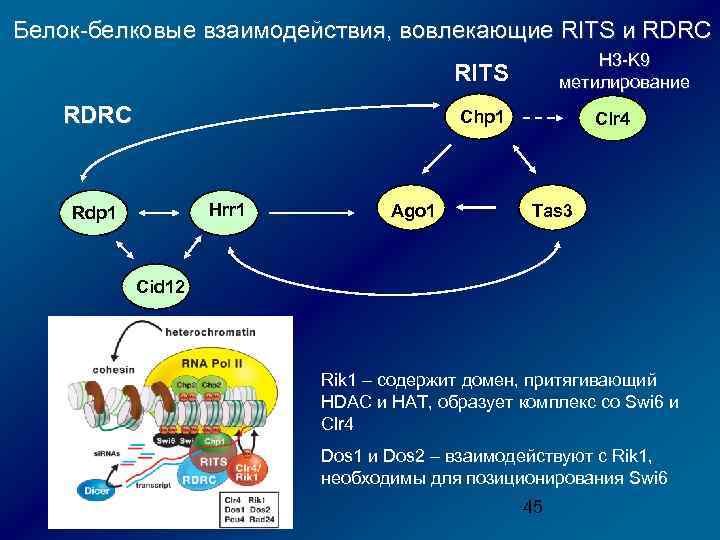 Белок-белковые взаимодействия, вовлекающие RITS и RDRC H 3 -K 9 метилирование RITS RDRC Chp 1 Hrr 1 Rdp 1 Ago 1 Clr 4 Tas 3 Cid 12 Rik 1 – содержит домен, притягивающий HDAC и HAT, образует комплекс со Swi 6 и Clr 4 Dos 1 и Dos 2 – взаимодействуют с Rik 1, необходимы для позиционирования Swi 6 45
Белок-белковые взаимодействия, вовлекающие RITS и RDRC H 3 -K 9 метилирование RITS RDRC Chp 1 Hrr 1 Rdp 1 Ago 1 Clr 4 Tas 3 Cid 12 Rik 1 – содержит домен, притягивающий HDAC и HAT, образует комплекс со Swi 6 и Clr 4 Dos 1 и Dos 2 – взаимодействуют с Rik 1, необходимы для позиционирования Swi 6 45
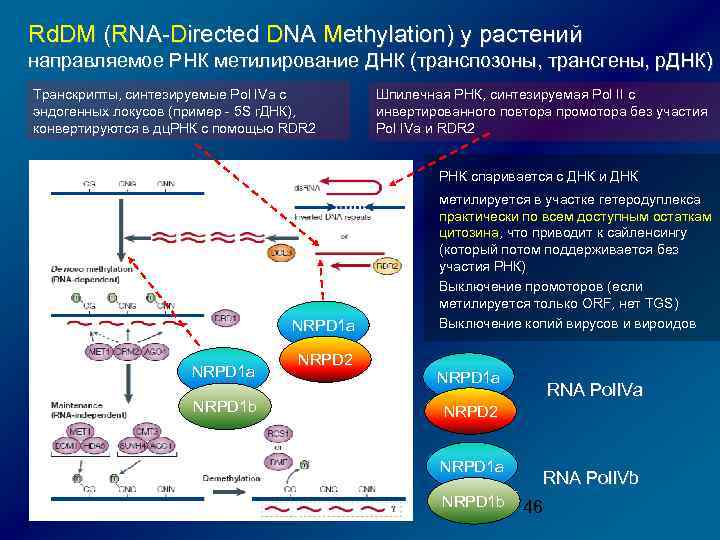 Rd. DM (RNA-Directed DNA Methylation) у растений направляемое РНК метилирование ДНК (транспозоны, трансгены, р. ДНК) Транскрипты, синтезируемые Pol IVa с эндогенных локусов (пример - 5 S r. ДНК), конвертируются в дц. РНК с помощью RDR 2 Шпилечная РНК, синтезируемая Pol II с инвертированного повтора промотора без участия Pol IVa и RDR 2 РНК спаривается с ДНК и ДНК NRPD 1 a NRPD 1 b NRPD 2 метилируется в участке гетеродуплекса практически по всем доступным остаткам цитозина, что приводит к сайленсингу (который потом поддерживается без участия РНК) Выключение промоторов (если метилируется только ORF, нет TGS) Выключение копий вирусов и вироидов NRPD 1 a RNA Pol. IVa NRPD 2 NRPD 1 a NRPD 1 b RNA Pol. IVb 46
Rd. DM (RNA-Directed DNA Methylation) у растений направляемое РНК метилирование ДНК (транспозоны, трансгены, р. ДНК) Транскрипты, синтезируемые Pol IVa с эндогенных локусов (пример - 5 S r. ДНК), конвертируются в дц. РНК с помощью RDR 2 Шпилечная РНК, синтезируемая Pol II с инвертированного повтора промотора без участия Pol IVa и RDR 2 РНК спаривается с ДНК и ДНК NRPD 1 a NRPD 1 b NRPD 2 метилируется в участке гетеродуплекса практически по всем доступным остаткам цитозина, что приводит к сайленсингу (который потом поддерживается без участия РНК) Выключение промоторов (если метилируется только ORF, нет TGS) Выключение копий вирусов и вироидов NRPD 1 a RNA Pol. IVa NRPD 2 NRPD 1 a NRPD 1 b RNA Pol. IVb 46
 РНК-интерференция вовлечена и в образование гетерохроматина у насекомых и млекопитающих: PIWI белки в комплексе с pi. РНК у Drosophila участвуют в гетерохроматинизации протяженных районов хромосом в половых клетках, взаимодействуя непосредственно с HP 1 Отдельные гены млекопитающих могут быть подвержены РНК-зависимому TGS (без деградации м. РНК), включающему сиквенс-зависимое метилирование H 3 -K 9 и последующую гетерохроматинизацию Мишенью чаще выступает регуляторный, чем кодирующий район Но показан и TGS, не использующий метилирование! “Горячие точки” исследования механизмов РНК-зависимого генетического сайленсинга
РНК-интерференция вовлечена и в образование гетерохроматина у насекомых и млекопитающих: PIWI белки в комплексе с pi. РНК у Drosophila участвуют в гетерохроматинизации протяженных районов хромосом в половых клетках, взаимодействуя непосредственно с HP 1 Отдельные гены млекопитающих могут быть подвержены РНК-зависимому TGS (без деградации м. РНК), включающему сиквенс-зависимое метилирование H 3 -K 9 и последующую гетерохроматинизацию Мишенью чаще выступает регуляторный, чем кодирующий район Но показан и TGS, не использующий метилирование! “Горячие точки” исследования механизмов РНК-зависимого генетического сайленсинга
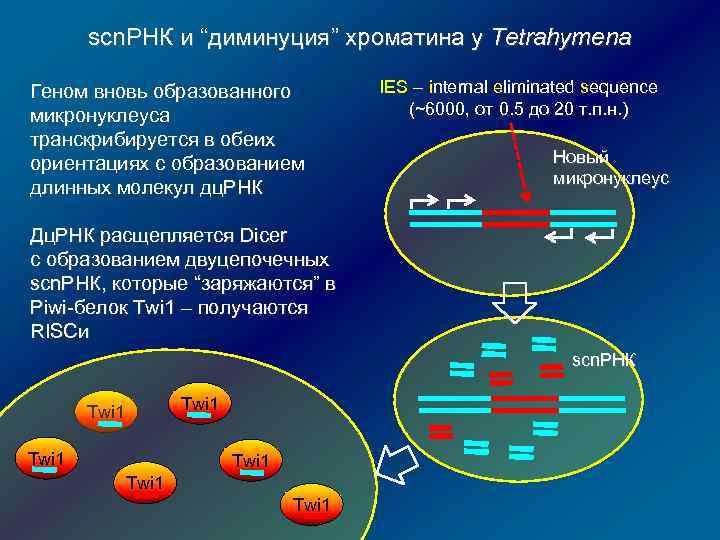 scn. РНК и “диминуция” хроматина у Tetrahymena Геном вновь образованного микронуклеуса транскрибируется в обеих ориентациях с образованием длинных молекул дц. РНК IES – internal eliminated sequence (~6000, от 0. 5 до 20 т. п. н. ) Новый микронуклеус Дц. РНК расщепляется Dicer с образованием двуцепочечных scn. РНК, которые “заряжаются” в Piwi-белок Twi 1 – получаются RISCи scn. РНК Twi 1 Twi 1
scn. РНК и “диминуция” хроматина у Tetrahymena Геном вновь образованного микронуклеуса транскрибируется в обеих ориентациях с образованием длинных молекул дц. РНК IES – internal eliminated sequence (~6000, от 0. 5 до 20 т. п. н. ) Новый микронуклеус Дц. РНК расщепляется Dicer с образованием двуцепочечных scn. РНК, которые “заряжаются” в Piwi-белок Twi 1 – получаются RISCи scn. РНК Twi 1 Twi 1
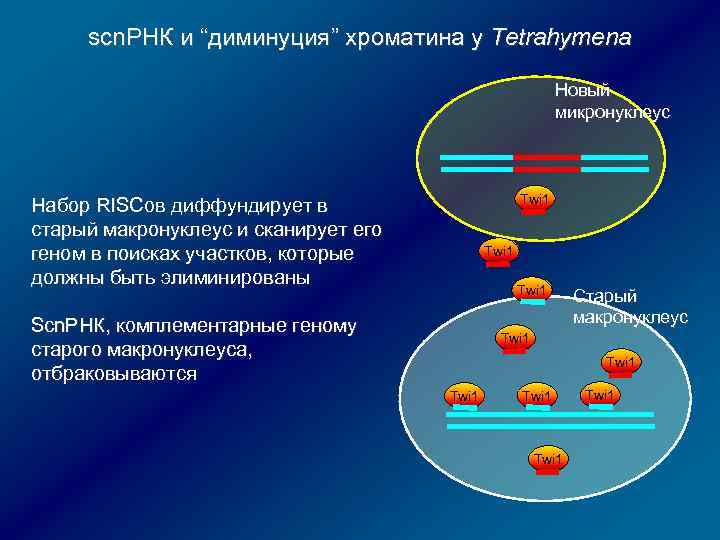 scn. РНК и “диминуция” хроматина у Tetrahymena Новый микронуклеус Twi 1 Набор RISCов диффундирует в старый макронуклеус и сканирует его геном в поисках участков, которые должны быть элиминированы Twi 1 Scn. РНК, комплементарные геному старого макронуклеуса, отбраковываются Старый макронуклеус Twi 1 Twi 1
scn. РНК и “диминуция” хроматина у Tetrahymena Новый микронуклеус Twi 1 Набор RISCов диффундирует в старый макронуклеус и сканирует его геном в поисках участков, которые должны быть элиминированы Twi 1 Scn. РНК, комплементарные геному старого макронуклеуса, отбраковываются Старый макронуклеус Twi 1 Twi 1
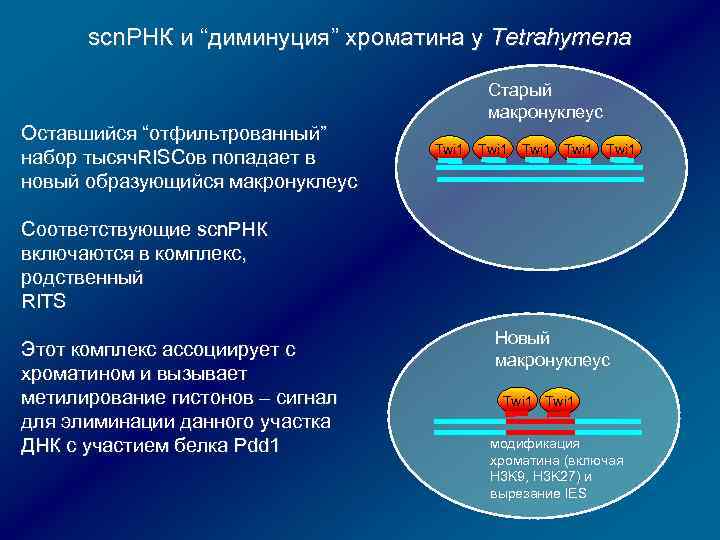 scn. РНК и “диминуция” хроматина у Tetrahymena Оставшийся “отфильтрованный” набор тысяч. RISCов попадает в новый образующийся макронуклеус Старый макронуклеус Twi 1 Twi 1 Соответствующие scn. РНК включаются в комплекс, родственный RITS Этот комплекс ассоциирует с хроматином и вызывает метилирование гистонов – сигнал для элиминации данного участка ДНК с участием белка Pdd 1 Новый макронуклеус Twi 1 модификация хроматина (включая H 3 K 9, H 3 K 27) и вырезание IES
scn. РНК и “диминуция” хроматина у Tetrahymena Оставшийся “отфильтрованный” набор тысяч. RISCов попадает в новый образующийся макронуклеус Старый макронуклеус Twi 1 Twi 1 Соответствующие scn. РНК включаются в комплекс, родственный RITS Этот комплекс ассоциирует с хроматином и вызывает метилирование гистонов – сигнал для элиминации данного участка ДНК с участием белка Pdd 1 Новый макронуклеус Twi 1 модификация хроматина (включая H 3 K 9, H 3 K 27) и вырезание IES
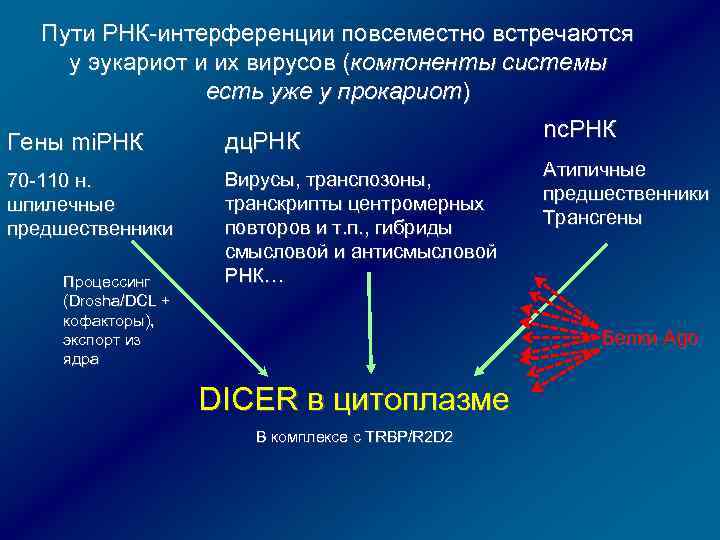 Пути РНК-интерференции повсеместно встречаются у эукариот и их вирусов (компоненты системы есть уже у прокариот) Гены mi. РНК дц. РНК 70 -110 н. шпилечные предшественники Вирусы, транспозоны, транскрипты центромерных повторов и т. п. , гибриды смысловой и антисмысловой РНК… Процессинг (Drosha/DCL + кофакторы), экспорт из ядра nc. РНК Атипичные предшественники Трансгены Белки Ago DICER в цитоплазме В комплексе с TRBP/R 2 D 2
Пути РНК-интерференции повсеместно встречаются у эукариот и их вирусов (компоненты системы есть уже у прокариот) Гены mi. РНК дц. РНК 70 -110 н. шпилечные предшественники Вирусы, транспозоны, транскрипты центромерных повторов и т. п. , гибриды смысловой и антисмысловой РНК… Процессинг (Drosha/DCL + кофакторы), экспорт из ядра nc. РНК Атипичные предшественники Трансгены Белки Ago DICER в цитоплазме В комплексе с TRBP/R 2 D 2
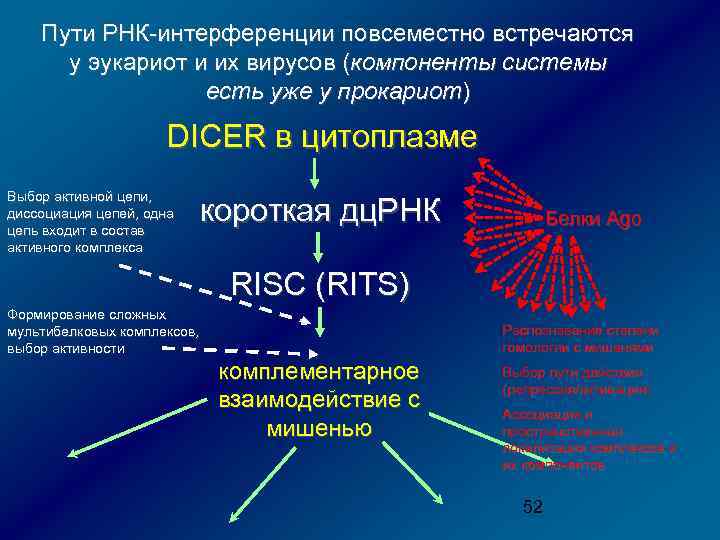 Пути РНК-интерференции повсеместно встречаются у эукариот и их вирусов (компоненты системы есть уже у прокариот) DICER в цитоплазме Выбор активной цепи, диссоциация цепей, одна цепь входит в состав активного комплекса короткая дц. РНК Белки Ago RISC (RITS) Формирование сложных мультибелковых комплексов, выбор активности Распознавание степени гомологии с мишенями комплементарное взаимодействие с мишенью Выбор пути действия (репрессия/активация) Ассоциация и пространственная локализация комплексов и их компонентов 52
Пути РНК-интерференции повсеместно встречаются у эукариот и их вирусов (компоненты системы есть уже у прокариот) DICER в цитоплазме Выбор активной цепи, диссоциация цепей, одна цепь входит в состав активного комплекса короткая дц. РНК Белки Ago RISC (RITS) Формирование сложных мультибелковых комплексов, выбор активности Распознавание степени гомологии с мишенями комплементарное взаимодействие с мишенью Выбор пути действия (репрессия/активация) Ассоциация и пространственная локализация комплексов и их компонентов 52
 Некоторые пути могут отличаться у разных объектов: Системный сайленсинг (распространение РНКинтерференции от клетки к клетке за счет амплификации сигнала с участием активности Rd. RP) Растения, C. elegans, но НЕ Drosophila и млекопитающие? Связывают с трансмембранными белками группы SID (из животных эти функции показаны только для SID-1 и SID-2 у С. elegans) РНК-зависимый транскрипционный сайленсинг (TGS) (формирование ГХ с участием механизмов РНКi) Не обнаружен у S. cerevisiae, слабо проявляется у Drosophila и млекопитающих (включая регуляцию генов, прилежащих к ГХ блокам) (у которых, судя по всему, РНК-зависимые модификации хроматина вытесняются РНК-независимыми)
Некоторые пути могут отличаться у разных объектов: Системный сайленсинг (распространение РНКинтерференции от клетки к клетке за счет амплификации сигнала с участием активности Rd. RP) Растения, C. elegans, но НЕ Drosophila и млекопитающие? Связывают с трансмембранными белками группы SID (из животных эти функции показаны только для SID-1 и SID-2 у С. elegans) РНК-зависимый транскрипционный сайленсинг (TGS) (формирование ГХ с участием механизмов РНКi) Не обнаружен у S. cerevisiae, слабо проявляется у Drosophila и млекопитающих (включая регуляцию генов, прилежащих к ГХ блокам) (у которых, судя по всему, РНК-зависимые модификации хроматина вытесняются РНК-независимыми)
 Некоторые пути могут отличаться у разных объектов: Репрессия трансляции с участием mi. РНК Не обнаружена у некоторых дрожжей, слабо проявляется у растений Классическая РНК-интерференция в цитоплазме, запускаемая длинным дц. РНК-индуктором Нет у млекопитающих – дц. РНК запускает интерфероновый ответ НО: путь PKR действует в цитоплазме, если si. РНК образуется в ядре – запускается механизм РНК-интерференции – все активные компоненты системы есть в наличии!
Некоторые пути могут отличаться у разных объектов: Репрессия трансляции с участием mi. РНК Не обнаружена у некоторых дрожжей, слабо проявляется у растений Классическая РНК-интерференция в цитоплазме, запускаемая длинным дц. РНК-индуктором Нет у млекопитающих – дц. РНК запускает интерфероновый ответ НО: путь PKR действует в цитоплазме, если si. РНК образуется в ядре – запускается механизм РНК-интерференции – все активные компоненты системы есть в наличии!
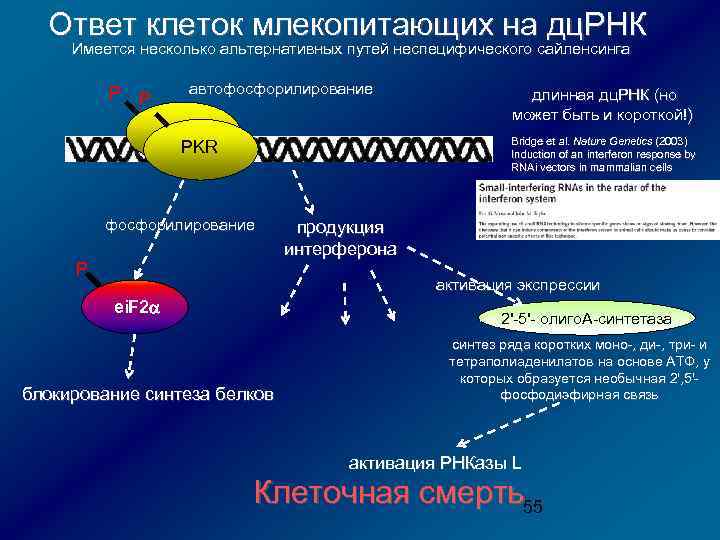 Ответ клеток млекопитающих на дц. РНК Имеется несколько альтернативных путей неспецифического сайленсинга P P автофосфорилирование длинная дц. РНК (но может быть и короткой!) Bridge et al. Nature Genetics (2003) Bridge et al. Nature Genetics (2003) Induction of an interferon response by RNAi vectors in mammalian cells PKR фосфорилирование P продукция интерферона активация экспрессии ei. F 2 a 2'-5'- олиго. А-синтетаза блокирование синтеза белков синтез ряда коротких моно-, ди-, три- и тетраполиаденилатов на основе АТФ, у которых образуется необычная 2', 5'фосфодиэфирная связь активация РНКазы L Клеточная смерть55
Ответ клеток млекопитающих на дц. РНК Имеется несколько альтернативных путей неспецифического сайленсинга P P автофосфорилирование длинная дц. РНК (но может быть и короткой!) Bridge et al. Nature Genetics (2003) Bridge et al. Nature Genetics (2003) Induction of an interferon response by RNAi vectors in mammalian cells PKR фосфорилирование P продукция интерферона активация экспрессии ei. F 2 a 2'-5'- олиго. А-синтетаза блокирование синтеза белков синтез ряда коротких моно-, ди-, три- и тетраполиаденилатов на основе АТФ, у которых образуется необычная 2', 5'фосфодиэфирная связь активация РНКазы L Клеточная смерть55
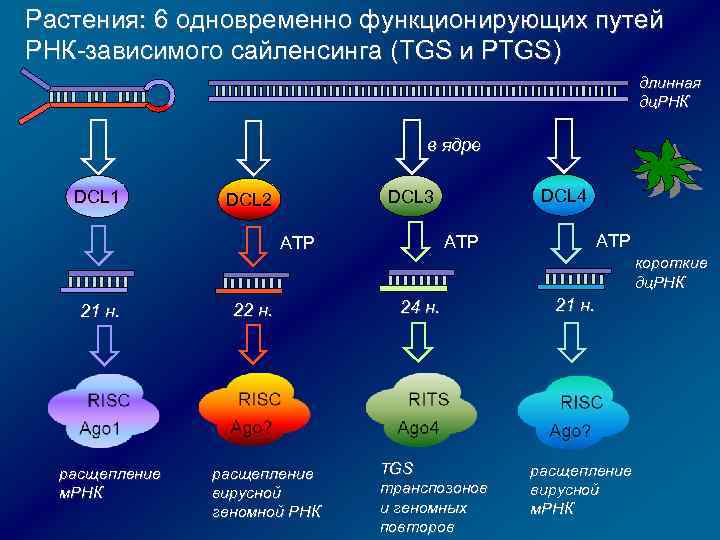 Растения: 6 одновременно функционирующих путей РНК-зависимого сайленсинга (TGS и PTGS) длинная дц. РНК в ядре DCL 1 DCL 4 DCL 3 DCL 2 ATP ATP короткие дц. РНК 21 н. расщепление м. РНК 22 н. расщепление вирусной геномной РНК 24 н. TGS транспозонов и геномных повторов 21 н. расщепление вирусной м. РНК
Растения: 6 одновременно функционирующих путей РНК-зависимого сайленсинга (TGS и PTGS) длинная дц. РНК в ядре DCL 1 DCL 4 DCL 3 DCL 2 ATP ATP короткие дц. РНК 21 н. расщепление м. РНК 22 н. расщепление вирусной геномной РНК 24 н. TGS транспозонов и геномных повторов 21 н. расщепление вирусной м. РНК
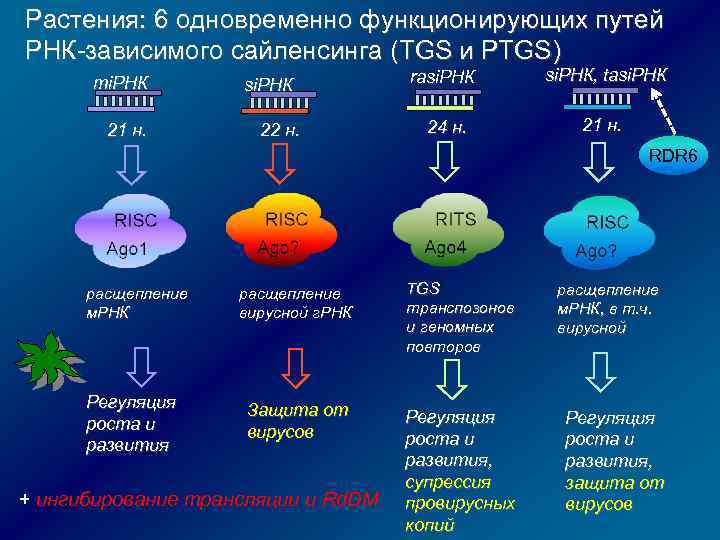 Растения: 6 одновременно функционирующих путей РНК-зависимого сайленсинга (TGS и PTGS) mi. РНК 21 н. si. РНК 22 н. rasi. РНК, tasi. РНК 24 н. 21 н. RDR 6 расщепление м. РНК Регуляция роста и развития расщепление вирусной г. РНК TGS транспозонов и геномных повторов Защита от вирусов Регуляция роста и развития, супрессия провирусных копий + ингибирование трансляции и Rd. DM расщепление м. РНК, в т. ч. вирусной Регуляция роста и развития, защита от вирусов
Растения: 6 одновременно функционирующих путей РНК-зависимого сайленсинга (TGS и PTGS) mi. РНК 21 н. si. РНК 22 н. rasi. РНК, tasi. РНК 24 н. 21 н. RDR 6 расщепление м. РНК Регуляция роста и развития расщепление вирусной г. РНК TGS транспозонов и геномных повторов Защита от вирусов Регуляция роста и развития, супрессия провирусных копий + ингибирование трансляции и Rd. DM расщепление м. РНК, в т. ч. вирусной Регуляция роста и развития, защита от вирусов
 Основные различия между системой mi. РНК-опосредованного сайленсинга между растениями и животными – не качественные! Растения Животные Локализация в геноме В основном межгенные районы Интроны, экзоны, межгенные районы Кластеры генов Нетипичны Типичны Биосинтез mi. РНК Несколько стадий Drosha в ядре и Dicer в процессинга DCL в ядре цитоплазме Основной механизм сайленсинга Расщепление мишеней Репрессия трансляции Основные мишени ORF 3’UTR Количество мишеней на Как правило, одна одну mi. РНК Как правило, несколько Основные известные мишени Гены, участвующие в регуляции, ферменты, гены структурных белков Гены, участвующие в регуляции, ферменты 2009 г. ингибирование трансляции с участием микро. РНК характерно и для растений! (Brodersen et al. Science 2008; Lanet et al. , Plant Cell 2009)
Основные различия между системой mi. РНК-опосредованного сайленсинга между растениями и животными – не качественные! Растения Животные Локализация в геноме В основном межгенные районы Интроны, экзоны, межгенные районы Кластеры генов Нетипичны Типичны Биосинтез mi. РНК Несколько стадий Drosha в ядре и Dicer в процессинга DCL в ядре цитоплазме Основной механизм сайленсинга Расщепление мишеней Репрессия трансляции Основные мишени ORF 3’UTR Количество мишеней на Как правило, одна одну mi. РНК Как правило, несколько Основные известные мишени Гены, участвующие в регуляции, ферменты, гены структурных белков Гены, участвующие в регуляции, ферменты 2009 г. ингибирование трансляции с участием микро. РНК характерно и для растений! (Brodersen et al. Science 2008; Lanet et al. , Plant Cell 2009)
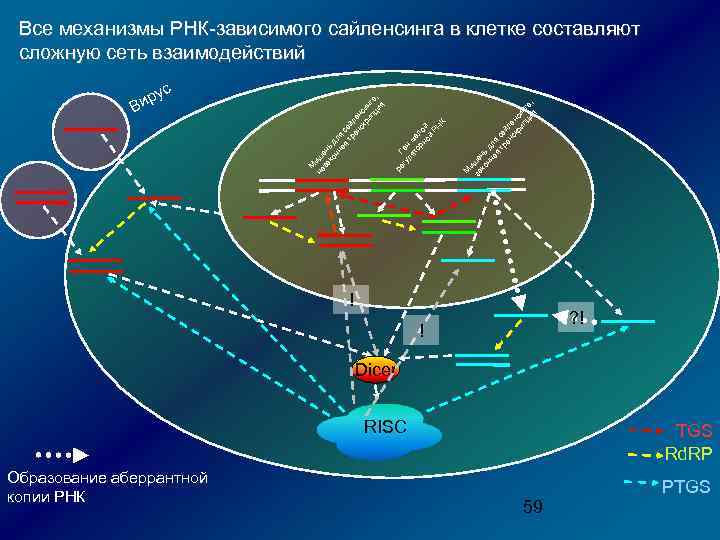 М и за ше ко нь нн д ая ля т са ра й нс ле кр нс ип ин ци га я , гу Ген ля м то ал рн о ой й Р НК ре ус р Ви М не иш за ен ко ь д нн л ая я с т ай ра л нс ен кр си ип нг ци а, я Все механизмы РНК-зависимого сайленсинга в клетке составляют сложную сеть взаимодействий ! ? ! ! Dicer RISC Образование аберрантной копии РНК TGS Rd. RP PTGS 59
М и за ше ко нь нн д ая ля т са ра й нс ле кр нс ип ин ци га я , гу Ген ля м то ал рн о ой й Р НК ре ус р Ви М не иш за ен ко ь д нн л ая я с т ай ра л нс ен кр си ип нг ци а, я Все механизмы РНК-зависимого сайленсинга в клетке составляют сложную сеть взаимодействий ! ? ! ! Dicer RISC Образование аберрантной копии РНК TGS Rd. RP PTGS 59
 М и за ше ко нь нн д ая ля т са ра й нс ле кр нс ип ин ци га я , гу Ген ля м то ал рн о ой й Р НК ус р Ви М не иш за ен ко ь д нн л ая я с т ай ра л нс ен кр си ип нг ци а, я И Dicer, и Rd. RP, и Ago распределены между ядром и цитоплазмой, возможен активный транспорт в ядро (напр. , imp 8 для Ago 2) Зачем? Ведь есть интерфероновый ответ ре В ядрах ряда модельных объектов обнаружены белки Ago, характерные для RISC (C. elegans, D. melanogaster, A. thaliana и т. д. ) Млекопитающие: возможна индукция РНК-интерференции против ядерных РНК (sn. RNA 7 SK и U 6). При этом активный RISC собирается в ядре! Те же компоненты RISC объединяются в цитоплазме, если мишень РНКi – цитоплазматическая РНК (например, РНК ВГС) (Berezhna et al. , PNAS 2006) ! ! Dicer RISC Образование аберрантной копии РНК ? ! TGS Rd. RP PTGS Ядерные и цитоплазматические фракции трудно разделить – ассоциация с мембранами…
М и за ше ко нь нн д ая ля т са ра й нс ле кр нс ип ин ци га я , гу Ген ля м то ал рн о ой й Р НК ус р Ви М не иш за ен ко ь д нн л ая я с т ай ра л нс ен кр си ип нг ци а, я И Dicer, и Rd. RP, и Ago распределены между ядром и цитоплазмой, возможен активный транспорт в ядро (напр. , imp 8 для Ago 2) Зачем? Ведь есть интерфероновый ответ ре В ядрах ряда модельных объектов обнаружены белки Ago, характерные для RISC (C. elegans, D. melanogaster, A. thaliana и т. д. ) Млекопитающие: возможна индукция РНК-интерференции против ядерных РНК (sn. RNA 7 SK и U 6). При этом активный RISC собирается в ядре! Те же компоненты RISC объединяются в цитоплазме, если мишень РНКi – цитоплазматическая РНК (например, РНК ВГС) (Berezhna et al. , PNAS 2006) ! ! Dicer RISC Образование аберрантной копии РНК ? ! TGS Rd. RP PTGS Ядерные и цитоплазматические фракции трудно разделить – ассоциация с мембранами…
 Откуда происходят новые малые РНК для специфической регуляции? 1. Новые гены из уже имеющихся генов микро. РНК – происхождение можно проследить 2. Интроны белок-кодирующих генов 3. Из собственных мишеней? 4. Длинные некодирующие РНК Геномы эволюционируют в сторону увеличения доли “некодирующей” ДНК количества псевдогенов (у человека порядка 20, 000 (Harrison et al. , Genome Res. 2002) ). 2002) характерной длины интронов доли интронных последовательностей в составе гена сложности регуляции экспрессии
Откуда происходят новые малые РНК для специфической регуляции? 1. Новые гены из уже имеющихся генов микро. РНК – происхождение можно проследить 2. Интроны белок-кодирующих генов 3. Из собственных мишеней? 4. Длинные некодирующие РНК Геномы эволюционируют в сторону увеличения доли “некодирующей” ДНК количества псевдогенов (у человека порядка 20, 000 (Harrison et al. , Genome Res. 2002) ). 2002) характерной длины интронов доли интронных последовательностей в составе гена сложности регуляции экспрессии
 Длинные нк. РНК и РНК-интерференция Количество данных о высоком содержании некодирующей РНК возрастает… Человеческий транскриптом удивительно сложен, большая часть генома транскрибируется, большая часть транскриптов (>80%), даже включающая фрагменты известных ORF, не кодирует полипептиды! (Cawley et al. , Cell 2004); Cheng et al. , Science 2005; Kapranov et al. , Genome Research 2005) Псевдогены могут кодировать РНК-регуляторы своих белок-кодирующих гомологов (Hirotsune et al. Nature 2003) Многие последовательности в геноме (>20%) транскрибируются по обеим цепям 45% генома млекопитающих– это транспозоны, и еще 10% - простые повторы Длинные нк. РНК (long nc. RNAs) – длиннее 200 н. , не кодируют полипептиды От ½ до ¾ всего разнообразия транскриптов в клетках человека! В геномах млекопитающих выявлено ~35, 000 достаточно протяженных белокнекодирующих транскриптов из ~10, 000 разных локусов, для которых были характерны многие черты м. РНК (кэпирование, сплайсинг, полиаденилирование), но они не имели протяженных ORF (Carninci et al. , Science 2005) Помимо этого, 40% транскриптов не полиаденилированы – что в них?
Длинные нк. РНК и РНК-интерференция Количество данных о высоком содержании некодирующей РНК возрастает… Человеческий транскриптом удивительно сложен, большая часть генома транскрибируется, большая часть транскриптов (>80%), даже включающая фрагменты известных ORF, не кодирует полипептиды! (Cawley et al. , Cell 2004); Cheng et al. , Science 2005; Kapranov et al. , Genome Research 2005) Псевдогены могут кодировать РНК-регуляторы своих белок-кодирующих гомологов (Hirotsune et al. Nature 2003) Многие последовательности в геноме (>20%) транскрибируются по обеим цепям 45% генома млекопитающих– это транспозоны, и еще 10% - простые повторы Длинные нк. РНК (long nc. RNAs) – длиннее 200 н. , не кодируют полипептиды От ½ до ¾ всего разнообразия транскриптов в клетках человека! В геномах млекопитающих выявлено ~35, 000 достаточно протяженных белокнекодирующих транскриптов из ~10, 000 разных локусов, для которых были характерны многие черты м. РНК (кэпирование, сплайсинг, полиаденилирование), но они не имели протяженных ORF (Carninci et al. , Science 2005) Помимо этого, 40% транскриптов не полиаденилированы – что в них?
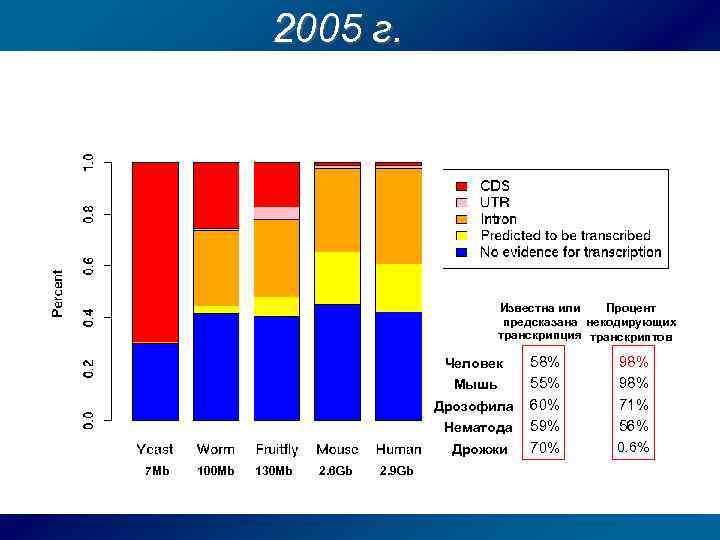 2005 г. Известна или Процент предсказана некодирующих транскрипция транскриптов Человек Мышь Дрозофила Нематода Дрожжи 7 Mb 100 Mb 130 Mb 2. 6 Gb 2. 9 Gb 58% 55% 60% 59% 70% 98% 71% 56% 0. 6%
2005 г. Известна или Процент предсказана некодирующих транскрипция транскриптов Человек Мышь Дрозофила Нематода Дрожжи 7 Mb 100 Mb 130 Mb 2. 6 Gb 2. 9 Gb 58% 55% 60% 59% 70% 98% 71% 56% 0. 6%
 Большинство закодировано в межгенных участках, транскрибируются в виде сложной “сети” смысловых и антисмысловых перекрывающихся транскриптов, включающих сегменты белок-кодирующих РНК Многие секвенированные к. ДНК в библиотеках, которые ранее считали усеченными вариантами кодирующих последовательностей, оказались продуктами обратной транскрипции нк. РНК, гомологичных белок-кодирующим РНК! Функции разнообразны: Модуляция активности транскрипционных факторов, в частности, базальных ТФ, необходимых для транскрипции Pol. II (как активация, так и репрессия) Один из вариантов – образование триплексных структур ДНК/РНК в промоторных участках, но возможно и специфическое взаимодействие с белками Большое число примеров не ген-специфических эффектов на регуляцию! Контроль альтернативного сплайсинга, репрессия трансляции, эпигенетическая регуляция транскрипции, геномный импринтинг, блокирование теломеразы, регуляция поддержания структуры теломер Транскрипция часто активируется в ответ на стресс! При стрессе (тепловой шок, вирусная инфекция) Pol III синтезирует длинные нк. РНК по SINE ретроэлементам (например, Alu повторам), затем они связываются с Pol II и блокируют образование преинициаторных комплексов транскрипции (показано как для Arabidopsis, так и для клеток H. sapiens)
Большинство закодировано в межгенных участках, транскрибируются в виде сложной “сети” смысловых и антисмысловых перекрывающихся транскриптов, включающих сегменты белок-кодирующих РНК Многие секвенированные к. ДНК в библиотеках, которые ранее считали усеченными вариантами кодирующих последовательностей, оказались продуктами обратной транскрипции нк. РНК, гомологичных белок-кодирующим РНК! Функции разнообразны: Модуляция активности транскрипционных факторов, в частности, базальных ТФ, необходимых для транскрипции Pol. II (как активация, так и репрессия) Один из вариантов – образование триплексных структур ДНК/РНК в промоторных участках, но возможно и специфическое взаимодействие с белками Большое число примеров не ген-специфических эффектов на регуляцию! Контроль альтернативного сплайсинга, репрессия трансляции, эпигенетическая регуляция транскрипции, геномный импринтинг, блокирование теломеразы, регуляция поддержания структуры теломер Транскрипция часто активируется в ответ на стресс! При стрессе (тепловой шок, вирусная инфекция) Pol III синтезирует длинные нк. РНК по SINE ретроэлементам (например, Alu повторам), затем они связываются с Pol II и блокируют образование преинициаторных комплексов транскрипции (показано как для Arabidopsis, так и для клеток H. sapiens)
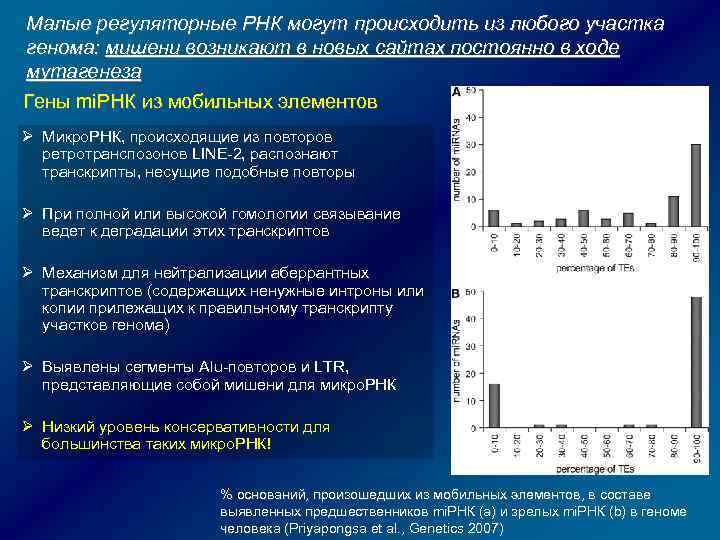 Малые регуляторные РНК могут происходить из любого участка генома: мишени возникают в новых сайтах постоянно в ходе мутагенеза Гены mi. РНК из мобильных элементов Ø Микро. РНК, происходящие из повторов ретротранспозонов LINE-2, распознают транскрипты, несущие подобные повторы Ø При полной или высокой гомологии связывание ведет к деградации этих транскриптов Ø Механизм для нейтрализации аберрантных транскриптов (содержащих ненужные интроны или копии прилежащих к правильному транскрипту участков генома) Ø Выявлены сегменты Alu-повторов и LTR, представляющие собой мишени для микро. РНК Ø Низкий уровень консервативности для большинства таких микро. РНК! % оснований, произошедших из мобильных элементов, в составе выявленных предшественников mi. РНК (а) и зрелых mi. РНК (b) в геноме человека (Priyapongsa et al. , Genetics 2007)
Малые регуляторные РНК могут происходить из любого участка генома: мишени возникают в новых сайтах постоянно в ходе мутагенеза Гены mi. РНК из мобильных элементов Ø Микро. РНК, происходящие из повторов ретротранспозонов LINE-2, распознают транскрипты, несущие подобные повторы Ø При полной или высокой гомологии связывание ведет к деградации этих транскриптов Ø Механизм для нейтрализации аберрантных транскриптов (содержащих ненужные интроны или копии прилежащих к правильному транскрипту участков генома) Ø Выявлены сегменты Alu-повторов и LTR, представляющие собой мишени для микро. РНК Ø Низкий уровень консервативности для большинства таких микро. РНК! % оснований, произошедших из мобильных элементов, в составе выявленных предшественников mi. РНК (а) и зрелых mi. РНК (b) в геноме человека (Priyapongsa et al. , Genetics 2007)
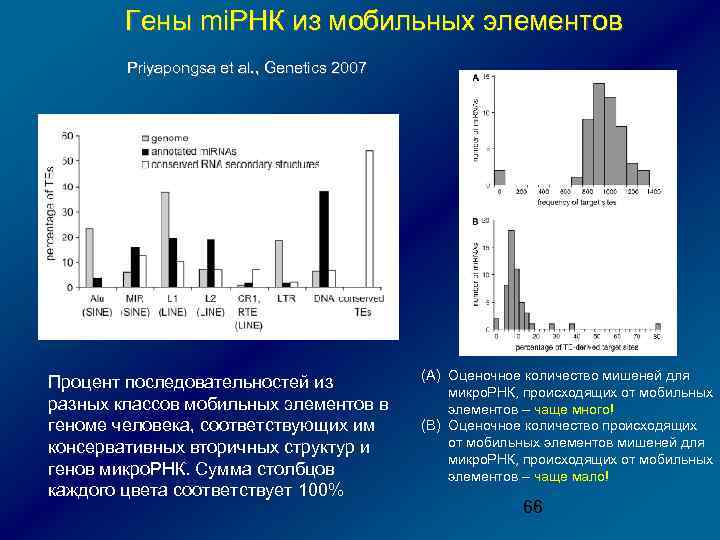 Гены mi. РНК из мобильных элементов Priyapongsa et al. , Genetics 2007 Процент последовательностей из разных классов мобильных элементов в геноме человека, соответствующих им консервативных вторичных структур и генов микро. РНК. Сумма столбцов каждого цвета соответствует 100% (A) Оценочное количество мишеней для микро. РНК, происходящих от мобильных элементов – чаще много! (B) Оценочное количество происходящих от мобильных элементов мишеней для микро. РНК, происходящих от мобильных элементов – чаще мало! 66
Гены mi. РНК из мобильных элементов Priyapongsa et al. , Genetics 2007 Процент последовательностей из разных классов мобильных элементов в геноме человека, соответствующих им консервативных вторичных структур и генов микро. РНК. Сумма столбцов каждого цвета соответствует 100% (A) Оценочное количество мишеней для микро. РНК, происходящих от мобильных элементов – чаще много! (B) Оценочное количество происходящих от мобильных элементов мишеней для микро. РНК, происходящих от мобильных элементов – чаще мало! 66
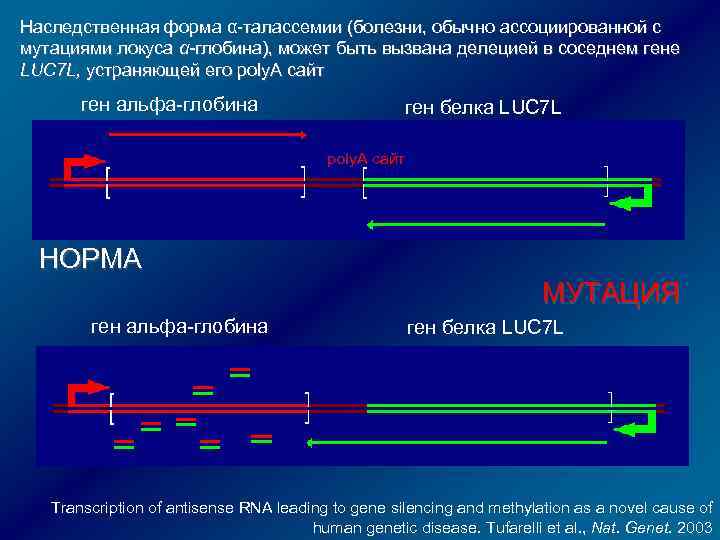 Наследственная форма α-талассемии (болезни, обычно ассоциированной с мутациями локуса α-глобина), может быть вызвана делецией в соседнем гене LUC 7 L, устраняющей его poly. A сайт ген альфа-глобина ген белка LUC 7 L poly. A сайт НОРМА МУТАЦИЯ ген альфа-глобина ген белка LUC 7 L Transcription of antisense RNA leading to gene silencing and methylation as a novel cause of human genetic disease. Tufarelli et al. , Nat. Genet. 2003
Наследственная форма α-талассемии (болезни, обычно ассоциированной с мутациями локуса α-глобина), может быть вызвана делецией в соседнем гене LUC 7 L, устраняющей его poly. A сайт ген альфа-глобина ген белка LUC 7 L poly. A сайт НОРМА МУТАЦИЯ ген альфа-глобина ген белка LUC 7 L Transcription of antisense RNA leading to gene silencing and methylation as a novel cause of human genetic disease. Tufarelli et al. , Nat. Genet. 2003
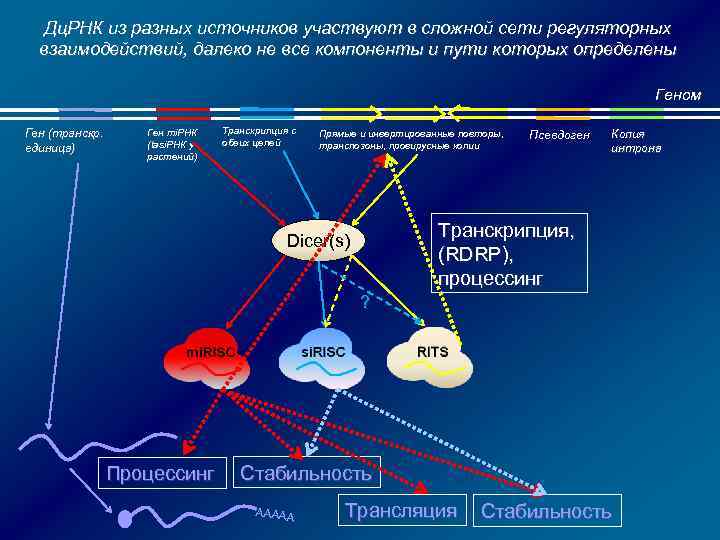 Дц. РНК из разных источников участвуют в сложной сети регуляторных взаимодействий, далеко не все компоненты и пути которых определены Геном Ген (транскр. единица) Ген mi. РНК (tasi. РНК у растений) Транскрипция с обеих цепей Прямые и инвертированные повторы, транспозоны, провирусные копии Псевдоген Копия интрона Транскрипция, (RDRP), процессинг Dicer(s) ? Процессинг Стабильность ААААА Трансляция Стабильность
Дц. РНК из разных источников участвуют в сложной сети регуляторных взаимодействий, далеко не все компоненты и пути которых определены Геном Ген (транскр. единица) Ген mi. РНК (tasi. РНК у растений) Транскрипция с обеих цепей Прямые и инвертированные повторы, транспозоны, провирусные копии Псевдоген Копия интрона Транскрипция, (RDRP), процессинг Dicer(s) ? Процессинг Стабильность ААААА Трансляция Стабильность
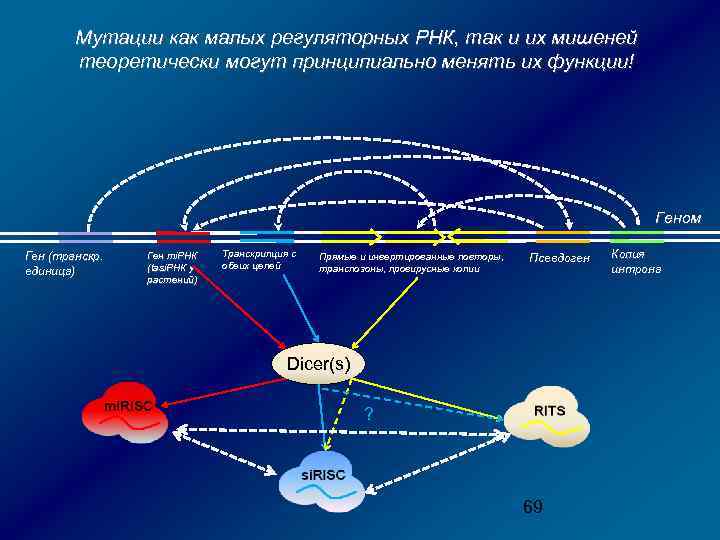 Мутации как малых регуляторных РНК, так и их мишеней теоретически могут принципиально менять их функции! Геном Ген (транскр. единица) Ген mi. РНК (tasi. РНК у растений) Транскрипция с обеих цепей Прямые и инвертированные повторы, транспозоны, провирусные копии Псевдоген Dicer(s) ? 69 Копия интрона
Мутации как малых регуляторных РНК, так и их мишеней теоретически могут принципиально менять их функции! Геном Ген (транскр. единица) Ген mi. РНК (tasi. РНК у растений) Транскрипция с обеих цепей Прямые и инвертированные повторы, транспозоны, провирусные копии Псевдоген Dicer(s) ? 69 Копия интрона
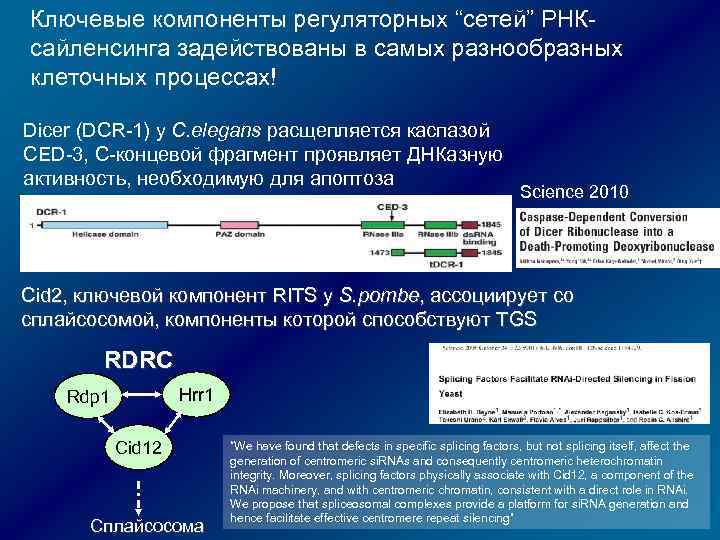 Ключевые компоненты регуляторных “сетей” РНКсайленсинга задействованы в самых разнообразных клеточных процессах! Dicer (DCR-1) у C. elegans расщепляется каспазой CED-3, С-концевой фрагмент проявляет ДНКазную активность, необходимую для апоптоза Science 2010 Cid 2, ключевой компонент RITS у S. pombe, ассоциирует со сплайсосомой, компоненты которой способствуют TGS RDRC Hrr 1 Rdp 1 Cid 12 Сплайсосома “We have found that defects in specific splicing factors, but not splicing itself, affect the generation of centromeric si. RNAs and consequently centromeric heterochromatin integrity. Moreover, splicing factors physically associate with Cid 12, a component of the RNAi machinery, and with centromeric chromatin, consistent with a direct role in RNAi. We propose that spliceosomal complexes provide a platform for si. RNA generation and hence facilitate effective centromere repeat silencing”
Ключевые компоненты регуляторных “сетей” РНКсайленсинга задействованы в самых разнообразных клеточных процессах! Dicer (DCR-1) у C. elegans расщепляется каспазой CED-3, С-концевой фрагмент проявляет ДНКазную активность, необходимую для апоптоза Science 2010 Cid 2, ключевой компонент RITS у S. pombe, ассоциирует со сплайсосомой, компоненты которой способствуют TGS RDRC Hrr 1 Rdp 1 Cid 12 Сплайсосома “We have found that defects in specific splicing factors, but not splicing itself, affect the generation of centromeric si. RNAs and consequently centromeric heterochromatin integrity. Moreover, splicing factors physically associate with Cid 12, a component of the RNAi machinery, and with centromeric chromatin, consistent with a direct role in RNAi. We propose that spliceosomal complexes provide a platform for si. RNA generation and hence facilitate effective centromere repeat silencing”
 Повторенные последовательности, служащие источником для новых регуляторных РНК, могут подвергаться направленному мутагенезу, приводящему к накоплению уникальных вариантов У Neurospora активна система, индуцирующая возникновение мутаций в участках размером более нескольких сотен п. н. , повторенных в гаплоидных тканях (в основном - копиях транспозонов) (RIP – repeat-induced point mutation) в аскогенных тканях, сопряженная с метилированием de novo. C/G пары заменяются на T/A, цитозины в этих парах являются мишенями для метилазы ( см. напр. Freitag et al. , PNAS 2002) Копии трансгенов и транспозонов у растений способны к эктопическому спариванию (непосредственное взаимодействие), что способствует их сайленсингу (см. напр. Matzke et al. Genetics 2001) …возможен сайленсинг без РНК-интерференции пересечение с путями доменной организации?
Повторенные последовательности, служащие источником для новых регуляторных РНК, могут подвергаться направленному мутагенезу, приводящему к накоплению уникальных вариантов У Neurospora активна система, индуцирующая возникновение мутаций в участках размером более нескольких сотен п. н. , повторенных в гаплоидных тканях (в основном - копиях транспозонов) (RIP – repeat-induced point mutation) в аскогенных тканях, сопряженная с метилированием de novo. C/G пары заменяются на T/A, цитозины в этих парах являются мишенями для метилазы ( см. напр. Freitag et al. , PNAS 2002) Копии трансгенов и транспозонов у растений способны к эктопическому спариванию (непосредственное взаимодействие), что способствует их сайленсингу (см. напр. Matzke et al. Genetics 2001) …возможен сайленсинг без РНК-интерференции пересечение с путями доменной организации?
 sm. RNA (small modulatory RNAs) (Kuwabara et al. , 2004): открыты у мышей, консервативны среди позвоночных ~20 н. , модуляция транскрипции, судя по всему, за счет взаимодействия с факторами транскрипции в нейрональных стволовых клетках “переключение” (switch) судьбы клетки при дифференцировке взаимодействуют с регуляторным белком превращают репрессор транскрипции в активатор превращают репрессор транскрипции NRSF/REST (Neuronal Restricted Silencing Factor) – NRSF/REST ( Neuronal Restricted Silencing Factor) – репрессор транскрипции, связываясь с Neuronal Restricted Silencing Element (NRSE), подавляет транскрипцию ряда нейрон-специфичных генов в ненейрональных клетках. В нейрональных клетках экспрессируются sm. РНК, активируют транскрипцию. Предполагается вклад в изменение конформации белков sa. RNAs – small activating RNAs предполагается взаимодействие с промоторами (либо связанными с ними РНК) по принципу комплементарности
sm. RNA (small modulatory RNAs) (Kuwabara et al. , 2004): открыты у мышей, консервативны среди позвоночных ~20 н. , модуляция транскрипции, судя по всему, за счет взаимодействия с факторами транскрипции в нейрональных стволовых клетках “переключение” (switch) судьбы клетки при дифференцировке взаимодействуют с регуляторным белком превращают репрессор транскрипции в активатор превращают репрессор транскрипции NRSF/REST (Neuronal Restricted Silencing Factor) – NRSF/REST ( Neuronal Restricted Silencing Factor) – репрессор транскрипции, связываясь с Neuronal Restricted Silencing Element (NRSE), подавляет транскрипцию ряда нейрон-специфичных генов в ненейрональных клетках. В нейрональных клетках экспрессируются sm. РНК, активируют транскрипцию. Предполагается вклад в изменение конформации белков sa. RNAs – small activating RNAs предполагается взаимодействие с промоторами (либо связанными с ними РНК) по принципу комплементарности
 РНК-сайленсинг – связь с модификациями хроматина и пересечение путей: итоги Ø РНК-зависимый сайленсинг действует на всех уровнях экспрессии генов, включая транскрипционный, а его компоненты у ряда организмов задействованы в механизмах изменения последовательности ДНК в геноме Ø Эволюция аппарата РНК-зависимого сайленсинга у разных организмов привела к заметным различиям в наборе активных механизмов у растений, животных и грибов Ø Количество генетического материала для возникновения новых РНК, участвующих в сайленсинге, возрастает за счет накопления повторенных последовательностей, роста количества и увеличения длины интронов и псевдогенов Ø Роль компонентов системы РНК-зависимого сайленсинга не ограничивается РНК-зависимым сайленсингом
РНК-сайленсинг – связь с модификациями хроматина и пересечение путей: итоги Ø РНК-зависимый сайленсинг действует на всех уровнях экспрессии генов, включая транскрипционный, а его компоненты у ряда организмов задействованы в механизмах изменения последовательности ДНК в геноме Ø Эволюция аппарата РНК-зависимого сайленсинга у разных организмов привела к заметным различиям в наборе активных механизмов у растений, животных и грибов Ø Количество генетического материала для возникновения новых РНК, участвующих в сайленсинге, возрастает за счет накопления повторенных последовательностей, роста количества и увеличения длины интронов и псевдогенов Ø Роль компонентов системы РНК-зависимого сайленсинга не ограничивается РНК-зависимым сайленсингом
 Благодарю за внимание!
Благодарю за внимание!


