коронарная недостаточность.ppt
- Количество слайдов: 69
 Коронарная недостаточность
Коронарная недостаточность
 Это – типовая форма патологии сердца, характеризующаяся превышением потребности миокарда в кислороде и субстратах метаболизма над их реальным притоком по коронарным артериям, а так же нарушением оттока от миокарда метаболитов, ионов, БАВ. Следствие КН – формирование ИБС.
Это – типовая форма патологии сердца, характеризующаяся превышением потребности миокарда в кислороде и субстратах метаболизма над их реальным притоком по коронарным артериям, а так же нарушением оттока от миокарда метаболитов, ионов, БАВ. Следствие КН – формирование ИБС.
 ИБС – патологическое состояние, в основе которого лежит гипоксия миокарда, ведущая к нарушению равновесия между метаболическими потребностями миокарда и коронарным кровотоком (в данный момент времени)
ИБС – патологическое состояние, в основе которого лежит гипоксия миокарда, ведущая к нарушению равновесия между метаболическими потребностями миокарда и коронарным кровотоком (в данный момент времени)
 Разновидности КН 1. Обратимые (транзиторные) нарушения коронарного кровотока 2. Необратимые нарушения коронарного кровотока – абсолютная (коранорогенная) КН
Разновидности КН 1. Обратимые (транзиторные) нарушения коронарного кровотока 2. Необратимые нарушения коронарного кровотока – абсолютная (коранорогенная) КН
 Особенности коронарного кровотока 1. Высокая приспособляемость миокарда к различному уровню функциональной активности 2. Кровоснабжение миокарда в 10 раз превышает питание других органов 3. При резком падении МОС величина венечного кровотока изменяется незначительно 4. Коронарный кровоток находится под влиянием фаз сердечного цикла – наилучший в диастолу
Особенности коронарного кровотока 1. Высокая приспособляемость миокарда к различному уровню функциональной активности 2. Кровоснабжение миокарда в 10 раз превышает питание других органов 3. При резком падении МОС величина венечного кровотока изменяется незначительно 4. Коронарный кровоток находится под влиянием фаз сердечного цикла – наилучший в диастолу
 5. Коронарные артерии являются функционально концевыми. Внезапная и полная закупорка приводит к нарушению кровотока дистальнее поврежденного участка 6. Феномен «подпора» оказывает существенное значение в формировании ИБС (нарушение венозного оттока) 7. При снижении давления или наличия препятствий гладкие мышцы эпикардиальных коронарных артерий и проксимальных артериол расширяются, а когда давление в аорте повышается артериолы сокращаются
5. Коронарные артерии являются функционально концевыми. Внезапная и полная закупорка приводит к нарушению кровотока дистальнее поврежденного участка 6. Феномен «подпора» оказывает существенное значение в формировании ИБС (нарушение венозного оттока) 7. При снижении давления или наличия препятствий гладкие мышцы эпикардиальных коронарных артерий и проксимальных артериол расширяются, а когда давление в аорте повышается артериолы сокращаются
 8. Расширение коронарных сосудов вызывают СО 2 , Н+, К+, простациклин 9. При падении перфузионного давления главный метаболит расширения коронарных сосудов – аденозин 10. При давлении ниже 50 -60 мм рт. ст. , несмотря на расширение коронарных сосудов, кровоток уменьшается
8. Расширение коронарных сосудов вызывают СО 2 , Н+, К+, простациклин 9. При падении перфузионного давления главный метаболит расширения коронарных сосудов – аденозин 10. При давлении ниже 50 -60 мм рт. ст. , несмотря на расширение коронарных сосудов, кровоток уменьшается
 ЭНЕРГЕТИКА МИОКАРДА • имеет преимущественно аэробный характер (85% энергии обеспечивается с помощью кислорода, 15% за счет гликолиза), • в покое сердце потребляет в 15 раз больше кислорода на 100 г ткани, чем другие органы • сердце не имеет запасов субстратов • запасы кислорода в миокарде незначительны • экстракция кислорода из притекающей крови очень эффективна
ЭНЕРГЕТИКА МИОКАРДА • имеет преимущественно аэробный характер (85% энергии обеспечивается с помощью кислорода, 15% за счет гликолиза), • в покое сердце потребляет в 15 раз больше кислорода на 100 г ткани, чем другие органы • сердце не имеет запасов субстратов • запасы кислорода в миокарде незначительны • экстракция кислорода из притекающей крови очень эффективна
 • в большинстве тканей имеется кислородный резерв - за счет увеличения степени экстракции О 2 при возрастании функциональной нагрузки и в условиях ограниченного кровоснабжения • Коэффициент безопасности по кислороду в организме=3, а для миокарда=1, то есть увеличение снабжения сердца кислородом за счет интенсивного его экстрагирования невозможно • Даже небольшое ограничение коронарного кровотока приводит к нарушению кислородного снабжения миокарда
• в большинстве тканей имеется кислородный резерв - за счет увеличения степени экстракции О 2 при возрастании функциональной нагрузки и в условиях ограниченного кровоснабжения • Коэффициент безопасности по кислороду в организме=3, а для миокарда=1, то есть увеличение снабжения сердца кислородом за счет интенсивного его экстрагирования невозможно • Даже небольшое ограничение коронарного кровотока приводит к нарушению кислородного снабжения миокарда
 • Ишемия миокарда проявляется клинически при сужении сосуда до 7590% исходного диаметра • При более умеренном стенозе снижается расширительный резерв коронарных сосудов, то есть при возрастании энергетических потребностей миокарда, возникает стенокардия напряжения
• Ишемия миокарда проявляется клинически при сужении сосуда до 7590% исходного диаметра • При более умеренном стенозе снижается расширительный резерв коронарных сосудов, то есть при возрастании энергетических потребностей миокарда, возникает стенокардия напряжения
 Этиология КН I. Факторы, вызывающие уменьшение или полное закрытие просвета коронарных артерий (коронарогенные факторы) → абсолютная КН 1. Стенозирующий атеросклероз коронарных артерий 2. Тромбоз коронарных артерий 3. Спазм коронарных артерий (возбуждение αадренорецепторов, увеличение содержания вазоконстрикторов – катехоламины, серотонин, гистамин, эндотелин, тромбоксан, ангиотензин-II, снижение содержания вазодилятаторов – NO, простациклин, юрадикинин и др. ) 4. Снижение перфузионного давления в аорте (мерцание предсердий, недостаточность клапанов аорты, сдавление сосудов опухолью, рубцом, инородным телом) 5. Васкулиты (узелковый периартериит, ревматоидный артрит и др. ) 6. Эмболии (инфекционный эндокардит. . . )
Этиология КН I. Факторы, вызывающие уменьшение или полное закрытие просвета коронарных артерий (коронарогенные факторы) → абсолютная КН 1. Стенозирующий атеросклероз коронарных артерий 2. Тромбоз коронарных артерий 3. Спазм коронарных артерий (возбуждение αадренорецепторов, увеличение содержания вазоконстрикторов – катехоламины, серотонин, гистамин, эндотелин, тромбоксан, ангиотензин-II, снижение содержания вазодилятаторов – NO, простациклин, юрадикинин и др. ) 4. Снижение перфузионного давления в аорте (мерцание предсердий, недостаточность клапанов аорты, сдавление сосудов опухолью, рубцом, инородным телом) 5. Васкулиты (узелковый периартериит, ревматоидный артрит и др. ) 6. Эмболии (инфекционный эндокардит. . . )
 II. Факторы, вызывающие значительное увеличение потребления миокардом кислорода (некоронарогенные факторы) → относительная КН 1. Повышение уровня КА (стресс, феохромоцитома): - повышение расхода кислорода миокардом, - снижение синтеза АТФ, активация ПОЛ, увеличение уровня кальция в кардиомиоцитах, - укорочение диастолы. 2. Значительное возрастание работы сердца – состояния, вызывающие гиперфункцию миокрада (АГ, физ. нагрузка, гиперволемия, тахикардия, гемоконцентрация, аортальный стеноз, гипертиреоидизм, анемия, гипотензия, отравление СО) 3. Врожденные аномалии коронарных сосудов
II. Факторы, вызывающие значительное увеличение потребления миокардом кислорода (некоронарогенные факторы) → относительная КН 1. Повышение уровня КА (стресс, феохромоцитома): - повышение расхода кислорода миокардом, - снижение синтеза АТФ, активация ПОЛ, увеличение уровня кальция в кардиомиоцитах, - укорочение диастолы. 2. Значительное возрастание работы сердца – состояния, вызывающие гиперфункцию миокрада (АГ, физ. нагрузка, гиперволемия, тахикардия, гемоконцентрация, аортальный стеноз, гипертиреоидизм, анемия, гипотензия, отравление СО) 3. Врожденные аномалии коронарных сосудов
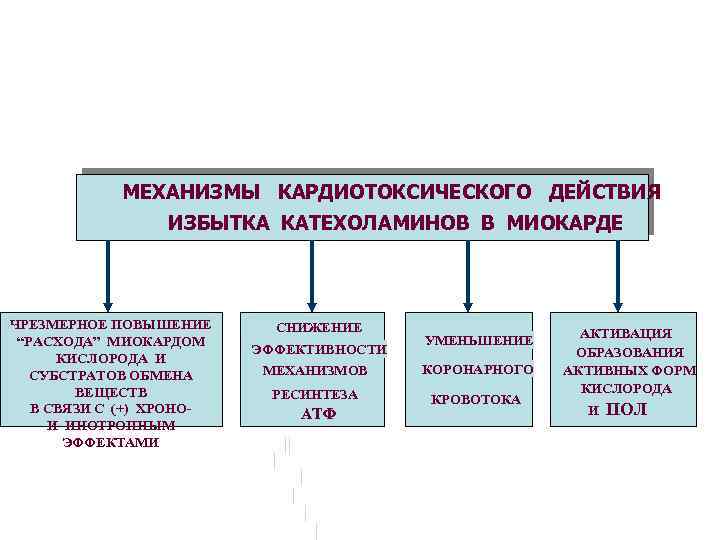 МЕХАНИЗМЫ КАРДИОТОКСИЧЕСКОГО ДЕЙСТВИЯ ИЗБЫТКА КАТЕХОЛАМИНОВ В МИОКАРДЕ ЧРЕЗМЕРНОЕ ПОВЫШЕНИЕ “РАСХОДА” МИОКАРДОМ КИСЛОРОДА И СУБСТРАТОВ ОБМЕНА ВЕЩЕСТВ В СВЯЗИ С (+) ХРОНОИ ИНОТРОПНЫМ ЭФФЕКТАМИ СНИЖЕНИЕ ЭФФЕКТИВНОСТИ МЕХАНИЗМОВ РЕСИНТЕЗА АТФ УМЕНЬШЕНИЕ КОРОНАРНОГО КРОВОТОКА АКТИВАЦИЯ ОБРАЗОВАНИЯ АКТИВНЫХ ФОРМ КИСЛОРОДА И ПОЛ
МЕХАНИЗМЫ КАРДИОТОКСИЧЕСКОГО ДЕЙСТВИЯ ИЗБЫТКА КАТЕХОЛАМИНОВ В МИОКАРДЕ ЧРЕЗМЕРНОЕ ПОВЫШЕНИЕ “РАСХОДА” МИОКАРДОМ КИСЛОРОДА И СУБСТРАТОВ ОБМЕНА ВЕЩЕСТВ В СВЯЗИ С (+) ХРОНОИ ИНОТРОПНЫМ ЭФФЕКТАМИ СНИЖЕНИЕ ЭФФЕКТИВНОСТИ МЕХАНИЗМОВ РЕСИНТЕЗА АТФ УМЕНЬШЕНИЕ КОРОНАРНОГО КРОВОТОКА АКТИВАЦИЯ ОБРАЗОВАНИЯ АКТИВНЫХ ФОРМ КИСЛОРОДА И ПОЛ
 Факторы риска КН I. Экзогенные - первичные (социально -опосредованные) – высококалорийная диета, гиподинамия, стрессы, курение, алкоголизм II. Эндогенные (вторичные) - АГ, ожирение, гипотиреоз, СД, наследственность, возраст > 45 (м) и > 55 (ж)
Факторы риска КН I. Экзогенные - первичные (социально -опосредованные) – высококалорийная диета, гиподинамия, стрессы, курение, алкоголизм II. Эндогенные (вторичные) - АГ, ожирение, гипотиреоз, СД, наследственность, возраст > 45 (м) и > 55 (ж)
 ИБС – клинический синдром, обусловленный уменьшением или полным прекращением коронарного кровотока по одной из ветвей коронарной артерии или появлением несоответствия между потребностью миокарда в кислороде и его реальным обеспечением
ИБС – клинический синдром, обусловленный уменьшением или полным прекращением коронарного кровотока по одной из ветвей коронарной артерии или появлением несоответствия между потребностью миокарда в кислороде и его реальным обеспечением
 Формы ИБС 1. Внезапная коронарная смерть (выраженный распространенный атеросклероз коронарных артерий, поражение двух и более основных ветвей) – фибрилляция желудочков→ остановка сердца 2. Стенокардия напряжения стабильная (фиксированное сужение одной или нескольких коронарных артерий) 3. Нестабильная стенокардия – разрыв бляшки и сопутствующее тромбообразование 4. Вариантная стенокардия - вазоспастическая (Принцметалла) – приступы боли возникают в покое 5. ИМ 6. Постинфарктный кардиосклероз 7. Нарушение ритма и проводимости 8. Безболевая ишемия миокарда 9. Острый коронарный синдром 10. СН
Формы ИБС 1. Внезапная коронарная смерть (выраженный распространенный атеросклероз коронарных артерий, поражение двух и более основных ветвей) – фибрилляция желудочков→ остановка сердца 2. Стенокардия напряжения стабильная (фиксированное сужение одной или нескольких коронарных артерий) 3. Нестабильная стенокардия – разрыв бляшки и сопутствующее тромбообразование 4. Вариантная стенокардия - вазоспастическая (Принцметалла) – приступы боли возникают в покое 5. ИМ 6. Постинфарктный кардиосклероз 7. Нарушение ритма и проводимости 8. Безболевая ишемия миокарда 9. Острый коронарный синдром 10. СН
 Механизм ишемического повреждения миокарда 1. Органическая обструкция коронарной артерий бляшкой 2. Недостаточное расширение артерий при повышении потребности миокарда в кислороде при их склерозировании 3. Динамическая обструкция за счет коронароспазма при стимуляции α-адренорецепторов 4. Увеличение продукции эндотелина-1 и недостаточная продукция простациклина и оксида азота 5. Повышенная продукция тромбоксана 6. Повышенная агрегация тромбоцитов
Механизм ишемического повреждения миокарда 1. Органическая обструкция коронарной артерий бляшкой 2. Недостаточное расширение артерий при повышении потребности миокарда в кислороде при их склерозировании 3. Динамическая обструкция за счет коронароспазма при стимуляции α-адренорецепторов 4. Увеличение продукции эндотелина-1 и недостаточная продукция простациклина и оксида азота 5. Повышенная продукция тромбоксана 6. Повышенная агрегация тромбоцитов
 7. Гипоксемии 8. Падение уровня АД 9. Появление антител к белкам миокарда 10. Активация ПОЛ – ускорение деградации NO 11. Повышенная потребность миокарда в кислороде при тахикардии, АГ, стрессах
7. Гипоксемии 8. Падение уровня АД 9. Появление антител к белкам миокарда 10. Активация ПОЛ – ускорение деградации NO 11. Повышенная потребность миокарда в кислороде при тахикардии, АГ, стрессах
 Механизм ишемического повреждения миокарда на уровне клетки • Нарушение энергетического обеспечения миокарда • Нарушение электролитного баланса в кардиомиоцитах (повышение кальция активирует ФЛ А 2 и процессы ПОЛ) • Накопление лактата → метаболический ацидоз → активация лизосомальных гидролаз → повреждение кардиомиоцитов • Ионы Н+ конкурируют с кальцием за места связывания с тропонином → угнетение сократительной активности кардиомиоцитов
Механизм ишемического повреждения миокарда на уровне клетки • Нарушение энергетического обеспечения миокарда • Нарушение электролитного баланса в кардиомиоцитах (повышение кальция активирует ФЛ А 2 и процессы ПОЛ) • Накопление лактата → метаболический ацидоз → активация лизосомальных гидролаз → повреждение кардиомиоцитов • Ионы Н+ конкурируют с кальцием за места связывания с тропонином → угнетение сократительной активности кардиомиоцитов
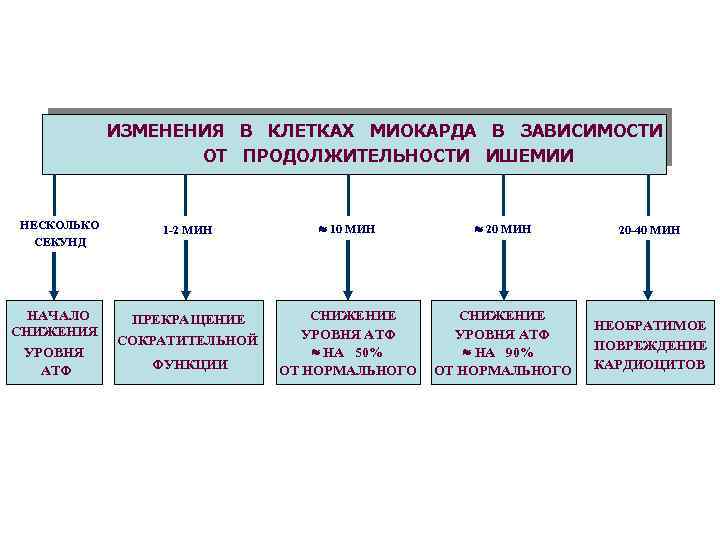 ИЗМЕНЕНИЯ В КЛЕТКАХ МИОКАРДА В ЗАВИСИМОСТИ ОТ ПРОДОЛЖИТЕЛЬНОСТИ ИШЕМИИ НЕСКОЛЬКО СЕКУНД НАЧАЛО СНИЖЕНИЯ УРОВНЯ АТФ 1 -2 МИН 10 МИН 20 МИН 20 -40 МИН ПРЕКРАЩЕНИЕ СНИЖЕНИЕ УРОВНЯ АТФ НА 50% ОТ НОРМАЛЬНОГО СНИЖЕНИЕ УРОВНЯ АТФ НА 90% ОТ НОРМАЛЬНОГО НЕОБРАТИМОЕ ПОВРЕЖДЕНИЕ КАРДИОЦИТОВ СОКРАТИТЕЛЬНОЙ ФУНКЦИИ
ИЗМЕНЕНИЯ В КЛЕТКАХ МИОКАРДА В ЗАВИСИМОСТИ ОТ ПРОДОЛЖИТЕЛЬНОСТИ ИШЕМИИ НЕСКОЛЬКО СЕКУНД НАЧАЛО СНИЖЕНИЯ УРОВНЯ АТФ 1 -2 МИН 10 МИН 20 МИН 20 -40 МИН ПРЕКРАЩЕНИЕ СНИЖЕНИЕ УРОВНЯ АТФ НА 50% ОТ НОРМАЛЬНОГО СНИЖЕНИЕ УРОВНЯ АТФ НА 90% ОТ НОРМАЛЬНОГО НЕОБРАТИМОЕ ПОВРЕЖДЕНИЕ КАРДИОЦИТОВ СОКРАТИТЕЛЬНОЙ ФУНКЦИИ
 Роль NO и ПГI 2 в патогенезе КН • NO - мультипотентная молекула, ингибирующая проникновение Мн в эндотелий, трансформацию в Мф, тормозит продукцию провоспалительных цитокинов, тормозит адгизию и агрегацию Тr, ингибирует пролиферацию и миграцию ГМК в интиму сосудов • ПГI 2 – расширение сосудов и торможение агрегации Тr При ИБС – снижение уровня NO и ПГI 2 и повышение уровня эндотелина
Роль NO и ПГI 2 в патогенезе КН • NO - мультипотентная молекула, ингибирующая проникновение Мн в эндотелий, трансформацию в Мф, тормозит продукцию провоспалительных цитокинов, тормозит адгизию и агрегацию Тr, ингибирует пролиферацию и миграцию ГМК в интиму сосудов • ПГI 2 – расширение сосудов и торможение агрегации Тr При ИБС – снижение уровня NO и ПГI 2 и повышение уровня эндотелина
 Эндотелин – сужение сосудов, стимуляция пролиферации ГМК, адгезии лейкоцитов к эндотелию, ингибирование фибринолиза
Эндотелин – сужение сосудов, стимуляция пролиферации ГМК, адгезии лейкоцитов к эндотелию, ингибирование фибринолиза
 При КН возникают: • Гипоэргоз миокарда • Диастолическая жесткость миокарда
При КН возникают: • Гипоэргоз миокарда • Диастолическая жесткость миокарда
 Ремоделирование миокрада – ключевое звено декомпенсации поврежденного сердца Этиология: ИБС и реперфузия, ХСН, кардиомиопатии Сущность – структурно-геометрические изменения в сердце (гипертрофия, гиперплазия, нарушение взаимного расположения кардиомиоцитов, дистрофия и фиброз миокрада, замена коллагена типа I на тип III, снижение относительной плотности капилляров)→ дилятация и изменение геометрии полостей сердца, прогрессирующее снижение сократительной функции
Ремоделирование миокрада – ключевое звено декомпенсации поврежденного сердца Этиология: ИБС и реперфузия, ХСН, кардиомиопатии Сущность – структурно-геометрические изменения в сердце (гипертрофия, гиперплазия, нарушение взаимного расположения кардиомиоцитов, дистрофия и фиброз миокрада, замена коллагена типа I на тип III, снижение относительной плотности капилляров)→ дилятация и изменение геометрии полостей сердца, прогрессирующее снижение сократительной функции
 Механизмы ремоделирования • гибель кардиомиоцитов • тотальный кардиофиброз • повышенное образование и лизис коллагена • разрывы сшивок кардиомиоцитов → продольное проскальзывание • эксцентрическая гипертрофия миокарда (перерастяжение и увеличение продольного размера кардиомиоцитов) • изменения в гено- и фенотипе: активация экспрессии гена тяжелых цепей миозина, снижение АТФ-азной активности миозина, снижение инотропизма миокарда, торможение процесса образования миофибрилл
Механизмы ремоделирования • гибель кардиомиоцитов • тотальный кардиофиброз • повышенное образование и лизис коллагена • разрывы сшивок кардиомиоцитов → продольное проскальзывание • эксцентрическая гипертрофия миокарда (перерастяжение и увеличение продольного размера кардиомиоцитов) • изменения в гено- и фенотипе: активация экспрессии гена тяжелых цепей миозина, снижение АТФ-азной активности миозина, снижение инотропизма миокарда, торможение процесса образования миофибрилл
 «Новые» ишемические синдромы при реперфузии миокарда
«Новые» ишемические синдромы при реперфузии миокарда
 1. Гибернирующий ( «спящий» миокард) адаптивняя реакция миокарда в ответ на ишемию-реперфузию Стойкое (обратимое) локальное снижение сократительной функции жизнеспособного миокарда ЛЖ вследствие длительной гипоперфузии (приспособительная реакция) → полностью или частично ликвидируется после улучшения коронарного кровотока. Коррекция – хирургическая реваскуляризация Виды: острая (краткосрочная) хроническая
1. Гибернирующий ( «спящий» миокард) адаптивняя реакция миокарда в ответ на ишемию-реперфузию Стойкое (обратимое) локальное снижение сократительной функции жизнеспособного миокарда ЛЖ вследствие длительной гипоперфузии (приспособительная реакция) → полностью или частично ликвидируется после улучшения коронарного кровотока. Коррекция – хирургическая реваскуляризация Виды: острая (краткосрочная) хроническая
 Механизмы острой гибернации • нарушение захвата кальция СПР • снижение чувствительности миофибрилл к кальцию • расстройство кальциевой регуляции взаимодействия актина и миозина • снижение содержания в кардиомиоцитах сократительных белков • массированный апоптоз кардиомиоцитов • дедифференцировка и утрата специфических свойств кардиомиоцитов • накопление неорганического фосфата
Механизмы острой гибернации • нарушение захвата кальция СПР • снижение чувствительности миофибрилл к кальцию • расстройство кальциевой регуляции взаимодействия актина и миозина • снижение содержания в кардиомиоцитах сократительных белков • массированный апоптоз кардиомиоцитов • дедифференцировка и утрата специфических свойств кардиомиоцитов • накопление неорганического фосфата
 Механизмы хронической гибернации • усиленный захват глюкозы из кровотока, превышающий метаболические потребности миокарда, накопление глюкозы в саркоплазме в форме гликогена • активация генетической программы выживания кардиомиоцитов: усиление экспресии генов белка теплового шока, сосудистого эндотелиального фактора роста, транспортера глюкозы 1. Эти белки обладают цитопротективными свойствами • феномен аутофагии - усиление деградации белков и органелл кардиомиоцитов в лизосомах → удаление ненфункционирующих клеток, перераспределение пула аминокислот в пользу клеток, сохраняющих метаболическую активность
Механизмы хронической гибернации • усиленный захват глюкозы из кровотока, превышающий метаболические потребности миокарда, накопление глюкозы в саркоплазме в форме гликогена • активация генетической программы выживания кардиомиоцитов: усиление экспресии генов белка теплового шока, сосудистого эндотелиального фактора роста, транспортера глюкозы 1. Эти белки обладают цитопротективными свойствами • феномен аутофагии - усиление деградации белков и органелл кардиомиоцитов в лизосомах → удаление ненфункционирующих клеток, перераспределение пула аминокислот в пользу клеток, сохраняющих метаболическую активность
 2. Оглушенный миокард (станнинг) Обратимая постишемическая дисфункция миокарда (угнетение сократимости) после восстановления коронарного кровотока (реперфузии) (при применении тромболитиков при ИМ, хранении донорского сердца, при АКШ) – осложнение реперфузии. Возникает гипо-, а- или дискинезия ЛЖ
2. Оглушенный миокард (станнинг) Обратимая постишемическая дисфункция миокарда (угнетение сократимости) после восстановления коронарного кровотока (реперфузии) (при применении тромболитиков при ИМ, хранении донорского сердца, при АКШ) – осложнение реперфузии. Возникает гипо-, а- или дискинезия ЛЖ
 Гипотеза свободнорадикального повреждения 1. Реперфузия→оксидативный стресс с образованием активных форм кислорода (из-за нарушения электронтранспортных цепей митохондрий, активации каскада превращения АК, аутоокисления КА, активации НАФНоксидаз)→повреждение сократительных белков, инактивация ферментов. 2. Оксидативный стресс → повреждение сарколеммы: АФК ингибируют Na+-К+-АТФ-азу → перегрузка клеток натрием и активация Na+-Ca 2+-обменника → перегрузка кардиомиоцитов кальцием 3. АФК снижают чувствительность миофиламентов к кальцию (повреждение сократительных белков за счет окисления тиоловых групп) 4. АФК повреждают СПР
Гипотеза свободнорадикального повреждения 1. Реперфузия→оксидативный стресс с образованием активных форм кислорода (из-за нарушения электронтранспортных цепей митохондрий, активации каскада превращения АК, аутоокисления КА, активации НАФНоксидаз)→повреждение сократительных белков, инактивация ферментов. 2. Оксидативный стресс → повреждение сарколеммы: АФК ингибируют Na+-К+-АТФ-азу → перегрузка клеток натрием и активация Na+-Ca 2+-обменника → перегрузка кардиомиоцитов кальцием 3. АФК снижают чувствительность миофиламентов к кальцию (повреждение сократительных белков за счет окисления тиоловых групп) 4. АФК повреждают СПР
 Кальциевая гипотеза • пониженная чувствительность сократительного аппарата кардиоцитов к кальцию (за счет структурных изменений некоторых белков миофибрилл – сократительный белка α-актинина и регуляторного белка тропонина I) • кальциевая перегрузка миокарда →активация ферментов – кальпаинов→ активация протеолиза • нарушение электромеханического сопряжения при дисфункции СПР
Кальциевая гипотеза • пониженная чувствительность сократительного аппарата кардиоцитов к кальцию (за счет структурных изменений некоторых белков миофибрилл – сократительный белка α-актинина и регуляторного белка тропонина I) • кальциевая перегрузка миокарда →активация ферментов – кальпаинов→ активация протеолиза • нарушение электромеханического сопряжения при дисфункции СПР
 3. Феномен «no-reflow» постишемического невосстановления кровотока Отсутствие или значительное снижение кровотока в ранее ишемизированном участке при его реваскуляризации (при тромболизисе, тромбэктомии, АКШ, стентировании)
3. Феномен «no-reflow» постишемического невосстановления кровотока Отсутствие или значительное снижение кровотока в ранее ишемизированном участке при его реваскуляризации (при тромболизисе, тромбэктомии, АКШ, стентировании)
 Основные механизмы феномена «no-reflow» • обтурация сосудов МЦ микротромбами и атероматозными массами • адгезия лейкоцитарных агрегатов к эндотелию→ свободные радикалы → повреждение эндотелия • сужение просвета микрососудов отечными клетками эндотелия • сдавление сосудов отекшими кардиомиоцитами • спазм артериол при избытке КА (αадренергическая констрикция) • сдавление микрососудов
Основные механизмы феномена «no-reflow» • обтурация сосудов МЦ микротромбами и атероматозными массами • адгезия лейкоцитарных агрегатов к эндотелию→ свободные радикалы → повреждение эндотелия • сужение просвета микрососудов отечными клетками эндотелия • сдавление сосудов отекшими кардиомиоцитами • спазм артериол при избытке КА (αадренергическая констрикция) • сдавление микрососудов
 Изменение показателей функции сердца при КН • Снижение УО и МОС из-за отсутствия сокращений в ишемизированном регионе → ↑ЧСС (при активации САС и повышения давления в ПВ и предсердиях) • Возрастание КДД в полостях сердца • Снижение скорости систолического сокращения и диастолического расслабления миокарда
Изменение показателей функции сердца при КН • Снижение УО и МОС из-за отсутствия сокращений в ишемизированном регионе → ↑ЧСС (при активации САС и повышения давления в ПВ и предсердиях) • Возрастание КДД в полостях сердца • Снижение скорости систолического сокращения и диастолического расслабления миокарда
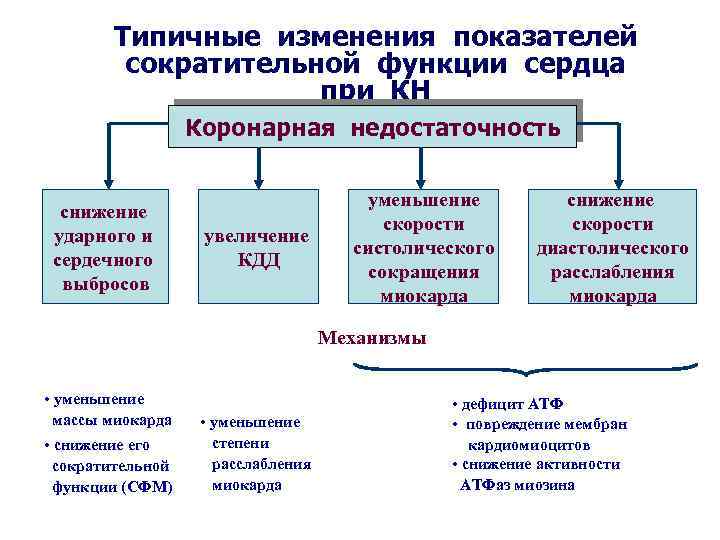 Типичные изменения показателей сократительной функции сердца при КН Коронарная недостаточность снижение ударного и сердечного выбросов увеличение КДД уменьшение скорости систолического сокращения миокарда снижение скорости диастолического расслабления миокарда Механизмы • уменьшение массы миокарда • снижение его сократительной функции (СФМ) • уменьшение степени расслабления миокарда • дефицит АТФ • повреждение мембран кардиомиоцитов • снижение активности АТФаз миозина
Типичные изменения показателей сократительной функции сердца при КН Коронарная недостаточность снижение ударного и сердечного выбросов увеличение КДД уменьшение скорости систолического сокращения миокарда снижение скорости диастолического расслабления миокарда Механизмы • уменьшение массы миокарда • снижение его сократительной функции (СФМ) • уменьшение степени расслабления миокарда • дефицит АТФ • повреждение мембран кардиомиоцитов • снижение активности АТФаз миозина
 Внезапная коронарная смерть Наступает мгновенно или в первые 6 часов от начала приступа: ● перенесенный ИМ ● ишемия при физической нагрузке ● проявления СН ● нарушения ритма высоких градаций
Внезапная коронарная смерть Наступает мгновенно или в первые 6 часов от начала приступа: ● перенесенный ИМ ● ишемия при физической нагрузке ● проявления СН ● нарушения ритма высоких градаций
 Инфаркт миокарда - форма ИБС, в основе которой лежит развитие очаговой ишемии с последующим некрозом участка миокарда в результате поступления крови в количестве, недостаточ-ном для восполнения энергетических потребностей миокарда, или быстро возникшего полного прекращения кровотока в одной из крупных коронарных артерий вследствие закупорки атеросклеротической бляшкой или тромбом
Инфаркт миокарда - форма ИБС, в основе которой лежит развитие очаговой ишемии с последующим некрозом участка миокарда в результате поступления крови в количестве, недостаточ-ном для восполнения энергетических потребностей миокарда, или быстро возникшего полного прекращения кровотока в одной из крупных коронарных артерий вследствие закупорки атеросклеротической бляшкой или тромбом
 Возможен токсический ИМ: катехоламины, амфетамины, противозачаточные, тиреоидные препараты, окись углерода
Возможен токсический ИМ: катехоламины, амфетамины, противозачаточные, тиреоидные препараты, окись углерода
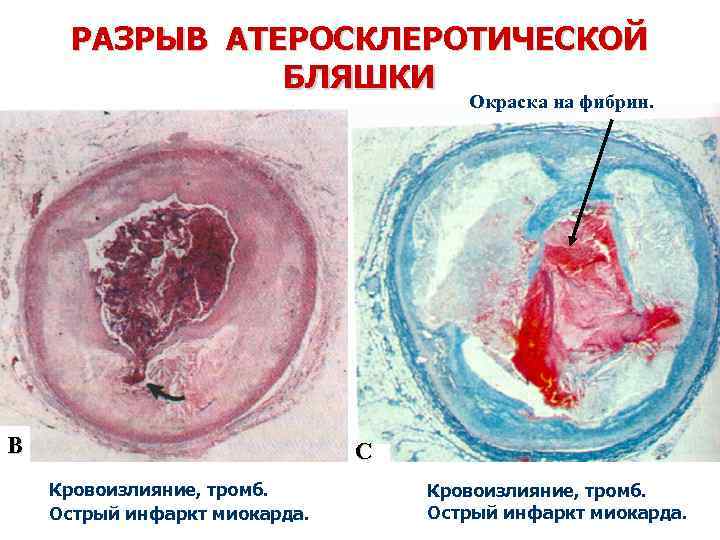 РАЗРЫВ АТЕРОСКЛЕРОТИЧЕСКОЙ БЛЯШКИ Окраска на фибрин. В С Кровоизлияние, тромб. Острый инфаркт миокарда.
РАЗРЫВ АТЕРОСКЛЕРОТИЧЕСКОЙ БЛЯШКИ Окраска на фибрин. В С Кровоизлияние, тромб. Острый инфаркт миокарда.
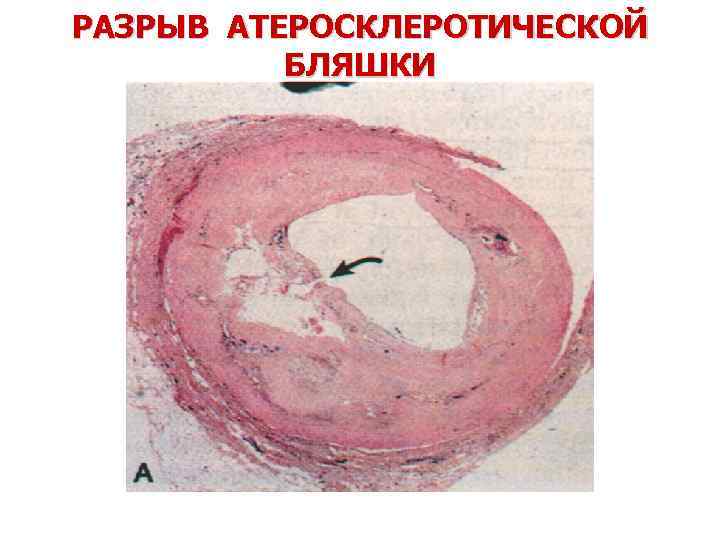 РАЗРЫВ АТЕРОСКЛЕРОТИЧЕСКОЙ БЛЯШКИ
РАЗРЫВ АТЕРОСКЛЕРОТИЧЕСКОЙ БЛЯШКИ
 В основе развития ИМ – патофизиологическая триада: 1. надрыв (разрыв) атеросклеротической бляшки 2. тромбоз 3. вазоконстрикция
В основе развития ИМ – патофизиологическая триада: 1. надрыв (разрыв) атеросклеротической бляшки 2. тромбоз 3. вазоконстрикция
 Проявления ИМ • Падение насосной функции миокарда вплоть до развития КШ • Боль • Прогрессирующая гиперкоагуляция • Одышка • Резорбционно-некротический синдром
Проявления ИМ • Падение насосной функции миокарда вплоть до развития КШ • Боль • Прогрессирующая гиперкоагуляция • Одышка • Резорбционно-некротический синдром
 Механизм боли • понижение порога болевой чувствительности • острая дилятация сердца • ↑ внеклеточного калия (потеря кардиомиоцитами) • ↑ брадикинина, субстанции Р, аденозина, серотонина, свободных кининов • метаболический ацидоз
Механизм боли • понижение порога болевой чувствительности • острая дилятация сердца • ↑ внеклеточного калия (потеря кардиомиоцитами) • ↑ брадикинина, субстанции Р, аденозина, серотонина, свободных кининов • метаболический ацидоз
 Импульсы передаются по афферентным симпатическим волокнам предсердий и желудочков в верхние грудные симпатические ганглии, верхние дорзальные пути спинного мозга, «переплетаясь» с другими грудными путями, что обуславливает иррадиирующую боль в левую руку (мизинец), грудную стенку.
Импульсы передаются по афферентным симпатическим волокнам предсердий и желудочков в верхние грудные симпатические ганглии, верхние дорзальные пути спинного мозга, «переплетаясь» с другими грудными путями, что обуславливает иррадиирующую боль в левую руку (мизинец), грудную стенку.
 Одышка • повышение давления в левом желудочке и предсердии, легочных капиллярах, • преобладание гидростатического давления над онкотическим, • выход жидкости в интерстиций, • раздражение юкстакапиллярных рецепторов, • рефлекторное учащение дыхания
Одышка • повышение давления в левом желудочке и предсердии, легочных капиллярах, • преобладание гидростатического давления над онкотическим, • выход жидкости в интерстиций, • раздражение юкстакапиллярных рецепторов, • рефлекторное учащение дыхания
 Резорбционно-некротический синдром • ООФ – лихорадка, ускорение СОЭ, лейкоцитоз со сдвигом влево, биохимические признаки воспаления (СРБ), белки ОФ • маркеры гибели кардиомиоцитов (тропонин, миоглобин)
Резорбционно-некротический синдром • ООФ – лихорадка, ускорение СОЭ, лейкоцитоз со сдвигом влево, биохимические признаки воспаления (СРБ), белки ОФ • маркеры гибели кардиомиоцитов (тропонин, миоглобин)
 • Брадикардия и АВ блокады при обструкции правой коронарной артерии, ветви которой кровоснабжают атриовентрикулярный узел • Тахикардия - симпато-адренергическая компенсация для поддержания ударного выброса сердца • Тошнота и рвота – активация n. vagus
• Брадикардия и АВ блокады при обструкции правой коронарной артерии, ветви которой кровоснабжают атриовентрикулярный узел • Тахикардия - симпато-адренергическая компенсация для поддержания ударного выброса сердца • Тошнота и рвота – активация n. vagus
 Механизм гиперкоагуляции • Снижение синтеза эндотелием простациклина • Увеличение синтеза тромбоксана А 2 • Снижение фибринолитической активности (за счет синтеза ингибитора активатора плазминогена под влиянием ИЛ-1 и. ФНО)
Механизм гиперкоагуляции • Снижение синтеза эндотелием простациклина • Увеличение синтеза тромбоксана А 2 • Снижение фибринолитической активности (за счет синтеза ингибитора активатора плазминогена под влиянием ИЛ-1 и. ФНО)
 Расширение зоны некроза • Соскальзывание мышечных пучков по отношению друг к другу • Постепенная гибель оставшихся в живых кардиомиоцитов в зоне поражения • Разрыв здоровых кардиомиоцитов из-за дилатации полостей
Расширение зоны некроза • Соскальзывание мышечных пучков по отношению друг к другу • Постепенная гибель оставшихся в живых кардиомиоцитов в зоне поражения • Разрыв здоровых кардиомиоцитов из-за дилатации полостей
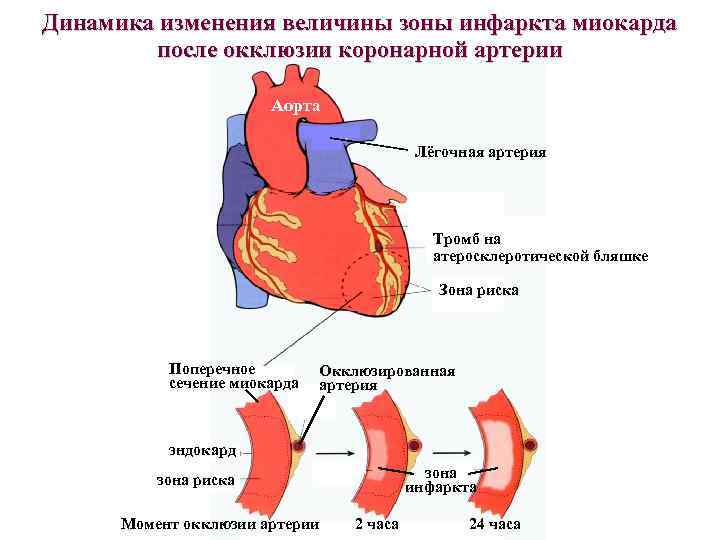 Динамика изменения величины зоны инфаркта миокарда после окклюзии коронарной артерии Аорта Лёгочная артерия Тромб на атеросклеротической бляшке Зона риска Поперечное сечение миокарда Окклюзированная артерия эндокард зона инфаркта зона риска Момент окклюзии артерии 2 часа 24 часа
Динамика изменения величины зоны инфаркта миокарда после окклюзии коронарной артерии Аорта Лёгочная артерия Тромб на атеросклеротической бляшке Зона риска Поперечное сечение миокарда Окклюзированная артерия эндокард зона инфаркта зона риска Момент окклюзии артерии 2 часа 24 часа
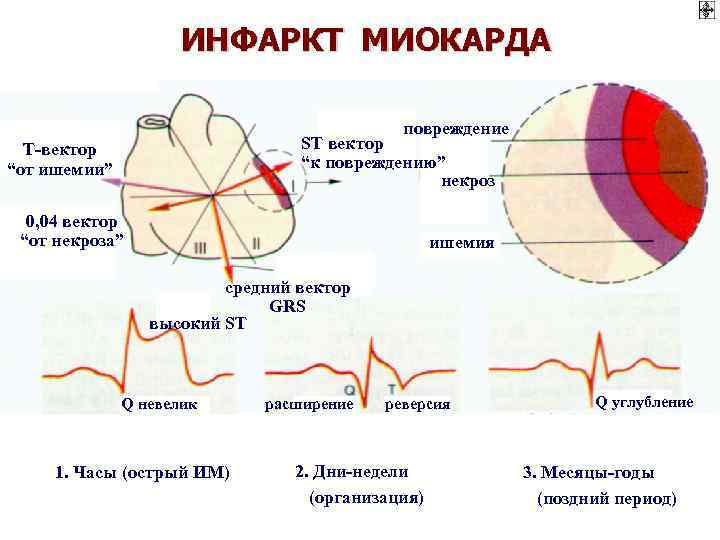 ИНФАРКТ МИОКАРДА повреждение SТ вектор “к повреждению” некроз Т-вектор “от ишемии” 0, 04 вектор “от некроза” ишемия средний вектор GRS высокий ST Q невелик 1. Часы (острый ИМ) расширение реверсия 2. Дни-недели (организация) Q углубление 3. Месяцы-годы (поздний период)
ИНФАРКТ МИОКАРДА повреждение SТ вектор “к повреждению” некроз Т-вектор “от ишемии” 0, 04 вектор “от некроза” ишемия средний вектор GRS высокий ST Q невелик 1. Часы (острый ИМ) расширение реверсия 2. Дни-недели (организация) Q углубление 3. Месяцы-годы (поздний период)
 Активность ферментов при ИМ l МВ-фракция КФК – возрастает через 312 ч от начала боли, max – через 24 ч, возврат к норме– 48 -72 ч l Сердечные тропонины (определяют смертность)–возрастает через 3 -12 ч от начала боли, max – через 24 -48 ч, возврат к норме – через 5 -14 суток l ЛДГ 1 -2: 12 ч → 24 -48 ч → 10 -14 сут
Активность ферментов при ИМ l МВ-фракция КФК – возрастает через 312 ч от начала боли, max – через 24 ч, возврат к норме– 48 -72 ч l Сердечные тропонины (определяют смертность)–возрастает через 3 -12 ч от начала боли, max – через 24 -48 ч, возврат к норме – через 5 -14 суток l ЛДГ 1 -2: 12 ч → 24 -48 ч → 10 -14 сут
 Осложнения ИМ I. Ранние: • Пристеночный тромбоз • Острая аневризма • Разрыв стенки с тампонадой перикарда • Кардиогенный шок • Отек легких (ОЛН) • Аритмии (вплоть до фибрилляции желудочков)
Осложнения ИМ I. Ранние: • Пристеночный тромбоз • Острая аневризма • Разрыв стенки с тампонадой перикарда • Кардиогенный шок • Отек легких (ОЛН) • Аритмии (вплоть до фибрилляции желудочков)
 Осложнения ИМ II. Поздние: • хроническая аневризма сердца • разрывы сердца • тромбоэмболии • синдром Дресслера - аутоимммунное поражение кардиомиоцитов (плеврит, перикардит)
Осложнения ИМ II. Поздние: • хроническая аневризма сердца • разрывы сердца • тромбоэмболии • синдром Дресслера - аутоимммунное поражение кардиомиоцитов (плеврит, перикардит)
 ОСНОВНЫЕ МЕХАНИЗМЫ РАЗВИТИЯ АРИТМИЙ ПРИ ИМ • изменение электрофизиологических свойств миокарда в области поражения • электрическая негомогенность миокарда • появления эктопических очагов, потеря электрической стабильности • дисбаланс ионов • гиперкатехоламиинемия • острая дилятация миокарда • развитие феномена re-entry и высокая спонтанная диастолическая реполяризация
ОСНОВНЫЕ МЕХАНИЗМЫ РАЗВИТИЯ АРИТМИЙ ПРИ ИМ • изменение электрофизиологических свойств миокарда в области поражения • электрическая негомогенность миокарда • появления эктопических очагов, потеря электрической стабильности • дисбаланс ионов • гиперкатехоламиинемия • острая дилятация миокарда • развитие феномена re-entry и высокая спонтанная диастолическая реполяризация
 Кардиогенный шок -это острая СН, вызванная резким нарушением насосной способности миокарда, в том числе при остром ИМ По патогенезу 4 вида КШ: 1. Рефлекторный КШ – при выраженном болевом синдроме 2. Истинный КШ – при резком уменьшении систолической функции ЛЖ на фоне потери более 40% массы сократительного миокарда 3. Аритмический КШ – вследствие пароксизмальных нарушений ритма, ав- блокады II-III степени 4. Гиповолемический КШ – при резком нарушении микроциркуляции (наркотики → снижение преднагрузки)
Кардиогенный шок -это острая СН, вызванная резким нарушением насосной способности миокарда, в том числе при остром ИМ По патогенезу 4 вида КШ: 1. Рефлекторный КШ – при выраженном болевом синдроме 2. Истинный КШ – при резком уменьшении систолической функции ЛЖ на фоне потери более 40% массы сократительного миокарда 3. Аритмический КШ – вследствие пароксизмальных нарушений ритма, ав- блокады II-III степени 4. Гиповолемический КШ – при резком нарушении микроциркуляции (наркотики → снижение преднагрузки)
 По тяжести: I степень – САД ↓ до 80 мм. рт. ст. , ЧСС 100 -110 уд/мин II степень – САД ↓ до 70 мм. рт. ст. , ЧСС 110 и более уд/мин III степень – САД ↓ до 50 мм. рт. ст. и менее, ДАД – не определяется
По тяжести: I степень – САД ↓ до 80 мм. рт. ст. , ЧСС 100 -110 уд/мин II степень – САД ↓ до 70 мм. рт. ст. , ЧСС 110 и более уд/мин III степень – САД ↓ до 50 мм. рт. ст. и менее, ДАД – не определяется
 По продолжительности: 1 степень – до 2 часов 2 степень – до 3 -6 часов 3 степень – более 6 часов
По продолжительности: 1 степень – до 2 часов 2 степень – до 3 -6 часов 3 степень – более 6 часов
 По реакции на прессорное вещество (мезатон): 1 степень – САД нормализуется после однократного в/в введения 2 степень – требуются повторные инъекции 3 степень – требуется непрерывное введение
По реакции на прессорное вещество (мезатон): 1 степень – САД нормализуется после однократного в/в введения 2 степень – требуются повторные инъекции 3 степень – требуется непрерывное введение
 Прогрессирующее падение сократительной способности миокарда обусловливает: 1. Снижение перфузионного давления мио-карда вследствие артериальной гипотензии 2. Острая дистрофия миокарда под влиянием избыточной адренергической стимуляции 3. Увеличение несоответствия между доставкой кислорода и потребностью кардиомиоцитов в кислороде
Прогрессирующее падение сократительной способности миокарда обусловливает: 1. Снижение перфузионного давления мио-карда вследствие артериальной гипотензии 2. Острая дистрофия миокарда под влиянием избыточной адренергической стимуляции 3. Увеличение несоответствия между доставкой кислорода и потребностью кардиомиоцитов в кислороде
 Компенсаторные реакции при КШ включают: • Нейрогенный спазм вен • Активация РААС • Аутогемодилюция Биол. смысл – поддержание МОК и АД через рост венозного возврата, задержку натрия и воды, расширение внутрисосудистого жидкостного сектора и возрастание ОПСС
Компенсаторные реакции при КШ включают: • Нейрогенный спазм вен • Активация РААС • Аутогемодилюция Биол. смысл – поддержание МОК и АД через рост венозного возврата, задержку натрия и воды, расширение внутрисосудистого жидкостного сектора и возрастание ОПСС
 НО! Компенсаторные реакции увеличивают пред- и постнагрузку→ повышают утилизацию энергии кардиомиоцитами → нарастает несоответствие между потребностью сердца и доставкой к нему кислорода → растет масса гипоксического миокарда → падает сократимость миокарда → порочный круг
НО! Компенсаторные реакции увеличивают пред- и постнагрузку→ повышают утилизацию энергии кардиомиоцитами → нарастает несоответствие между потребностью сердца и доставкой к нему кислорода → растет масса гипоксического миокарда → падает сократимость миокарда → порочный круг
 Основная патофизиологическая особенность КШ - изначально присущие компенсаторным реакциям свойства звеньев патогенеза, действие которых обусловливает прогрессирование шока и приобретение им необратимого характера - при КШ поражен основной эффектор компенсаторных реакций, направленных на поддержание МОК, – сердце
Основная патофизиологическая особенность КШ - изначально присущие компенсаторным реакциям свойства звеньев патогенеза, действие которых обусловливает прогрессирование шока и приобретение им необратимого характера - при КШ поражен основной эффектор компенсаторных реакций, направленных на поддержание МОК, – сердце
 Патогенез ИБС по Ф. З. Меерсону • стрессорная гиперхолестеринемия • первичные стрессорные повреждения миокарда (метаболические и структурные изменения) • гиперкатехоламинемия с последующим коронароспазмом и вторичным ишемическим повреждением • активация избытком КА свертывающей системы крови и образование тромбов
Патогенез ИБС по Ф. З. Меерсону • стрессорная гиперхолестеринемия • первичные стрессорные повреждения миокарда (метаболические и структурные изменения) • гиперкатехоламинемия с последующим коронароспазмом и вторичным ишемическим повреждением • активация избытком КА свертывающей системы крови и образование тромбов
 • снижение резистентности миокарда к гипоксии и ишемии вследствие длительной стресс реакции • адренергическое повышение сопротивления сосудистого русла и увеличение нагрузки на сердце • снижение тонуса емкостных сосудов (в основном портальной системы), приводящее в депонированию крови и ↓ ОЦК • гипервентиляция, приводящая к развитию алкалоза и ↓ коронарного кровотока
• снижение резистентности миокарда к гипоксии и ишемии вследствие длительной стресс реакции • адренергическое повышение сопротивления сосудистого русла и увеличение нагрузки на сердце • снижение тонуса емкостных сосудов (в основном портальной системы), приводящее в депонированию крови и ↓ ОЦК • гипервентиляция, приводящая к развитию алкалоза и ↓ коронарного кровотока
 Коррекция КН и ИМ • Купирование боли • Снижение «преднагрузки» (↓ возврат венозной крови) и расширение коронарных артерий – нитраты • Снижение постнагрузки (↓ тонуса резистивных сосудов) – нитраты+ антагонисты кальция • Улучшение коронарного кровотока – нитраты+ антагонисты кальция+ дезагреганты+ антиокагулянты • Снижение сократительной нагрузки на миокард –ß-блокаторы + антагонисты кальция • Восстановление обменных процессов в миокарде • Оксигенотерапия • Тромболитическая терапия • Понижение потребности миокарда в О 2
Коррекция КН и ИМ • Купирование боли • Снижение «преднагрузки» (↓ возврат венозной крови) и расширение коронарных артерий – нитраты • Снижение постнагрузки (↓ тонуса резистивных сосудов) – нитраты+ антагонисты кальция • Улучшение коронарного кровотока – нитраты+ антагонисты кальция+ дезагреганты+ антиокагулянты • Снижение сократительной нагрузки на миокард –ß-блокаторы + антагонисты кальция • Восстановление обменных процессов в миокарде • Оксигенотерапия • Тромболитическая терапия • Понижение потребности миокарда в О 2
 Основные классы антиангинальных лекарственных средств • β-адреноблокаторы • Антагонисты кальция • Нитраты и нитратоподобные препараты • Миокардиальные цитопротекторы
Основные классы антиангинальных лекарственных средств • β-адреноблокаторы • Антагонисты кальция • Нитраты и нитратоподобные препараты • Миокардиальные цитопротекторы
 Постинфарктный кардиосклероз - это разрастание соединительной ткани в миокарде 1. Очаговый – после ИМ 2. Диффузный – при ИБС без ИМ
Постинфарктный кардиосклероз - это разрастание соединительной ткани в миокарде 1. Очаговый – после ИМ 2. Диффузный – при ИБС без ИМ


