Координационые соединения.ppt
- Количество слайдов: 30

Координационные соединения. Комлексообразование. Пространственная структура комплексов. Применение комплексных соединений.

Впервые свойства и строение комплексных соединений объяснил в 1893 году в возрасте 27 лет Альфред Вернер.

Координационная теория в СССР была развита Чугаевым Л. А. , академиком Гринбергом А. А. • Для понимания структуры комплексных соединений и донорно-акцепторной связи в настоящее время привлекаются методы МВС, ММО и теория кристаллического поля.

С позиции ММО донорноакцепторная связь образуется между частицами, если: • в одной из частиц высшая заполненная электронами молекулярная орбиталь является несвязующей, а в другой частице (атоме, ионе) есть близкая по энергии и соответствующая по симметрии свободная связующая молекулярная орбиталь.
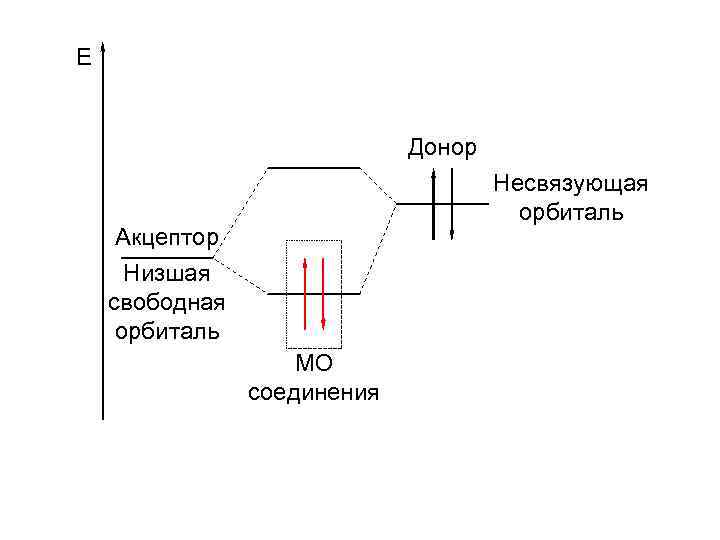
E Донор Несвязующая орбиталь Акцептор Низшая свободная орбиталь МО соединения

При образовании комплексных соединений донорами электронов могут быть : • Молекулы – • Ионы – которые называются лиганды.
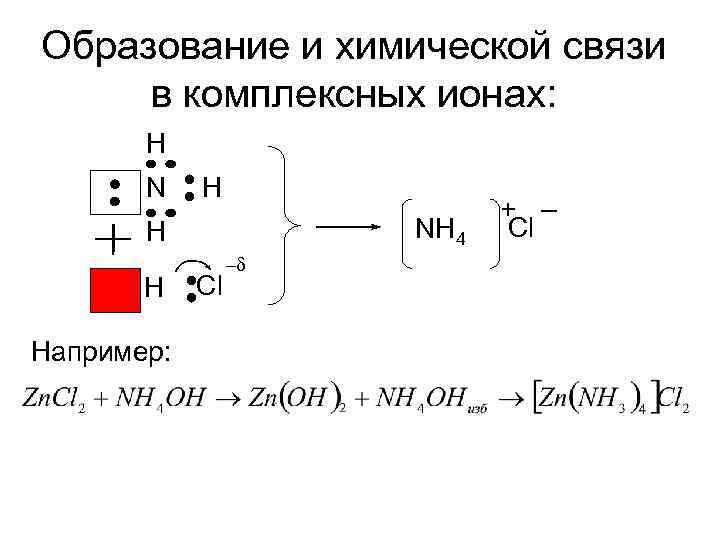
Образование и химической связи в комплексных ионах: H NH 4 H H Например: Cl –δ + – Cl
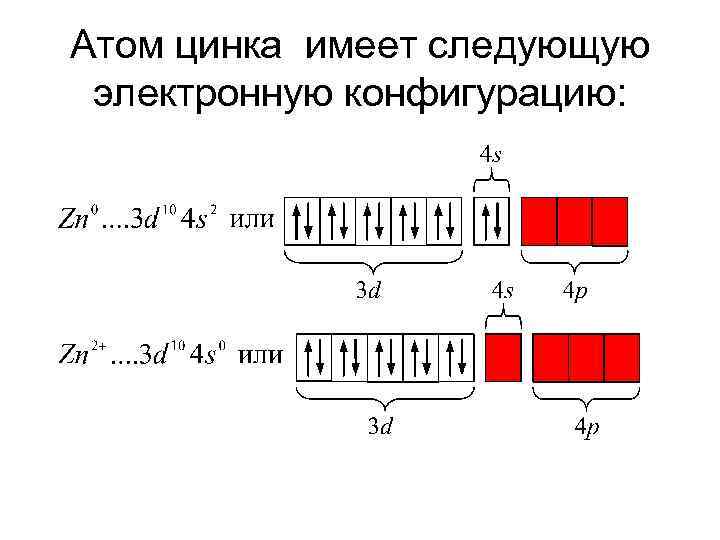
Атом цинка имеет следующую электронную конфигурацию:
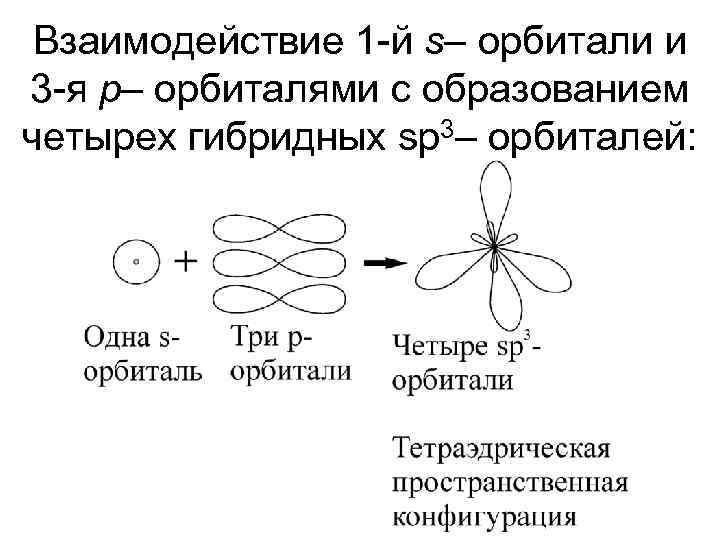
Взаимодействие 1 -й s– орбитали и 3 -я p– орбиталями с образованием четырех гибридных sp 3– орбиталей:
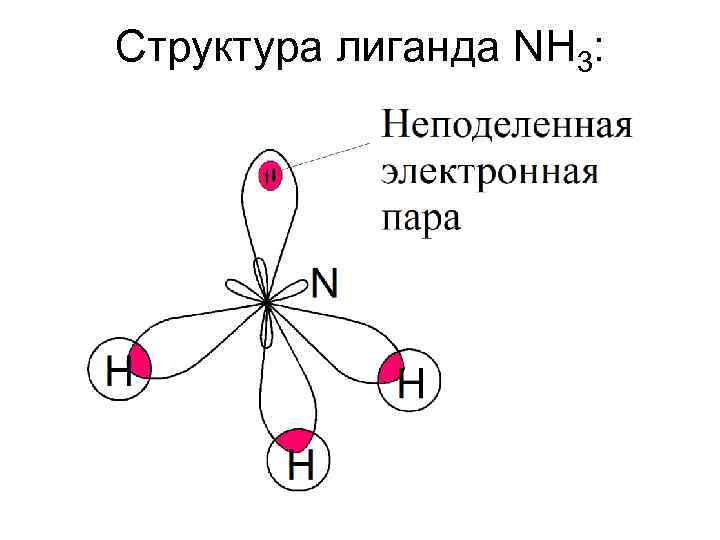
Структура лиганда NH 3:
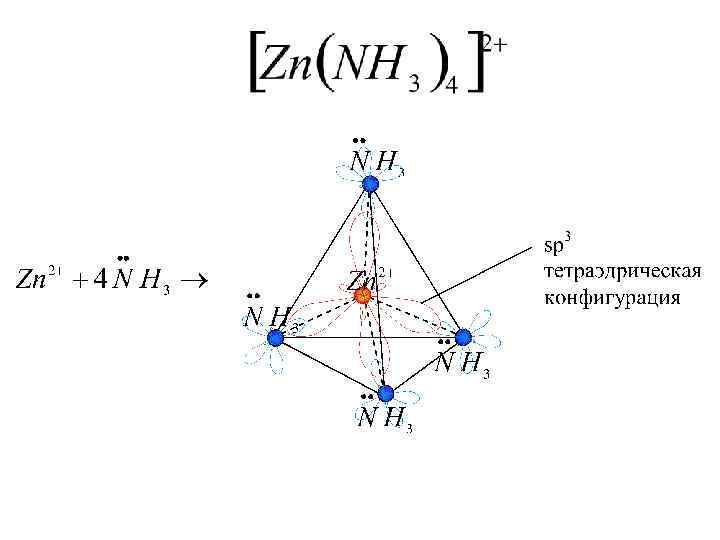

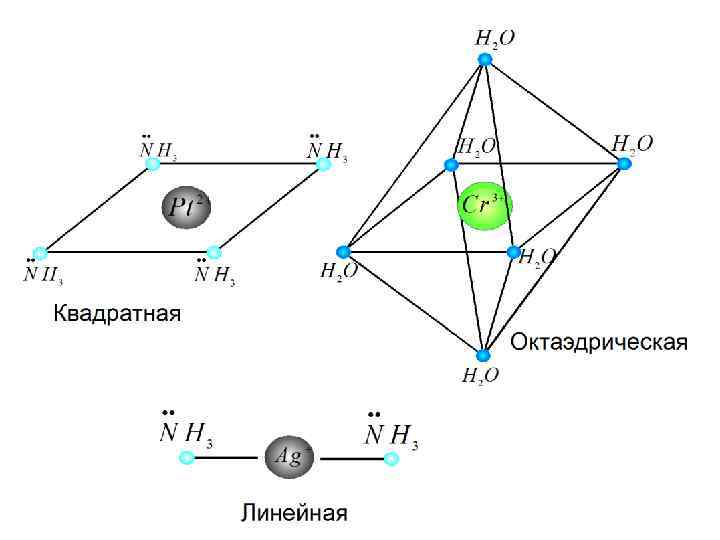
Структура комплексов. Координационн Пространственн Комплексообраз ое число ая ователь конфигураци я 4 Тетраэдрическая : Квадратная: Fe 2+, Co 2+, Zn 2+ Pt 2+, Au 3+ 6 Октаэдрическая: Cr 3+, Fe 3+ 2 Линейная: Ag+

Особенности комплексов.

Особенности комплексов.

Номенклатура.

Классификация. • По принадлежности различают: соль, кислота, основание. • По природе лигандов:

Свойство комплексных соединений. • Комплексные соединения способны диссоциировать: • По закону действующих масс: константа нестойкости

Для сравнения: Устойчивость можно рассчитать по уравнению Гиббса:

Химические свойства.

Применение комплексных соединений.

Теория кристаллического поля. • Многие растворы комплексных соединений – цветные. • Теория кристаллического поля объясняет цветность растворов комплексных соединений. • Теория кристаллического поля основана на предположении, что между комплексообразователем (его d- орбиталями) и лигандами осуществляется электростатическое взаимодействие с учетом пространственного распределения электронной плотности dорбиталей комплексообразователя.
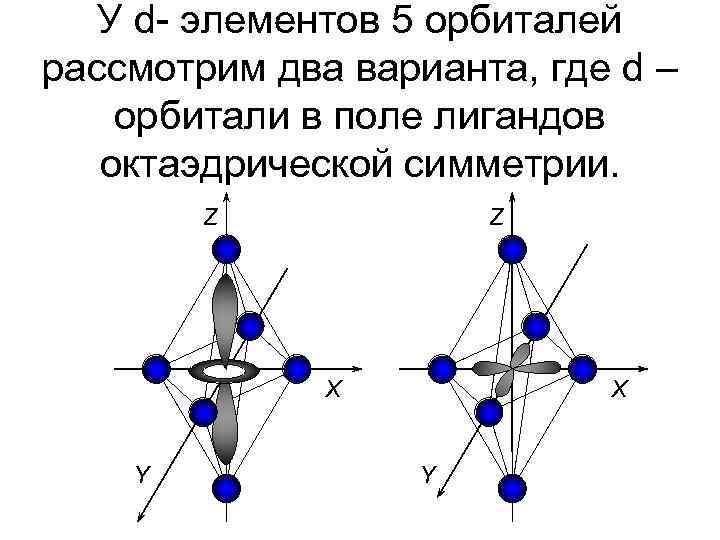
У d- элементов 5 орбиталей рассмотрим два варианта, где d – орбитали в поле лигандов октаэдрической симметрии. Z Z X Y
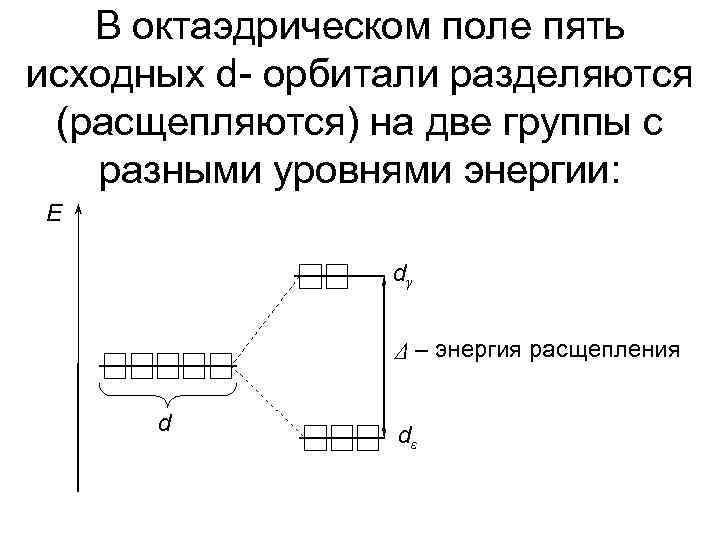
В октаэдрическом поле пять исходных d- орбитали разделяются (расщепляются) на две группы с разными уровнями энергии: E dγ Δ – энергия расщепления d dε

В порядке убывания энергии расщепления лиганды располагаются в следующем порядке:

Комплексообразование с участием комплексообразователя – Co 3+ Электронная структура Co 3+: E E dγ dγ Δ Δ dε d II dε

Распределение электронов происходит согласно квантовомеханическим принципам: • Электрон сначала заполняет уровни с минимальной энергией, соблюдая принципы Паули и Гунда. В первом комплексе четыре неспаренных электрона, поэтому ион парамагнитен (втягивается магнитным полем). Во втором комплексе все электроны спарены, поэтому ион диамагнитен (выталкивается магнитным полем).

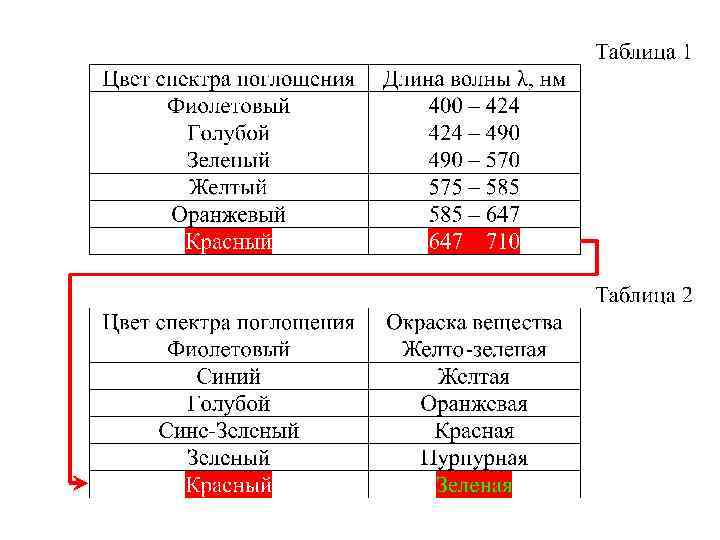
Для определения цвета иона используется соотношение:

Координационые соединения.ppt