5 контроль качества.ppt
- Количество слайдов: 38
 Контроль качества
Контроль качества
 Системы контроля качества производителей рассчитаны на то, чтобы обеспечить соответствие всех серий выпускаемых в продажу ЛС, соответствующим установленным спецификациям. Критерии качества в выпускаемых спецификациях должны быть достаточно жесткими, чтобы гарантировать соответствие каждого отобранного от серии индивидуального образца всем официальным требованиям - от момента производства и до окончания срока годности. Организация контроля качества ЛС, производимых в Российской Федерации и ввозимых из-за границы, входит в компетенцию Министерства здравоохранения Российской Федерации как высшего органа государственного управления в области здравоохранения.
Системы контроля качества производителей рассчитаны на то, чтобы обеспечить соответствие всех серий выпускаемых в продажу ЛС, соответствующим установленным спецификациям. Критерии качества в выпускаемых спецификациях должны быть достаточно жесткими, чтобы гарантировать соответствие каждого отобранного от серии индивидуального образца всем официальным требованиям - от момента производства и до окончания срока годности. Организация контроля качества ЛС, производимых в Российской Федерации и ввозимых из-за границы, входит в компетенцию Министерства здравоохранения Российской Федерации как высшего органа государственного управления в области здравоохранения.
 Государственный контроль при обращении лекарственных средств осуществляется посредством: 1) проведения проверок соблюдения субъектами обращения лекарственных средств … правил организации производства и контроля качества лекарственных средств; 2) лицензирования производства лекарственных средств и фармацевтической деятельности, проведения проверок соблюдения лицензионных требований и условий; 3) контроля качества лекарственных средств при гражданском обороте: а) в форме выборочного контроля; б) при выявлении несоответствия лицензионным требованиям и условиям условий производства и контроля качества лекарственных средств; 4) выдачи разрешений на ввоз лекарственных средств на территорию Российской Федерации; 5) проведения мониторинга безопасности лекарственных препаратов. 61 ФЗ, глава 4, статья 9.
Государственный контроль при обращении лекарственных средств осуществляется посредством: 1) проведения проверок соблюдения субъектами обращения лекарственных средств … правил организации производства и контроля качества лекарственных средств; 2) лицензирования производства лекарственных средств и фармацевтической деятельности, проведения проверок соблюдения лицензионных требований и условий; 3) контроля качества лекарственных средств при гражданском обороте: а) в форме выборочного контроля; б) при выявлении несоответствия лицензионным требованиям и условиям условий производства и контроля качества лекарственных средств; 4) выдачи разрешений на ввоз лекарственных средств на территорию Российской Федерации; 5) проведения мониторинга безопасности лекарственных препаратов. 61 ФЗ, глава 4, статья 9.
 Государственный контроль качества ЛС Образцы ЛС для проведения выборочного и повторного выборочного контроля качества отбираются специалистами Минздрава России и (или) учреждений, входящих в государственную систему контроля качества, эффективности, безопасности ЛС, на основании решения Минздрава России. Отбор образцов отечественных ЛС для выборочного контроля их качества осуществляется с участием представителей отдела контроля качества, повторного выборочного контроля качества ЛС - из архивных образцов ЛС ОКК предприятия-производителя. Отбор образцов ЛС на выборочный контроль качества может проводиться также при проверках предприятия-производителя с целью инспектирования качества ЛС. Отбор образцов зарубежных ЛС на выборочный контроль качества проводится со складов на территории Российской Федерации, указанных зарубежным предприятием-изготовителем. Минздрав России может передавать полномочия по отбору образцов ЛС территориальным органам контроля качества.
Государственный контроль качества ЛС Образцы ЛС для проведения выборочного и повторного выборочного контроля качества отбираются специалистами Минздрава России и (или) учреждений, входящих в государственную систему контроля качества, эффективности, безопасности ЛС, на основании решения Минздрава России. Отбор образцов отечественных ЛС для выборочного контроля их качества осуществляется с участием представителей отдела контроля качества, повторного выборочного контроля качества ЛС - из архивных образцов ЛС ОКК предприятия-производителя. Отбор образцов ЛС на выборочный контроль качества может проводиться также при проверках предприятия-производителя с целью инспектирования качества ЛС. Отбор образцов зарубежных ЛС на выборочный контроль качества проводится со складов на территории Российской Федерации, указанных зарубежным предприятием-изготовителем. Минздрав России может передавать полномочия по отбору образцов ЛС территориальным органам контроля качества.
 Контроль субстанций Государственный контроль качества веществ растительного, животного, микробного или синтетического происхождения, обладающих фармакологической активностью и предназначенных для производства ЛС проводится на этапе их регистрации, а также в рамках предварительного и выборочного контроля их качества как ЛС на основании решения Минздрава России в соответствии с вышеизложенными положениями (Приказ № 137 от 04. 2003). Экспертизе качества подлежат все субстанции на этапе их регистрации, а также субстанции, ввозимые на территорию Российской Федерации и предназначенные для изготовления ЛС (Приказ № 137 от 04. 2003).
Контроль субстанций Государственный контроль качества веществ растительного, животного, микробного или синтетического происхождения, обладающих фармакологической активностью и предназначенных для производства ЛС проводится на этапе их регистрации, а также в рамках предварительного и выборочного контроля их качества как ЛС на основании решения Минздрава России в соответствии с вышеизложенными положениями (Приказ № 137 от 04. 2003). Экспертизе качества подлежат все субстанции на этапе их регистрации, а также субстанции, ввозимые на территорию Российской Федерации и предназначенные для изготовления ЛС (Приказ № 137 от 04. 2003).
 Концепция обеспечения качества и контроль качества представляют собой взаимосвязанные аспекты управления качеством
Концепция обеспечения качества и контроль качества представляют собой взаимосвязанные аспекты управления качеством
 Отдел контроля качества (ОКК) лекарственных средств - функции и задачи Контроль качества мероприятия по обеспечению качества, позволяющие определить количественные и качественные показатели свойств и характеристик лекарственных средств.
Отдел контроля качества (ОКК) лекарственных средств - функции и задачи Контроль качества мероприятия по обеспечению качества, позволяющие определить количественные и качественные показатели свойств и характеристик лекарственных средств.
 Отдел контроля качества (ОКК) лекарственных средств - функции и задачи Контроль качества мероприятия по обеспечению качества, позволяющие определить количественные и качественные показатели свойств и характеристик лекарственных средств.
Отдел контроля качества (ОКК) лекарственных средств - функции и задачи Контроль качества мероприятия по обеспечению качества, позволяющие определить количественные и качественные показатели свойств и характеристик лекарственных средств.
 Главный принцип- независимость контроля качества современного менеджмента от производства Подсистема контроля показателей качества функционирует на предприятии в форме отдела контроля качества (ОКК), который осуществляет контроля сырья и материалов, полупродуктов, производственного процесса, персонала, окружающей среды и готового продукта.
Главный принцип- независимость контроля качества современного менеджмента от производства Подсистема контроля показателей качества функционирует на предприятии в форме отдела контроля качества (ОКК), который осуществляет контроля сырья и материалов, полупродуктов, производственного процесса, персонала, окружающей среды и готового продукта.

 Общие положения _ _ На каждом предприятии-изготовителе должен быть отдел контроля качества, независимый от других подразделений. Руководитель этого отдела должен иметь необходимый опыт и квалификацию. К отделу контроля качества относятся одна или несколько контрольных лабораторий. Для выполнения своих функций отдел должен быть обеспечен всеми необходимыми ресурсами. На отдел возлагаются также обязанности по разработке, аттестации (испытаниям), внедрению всех инструкций (методик) по контролю качества; хранению контрольных образцов материалов и продукции; контролю правильности маркировки упаковок с материалами и продукцией; обеспечению контроля стабильности продукции; участию в расследовании рекламаций, связанных с качеством продукции, и т. п.
Общие положения _ _ На каждом предприятии-изготовителе должен быть отдел контроля качества, независимый от других подразделений. Руководитель этого отдела должен иметь необходимый опыт и квалификацию. К отделу контроля качества относятся одна или несколько контрольных лабораторий. Для выполнения своих функций отдел должен быть обеспечен всеми необходимыми ресурсами. На отдел возлагаются также обязанности по разработке, аттестации (испытаниям), внедрению всех инструкций (методик) по контролю качества; хранению контрольных образцов материалов и продукции; контролю правильности маркировки упаковок с материалами и продукцией; обеспечению контроля стабильности продукции; участию в расследовании рекламаций, связанных с качеством продукции, и т. п.
 Общие положения (продолжение) _ _ _ Все эти функции должны выполняться в соответствии с утвержденными инструкциями с оформлением протоколов (при необходимости). При оценке качества готовой продукции следует рассматривать все сопутствующие факторы, в т. ч. условия производства, результаты внутрипроизводственного контроля, анализ производственной документации (в т. ч. документации на упаковку), соответствие спецификациям на готовую продукцию и состояние окончательной упаковки готовой продукции. Сотрудники отдела контроля качества, должны иметь доступ в производственные зоны для отбора проб и проведения анализов.
Общие положения (продолжение) _ _ _ Все эти функции должны выполняться в соответствии с утвержденными инструкциями с оформлением протоколов (при необходимости). При оценке качества готовой продукции следует рассматривать все сопутствующие факторы, в т. ч. условия производства, результаты внутрипроизводственного контроля, анализ производственной документации (в т. ч. документации на упаковку), соответствие спецификациям на готовую продукцию и состояние окончательной упаковки готовой продукции. Сотрудники отдела контроля качества, должны иметь доступ в производственные зоны для отбора проб и проведения анализов.
 Документация Ø Ø Ø Ø К документации по контролю качества относятся: - спецификации; - методики отбора проб; - методики и протоколы проведения испытаний (в т. ч. аналитические операционные листы и/или лабораторные журналы); - аналитические отчеты и/или паспорта; - результаты контроля окружающей среды в производственных помещениях; - протоколы аттестации (испытаний) аналитических методов; - методики и протоколы калибровки (поверки) приборов и обслуживания аппаратуры.
Документация Ø Ø Ø Ø К документации по контролю качества относятся: - спецификации; - методики отбора проб; - методики и протоколы проведения испытаний (в т. ч. аналитические операционные листы и/или лабораторные журналы); - аналитические отчеты и/или паспорта; - результаты контроля окружающей среды в производственных помещениях; - протоколы аттестации (испытаний) аналитических методов; - методики и протоколы калибровки (поверки) приборов и обслуживания аппаратуры.
 Документация Ø Ø Ø Документация по контролю качества, относящаяся к протоколам серий продукции, должна храниться в течение одного года после истечения срока годности серии и в течение не менее пяти лет после подтверждения уполномоченным лицом ее соответствия установленным требованиям. Для некоторых данных (например, результатов аналитических испытаний, выходов готовой продукции, параметров окружающей среды и т. п. ) целесообразно хранить протоколы в виде, позволяющем оценивать тенденции изменения параметров. В дополнение к протоколам на серии продукции следует хранить в доступном виде и другую первичную информацию (например, лабораторные журналы и/или протоколы).
Документация Ø Ø Ø Документация по контролю качества, относящаяся к протоколам серий продукции, должна храниться в течение одного года после истечения срока годности серии и в течение не менее пяти лет после подтверждения уполномоченным лицом ее соответствия установленным требованиям. Для некоторых данных (например, результатов аналитических испытаний, выходов готовой продукции, параметров окружающей среды и т. п. ) целесообразно хранить протоколы в виде, позволяющем оценивать тенденции изменения параметров. В дополнение к протоколам на серии продукции следует хранить в доступном виде и другую первичную информацию (например, лабораторные журналы и/или протоколы).
 Отбор проб должен проводиться в соответствии с утвержденными инструкциями, включающими в себя: - методику отбора проб; - перечень используемого оборудования; - количество проб, которое должно быть отобрано; - инструкции по разделению отобранной пробы на части (при необходимости); - тип и характеристики тары для отбора проб; - нанесение маркировки на тару с отобранными пробами; - специальные меры предосторожности, особенно в отношении стерильных и опасных веществ; - условия хранения; - инструкции по очистке и хранению оборудования для отбора проб.
Отбор проб должен проводиться в соответствии с утвержденными инструкциями, включающими в себя: - методику отбора проб; - перечень используемого оборудования; - количество проб, которое должно быть отобрано; - инструкции по разделению отобранной пробы на части (при необходимости); - тип и характеристики тары для отбора проб; - нанесение маркировки на тару с отобранными пробами; - специальные меры предосторожности, особенно в отношении стерильных и опасных веществ; - условия хранения; - инструкции по очистке и хранению оборудования для отбора проб.
 Отбор проб Отобранные контрольные образцы должны представлять собой представительную выборку серии материалов или продукции. Возможен отбор проб, характеризующих критические стадии технологического процесса (например, его начало или окончание). На маркировке тары с отобранными пробами должны быть указаны ее содержимое, даты отбора проб, а также обозначение упаковки, из которой эти пробы были отобраны.
Отбор проб Отобранные контрольные образцы должны представлять собой представительную выборку серии материалов или продукции. Возможен отбор проб, характеризующих критические стадии технологического процесса (например, его начало или окончание). На маркировке тары с отобранными пробами должны быть указаны ее содержимое, даты отбора проб, а также обозначение упаковки, из которой эти пробы были отобраны.
 Проведение испытаний k Аналитические методики должны быть аттестованы. Все испытания, приведенные в нормативной документации, должны быть проведены в соответствии с утвержденными методиками. k Полученные результаты испытаний должны быть оформлены документально с тщательной проверкой всех внесенных данных. Все расчеты следует тщательно проверять.
Проведение испытаний k Аналитические методики должны быть аттестованы. Все испытания, приведенные в нормативной документации, должны быть проведены в соответствии с утвержденными методиками. k Полученные результаты испытаний должны быть оформлены документально с тщательной проверкой всех внесенных данных. Все расчеты следует тщательно проверять.
 Проведение испытаний Проводимые испытания следует оформлять документально с указанием: k a) наименования материала или продукции и, при необходимости, лекарственной формы; k b) номера серии и, при необходимости, наименования производителя и/или поставщика; k c) ссылки на соответствующие спецификации и методики испытаний; k d) результатов испытаний, в т. ч. наблюдения, вычисления и ссылки на все протоколы проведенных анализов; k e) даты проведения испытаний; k f) фамилий и инициалов лиц, проводивших испытание; k g) фамилий и инициалов лиц, подтвердивших проведение испытаний и результаты вычислений; k h) четкого заключения о выдаче разрешения или отклонении продукции (или другого решения о статусе продукции), даты и подписи ответственного лица.
Проведение испытаний Проводимые испытания следует оформлять документально с указанием: k a) наименования материала или продукции и, при необходимости, лекарственной формы; k b) номера серии и, при необходимости, наименования производителя и/или поставщика; k c) ссылки на соответствующие спецификации и методики испытаний; k d) результатов испытаний, в т. ч. наблюдения, вычисления и ссылки на все протоколы проведенных анализов; k e) даты проведения испытаний; k f) фамилий и инициалов лиц, проводивших испытание; k g) фамилий и инициалов лиц, подтвердивших проведение испытаний и результаты вычислений; k h) четкого заключения о выдаче разрешения или отклонении продукции (или другого решения о статусе продукции), даты и подписи ответственного лица.
 Проведение испытаний k k k Все операции по внутрипроизводственному контролю, в т. ч. операции, выполняемые лицами, непосредственно работающими в производственных зонах, должны проводиться в соответствии с методиками, утвержденными отделом контроля качества, а их результаты должны быть оформлены документально. Особое внимание следует уделять качеству лабораторных реактивов, мерной лабораторной посуды и титрованных растворов, стандартных образцов и питательных сред. Их приготовление и подготовка должны соответствовать требованиям инструкций, утвержденных в установленном порядке. Реактивы, предназначенные для длительного использования, должны иметь маркировку с указанием даты приготовления и с подписями исполнителей. На этикетке должен быть указан срок годности нестабильных реактивов, питательных сред и специфические условия их хранения. Для титрованных растворов следует указывать дату последнего установления титра и соответствующий поправочный коэффициент.
Проведение испытаний k k k Все операции по внутрипроизводственному контролю, в т. ч. операции, выполняемые лицами, непосредственно работающими в производственных зонах, должны проводиться в соответствии с методиками, утвержденными отделом контроля качества, а их результаты должны быть оформлены документально. Особое внимание следует уделять качеству лабораторных реактивов, мерной лабораторной посуды и титрованных растворов, стандартных образцов и питательных сред. Их приготовление и подготовка должны соответствовать требованиям инструкций, утвержденных в установленном порядке. Реактивы, предназначенные для длительного использования, должны иметь маркировку с указанием даты приготовления и с подписями исполнителей. На этикетке должен быть указан срок годности нестабильных реактивов, питательных сред и специфические условия их хранения. Для титрованных растворов следует указывать дату последнего установления титра и соответствующий поправочный коэффициент.
 Проведение испытаний k k При необходимости на таре следует указывать дату получения каждого вещества, используемого для проведения испытаний (например, реактивов и стандартных образцов) с соответствующими инструкциями по их использованию и хранению. В некоторых случаях после получения или перед использованием реактива может возникнуть необходимость проведения его испытания на подлинность и/или другого испытания. Животных, используемых для контроля компонентов, материалов или продукции, следует, при необходимости, помещать в карантин перед началом работы с ними. Уход за животными и контроль за ними должны быть организованы так, чтобы обеспечить их пригодность к использованию по назначению. Животные должны быть маркированы, а истории работы с ними должны быть оформлены документально.
Проведение испытаний k k При необходимости на таре следует указывать дату получения каждого вещества, используемого для проведения испытаний (например, реактивов и стандартных образцов) с соответствующими инструкциями по их использованию и хранению. В некоторых случаях после получения или перед использованием реактива может возникнуть необходимость проведения его испытания на подлинность и/или другого испытания. Животных, используемых для контроля компонентов, материалов или продукции, следует, при необходимости, помещать в карантин перед началом работы с ними. Уход за животными и контроль за ними должны быть организованы так, чтобы обеспечить их пригодность к использованию по назначению. Животные должны быть маркированы, а истории работы с ними должны быть оформлены документально.
 Программа последующих испытаний стабильности + После реализации лекарственного средства следует систематически проводить испытания его стабильности по программе, позволяющей обнаруживать любые изменения, имеющие отношение к стабильности (например, изменение уровня загрязнения или характера раствора) в соответствии с рецептурой реализованного продукта. + Целью программы последующих испытаний стабильности является контроль самого продукта в течение его срока годности и установление того, что продукт соответствует (может быть признан соответствующим) спецификации при условиях хранения, указанных в маркировке.
Программа последующих испытаний стабильности + После реализации лекарственного средства следует систематически проводить испытания его стабильности по программе, позволяющей обнаруживать любые изменения, имеющие отношение к стабильности (например, изменение уровня загрязнения или характера раствора) в соответствии с рецептурой реализованного продукта. + Целью программы последующих испытаний стабильности является контроль самого продукта в течение его срока годности и установление того, что продукт соответствует (может быть признан соответствующим) спецификации при условиях хранения, указанных в маркировке.
 Программа последующих испытаний стабильности + Вышеуказанные требования относятся, главным образом, к готовым лекарственным средствам в упаковке, предназначенной для продажи, но следует также обратить внимание на включение в методику нерасфасованной продукции. Например, если нерасфасованную продукцию хранят длительное время до упаковки и/или передачи с производственного участка на участок упаковки, то следует изучить и оценить влияние этого фактора на стабильность готовой продукции при соответствующих параметрах окружающей среды. Более того, следует обратить внимание на промежуточную продукцию, которая хранится и используется в течение длительного периода. Исследование стабильности переработанных продуктов проводят при разработке лекарственного средства; последующего контроля стабильности такого продукта не требуется. Однако, при необходимости, может проводиться контроль стабильности переработанного продукта.
Программа последующих испытаний стабильности + Вышеуказанные требования относятся, главным образом, к готовым лекарственным средствам в упаковке, предназначенной для продажи, но следует также обратить внимание на включение в методику нерасфасованной продукции. Например, если нерасфасованную продукцию хранят длительное время до упаковки и/или передачи с производственного участка на участок упаковки, то следует изучить и оценить влияние этого фактора на стабильность готовой продукции при соответствующих параметрах окружающей среды. Более того, следует обратить внимание на промежуточную продукцию, которая хранится и используется в течение длительного периода. Исследование стабильности переработанных продуктов проводят при разработке лекарственного средства; последующего контроля стабильности такого продукта не требуется. Однако, при необходимости, может проводиться контроль стабильности переработанного продукта.
 Программа последующих испытаний стабильности Отчет о работе по программе последующих испытаний стабильности должен включать в себя весь период до истечения срока годности продукции и содержать следующие данные (но не ограничиваться ими): + - номера серий для различных показателей эффективности и размеров серий, если требуется; + - данные о физических, химических, микробиологических и биологических методах испытаний; + - критерии приемлемости; + - ссылки на методы испытаний; + - описание упаковки и системы укупоривания; + - периодичность испытаний (даты); + - описание условий хранения (следует использовать стандартные условия ICH при длительных испытаниях, соответствующих данным маркировки); + - другие показатели, относящиеся к данному лекарственному средству. n 6. 28 Отчет о работе по программе последующих испытаний
Программа последующих испытаний стабильности Отчет о работе по программе последующих испытаний стабильности должен включать в себя весь период до истечения срока годности продукции и содержать следующие данные (но не ограничиваться ими): + - номера серий для различных показателей эффективности и размеров серий, если требуется; + - данные о физических, химических, микробиологических и биологических методах испытаний; + - критерии приемлемости; + - ссылки на методы испытаний; + - описание упаковки и системы укупоривания; + - периодичность испытаний (даты); + - описание условий хранения (следует использовать стандартные условия ICH при длительных испытаниях, соответствующих данным маркировки); + - другие показатели, относящиеся к данному лекарственному средству. n 6. 28 Отчет о работе по программе последующих испытаний
 Программа последующих испытаний стабильности + + Отчет о работе по программе последующих испытаний стабильности может отличаться от отчета о первоначальном длительном испытании стабильности, прилагаемому к досье на продукт. Эти отличия должны быть указаны в отчете (например, периодичность контроля или проведение его в соответствии с рекомендациями ICH). Число серий и периодичность испытаний должны обеспечивать достаточный объем данных для проведения анализа тенденций изменения. Если не указано иное, то в программу испытаний стабильности следует включить не менее одной серии произведенной продукции за год для каждого значения эффективности и вида первичной упаковки (если они различаются). Исключением являются случаи, когда в течение года данный продукт не выпускался. Для продуктов, последующие испытания стабильности которых требуют использования животных и не существует альтернативного аттестованного метода, периодичность контроля может быть установлена с использованием анализа рисков. При наличии в отчете обоснования может использоваться принцип вынесения за скобки и построения матриц.
Программа последующих испытаний стабильности + + Отчет о работе по программе последующих испытаний стабильности может отличаться от отчета о первоначальном длительном испытании стабильности, прилагаемому к досье на продукт. Эти отличия должны быть указаны в отчете (например, периодичность контроля или проведение его в соответствии с рекомендациями ICH). Число серий и периодичность испытаний должны обеспечивать достаточный объем данных для проведения анализа тенденций изменения. Если не указано иное, то в программу испытаний стабильности следует включить не менее одной серии произведенной продукции за год для каждого значения эффективности и вида первичной упаковки (если они различаются). Исключением являются случаи, когда в течение года данный продукт не выпускался. Для продуктов, последующие испытания стабильности которых требуют использования животных и не существует альтернативного аттестованного метода, периодичность контроля может быть установлена с использованием анализа рисков. При наличии в отчете обоснования может использоваться принцип вынесения за скобки и построения матриц.
 Программа последующих испытаний стабильности + + В некоторых случаях в последующие испытания стабильности следует включать дополнительные серии. Например, последующие испытания стабильности следует проводить после любых существенных изменений или существенных отклонений в технологическом процессе или упаковке. Это же относится и к любым операциям по повторной обработке, переработке или регенерации. Результаты последующих испытаний стабильности должны быть доступны руководящим работникам, особенно уполномоченному лицу (лицам). Если последующие испытания стабильности проводят не на месте производства нерасфасованной или готовой продукции, то между участвующими сторонами должно быть оформлено письменное соглашение. Результаты последующих испытаний стабильности должны находиться на месте производства для представления надзорным органам. Следует анализировать случаи выхода за пределы спецификации и существенные необычные тенденции. Любой подтвержденный выход за пределы спецификации или существенные негативные тенденции должны доводиться до сведения надзорных органов. Следует документально оформлять и дополнять заключения по всем полученным данным, включая промежуточные выводы. Указанное заключение следует периодически рассматривать.
Программа последующих испытаний стабильности + + В некоторых случаях в последующие испытания стабильности следует включать дополнительные серии. Например, последующие испытания стабильности следует проводить после любых существенных изменений или существенных отклонений в технологическом процессе или упаковке. Это же относится и к любым операциям по повторной обработке, переработке или регенерации. Результаты последующих испытаний стабильности должны быть доступны руководящим работникам, особенно уполномоченному лицу (лицам). Если последующие испытания стабильности проводят не на месте производства нерасфасованной или готовой продукции, то между участвующими сторонами должно быть оформлено письменное соглашение. Результаты последующих испытаний стабильности должны находиться на месте производства для представления надзорным органам. Следует анализировать случаи выхода за пределы спецификации и существенные необычные тенденции. Любой подтвержденный выход за пределы спецификации или существенные негативные тенденции должны доводиться до сведения надзорных органов. Следует документально оформлять и дополнять заключения по всем полученным данным, включая промежуточные выводы. Указанное заключение следует периодически рассматривать.
 В соответствии с требованиями национального стандарта ГОСТ Р 52249 -2009, персонал ОКК должен обладать необходимой квалификацией и достаточным опытом и его численностью определяется объемом работы, рассчитанным на год. Как показывает мировой опыт, персонал ОКК составлен обычно 10 -15% штатной численности предприятия в целом
В соответствии с требованиями национального стандарта ГОСТ Р 52249 -2009, персонал ОКК должен обладать необходимой квалификацией и достаточным опытом и его численностью определяется объемом работы, рассчитанным на год. Как показывает мировой опыт, персонал ОКК составлен обычно 10 -15% штатной численности предприятия в целом
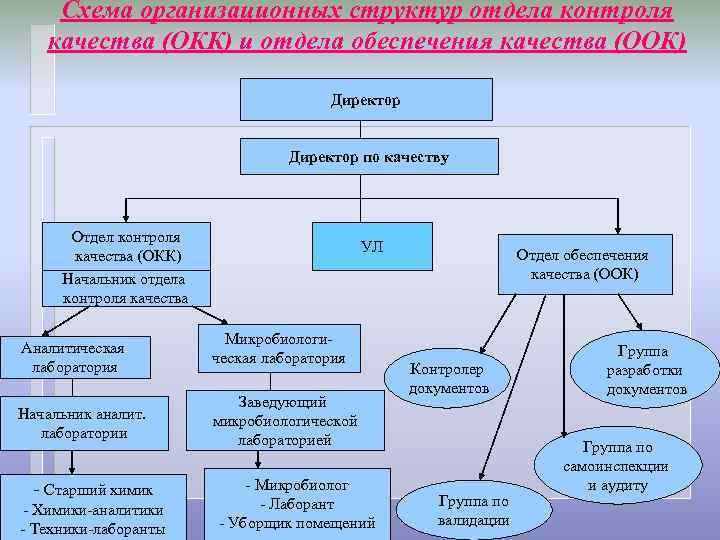 Схема организационных структур отдела контроля качества (ОКК) и отдела обеспечения качества (ООК) Директор по качеству Отдел контроля качества (ОКК) Начальник отдела контроля качества Аналитическая лаборатория Начальник аналит. лаборатории - Старший химик - Химики-аналитики - Техники-лаборанты УЛ Микробиологическая лаборатория Заведующий микробиологической лабораторией - Микробиолог - Лаборант - Уборщик помещений Отдел обеспечения качества (ООК) Контролер документов Группа по валидации Группа разработки документов Группа по самоинспекции и аудиту
Схема организационных структур отдела контроля качества (ОКК) и отдела обеспечения качества (ООК) Директор по качеству Отдел контроля качества (ОКК) Начальник отдела контроля качества Аналитическая лаборатория Начальник аналит. лаборатории - Старший химик - Химики-аналитики - Техники-лаборанты УЛ Микробиологическая лаборатория Заведующий микробиологической лабораторией - Микробиолог - Лаборант - Уборщик помещений Отдел обеспечения качества (ООК) Контролер документов Группа по валидации Группа разработки документов Группа по самоинспекции и аудиту
 В соответствии с приказом Росздравнадзора № 65 -Пр/04 от 23 августа 2004 г, ОКК предприятийпроизводителей ЛС подлежат аттестации. Аттестация ОКК является, официальным признанием технической компетентности лабораторий ОКК в проведении работ в области контроля качества ЛС в соответствии с требованиями действующих стандартов (ГФ, ФСП и. т. д. )
В соответствии с приказом Росздравнадзора № 65 -Пр/04 от 23 августа 2004 г, ОКК предприятийпроизводителей ЛС подлежат аттестации. Аттестация ОКК является, официальным признанием технической компетентности лабораторий ОКК в проведении работ в области контроля качества ЛС в соответствии с требованиями действующих стандартов (ГФ, ФСП и. т. д. )
 ГОСТ ИСО/МЭК 17025 -2009 Общие требования к компетентности испытательных лабораторий
ГОСТ ИСО/МЭК 17025 -2009 Общие требования к компетентности испытательных лабораторий
 Объективность и надежность оценки объектов контроля зависит от: -применяемых методов испытаний; -компетентности лабораторий, выполняющих контроль.
Объективность и надежность оценки объектов контроля зависит от: -применяемых методов испытаний; -компетентности лабораторий, выполняющих контроль.
 Условие доверия к результатам аккредитация лабораторий, основаная на гармонизации требований к деятельности лабораторий и оценки их технической компетентности.
Условие доверия к результатам аккредитация лабораторий, основаная на гармонизации требований к деятельности лабораторий и оценки их технической компетентности.
 Аккредитация – официальное признание органом по аккредитации компетентности физического или юридического лица выполнять работы в определенной области оценки соответствия (ФЗ «О техническом регулировании, ст. 2)
Аккредитация – официальное признание органом по аккредитации компетентности физического или юридического лица выполнять работы в определенной области оценки соответствия (ФЗ «О техническом регулировании, ст. 2)
 Основные документы по аккредитации испытательных лабораторий и требованиям к их деятельности n ГОСТ ИСО/МЭК 17025 -2009 «Общие требования к компетентности испытательных и калибровочных лабораторий» n ГОСТ Р 51000. 4 -2008 «Общие требования к аккредитации испытательных лабораторий» n Серия стандартов ГОСТ Р ИСО 5725 -(1 -6) -2002 «Точность (правильность и прецизионность) методов и результатов измерений» n ГОСТ Р 8. 563 -96 ГСИ. «Методики выполнения измерений»
Основные документы по аккредитации испытательных лабораторий и требованиям к их деятельности n ГОСТ ИСО/МЭК 17025 -2009 «Общие требования к компетентности испытательных и калибровочных лабораторий» n ГОСТ Р 51000. 4 -2008 «Общие требования к аккредитации испытательных лабораторий» n Серия стандартов ГОСТ Р ИСО 5725 -(1 -6) -2002 «Точность (правильность и прецизионность) методов и результатов измерений» n ГОСТ Р 8. 563 -96 ГСИ. «Методики выполнения измерений»
 ГОСТ ИСО/МЭК 17025 -2009 Предмет стандарта • общие требования к компетентности осуществлять испытания и калибровки, включая отбор образцов нормированными или ненормированными методами; • относится ко всем организациям, осуществляющим испытания или калибровки; • развитие системы менеджмента, ориентированного на качество, административную и техническую деятельности; • не рассматривает соответствие с правовыми требованиями безопасности; и требованиями • выполнение принципов стандарта ISO 9001; • оценка, подтверждение и признание компетентности
ГОСТ ИСО/МЭК 17025 -2009 Предмет стандарта • общие требования к компетентности осуществлять испытания и калибровки, включая отбор образцов нормированными или ненормированными методами; • относится ко всем организациям, осуществляющим испытания или калибровки; • развитие системы менеджмента, ориентированного на качество, административную и техническую деятельности; • не рассматривает соответствие с правовыми требованиями безопасности; и требованиями • выполнение принципов стандарта ISO 9001; • оценка, подтверждение и признание компетентности
 ГОСТ ИСО/МЭК 17025 -2009 Содержание 1. Область применения 2. Нормативные ссылки 3. Термины и определения 4. Требования к менеджменту 5. Технические требования Основные изменения по сравнению с ГОСТ Р ИСО/МЭК 17025 -2000 -по тексту : «система качества» заменена на «система менеджмента качества» -Введен пункт 4. 10 Улучшение -Актуализирована НД в ссылках и библиографии
ГОСТ ИСО/МЭК 17025 -2009 Содержание 1. Область применения 2. Нормативные ссылки 3. Термины и определения 4. Требования к менеджменту 5. Технические требования Основные изменения по сравнению с ГОСТ Р ИСО/МЭК 17025 -2000 -по тексту : «система качества» заменена на «система менеджмента качества» -Введен пункт 4. 10 Улучшение -Актуализирована НД в ссылках и библиографии
 ГОСТ ИСО/МЭК 17025 -2009 Содержание стандарта (основное) Требования к менеджменту Технические требования
ГОСТ ИСО/МЭК 17025 -2009 Содержание стандарта (основное) Требования к менеджменту Технические требования
 ГОСТ ИСО/МЭК 17025 -2009 n Требования к менеджменту n 4. 1 n n n n Организация 4. 2 Система менеджмента 4. 3 Управление документацией 4. 4 Анализ запросов, предложений и контрактов 4. 5 Субподряды испытаний и калибровок 4. 6 Покупка услуг и запасов 4. 7 Обслуживание заказчика 4. 8 Претензии 4. 9 Управление несоответствующей работой при испытании/калибровке 4. 10 Улучшение 4. 11 Корректирующие действия 4. 12 Предупреждающие действия 4. 13 Управление регистрацией данных 4. 14 Внутренние проверки 4. 15 Анализ со стороны руководства
ГОСТ ИСО/МЭК 17025 -2009 n Требования к менеджменту n 4. 1 n n n n Организация 4. 2 Система менеджмента 4. 3 Управление документацией 4. 4 Анализ запросов, предложений и контрактов 4. 5 Субподряды испытаний и калибровок 4. 6 Покупка услуг и запасов 4. 7 Обслуживание заказчика 4. 8 Претензии 4. 9 Управление несоответствующей работой при испытании/калибровке 4. 10 Улучшение 4. 11 Корректирующие действия 4. 12 Предупреждающие действия 4. 13 Управление регистрацией данных 4. 14 Внутренние проверки 4. 15 Анализ со стороны руководства
 ГОСТ ИСО/МЭК 17025 -2009 n Технические требования n 5. 1 Общие положения n 5. 2 Персонал 5. 3 Помещения и условия окружающей среды 5. 4 Методы испытаний и калибровок , их валидация 5. 5 Оборудование 5. 6 Прослеживаемость измерений 5. 7 Отбор образцов 5. 8 Обращение с испытуемыми и калибруемыми образцами 5. 9 Обеспечение качества результатов испытаний и калибровок 5. 10 Представление результатов n n n n
ГОСТ ИСО/МЭК 17025 -2009 n Технические требования n 5. 1 Общие положения n 5. 2 Персонал 5. 3 Помещения и условия окружающей среды 5. 4 Методы испытаний и калибровок , их валидация 5. 5 Оборудование 5. 6 Прослеживаемость измерений 5. 7 Отбор образцов 5. 8 Обращение с испытуемыми и калибруемыми образцами 5. 9 Обеспечение качества результатов испытаний и калибровок 5. 10 Представление результатов n n n n


