Концептуальная системы химии, основные законы.ppt
- Количество слайдов: 33

Концептуальная системы химии, основные законы У чебники: • Глинка Н. Л. Общая химия. 1970 -2007 гг. • Денисов В. В. Химия 2002 г. • Общая химия под ред. Киреева В. А. 1975 г. 1, 2 том. • Курс химии под редакцией Дмитриева Г. А. 1972 г. 1, 2 том.

Химия как наука • Менделеев Дмитрий Иванович: химия как наука есть в одно и тоже время – средство и цель; теория и практика. • главная задача химии – задача получения вещества с необходимыми свойствами.

Свойство веществ зависит от четырех факторов: • • от его элементарного и молекулярного состава; от структуры; от кинетических факторов (давление, температура, концентрация), в том числе и от природы реагентов; от высоты его химической организации (простые и сложные).
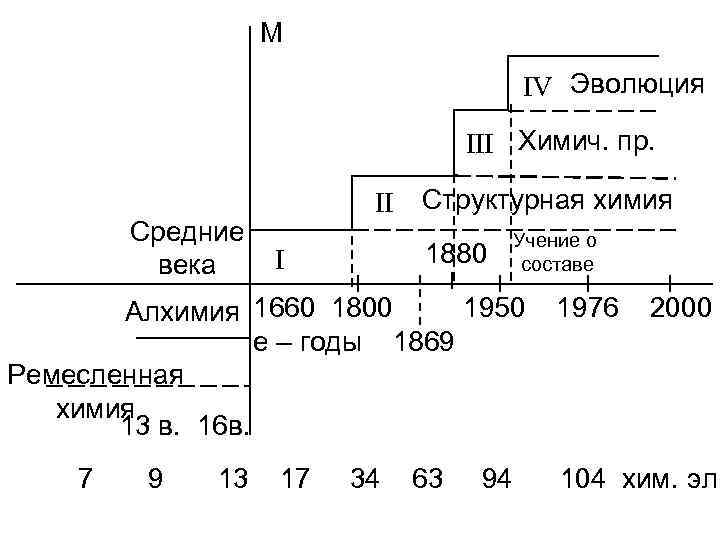
М IV Эволюция III Химич. пр. Средние века II Структурная химия 1880 I Учение о составе 1950 Алхимия 1660 1800 е – годы 1869 Ремесленная химия 13 в. 16 в. 7 9 13 17 34 63 94 1976 2000 104 хим. эл.

I эт. 1660 – Теория флогистона Шталь 1748 – Ан. Лавуазье Состав воздуха 1800 – Пруст О. Закон постоянства состава

II эт. 1802 – Петров В. Эл. Дуга 1802 -1811 – Дальтон ат. мол. Авогадро теория 1807 – Клеман, Дезори Катализ 1807 – Х. Деви Электролиз, катализ 1822 – [CO(NH 2)2] – синтез мочевины 1834 – М. Фарадей Законы электролиза 1861 – А. М. Бутлеров Теория химического строения 1869 – Д. И. Менделеев Периодический закон 1869 – Хайдат Пластмассы 1879 – А Федин – пиролиз нефти

III эт. 1884 – Ле-Шателье Принцип химического равновесия 1896 – Вернер Теория комплексных соединений 1896 – Беккерель явления р/о 1897 – Сабатье, Ипатьев Катализ органических соединений 1906 – Габбер Синтез NH 3 1915 – И. Андреев Синтез HNO 3 1918 – Резерфорд Превращение атомов 1928 – Семенов Н. И. Теория цепных реакций 1936 – Льюис Электролиз тяжелой воды 1940 – Петржак Деления ядер урана

Антуан Лавуазье изучал явление горения и установил: углерод – алмаз, сера, фосфор образуют при горении вещества по массе больше чем исходные. Виновником был кислород в воздухе. Он доказал, что вода это оксид водорода и получил водород из воды по реакции:

Свойства веществ определяются их составом Атомы любого химического элемента попадая в разные соединения иногда существенно изменяются. Например, водород в ряду: HCl, CH 4, H 2, Na. H • в молекуле - HCl H+ – катион; • в молекуле Na. H - H– – анион; • в молекуле CH 4 - H – прочно связан и в химическом отношении инертен.

Критерий для определения элемента Критерием общности всех атомов элемента – один и тот же заряд ядра. Химический элемент – совокупность лишь тех атомов, которые обладают одинаковым зарядом ядра, включая и изотопы, например: дейтерий, тритий соответственно.

Первая концепция химии в период 1660 – 1800 гг. Ряд основных количественных законов химии: 1. Закон сохранения массы М. В. Ломоносов, 1748 – 1756 гг. ; А. Лавуазье, 1777 г. 2. Закон постоянства состава (закон постоянных отношений) О. Пруст 1797 г. 3. Закон эквивалентных отношений И. Рихтер, 1792 г. 4. Закон кратных отношений Дж. Дальтон, 1803 г.
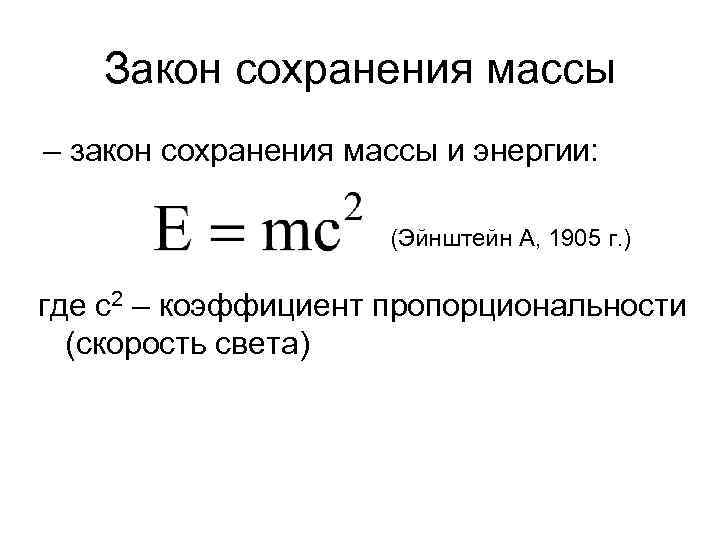
Закон сохранения массы – закон сохранения массы и энергии: (Эйнштейн А, 1905 г. ) где с2 – коэффициент пропорциональности (скорость света)
Поверхность твердого тела с некомпенсированными связями O O Si O (Si. O 2)n

Закон эквивалентов (И. Рихтер, 1792 г. ) где m 1, m 2 – масса реагирующих веществ, Э 1, Э 2 – соответственно их эквиваленты. Химический эквивалент элемента – это такое количество его атомов, которое полностью соединяется с 1 молем атомов водорода или замещает такое же количество водорода в его соединениях.

Применение закона эквивалентов Реакция: Молярная масса Химический эквивалента эквивалент А, моль , г/моль 1 моль атомов Cl 35, 5 ½ моль атомов S 32/2 = 16 1/ 14/3 = 4, 7 3 моль атомов N ¼ моль атомов C 12/4 = 3

Закон кратных отношений: Если химические элементы могут соединяться между собой, образуя несколько разных соединений, то масса элемента A, который связывается с постоянным количеством элемента B, относятся между собой, как небольшие целые числа.

Пример для закона кратных отношений: Оксиды азота Массы азота в этих соединениях относятся, как 5: 4: 3: 2: 1.
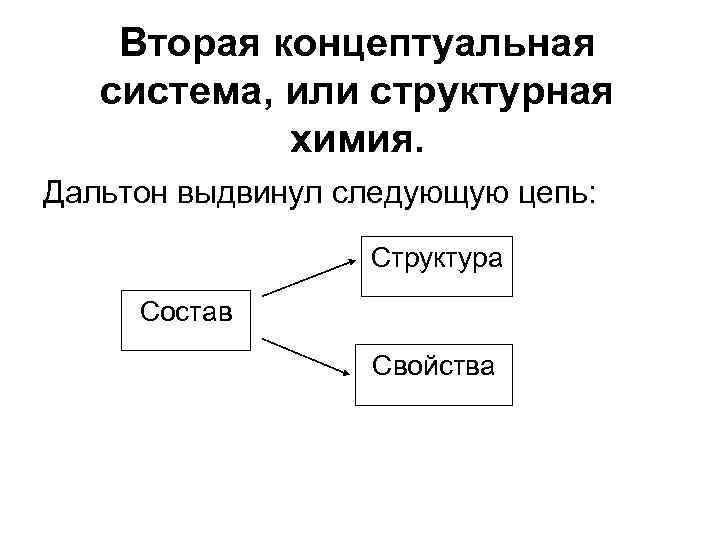
Вторая концептуальная система, или структурная химия. Дальтон выдвинул следующую цепь: Структура Состав Свойства
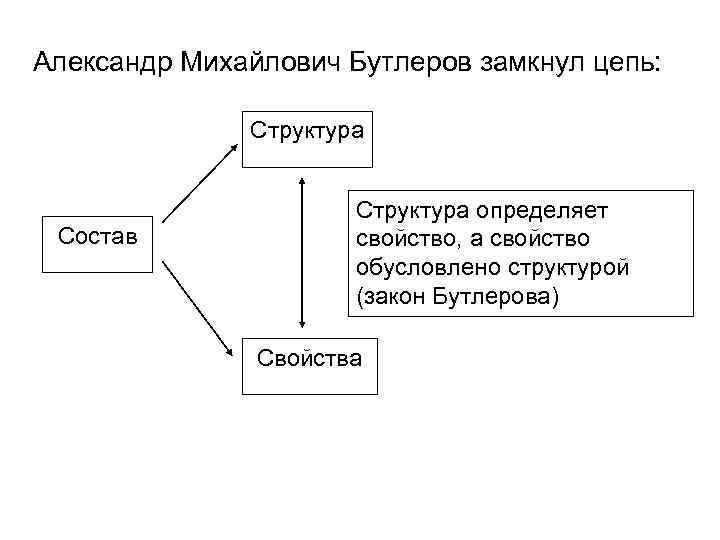
Александр Михайлович Бутлеров замкнул цепь: Структура Состав Структура определяет свойство, а свойство обусловлено структурой (закон Бутлерова) Свойства
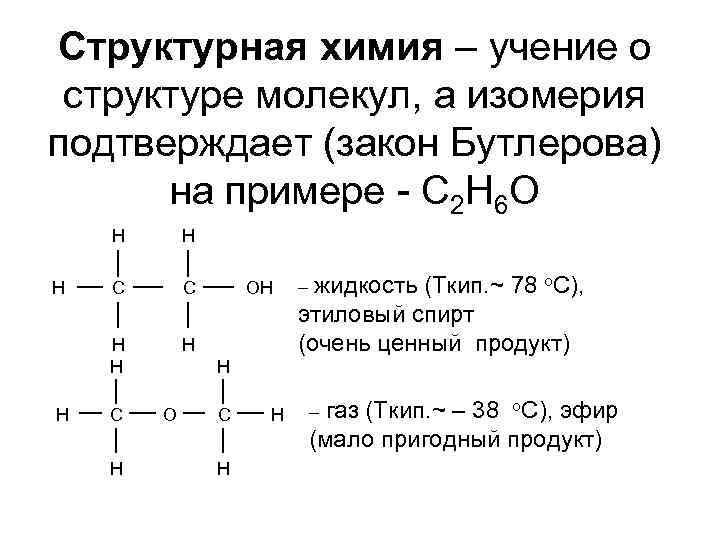
Структурная химия – учение о структуре молекул, а изомерия подтверждает (закон Бутлерова) на примере - C 2 H 6 O H H С С H H H С H OH жидкость (Tкип. ~ 78 o. C), этиловый спирт (очень ценный продукт) – H O С H H газ (Tкип. ~ – 38 o. C), эфир (мало пригодный продукт) –
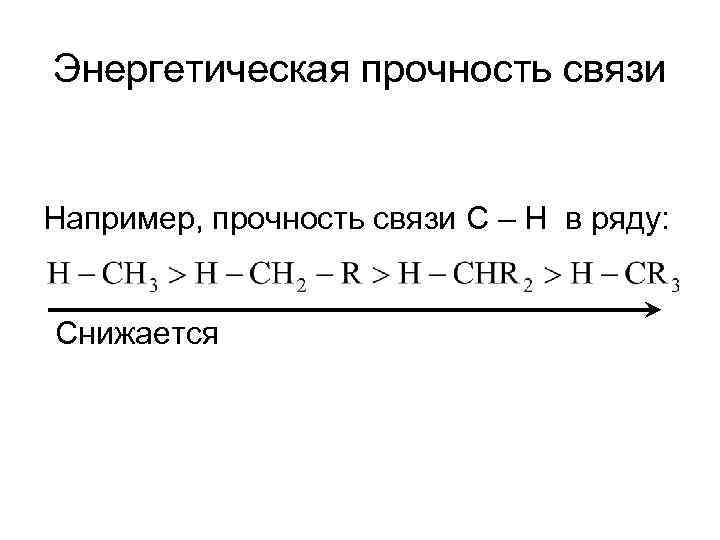
Энергетическая прочность связи Например, прочность связи C – H в ряду: Снижается

С развитием теории Бутлерова были открыты ряд функциональных групп:
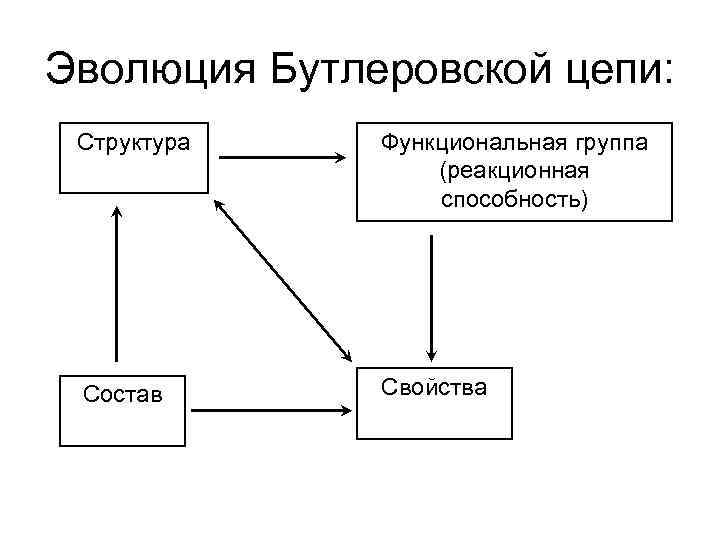
Эволюция Бутлеровской цепи: Структура Функциональная группа (реакционная способность) Состав Свойства

Третья концептуальная система – учение о химическом процессе. Одна из первых теорий химического процесса – закон действующих масс. (химик Гульдберг, математик Ваге, 1864 – 1867 гг. ).

Третья концептуальная система вызвана необходимостью роста промышленного производства Азот при обычной температуре инертен, энергия связи N 2 - Eсвязи=941 к. Дж/моль. Для реакции: требуется температура 4000 о. С Для синтеза аммиака NH 3: требуется температура 400 о. С и давление P=30 -100 МПа
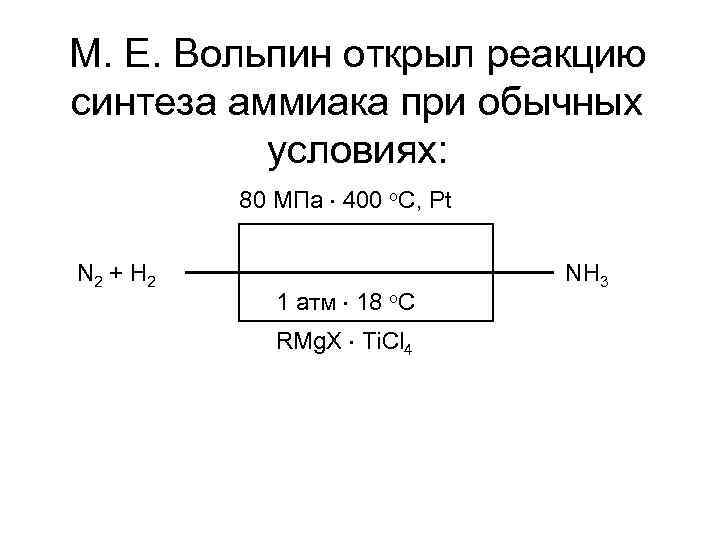
М. Е. Вольпин открыл реакцию синтеза аммиака при обычных условиях: 80 МПа 400 o. C, Pt N 2 + H 2 1 атм 18 o. C RMg. X Ti. Cl 4 NH 3

Критерием химической активности катализатора - служит значение энергии активации в уравнении Аррениуса:

Четвертая концептуальная система – эволюционная химия. Различие по составу и структуры между простым и сложным: Этилен – газ. Раствор Полиэтилен – твердое вещество. Кристаллы

Сахара из простых соединений: формальдегид

Известно 111 химических элементов • основу живых систем составляет 6 элементов - органогенов: углерод, водород, кислород, азот, фосфор, сера. Их общая массовая доля в организме составляет 97, 4%. • двенадцать элементов, которые участвуют в построении многих физиологически важных компонентов биосистем: Na, K, Ca, Mg, Fe, Si, Al, Cu, Zn, Co. Их массовая доля 1, 6%. • остальные (20 элементов) - около ~1%.

Фактор распределения элементов в космосе и на земле: • В космосе господствует всего два элемента – водород и гелий. • На Земле наиболее распространены – Fe, O, Si, Mg, Ca, Ni, Na, K. Углерод занимает 16 -е место. • В атмосфере земли углерода не более 0, 01% в океанах 0, 002%. Из органогенов наиболее распространен кислород и водород. Распространенность углерода, азота, фосфора, серы – примерно одинакова и в общем объеме составляет 0, 24%.

Пути интенсификации химических процессов. Два стратегических пути: 1. Направление развития химии нормальных состояний. 2. Направление в русле химических процессов протекающих при экстремальных параметрах.

В настоящем времени можно отметить следующее: А) химия экстремальных состояний. t<<0 о. С, вакуум. Реакция полимеризации формальдегида (Гольданский В. И. ) Б) химия нормальных состояний. t=0 -900 о. С, P=100 -1000 к. Па. Действуют законы Аррениуса, з-н действующих масс. В) химия экстремальных состояний. t=10004000 о. С, P=100 МПа, радиация, плазмохимия.
Концептуальная системы химии, основные законы.ppt