737277.ppt
- Количество слайдов: 17
 Конакова Елена Сергеевна Потенциометрический анализ. n Йошкар-Ола 2012
Конакова Елена Сергеевна Потенциометрический анализ. n Йошкар-Ола 2012
 Вопросы 1. 2. 3. Понятия и термины потенциометрии. Виды электродов. Основные характеристики электродов.
Вопросы 1. 2. 3. Понятия и термины потенциометрии. Виды электродов. Основные характеристики электродов.
 Понятия и термины потенциометрии • • Потенциометрия - электрохимический метод анализа, основанный на зависимости электродных потенциалов индикаторных электродов от концентрации определяемого иона в анализируемом растворе. Электрохимические процессы – окислительновосстановительные реакции на границе электрод/электролит. Электрод – материал, обладающий электронной проводимостью при погружении в раствор электролита. Гальванический полуэлемент – система из электрода, погруженного в раствор электролита. Система Zn/[Zn 2+]
Понятия и термины потенциометрии • • Потенциометрия - электрохимический метод анализа, основанный на зависимости электродных потенциалов индикаторных электродов от концентрации определяемого иона в анализируемом растворе. Электрохимические процессы – окислительновосстановительные реакции на границе электрод/электролит. Электрод – материал, обладающий электронной проводимостью при погружении в раствор электролита. Гальванический полуэлемент – система из электрода, погруженного в раствор электролита. Система Zn/[Zn 2+]
 Электродный потенциал Разность электростатических потенциалов на границе электрод/электролит называется электродным потенциалом. Символ – φ (фи), единица измерения – В (Вольт). Двойной электрический слой на границе металл — жидкость (диффузное строение слоя). Zn + + ++ + + + + - -+ - - ++ -- - + + - - ++ -- - + +
Электродный потенциал Разность электростатических потенциалов на границе электрод/электролит называется электродным потенциалом. Символ – φ (фи), единица измерения – В (Вольт). Двойной электрический слой на границе металл — жидкость (диффузное строение слоя). Zn + + ++ + + + + - -+ - - ++ -- - + + - - ++ -- - + +
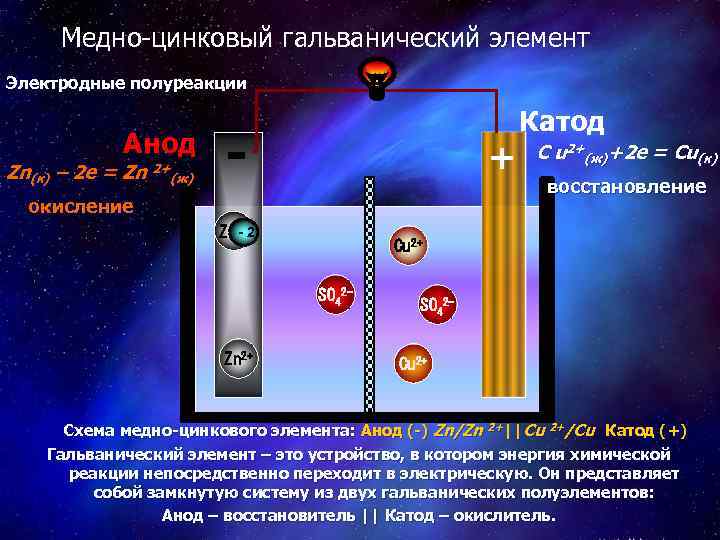 Медно-цинковый гальванический элемент Электродные полуреакции Анод Zn(к) – 2 е = Zn 2+(ж) - + окисление Zn 2+2 C u 2+(ж)+2 е = Cu(к) восстановление Cu 2+ SO 42 - Zn 2+ Катод SO 42 Cu 2+ Схема медно-цинкового элемента: Анод (-) Zn/Zn 2+||Cu 2+/Cu Катод (+) Гальванический элемент – это устройство, в котором энергия химической реакции непосредственно переходит в электрическую. Он представляет собой замкнутую систему из двух гальванических полуэлементов: Анод – восстановитель || Катод – окислитель.
Медно-цинковый гальванический элемент Электродные полуреакции Анод Zn(к) – 2 е = Zn 2+(ж) - + окисление Zn 2+2 C u 2+(ж)+2 е = Cu(к) восстановление Cu 2+ SO 42 - Zn 2+ Катод SO 42 Cu 2+ Схема медно-цинкового элемента: Анод (-) Zn/Zn 2+||Cu 2+/Cu Катод (+) Гальванический элемент – это устройство, в котором энергия химической реакции непосредственно переходит в электрическую. Он представляет собой замкнутую систему из двух гальванических полуэлементов: Анод – восстановитель || Катод – окислитель.
 n Напряжение гальванического элемента – это предельное значение разности электродных потенциалов окислителя и восстановителя, т. е. E, единица – В (Вольт). E = φок - φвос. = φкатода – φанода катода и анода. Символ В потенциометрии гальванический элемент (цепь) состоит из электрода сравнения (как правило, катод) и индикаторного электрода. Схематическое изображение цепи: (Pt) H 2 / H+ // KCl, Ag. Cl / Ag n Индикаторный электрод (для определения р. Н) n Электрод сравнения (хлорид серебряный) Система из индикаторного электрода и электрода сравнения, погруженных в раствор электролита, называется электрохимической ячейкой.
n Напряжение гальванического элемента – это предельное значение разности электродных потенциалов окислителя и восстановителя, т. е. E, единица – В (Вольт). E = φок - φвос. = φкатода – φанода катода и анода. Символ В потенциометрии гальванический элемент (цепь) состоит из электрода сравнения (как правило, катод) и индикаторного электрода. Схематическое изображение цепи: (Pt) H 2 / H+ // KCl, Ag. Cl / Ag n Индикаторный электрод (для определения р. Н) n Электрод сравнения (хлорид серебряный) Система из индикаторного электрода и электрода сравнения, погруженных в раствор электролита, называется электрохимической ячейкой.
 Уравнение электродного потенциала Электродный потенциал зависит от: 1) природы электрода; 2) температуры; 3) концентрации электролита; 4) природы растворителя. Зависимость потенциала от температуры (Т) и концентрации (Ci) выражена в уравнении электродного потенциала (уравнение Нернста): где φ = φ˚+ (RT/ n. F)*ln Ci , φ˚ - стандартный электродный потенциал, В; n - число электронов, участвующих в реакции; F - постоянная Фарадея (96485 Кл/моль); R - универсальная газовая постоянная. Подставив значения постоянных R , F, и T= 298 К , заменив натуральный логарифм на десятичный, получим выражение: φ = φ˚+ (0, 058 /n)*lg Ci
Уравнение электродного потенциала Электродный потенциал зависит от: 1) природы электрода; 2) температуры; 3) концентрации электролита; 4) природы растворителя. Зависимость потенциала от температуры (Т) и концентрации (Ci) выражена в уравнении электродного потенциала (уравнение Нернста): где φ = φ˚+ (RT/ n. F)*ln Ci , φ˚ - стандартный электродный потенциал, В; n - число электронов, участвующих в реакции; F - постоянная Фарадея (96485 Кл/моль); R - универсальная газовая постоянная. Подставив значения постоянных R , F, и T= 298 К , заменив натуральный логарифм на десятичный, получим выражение: φ = φ˚+ (0, 058 /n)*lg Ci
 Окислительно - восстановительный потенциал (ОВП) n ОВП – потенциал, возникающий на границе соприкосновения инертного электрода (Pt, Au) с раствором разнозаряженных ионов. Платина Fe 2+- восстановитель (Red) Fe 2+- ē = Fe 3+ - окислитель (ОХ) Fe 2+ Fe 3++ē Red Ox Fe 3+ + ē = Fe 2+ Уравнение Нернста для ОВП: φов=φ˚+(0, 058/n)*lg[ОХ]/[Red] где n – число электронов, участвующих в реакции.
Окислительно - восстановительный потенциал (ОВП) n ОВП – потенциал, возникающий на границе соприкосновения инертного электрода (Pt, Au) с раствором разнозаряженных ионов. Платина Fe 2+- восстановитель (Red) Fe 2+- ē = Fe 3+ - окислитель (ОХ) Fe 2+ Fe 3++ē Red Ox Fe 3+ + ē = Fe 2+ Уравнение Нернста для ОВП: φов=φ˚+(0, 058/n)*lg[ОХ]/[Red] где n – число электронов, участвующих в реакции.
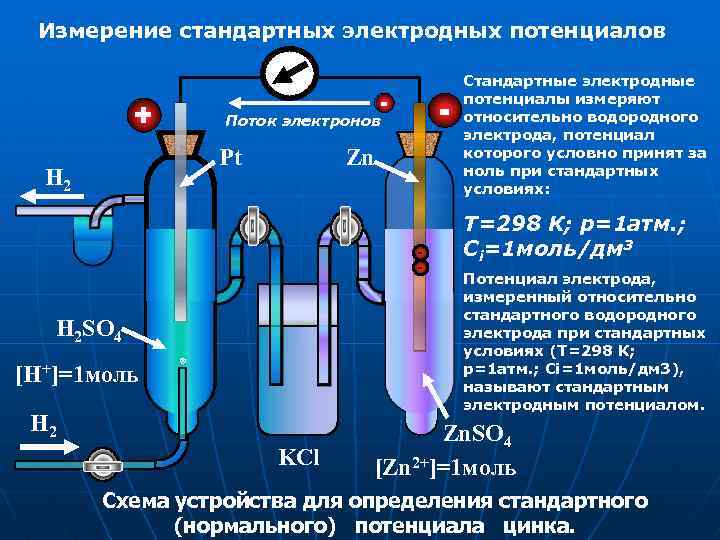 Измерение стандартных электродных потенциалов + - Pt H 2 - Поток электронов Zn - H 2 SO 4 [H+]=1 моль H 2 KCl Стандартные электродные потенциалы измеряют относительно водородного электрода, потенциал которого условно принят за ноль при стандартных условиях: Т=298 К; p=1 атм. ; Ci=1 моль/дм 3 Потенциал электрода, измеренный относительно стандартного водородного электрода при стандартных условиях (Т=298 К; p=1 атм. ; Ci=1 моль/дм 3), называют стандартным электродным потенциалом. Zn. SO 4 [Zn 2+]=1 моль Схема устройства для определения стандартного (нормального) потенциала цинка.
Измерение стандартных электродных потенциалов + - Pt H 2 - Поток электронов Zn - H 2 SO 4 [H+]=1 моль H 2 KCl Стандартные электродные потенциалы измеряют относительно водородного электрода, потенциал которого условно принят за ноль при стандартных условиях: Т=298 К; p=1 атм. ; Ci=1 моль/дм 3 Потенциал электрода, измеренный относительно стандартного водородного электрода при стандартных условиях (Т=298 К; p=1 атм. ; Ci=1 моль/дм 3), называют стандартным электродным потенциалом. Zn. SO 4 [Zn 2+]=1 моль Схема устройства для определения стандартного (нормального) потенциала цинка.
 Виды электродов в потенциометрии По назначению: 1. Индикаторные электроды – электроды, потенциал которых зависит от активности (концентрации) определяемых ионов в растворе. 2. Электроды сравнения – электроды, потенциал которых является постоянным при проведении измерений, не зависит от концентрации определяемых ионов. 5 4 3 2 1 Электрод сравнения: 1. – асбестовое волокно, обеспечивающее связь с испытуемым раствором; 2 – внутренний раствор KCl (нас. ); 3 – Ag. Cl (т); 4 – токоотводящий электрод (Ag) 5 – отверстие для ввода раствора KCl
Виды электродов в потенциометрии По назначению: 1. Индикаторные электроды – электроды, потенциал которых зависит от активности (концентрации) определяемых ионов в растворе. 2. Электроды сравнения – электроды, потенциал которых является постоянным при проведении измерений, не зависит от концентрации определяемых ионов. 5 4 3 2 1 Электрод сравнения: 1. – асбестовое волокно, обеспечивающее связь с испытуемым раствором; 2 – внутренний раствор KCl (нас. ); 3 – Ag. Cl (т); 4 – токоотводящий электрод (Ag) 5 – отверстие для ввода раствора KCl
 Виды электродов по устройству 1. Электроды первого рода – металлические (Zn, Ag). Zn - 2ē → Zn 2+ Эти электроды используются в качестве внутренних токоотводящих электродов. 2. Электроды второго рода – Ме / м. р. соль / Электролит с одноименным анионом Ag / Ag. Cl / KCl (насыщ) От концентрации электролита зависит потенциал электрода. В процессе электродных реакций освобождаются анионы: Ag. Cl + ē → Ag + Cl – Потенциал электродов второго рода зависит от концентрации анионов: где ах – - активность аниона, моль/л
Виды электродов по устройству 1. Электроды первого рода – металлические (Zn, Ag). Zn - 2ē → Zn 2+ Эти электроды используются в качестве внутренних токоотводящих электродов. 2. Электроды второго рода – Ме / м. р. соль / Электролит с одноименным анионом Ag / Ag. Cl / KCl (насыщ) От концентрации электролита зависит потенциал электрода. В процессе электродных реакций освобождаются анионы: Ag. Cl + ē → Ag + Cl – Потенциал электродов второго рода зависит от концентрации анионов: где ах – - активность аниона, моль/л
 Виды индикаторных электродов Окислительно-восстановительные электроды – индифферентные электроды, погруженные в раствор с разноименно заряженными ионами. Индифферентные электроды только проводники электронов (Pt, графитовые, стеклоуглерод) – используются в качестве индикаторных при измерении ОВП: Pt / Fe 2+ / Fe 3+ 2. Мембранные – электроды, в которых селективная полупроницаемая мембрана отделяет анализируемый раствор от внутреннего раствора сравнения, содержащего потенциалопределяющие ионы: 1. ППМ Внутренний электрод Внутренний раствор сравнения (токоотводящий) (приэлектродный) Анализируемый раствор
Виды индикаторных электродов Окислительно-восстановительные электроды – индифферентные электроды, погруженные в раствор с разноименно заряженными ионами. Индифферентные электроды только проводники электронов (Pt, графитовые, стеклоуглерод) – используются в качестве индикаторных при измерении ОВП: Pt / Fe 2+ / Fe 3+ 2. Мембранные – электроды, в которых селективная полупроницаемая мембрана отделяет анализируемый раствор от внутреннего раствора сравнения, содержащего потенциалопределяющие ионы: 1. ППМ Внутренний электрод Внутренний раствор сравнения (токоотводящий) (приэлектродный) Анализируемый раствор
 Стеклянный электрод для измерения р. Н 1. 2. 3. 4. 5. 6. - стеклянная р. Н-чувствительная мембрана; - 0, 1 М раствор HCl, насыщенный Ag. Cl; - серебряная проволочка; - стеклянная трубка; - изоляция; - токоотвод Мембраны бывают: 1) Газовые 3) Ферментативные 5 4 3 2 Стеклянные, кристаллические. 2) 6 1
Стеклянный электрод для измерения р. Н 1. 2. 3. 4. 5. 6. - стеклянная р. Н-чувствительная мембрана; - 0, 1 М раствор HCl, насыщенный Ag. Cl; - серебряная проволочка; - стеклянная трубка; - изоляция; - токоотвод Мембраны бывают: 1) Газовые 3) Ферментативные 5 4 3 2 Стеклянные, кристаллические. 2) 6 1
 Виды электродов по типу электродной реакции Электронообменные – на границе электрод/электролит протекают реакции с участием электронов Анод: Ag – ē = Ag+ Катод: Ag+ + ē = Ag К электронообменным электродам относятся электроды 1 го и 2 -го рода. 2. Ионообменные (ионоселективные, ИСЭ) – на межфазных границах (электрод/электролит) протекают ионообменные реакции. Например, стеклянный электрод с водородной функцией: 1. H+ раствор + Me+ст ⇆ H+ст + Me+ / электрод, мембрана ⇆ электрод, мембрана / раствор Ме+ – ионы щелочного металла (Li, Na, K) ИСЭ – мембранные электроды.
Виды электродов по типу электродной реакции Электронообменные – на границе электрод/электролит протекают реакции с участием электронов Анод: Ag – ē = Ag+ Катод: Ag+ + ē = Ag К электронообменным электродам относятся электроды 1 го и 2 -го рода. 2. Ионообменные (ионоселективные, ИСЭ) – на межфазных границах (электрод/электролит) протекают ионообменные реакции. Например, стеклянный электрод с водородной функцией: 1. H+ раствор + Me+ст ⇆ H+ст + Me+ / электрод, мембрана ⇆ электрод, мембрана / раствор Ме+ – ионы щелочного металла (Li, Na, K) ИСЭ – мембранные электроды.
 Основные характеристики индикаторных электродов (ИЭ) 1. • • 2. 3. 4. Требования к ИЭ: химическая инертность; неполяризуемость; обратимость электродной реакции; быстрое установление равновесия электродной и химической реакций. Время отклика – время установления устойчивых показаний (до 30 с). Широкий диапазон определяемых концентраций – не менее: 10 -1 - 10 -5 моль/л. Специфичность – характеризуется коэффициентом селективности Kij : – концентрация определяемого иона – концентрация мешающего иона Kij < 1 - электрод селективен к определяемому иону Kij = 1 - электрод одинаково чувствителен к ионам Kij > 1 - электрод более чувствителен к мешающему иону 5. Изопотенциальная точка – характерна для электродов с водородной функцией – значение р. Н, при котором потенциал не зависит от температуры.
Основные характеристики индикаторных электродов (ИЭ) 1. • • 2. 3. 4. Требования к ИЭ: химическая инертность; неполяризуемость; обратимость электродной реакции; быстрое установление равновесия электродной и химической реакций. Время отклика – время установления устойчивых показаний (до 30 с). Широкий диапазон определяемых концентраций – не менее: 10 -1 - 10 -5 моль/л. Специфичность – характеризуется коэффициентом селективности Kij : – концентрация определяемого иона – концентрация мешающего иона Kij < 1 - электрод селективен к определяемому иону Kij = 1 - электрод одинаково чувствителен к ионам Kij > 1 - электрод более чувствителен к мешающему иону 5. Изопотенциальная точка – характерна для электродов с водородной функцией – значение р. Н, при котором потенциал не зависит от температуры.
 Характеристика некоторых ионоселективных электродов Опреде ляемый ион Состав мембраны Диапазон концентраций Область р. Н, коэффициент чувствительности F- La. F 3 10 -6 – 1 М р. Н 4 – 8, k F -, Cl - = 10 -3 Ag+ Ag 2 S 10 -7 – 1 М р. Н 2 – 9, k. Ag+, Cu 2+ = 10 -6 Br - Ag. Br/Ag 2 S 5· 10 -6 – 1 М р. Н 2 – 12, k Br -, Cl - = 5· 10 -3 K+ Валиномицин 10 -5 – 1 М р. Н 2 – 11, k. K, Na = 2, 6· 10 -4 NO 3 - 1, 10 Фенантролинат Ni 10 -5 – 1 М р. Н 2 – 12, k NO 3 - , NO 2 - = 6· 10 -3 H+ Стекло состава Si. O 2 -Ca. O-Ba. OCs 2 O-Li 2 O-La 2 O 3 р. Н 0, 5 – 14 k. H+, Na + = 10 -13
Характеристика некоторых ионоселективных электродов Опреде ляемый ион Состав мембраны Диапазон концентраций Область р. Н, коэффициент чувствительности F- La. F 3 10 -6 – 1 М р. Н 4 – 8, k F -, Cl - = 10 -3 Ag+ Ag 2 S 10 -7 – 1 М р. Н 2 – 9, k. Ag+, Cu 2+ = 10 -6 Br - Ag. Br/Ag 2 S 5· 10 -6 – 1 М р. Н 2 – 12, k Br -, Cl - = 5· 10 -3 K+ Валиномицин 10 -5 – 1 М р. Н 2 – 11, k. K, Na = 2, 6· 10 -4 NO 3 - 1, 10 Фенантролинат Ni 10 -5 – 1 М р. Н 2 – 12, k NO 3 - , NO 2 - = 6· 10 -3 H+ Стекло состава Si. O 2 -Ca. O-Ba. OCs 2 O-Li 2 O-La 2 O 3 р. Н 0, 5 – 14 k. H+, Na + = 10 -13
 n Спасибо за внимание
n Спасибо за внимание


