MG_7.ppt
- Количество слайдов: 32

Комплементаційний і рекомбінаційний аналіз у бактеріофагів 1
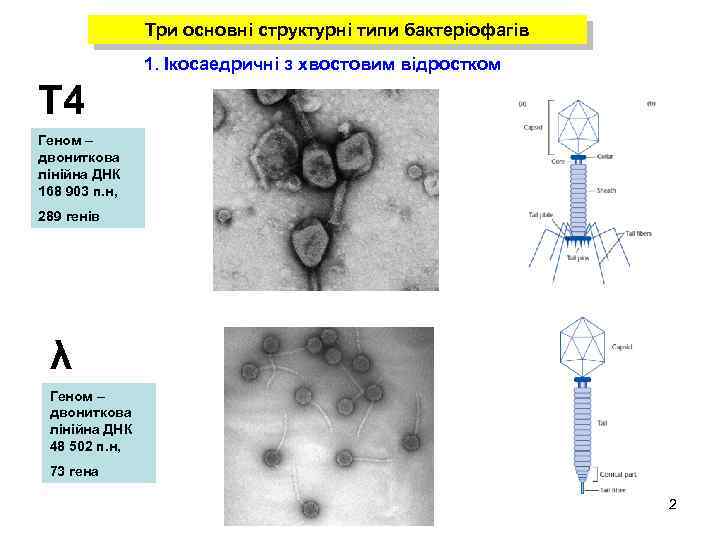
Три основні структурні типи бактеріофагів 1. Ікосаедричні з хвостовим відростком Т 4 Геном – двониткова лінійна ДНК 168 903 п. н, 289 генів λ Геном – двониткова лінійна ДНК 48 502 п. н, 73 гена 2
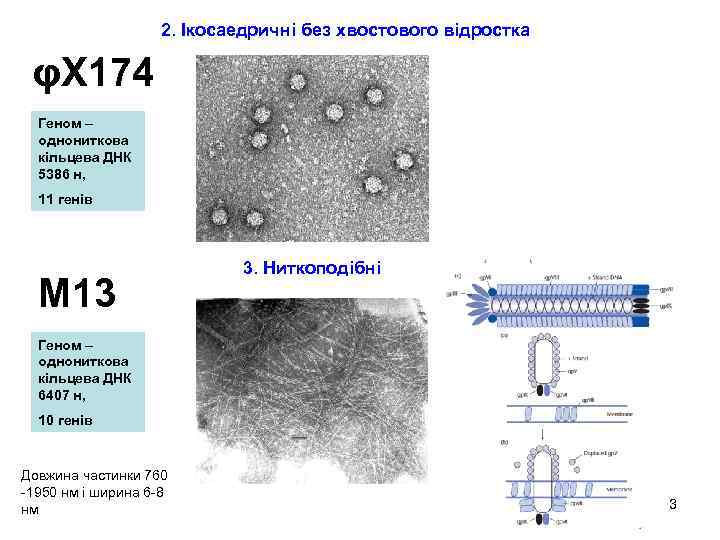
2. Ікосаедричні без хвостового відростка φХ 174 Геном – однониткова кільцева ДНК 5386 н, 11 генів М 13 3. Ниткоподібні Геном – однониткова кільцева ДНК 6407 н, 10 генів Довжина частинки 760 -1950 нм і ширина 6 -8 нм 3

q Види молекул нуклеїнових кислот, які виконують роль носіїв генетичної інформації бактеріофагів: § Двониткова лінійна ДНК – фаги E. coli Т 4, Р 1, Mu, λ, T 1, T 5, T 7, P 22 § Двониткова кільцева ДНК – фаги Alteromonas PM 2, Sulfolobus SSV 1, SNDP § § § Однониткова кільцева ДНК – фаг E. coli φX 174 Однониткова лінійна РНК (“+”- геном) – фаги E. coli MS 2, Qβ Двониткова сегментована РНК - фаг Pseudomonas φ6 q У геномах бактеріофагів від декількох до декількох сотень генів q Геноми бактеріофагів мають модульну організацію 4
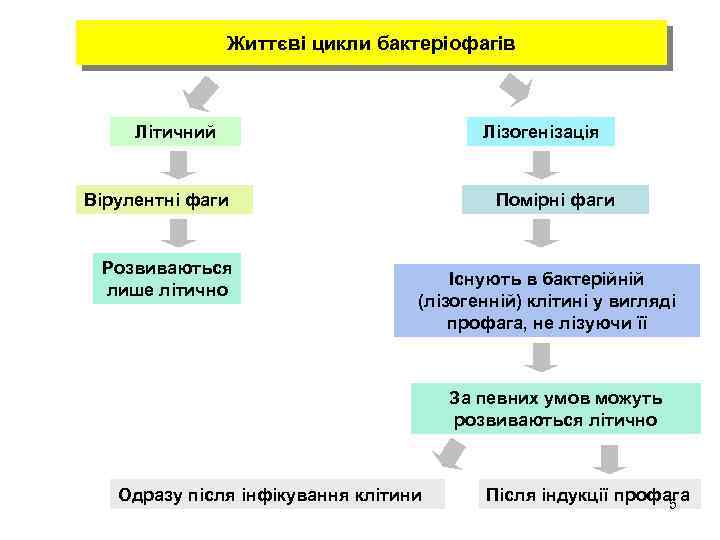
Життєві цикли бактеріофагів Літичний Лізогенізація Вірулентні фаги Розвиваються лише літично Помірні фаги Існують в бактерійній (лізогенній) клітині у вигляді профага, не лізуючи її За певних умов можуть розвиваються літично Одразу після інфікування клітини Після індукції профага 5
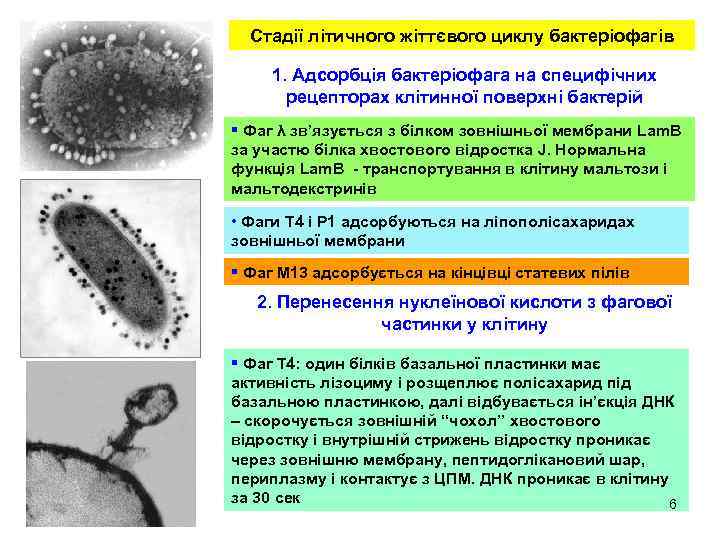
Стадії літичного жіттєвого циклу бактеріофагів 1. Адсорбція бактеріофага на специфічних рецепторах клітинної поверхні бактерій § Фаг λ зв’язується з білком зовнішньої мембрани Lam. B за участю білка хвостового відростка J. Нормальна функція Lam. B - транспортування в клітину мальтози і мальтодекстринів • Фаги Т 4 і Р 1 адсорбуються на ліпополісахаридах зовнішньої мембрани § Фаг М 13 адсорбується на кінцівці статевих пілів 2. Перенесення нуклеїнової кислоти з фагової частинки у клітину § Фаг Т 4: один білків базальної пластинки має активність лізоциму і розщеплює полісахарид під базальною пластинкою, далі відбувається ін’єкція ДНК – скорочується зовнішній “чохол” хвостового відростку і внутрішній стрижень відростку проникає через зовнішню мембрану, пептидоглікановий шар, периплазму і контактує з ЦПМ. ДНК проникає в клітину за 30 сек 6
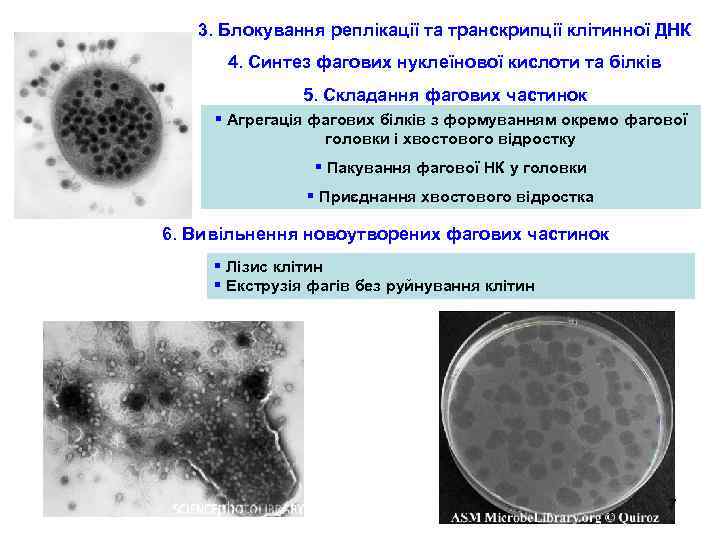
3. Блокування реплікації та транскрипції клітинної ДНК 4. Синтез фагових нуклеїнової кислоти та білків 5. Складання фагових частинок § Агрегація фагових білків з формуванням окремо фагової головки і хвостового відростку § Пакування фагової НК у головки § Приєднання хвостового відростка 6. Вивільнення новоутворених фагових частинок § Лізис клітин § Екструзія фагів без руйнування клітин 7
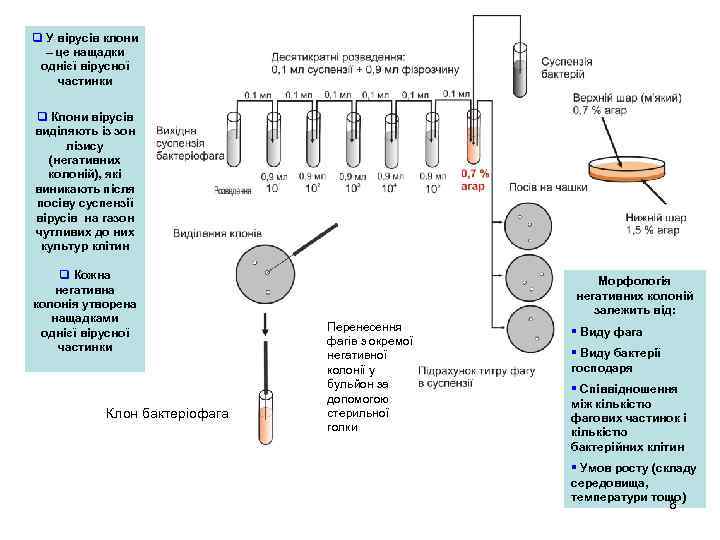
q У вірусів клони – це нащадки однієї вірусної частинки q Клони вірусів виділяють із зон лізису (негативних колоній), які виникають після посіву суспензії вірусів на газон чутливих до них культур клітин q Кожна негативна колонія утворена нащадками однієї вірусної частинки Клон бактеріофага Морфологія негативних колоній залежить від: Перенесення фагів з окремої негативної колонії у бульйон за допомогою стерильної голки § Виду фага § Виду бактерії господаря § Співвідношення між кількістю фагових частинок і кількістю бактерійних клітин § Умов росту (складу середовища, температури тощо) 8
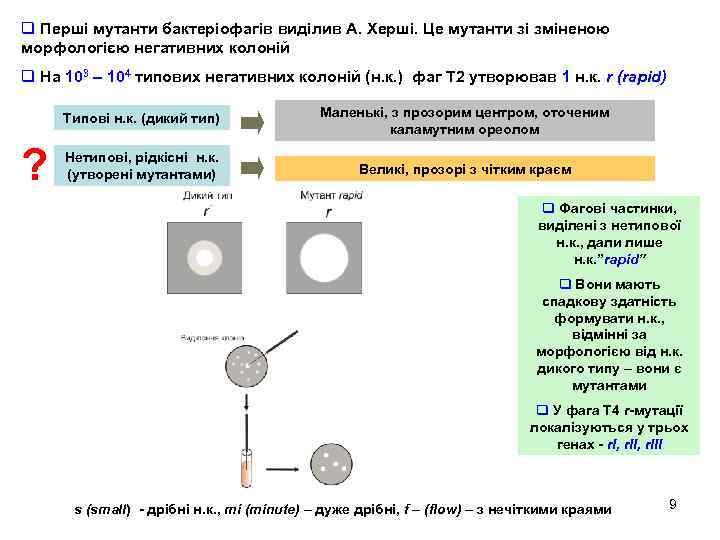
q Перші мутанти бактеріофагів виділив А. Херші. Це мутанти зі зміненою морфологією негативних колоній q На 103 – 104 типових негативних колоній (н. к. ) фаг Т 2 утворював 1 н. к. r (rapid) Типові н. к. (дикий тип) ? Маленькі, з прозорим центром, оточеним каламутним ореолом Нетипові, рідкісні н. к. (утворені мутантами) Великі, прозорі з чітким краєм q Фагові частинки, виділені з нетипової н. к. , дали лише н. к. ”rapid” q Вони мають спадкову здатність формувати н. к. , відмінні за морфологією від н. к. дикого типу – вони є мутантами q У фага Т 4 r-мутації локалізуються у трьох генах - r. I, r. III s (small) - дрібні н. к. , mi (minute) – дуже дрібні, f – (flow) – з нечіткими краями 9
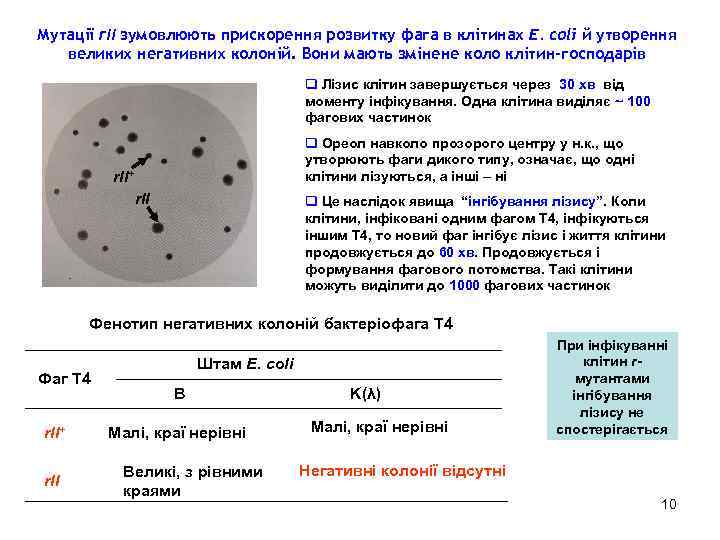
Мутації rІІ зумовлюють прискорення розвитку фага в клітинах E. coli й утворення великих негативних колоній. Вони мають змінене коло клітин-господарів q Лізис клітин завершується через 30 хв від моменту інфікування. Одна клітина виділяє ~ 100 фагових частинок q Ореол навколо прозорого центру у н. к. , що утворюють фаги дикого типу, означає, що одні клітини лізуються, а інші – ні r. II+ r. II q Це наслідок явища “інгібування лізису”. Коли клітини, інфіковані одним фагом Т 4, інфікуються іншим Т 4, то новий фаг інгібує лізис і життя клітини продовжується до 60 хв. Продовжується і формування фагового потомства. Такі клітини можуть виділити до 1000 фагових частинок Фенотип негативних колоній бактеріофага Т 4 Фаг Т 4 r. II+ r. II Штам E. coli B Малі, краї нерівні Великі, з рівними краями K(λ) Малі, краї нерівні При інфікуванні клітин rмутантами інгібування лізису не спостерігається Негативні колонії відсутні 10
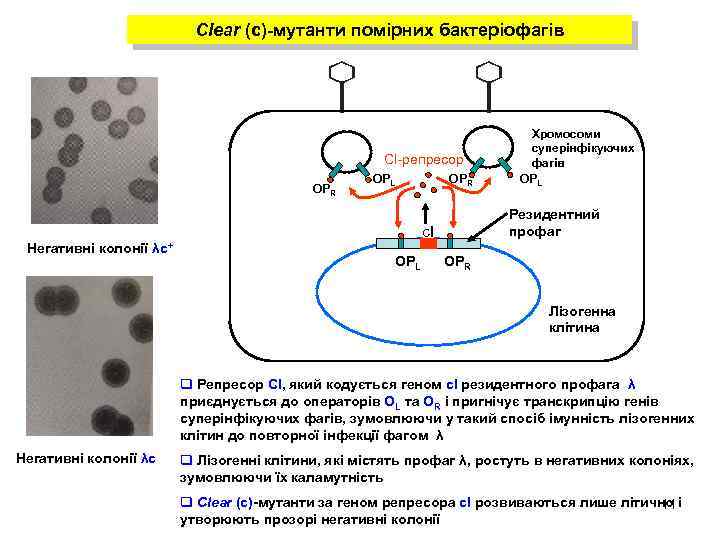
Clear (с)-мутанти помірних бактеріофагів CI-репресор ОPR Негативні колонії λс+ ОPL ОPR Резидентний профаг сІ ОPL Хромосоми суперінфікуючих фагів ОPL ОPR Лізогенна клітина q Репресор СІ, який кодується геном сІ резидентного профага λ приєднується до операторів OL та OR і пригнічує транскрипцію генів суперінфікуючих фагів, зумовлюючи у такий спосіб імунність лізогенних клітин до повторної інфекції фагом λ Негативні колонії λс q Лізогенні клітини, які містять профаг λ, ростуть в негативних колоніях, зумовлюючи їх каламутність q Clear (с)-мутанти за геном репресора сІ розвиваються лише літично і 11 утворюють прозорі негативні колонії
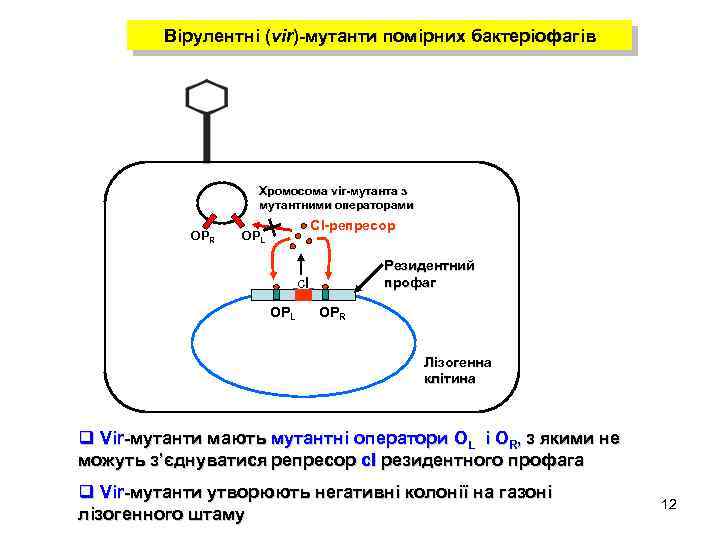
Вірулентні (vir)-мутанти помірних бактеріофагів Хромосома vir-мутанта з virмутантними операторами ОPR CI-репресор ОPL Резидентний профаг сІ ОPL ОPR Лізогенна клітина q Vir-мутанти мають мутантні оператори OL і OR, з якими не можуть з’єднуватися репресор сІ резидентного профага q Vir-мутанти утворюють негативні колонії на газоні лізогенного штаму 12
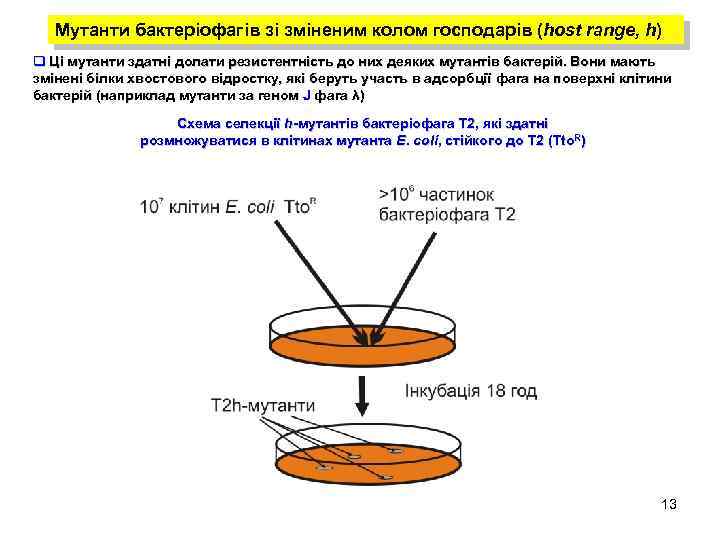
Мутанти бактеріофагів зі зміненим колом господарів (host range, h) q Ці мутанти здатні долати резистентність до них деяких мутантів бактерій. Вони мають змінені білки хвостового відростку, які беруть участь в адсорбції фага на поверхні клітини бактерій (наприклад мутанти за геном J фага λ) Схема селекції h-мутантів бактеріофага Т 2, які здатні розмножуватися в клітинах мутанта E. coli, стійкого до Т 2 (Tto. R) 13
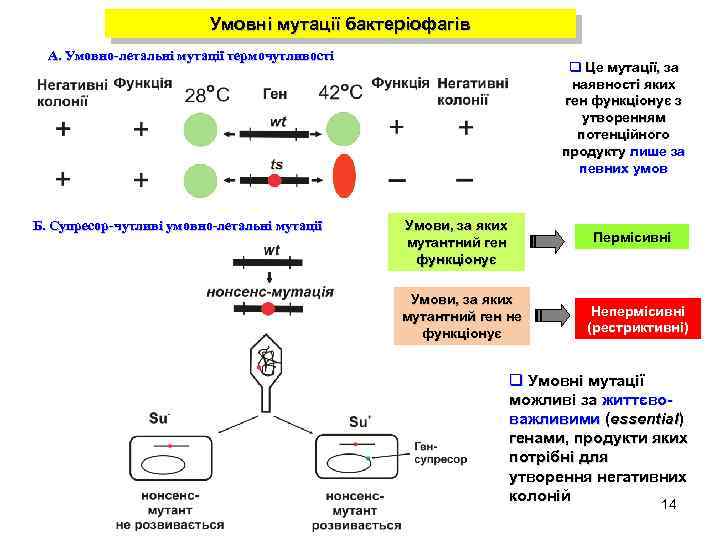
Умовні мутації бактеріофагів А. Умовно-летальні мутації термочутливості Б. Супресор-чутливі умовно-летальні мутації q Це мутації, за наявності яких ген функціонує з утворенням потенційного продукту лише за певних умов Умови, за яких мутантний ген функціонує Пермісивні Умови, за яких мутантний ген не функціонує Непермісивні (рестриктивні) q Умовні мутації можливі за життєвоважливими (essential) генами, продукти яких потрібні для утворення негативних колоній 14
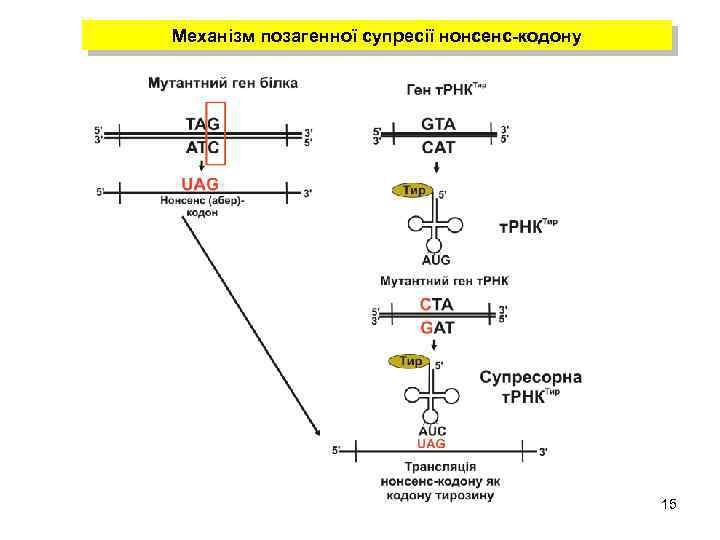
Механізм позагенної супресії нонсенс-кодону 15

Генетична рекомбінація у бактеріофагів q Відкрита у фага Т 2 М. Дельбрюком і А. Херші у 1946 році q Після одночасного інфікування E. coli h- і r-мутантами фага Т 2 серед нащадків виявлено рекомбінантні фаги. Виділено реципрокні класи рекомбінантів q Частота рекомбінантів залежить від того, яка пара маркерів використана у схрещуванні Реципрокні класи рекомбінантів Батьки h+r X hr+ hr h + r+ Загальні принципи генетичної рекомбінації і побудови генетичних карт в евкаріотів можна застосувати до бактеріофагів 16

Особливості генетичної рекомбінації у бактеріофагів q Теорію фагових схрещувань опрацювали Н. Вісконті і М. Дельбрюк для пояснення фактів, які не узгоджувалися з уявленнями про спільність механізмів генетичної рекомбінації у вищих організмів і бактеріофагів q Кросинговери відбуваються між молекулами фагової ДНК, які утворилися у зараженій клітині у ході реплікації q Геноми фагів формують загальний внутрішньоклітинний фонд (пул), між членами яких можлива рекомбінація q Кожен з геномів може брати участь у декількох повторних попарних схрещуваннях з іншими геномами пулу. Ці схрещування відбуваються випадково по часу і щодо партнерів q Частота рекомбінантів залежить не тільки віддалі між цими маркерами, але й від кількості актів схрещувань, що відбулися до моменту закінчення внутрішньоклітинного розвитку бактеріофагів Приклад: a+c x +bc Рекомбінанти дикого типу +++ не утворюються Якщо клітини інфікувати трьома різними мутантами a+c, +bc, ab+ , то рекомбінанти +++ утворюються. Вони є результатом двох попарних схрещувань: a+c x +bc ++c x ab+ +++ 17

Вивчення С. Бензером “тонкої” структури генів r. IIA та r. IIB бактеріофага T 4 Мета експериментів С. Бензера: q пов’язати концепцію гена як ділянки ДНК з класичними генетичними уявленнями – наповнити поняття “ген” молекулярним змістом; q вивчити внутрішню (тонку) будову гена; для цього картувати багато мутацій, які порушують одну функцію; q виявити найменшу генетичну віддаль - визначити роздільну здатність генетичного аналізу Cеймур Бензер (1921 - 2007) ? Скільком нуклеотидам у гені відповідає найменша генетична віддаль, яку можна спостерігати у схрещуваннях (найменший % рекомбінації) У 1953 – 1963 роках С. Бензер отримав колекцію з більш, ніж 2400 rмутантів, які отримані незалежно з того самого вихідного штаму Т 4 r. II+ 18
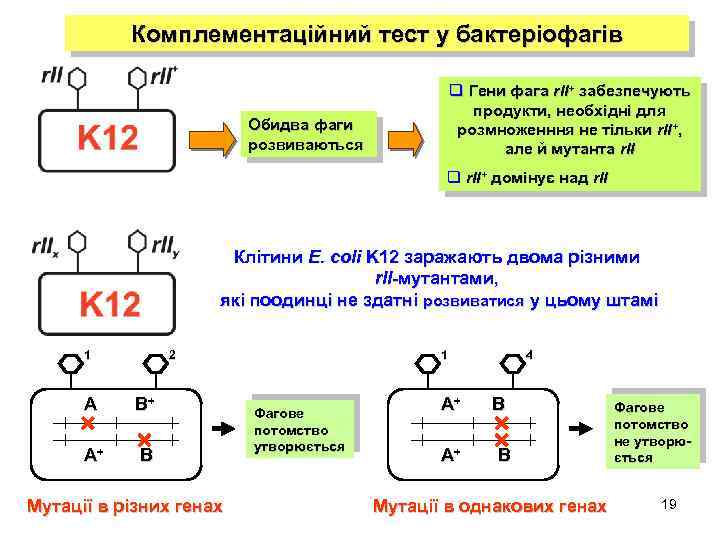
Комплементаційний тест у бактеріофагів q Гени фага r. II+ забезпечують продукти, необхідні для розмноженння не тільки rІІ+, але й мутанта r. II Обидва фаги розвиваються q rІІ+ домінує над r. II Клітини E. coli K 12 заражають двома різними r. II-мутантами, які поодинці не здатні розвиватися у цьому штамі 1 2 A B+ A+ B Мутації в різних генах 1 Фагове потомство утворюється A+ A+ 4 B B Мутації в однакових генах Фагове потомство не утворюється 19
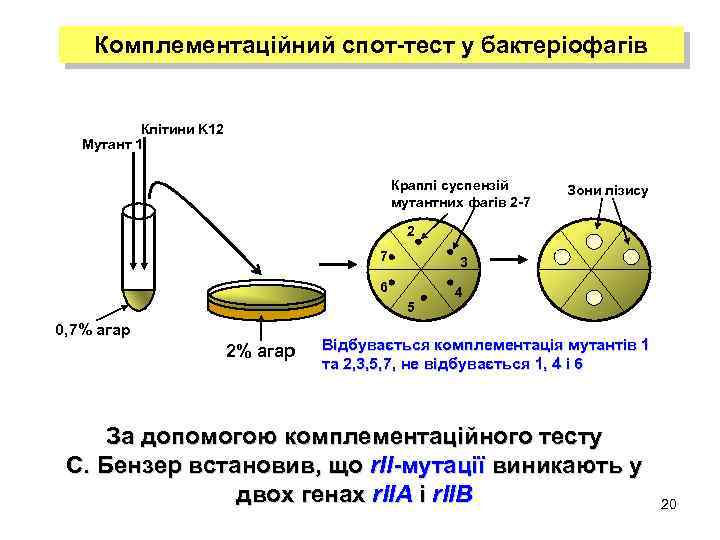
Комплементаційний спот-тест у бактеріофагів Клітини K 12 Мутант 1 Краплі суспензій мутантних фагів 2 -7 Зони лізису 2 7 3 6 5 0, 7% агар 2% агар 4 Відбувається комплементація мутантів 1 та 2, 3, 5, 7, не відбувається 1, 4 і 6 За допомогою комплементаційного тесту С. Бензер встановив, що r. II-мутації виникають у двох генах r. IIA і r. IIB 20
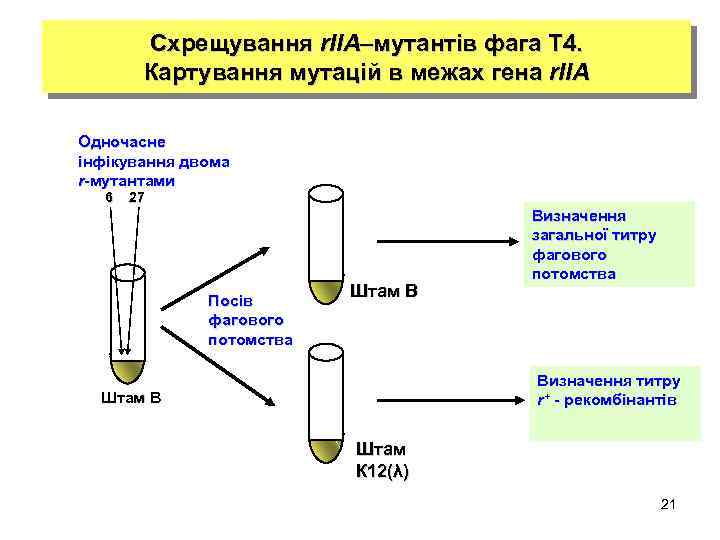
Схрещування r. IIA–мутантів фага Т 4. Картування мутацій в межах гена r. IIA Одночасне інфікування двома r-мутантами 6 27 Посів фагового потомства Штам В Визначення загальної титру фагового потомства Визначення титру r+ - рекомбінантів Штам В Штам К 12(λ) 21
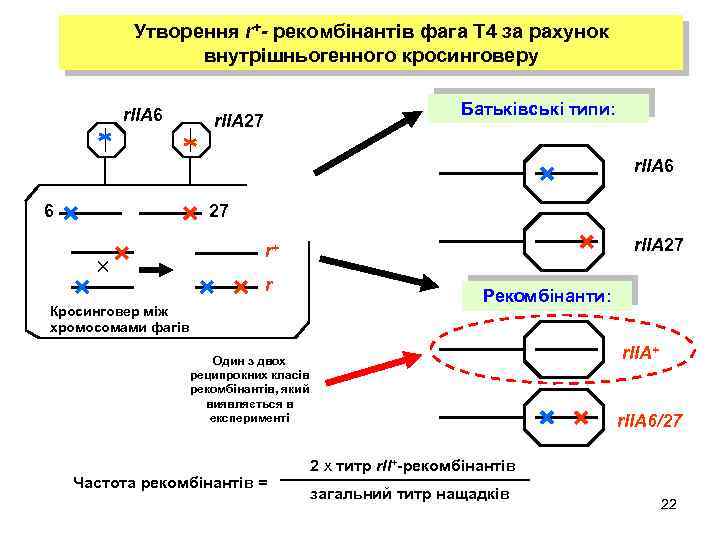
Утворення r+- рекомбінантів фага Т 4 за рахунок внутрішньогенного кросинговеру r. IIA 6 Батьківські типи: r. IIA 27 r. IIA 6 6 27 r. IIA 27 r+ r Кросинговер між хромосомами фагів Рекомбінанти: r. IIA+ Один з двох реципрокних класів рекомбінантів, який виявляється в експерименті Частота рекомбінантів = r. IIA 6/27 2 х титр r. II+-рекомбінантів загальний титр нащадків 22

Ген – це послідовність нуклеодидів в гені “Точкова” мутація – зміна однієї нуклеотидної пари в нуклеотидній послідовності гена Властивості точкових мутацій: q Їм відповідає певна точка на карті q Дають зворотні мутації (r. II → r. II+), що зумовлюють нормальний фенотип. Їх частота яких приблизно така ж, як і частота прямих точкових мутацій (r. II+ → r. II) q Точкові мутації повинні рекомбінувати з будь-якими іншими точковими мутаціями за виключенням тих, які є незалежними замінами тієї самої пари нуклеотидів (rx+ x + ry → ++, rx ry) Деякі мутації r. II: q Не ревертували до дикого типу q Не утворювали рекомбінантів дикого типу r+ після схрещування з 2 або більше r-мутаціями, які раніше були ідентифіковані як неалельні точкові мутації q Займали на карті ділянки більші, ніж точкові мутації q Це делеції нуклеотидних послідовностей 23
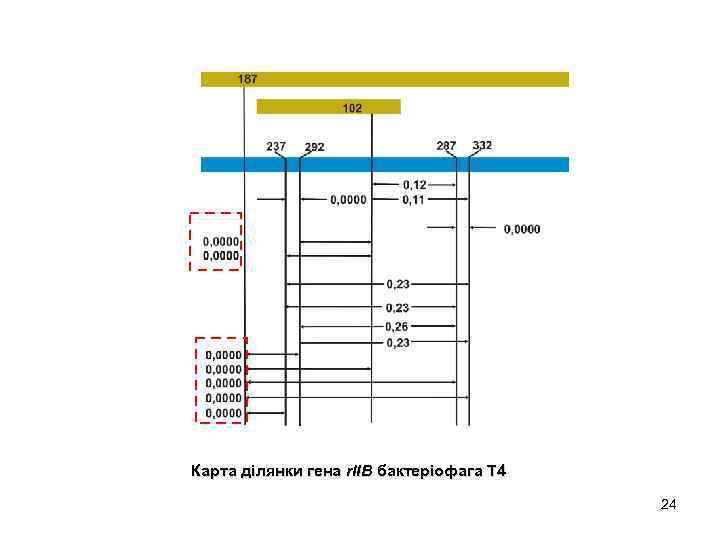
Карта ділянки гена r. IIB бактеріофага Т 4 24
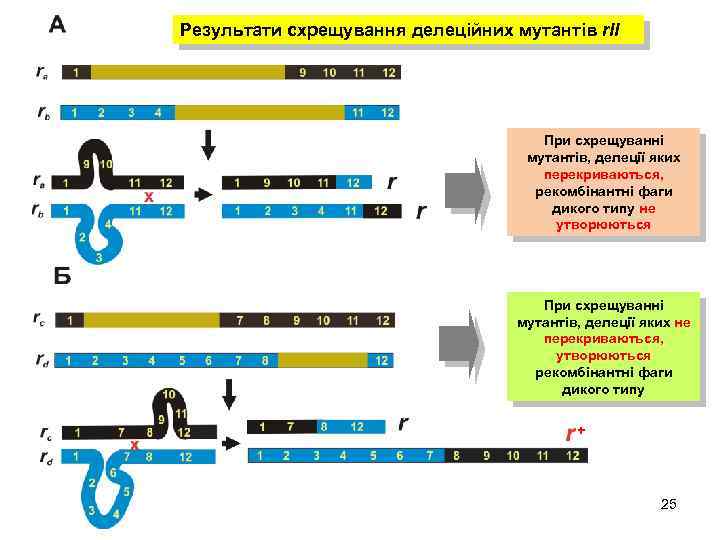
Результати схрещування делеційних мутантів r. II При схрещуванні мутантів, делеції яких перекриваються, рекомбінантні фаги дикого типу не утворюються При схрещуванні мутантів, делеції яких не перекриваються, утворюються рекомбінантні фаги дикого типу + 25
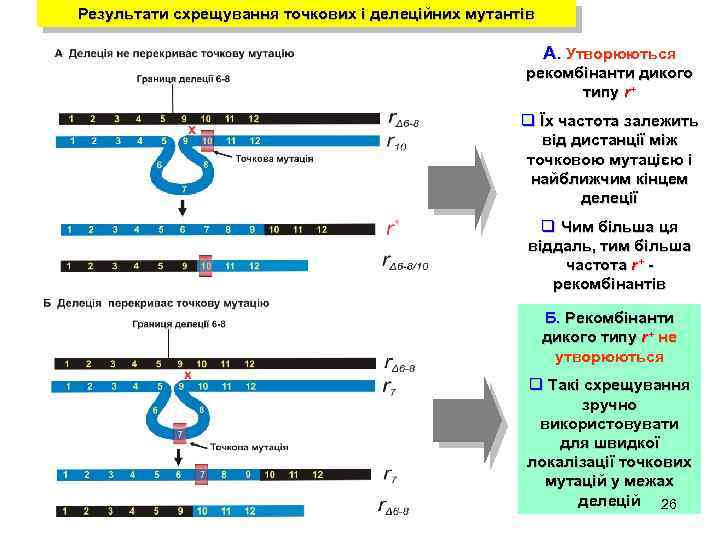
Результати схрещування точкових і делеційних мутантів А. Утворюються рекомбінанти дикого типу r+ q Їх частота залежить від дистанції між точковою мутацією і найближчим кінцем делеції q Чим більша ця віддаль, тим більша частота r+ рекомбінантів Б. Рекомбінанти дикого типу r+ не утворюються q Такі схрещування зручно використовувати для швидкої локалізації точкових мутацій у межах делецій 26
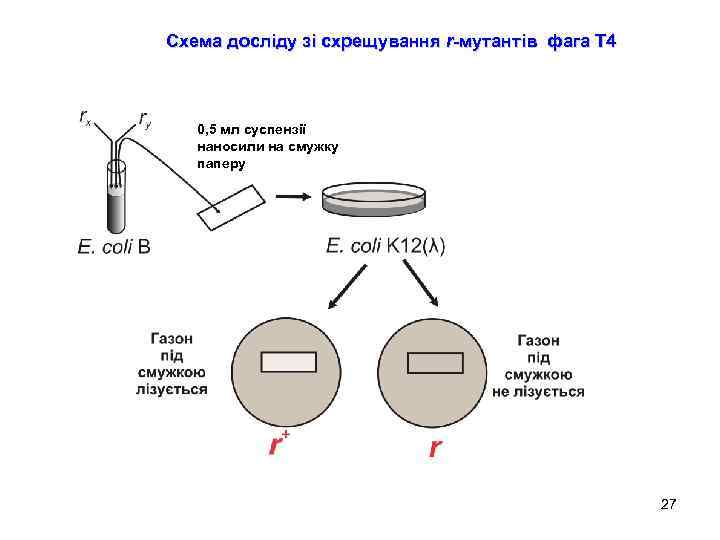
Схема досліду зі схрещування r-мутантів фага Т 4 0, 5 мл суспензії наносили на смужку паперу 27
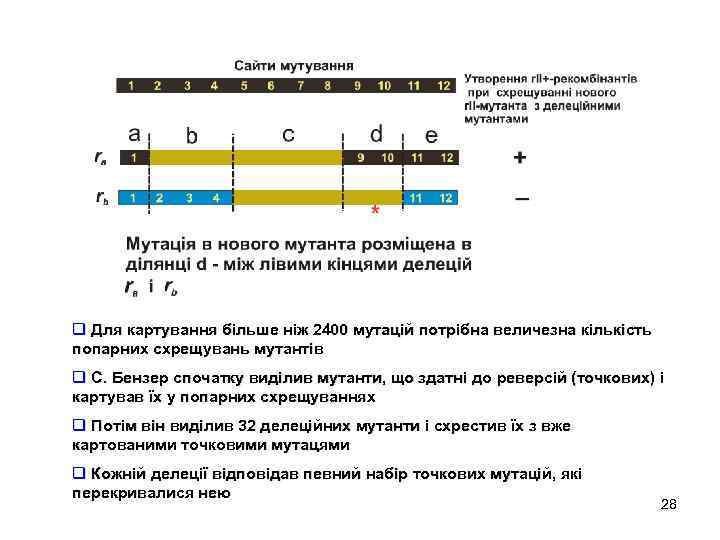
q Для картування більше ніж 2400 мутацій потрібна величезна кількість попарних схрещувань мутантів q С. Бензер спочатку виділив мутанти, що здатні до реверсій (точкових) і картував їх у попарних схрещуваннях q Потім він виділив 32 делеційних мутанти і схрестив їх з вже картованими точковими мутацями q Кожній делеції відповідав певний набір точкових мутацій, які перекривалися нею 28

Процедура делеційного картування С. Бензера q C. Бензер розділив ділянку r. II на 47 відрізків, границі яких визначаються кінцями делецій q Для того, щоб віднести нову мутацію до одного з цих відрізків, достатньо провести трохи більше 10 схрещувань q У цих схрещуваннях визначається не частота рекомбінантів, а наявність r. II+-рекомбінантів після посіву на E. coli K 12(λ). q Якщо точкова мутація не перекривається делецією, то r. II+рекомбінанти утворюються, якщо перекривається – то не утворюється q Картування проходить у два етапи: § Новий мутант схрещують з 7 мутантами з великими делеціями § Після того, як встановлено в якій з 7 ділянок локалізована мутація, новий мутант схрещують з мутантами, які мають менші делеції q Делеційне картування має обмеження. Делеції суттєвих генів летальні 29

Делеційне картування нової мутації r. II+ _ _ + * + + _ _ * Нова мутація локалізована у ділянці А 4 f 30
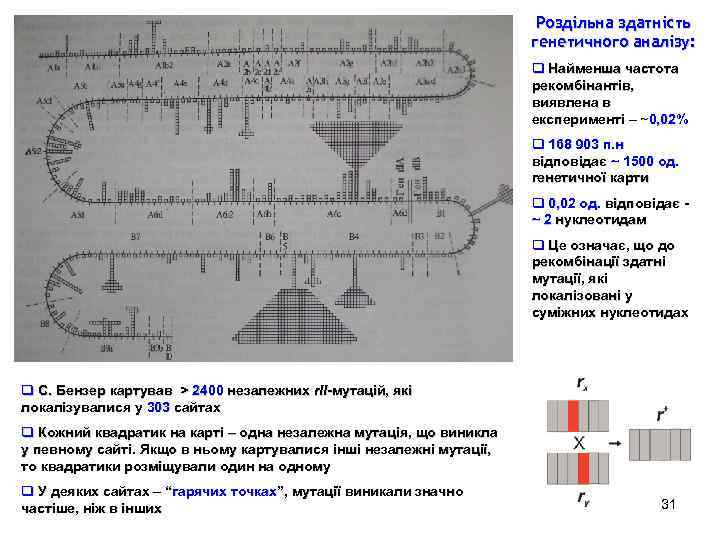
Роздільна здатність генетичного аналізу: q Найменша частота рекомбінантів, виявлена в експерименті – ~0, 02% q 168 903 п. н відповідає ~ 1500 од. генетичної карти q 0, 02 од. відповідає ~ 2 нуклеотидам q Це означає, що до рекомбінації здатні мутації, які локалізовані у суміжних нуклеотидах q С. Бензер картував > 2400 незалежних r. II-мутацій, які локалізувалися у 303 сайтах q Кожний квадратик на карті – одна незалежна мутація, що виникла у певному сайті. Якщо в ньому картувалися інші незалежні мутації, то квадратики розміщували один на одному q У деяких сайтах – “гарячих точках”, мутації виникали значно частіше, ніж в інших 31

Висновки С. Бензера q Ген – дискретна ділянка хромосоми, яка є окремою функціональною одиницею q Ген має складну мутаційну та рекомбінаційну структуру. Він побудований з лінійно розміщених елементів, потенційно здатних до змін (мутаційних сайтів). Кількість таких сайтів дорівнює кількості нуклеотидів у гені (ген r. IIA ~ 1800 п. н. , ген r. IIВ ~850 п. н. ) q Існують ділянки, де мутації відбуваються частіше, ніж в інших – “гарячі точки” мутацій q Внутрішньогенний кросинговер проходить з низькою частотою. Щоб виявити його, потрібно аналізувати велику кількість потомків від схрещування (десятки та сотні тисяч особин ) q Мінімальна генетична віддаль відповідає ~1 нуклеотиду q Кросинговером можуть бути розділені два суміжних нуклеотиди q Функціональні алелі (тобто зміни одного гена, які мають однаковий фенотиповий вияв) не обов’язково структурно алельні (можуть бути розділені кросинговером). Структурні алелі – це незалежні мутації, що виникли в тому самому нуклеотиді Одиниця мутації та рекомбінації – 1 п. н. 32
MG_7.ppt