комплекс косылыс1.pptx
- Количество слайдов: 34

Комплексті қосылыстар

Анықтама: Ø Бір атомды бір немесе бірнеше иондар мен молекулалар координациялағанда түзіледі Ø Бір немесе бірнеше координацияланған сферасы бар қосылыстар Ø Орталық ион және оны қоршайтын лигандалардан тұратын иондар немесе молекулалар Ø Лигандалар жиынтығы қоршаған орталық атом Ø Кристалл түйіндерінде өздігінен ерітінділерде түзілетін комплекстері бар қосылыстар

Альфред В е р н е р (1866— 1919 ж. ) 1898 ж комплексті қосылыстар теориясын (координациялық теория) ұсынды: Ø Комплексті косылыста оң зарядталған орталык ион, не атом к о м п л е кс т ү з у ш і деп аталады. Комплекс түзушілер көбінесе dэлементтер (Cu, Ag, Pt, Cr, Fe т. б. ), кейбір сілтілік және сілтілік-жер металдары (Na, Ca, Mg т. б. ). Ø Орталық комплекс түзуші ионның айналасындағы қарсы зарядталған иондар немесе бейтарап молекулалар – лигандалар (лат. Ligara - байланыстырушы). Ø Орталық комплекс түзуші иондар айналасын координациялайтын лигандарлар саны – координациялық сан деп аталады.
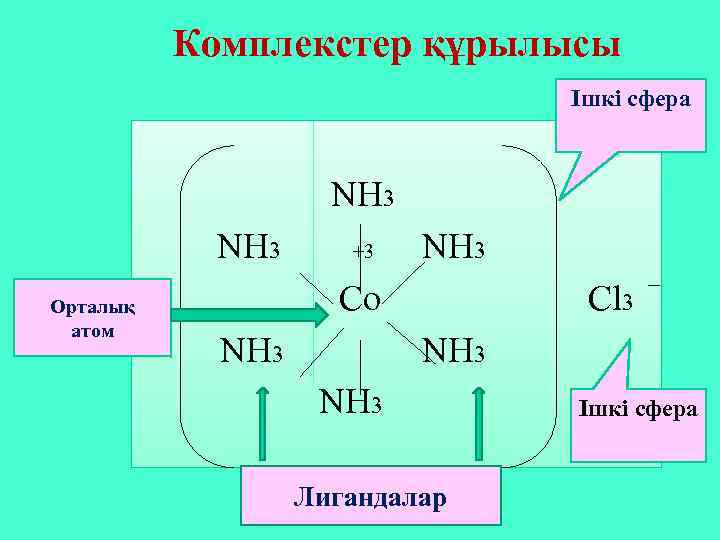
Комплекстер құрылысы Ішкі сфера NH 3 Орталық атом +3 NH 3 Co NH 3 Cl 3 NH 3 Лигандалар Ішкі сфера
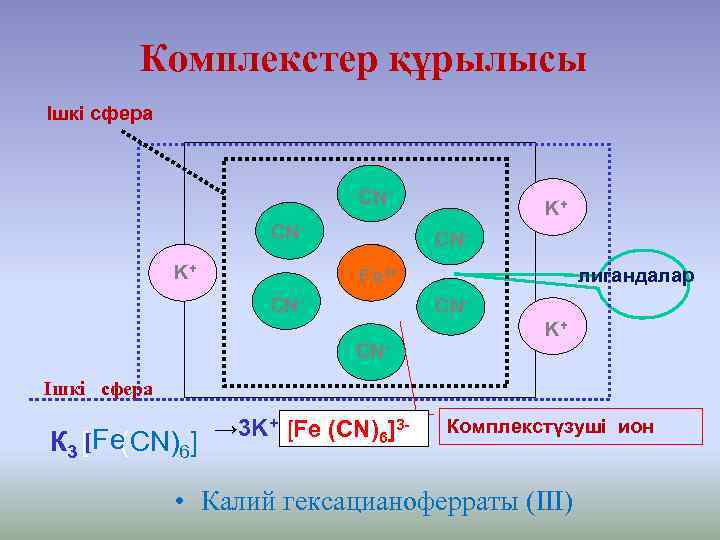
Комплекстер құрылысы Ішкі сфера CNCNK+ K+ CNлигандалар Fe 3+ CN- CNK+ CN- Ішкі сфера К 3 [[Fe(CN)6] → 3 K+ [Fe (CN)6]3 - Комплекстүзуші ион • Калий гексацианоферраты (III)
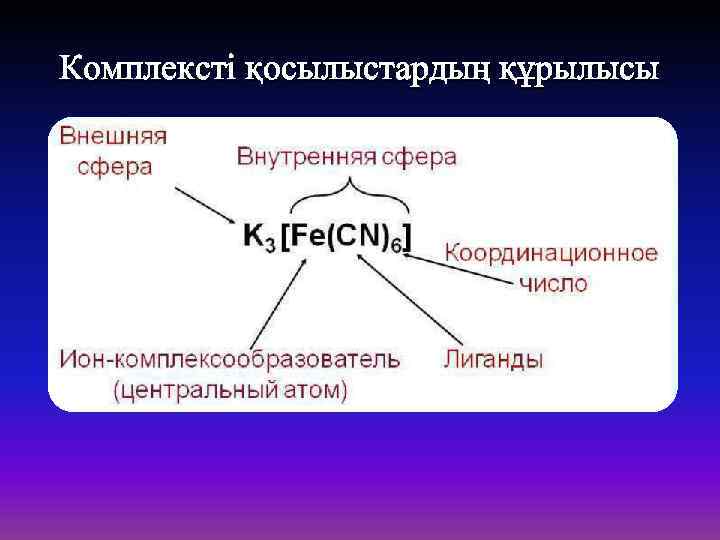
Комплексті қосылыстардың құрылысы

Орталық комплекс түзуіші ион зарядын анықтау Координациялық санға әсер ететін негізгі фактор – орталық ион заряды
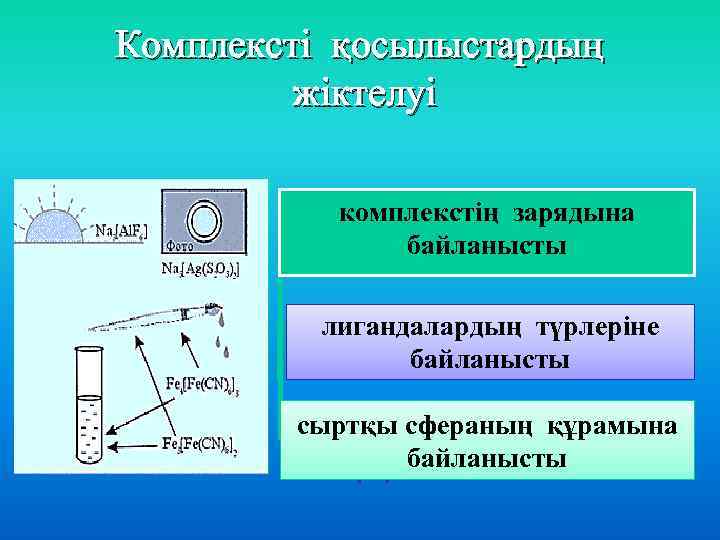
Комплексті қосылыстардың жіктелуі комплекстің зарядына байланысты лигандалардың түрлеріне байланысты сыртқы сфераның құрамына по составу внешней байланысты сферы

Лигандалар: Ø Бейтарап молекулалар: H 2 O, NH 3, CO Карбомид (NH 2)2 CO Этилендиамин NH 2 CH 2 NH 2 α-аминосірке қышқылы NH 2 COOH Ø Иондар: Cl-, J-, Br-, NO 2 -, OH-, CO 32 -
![Сыртқы сфераның құрамына байланысты жіктеу Қышқылдар H 2[Pt. Cl 6] Негіздер [Ag(NH 3)2]OH Тұздар Сыртқы сфераның құрамына байланысты жіктеу Қышқылдар H 2[Pt. Cl 6] Негіздер [Ag(NH 3)2]OH Тұздар](https://present5.com/presentation/1/258744455_437040132.pdf-img/258744455_437040132.pdf-10.jpg)
Сыртқы сфераның құрамына байланысты жіктеу Қышқылдар H 2[Pt. Cl 6] Негіздер [Ag(NH 3)2]OH Тұздар Na 3[Al. F 6] Бейэлектролиттер [Pt(NH 3)2 Cl 2]

Координацияланған лигандалар типі бойынша: 1. Aквакомплекстер – H 2 O. Комплекс түзушілер – тотығу дәрежесі +2 және одан жоғары металл катиондары. 2. Гидроксокомплекстер – OH- Комплекс түзушілер – амфотерлі металдар (Cr, Zn, Al). 3. Аммиакаттар - NH 3 Комплекс түзушілер – d-элементтер. 4. Ацидокомплекстер – бейорганикалық жіне органикалық қышқылдар.
![Лигандаларға байланысты жіктеу Аквакомплекстер Ацидокомплекстер [Fe(H 2 O)6]SO 4 K[Au(CN)4] [Al(H 2 O)6]Cl 3 Лигандаларға байланысты жіктеу Аквакомплекстер Ацидокомплекстер [Fe(H 2 O)6]SO 4 K[Au(CN)4] [Al(H 2 O)6]Cl 3](https://present5.com/presentation/1/258744455_437040132.pdf-img/258744455_437040132.pdf-12.jpg)
Лигандаларға байланысты жіктеу Аквакомплекстер Ацидокомплекстер [Fe(H 2 O)6]SO 4 K[Au(CN)4] [Al(H 2 O)6]Cl 3 K 3 [Al(C 2 O 4)3] Гидроксокомплекстер Аминокомплекстер Na[Al(OH)4] [Zn(NH 3)4]Cl 2 [Cu(NH 3)4]SO 4
![Ішкі сфера заряды бойынша: Катионды [Cr(H 2 O)4]3+Cl 3 Катионды анионды [Cu(NH 3)4]2+[Pt. Cl Ішкі сфера заряды бойынша: Катионды [Cr(H 2 O)4]3+Cl 3 Катионды анионды [Cu(NH 3)4]2+[Pt. Cl](https://present5.com/presentation/1/258744455_437040132.pdf-img/258744455_437040132.pdf-13.jpg)
Ішкі сфера заряды бойынша: Катионды [Cr(H 2 O)4]3+Cl 3 Катионды анионды [Cu(NH 3)4]2+[Pt. Cl 4]2 - Бейтарап [Pt. Cl 4(NH 3)2] Анионды K 2[Pt. Cl 6]2 -

КОМПЛЕКСТІ ҚОСЫЛЫСТАРДЫҢ НОМЕНКЛАТУРАСЫ САНАҚ бойынша АТАУЫ: ЛИГАНДАНЫҢ АТАУЫ: 2 - ди- H 2 O - аква 3 - три- NH 3 - амин 4 - тетра- СO - карбонил 5 - пента- OН- - гидроксо- 6 - гекса- (СN)- - циано (NO 2)- - нитро F-, Cl-, Br-, I- - фторо-, хлоро-, бромо-, йодо-

КОМПЛЕКСТІ АНИОНДАР АТАУЫ: +3 Fe - феррат +2 Cu - купрат + Ag - аргентат +3 Au - аурат +2 Hg - меркурат +2 Zn - цинкат +3 Al - алюминат Комплекс түзушінің латынша атауына байланысты ат жұрнағын жалғау арқылы түзіледі

Комплексті катионды атағанда ішкі сферадан бастап, алдымен саны кѳрсетіліп теріс зарядталган лигандалар, одан сон саны кѳрсетіліп бейтарап лигандтар, кейін орталык ион аталады. Мысалы: [Cu[(H 2 O)6]Cl 2. гексааквамыс (II) хлориді Комплексті анионды атағанда сыртқы сферадан бастап, орталық ион атауына –ат деген жалғау жалғап атайды. Мысалы: K 4 [Fe(CN)6] – калий гексацианоферраты (III) Бейтарап комплексті атағанда соңынан бастап, саны көрсетіліп теріс зарядталған лигандалар мен бейтарап лиганда, кейін орталық ион аталады. М: [Co(NH 3)3 Cl] – трихлоротриамин кобальт
![КОМПЛЕКСТІ ҚОСЫЛЫСТАРДЫҢ НОМЕНКЛАТУРАСЫ Na+2[Zn+2 (OH)-4] натрийдің тетрагидроксоцинкаты [Cr+3(H 2 O)06] Cl-3 гексааквахром(ІІІ) хлориді K+2 КОМПЛЕКСТІ ҚОСЫЛЫСТАРДЫҢ НОМЕНКЛАТУРАСЫ Na+2[Zn+2 (OH)-4] натрийдің тетрагидроксоцинкаты [Cr+3(H 2 O)06] Cl-3 гексааквахром(ІІІ) хлориді K+2](https://present5.com/presentation/1/258744455_437040132.pdf-img/258744455_437040132.pdf-17.jpg)
КОМПЛЕКСТІ ҚОСЫЛЫСТАРДЫҢ НОМЕНКЛАТУРАСЫ Na+2[Zn+2 (OH)-4] натрийдің тетрагидроксоцинкаты [Cr+3(H 2 O)06] Cl-3 гексааквахром(ІІІ) хлориді K+2 [Hg+2 I- 4] калийдің тетрайодо (ІІ) меркураты

ЗАТТАРДЫҢ ФОРМУЛАСЫН ҚҰРАСТЫРУ Калийдің гексахлороплатинаты (IV) Кобальттың (ІІІ) хлоронитротетрааммино нитраты Натрийдің гексагидроксохроматы (III) Никель (ІІ) гексааммино нитраты
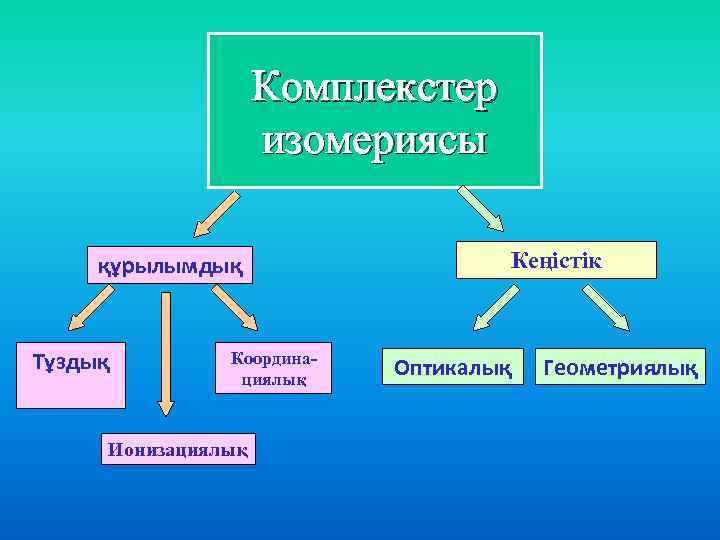
Комплекстер изомериясы құрылымдық Тұздық Координациялық Ионизациялық Кеңістік Оптикалық Геометриялық
![Изомерия түрлері Шарты Мысалы Гидраттық Су молекуласының комплексте орналасуына байланысты п/б [Cr(H 2 O)6]Cl Изомерия түрлері Шарты Мысалы Гидраттық Су молекуласының комплексте орналасуына байланысты п/б [Cr(H 2 O)6]Cl](https://present5.com/presentation/1/258744455_437040132.pdf-img/258744455_437040132.pdf-20.jpg)
Изомерия түрлері Шарты Мысалы Гидраттық Су молекуласының комплексте орналасуына байланысты п/б [Cr(H 2 O)6]Cl 3 - кулгін [Cr(H 2 O)5 Cl]Cl*H 2 O - кулгін –жасыл [Cr(H 2 O)4 Cl 2]Cl*2 H 2 O- жасыл Иондық Аниондардың ішкі және сыртқы сфераға әртүрлі таралуынан п/б [Co(NH 3)5 Br]SO 4 - қызыл-күлгін [Co(NH 3)5 SO 4] Br- қызыл Координация лық Екі түрлі лигандалардың екі түрлі комплекс түзуші айналасында әртүрлі жолмен координациялануынан п/б [Co(NH 3)6] [Cr(CN 6)] - I [Cr (NH 3)6] [Co(CN 6)] - II Геометриялы қ Октаэдрлі және квадратты комплекс құрамында 2 бірдей лиганда болғанда п/б Оптикалық Орталық атомы симметриялы емес октаэдрлі және тетраэдрлі комплекстеп және олардың симметриялы бейнесі 180 бұрылыста сыймайды. Дихлородиамин платина
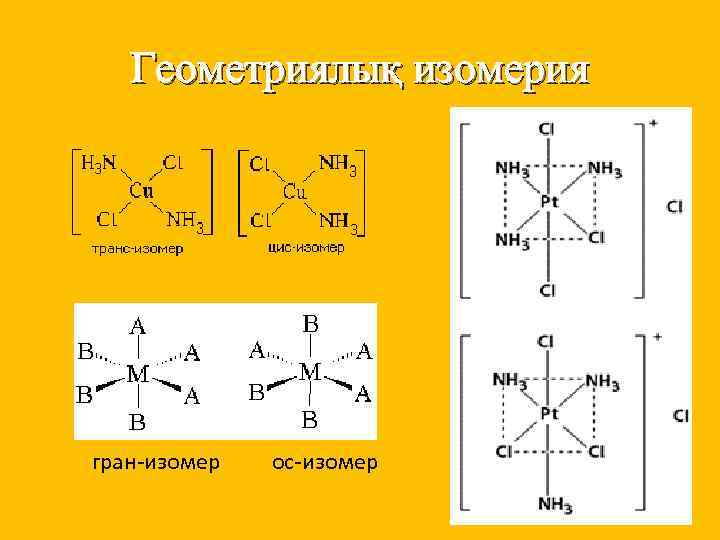
Геометриялық изомерия гран-изомер ос-изомер
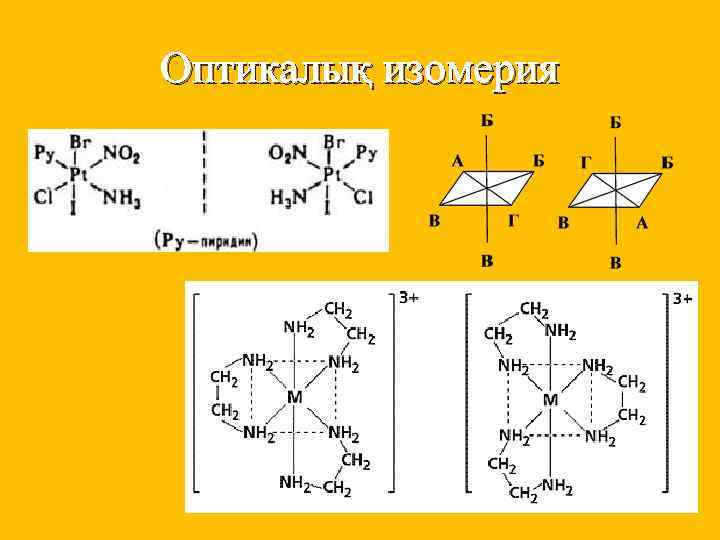
Оптикалық изомерия
![Координа циялық сан Құрылысы Мысал 2 Түзу сызықты Ag(NH 3)2]+ 3 Тең қабырғалы үшбұрыш Координа циялық сан Құрылысы Мысал 2 Түзу сызықты Ag(NH 3)2]+ 3 Тең қабырғалы үшбұрыш](https://present5.com/presentation/1/258744455_437040132.pdf-img/258744455_437040132.pdf-23.jpg)
Координа циялық сан Құрылысы Мысал 2 Түзу сызықты Ag(NH 3)2]+ 3 Тең қабырғалы үшбұрыш [(CH 3)3 S] [Hg. I 3] 4 тетраэдр немесе квадратты [Zn. Cl 4]2 - [Pt. Cl 4]2+ 5 үшбұрышты бипирамида квадратты пирамида Көп таралмаған 6 октаэдр [Co(NH 3)6] 3+

Геометрическое строение и тип гибридизации комплексных ионов
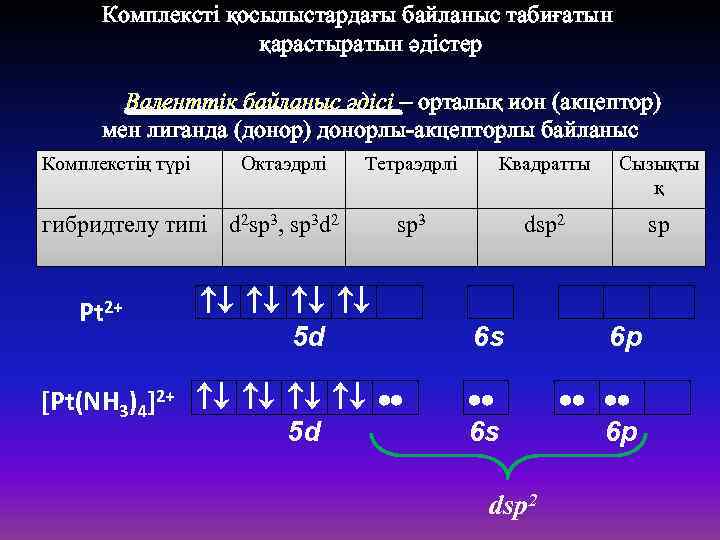
Комплексті қосылыстардағы байланыс табиғатын қарастыратын әдістер Валенттік байланыс әдісі – орталық ион (акцептор) мен лиганда (донор) донорлы-акцепторлы байланыс Комплекстің түрі Октаэдрлі арқылы. Тетраэдрлі Квадратты Сызықты қ гибридтелу типі d 2 sp 3, sp 3 d 2 Pt 2+ sp 3 5 d [Pt(NH 3)4]2+ 5 d dsp 2 sp 6 s 6 p 6 s 6 p dsp 2
![Строение ионов [Со(NH 3)6]3+ и [Co. F 6]3 - по МВС Строение ионов [Со(NH 3)6]3+ и [Co. F 6]3 - по МВС](https://present5.com/presentation/1/258744455_437040132.pdf-img/258744455_437040132.pdf-26.jpg)
Строение ионов [Со(NH 3)6]3+ и [Co. F 6]3 - по МВС
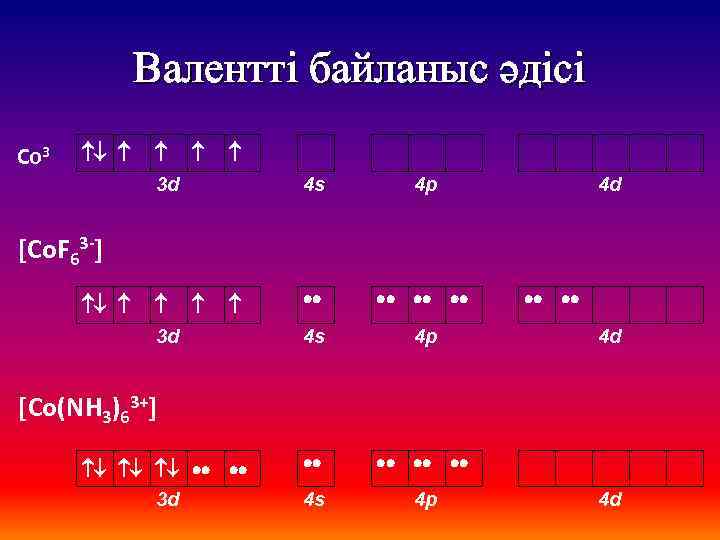
Валентті байланыс әдісі Со 3+ 3 d 4 s 4 p 4 d [Со. F 63 -] 3 d 4 d [Со(NH 3)63+] 4 d
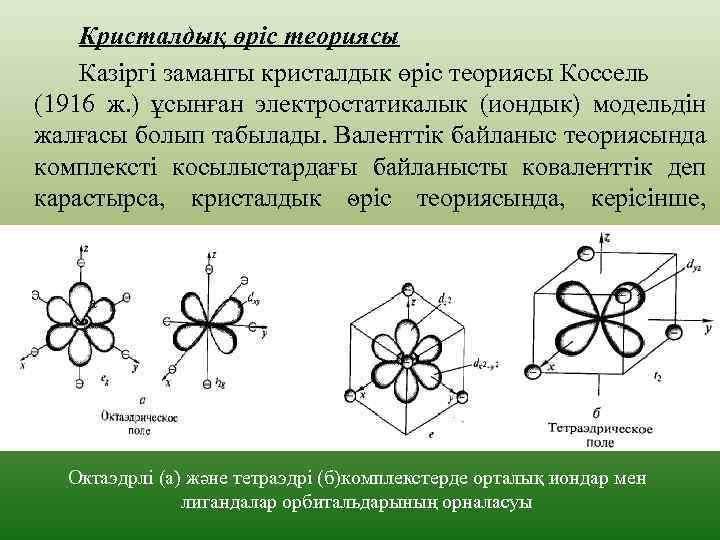
Кристалдық өріс теориясы Казіргі замангы кристалдык өріс теориясы Коссель (1916 ж. ) ұсынған электростатикалык (иондык) модельдін жалғасы болып табылады. Валенттік байланыс теориясында комплексті косылыстардағы байланысты коваленттік деп карастырса, кристалдык ѳріс теориясында, керісінше, иондык деп карастырылады. а Октаэдрлі (а) және тетраэдрі (б)комплекстерде орталық иондар мен лигандалар орбитальдарының орналасуы
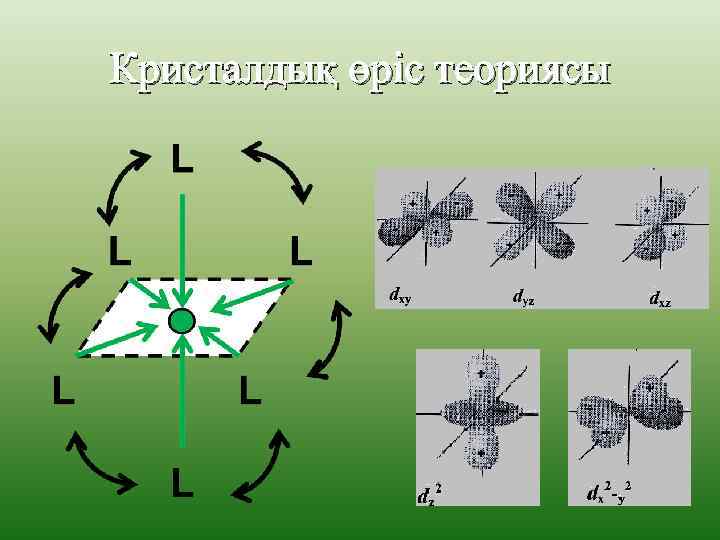
Кристалдық өріс теориясы
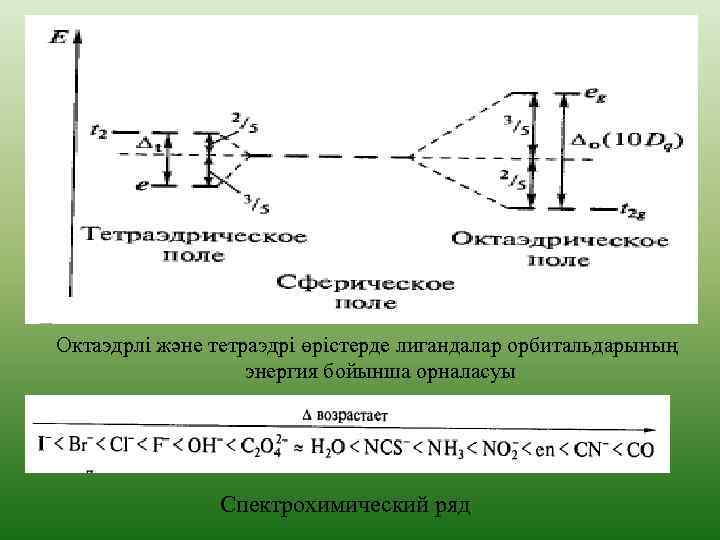
Октаэдрлі және тетраэдрі өрістерде лигандалар орбитальдарының энергия бойынша орналасуы Спектрохимический ряд
![[Co. F 6]3 - және [Co(NH 3)6]3+ иондарында электрондардың орбиталь бойынша орналасу энергетикалық диаграммасы [Co. F 6]3 - және [Co(NH 3)6]3+ иондарында электрондардың орбиталь бойынша орналасу энергетикалық диаграммасы](https://present5.com/presentation/1/258744455_437040132.pdf-img/258744455_437040132.pdf-31.jpg)
[Co. F 6]3 - және [Co(NH 3)6]3+ иондарында электрондардың орбиталь бойынша орналасу энергетикалық диаграммасы (p – жұптасу энергиясы)
![Со 3+ комплекстері үшін МО әдісі [Co. F 6]3 - ( sсв)2( рсв)6( dсв)4( Со 3+ комплекстері үшін МО әдісі [Co. F 6]3 - ( sсв)2( рсв)6( dсв)4(](https://present5.com/presentation/1/258744455_437040132.pdf-img/258744455_437040132.pdf-32.jpg)
Со 3+ комплекстері үшін МО әдісі [Co. F 6]3 - ( sсв)2( рсв)6( dсв)4( dразр)2 [Co(NH 3)6]3+ ( sсв)2( рсв)6( dсв)4( d)6
![Молекулалық орбитальдар әдісі Октаэдрлік комплекстің [Co(NH 3)6]3+ молекулалық орбитальдарының энергетикалық диаграммасы Молекулалық орбитальдар әдісі Октаэдрлік комплекстің [Co(NH 3)6]3+ молекулалық орбитальдарының энергетикалық диаграммасы](https://present5.com/presentation/1/258744455_437040132.pdf-img/258744455_437040132.pdf-33.jpg)
Молекулалық орбитальдар әдісі Октаэдрлік комплекстің [Co(NH 3)6]3+ молекулалық орбитальдарының энергетикалық диаграммасы
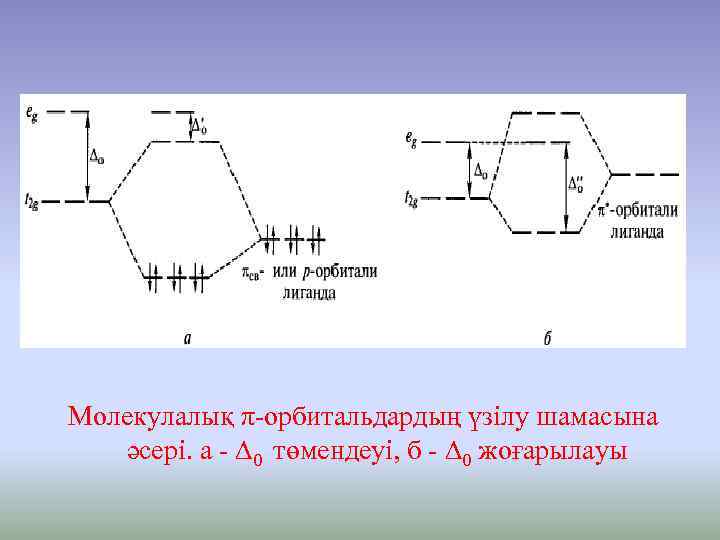
Молекулалық π-орбитальдардың үзілу шамасына әсері. а - ∆0 төмендеуі, б - ∆0 жоғарылауы
комплекс косылыс1.pptx