46cec31682923b39bc831c479a65bab2.ppt
- Количество слайдов: 21

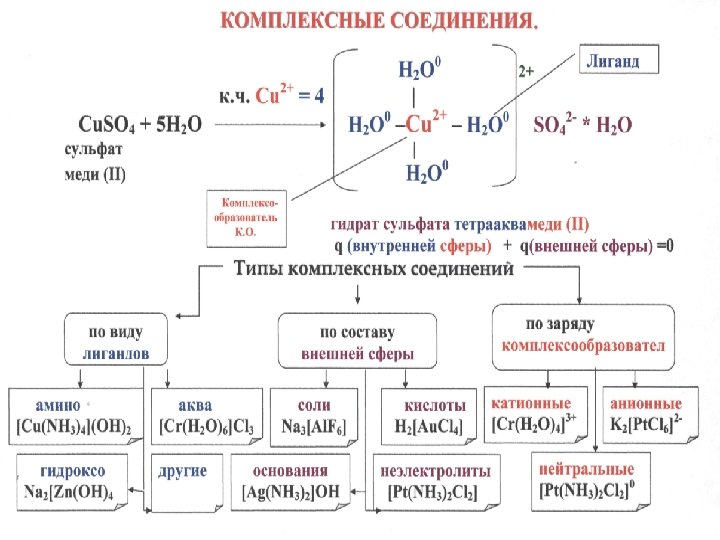
Комплексные соединения. витамин В 12, гемоглобин, хлорофилл и другие – играют важную роль в физиологических и биохимических процессах v часто имеют яркую окраску, поэтому их используют для проведения качественных реакций Cu. SO 4 * 5 H 2 O Ni. SO 4 * 7 H 2 O Co(NO 3)2 * 7 H 2 O v в качестве катализаторов v

Координационная теория, предложенная в 1893 году Альфредом Вернером и дополненная Л. А. Чугаевым.
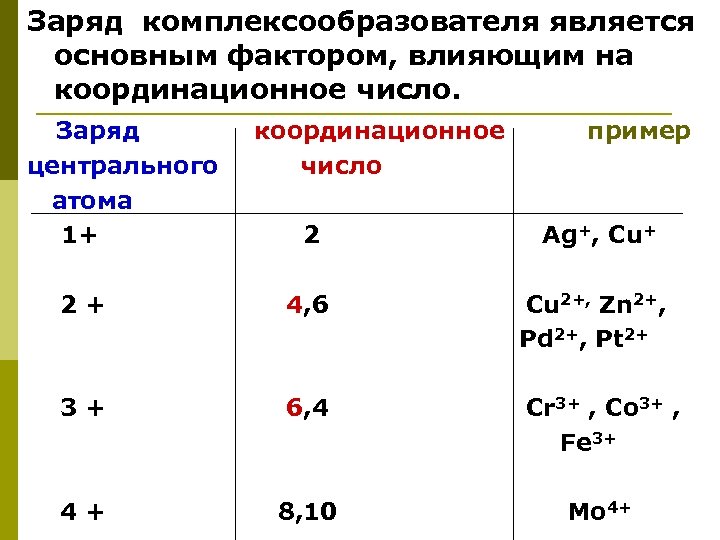
Заряд комплексообразователя является основным фактором, влияющим на координационное число. Заряд центрального атома 1+ координационное число пример 2 Ag+, Cu+ 2+ 4, 6 Cu 2+, Zn 2+, Pd 2+, Pt 2+ 3+ 6, 4 Cr 3+ , Co 3+ , Fe 3+ 4+ 8, 10 Mo 4+
![Вещества, в состав которых входят комплексные ионы, называются комплексными соединениями. q [внутренней сферы] +qвнешней Вещества, в состав которых входят комплексные ионы, называются комплексными соединениями. q [внутренней сферы] +qвнешней](https://present5.com/presentation/46cec31682923b39bc831c479a65bab2/image-5.jpg)
Вещества, в состав которых входят комплексные ионы, называются комплексными соединениями. q [внутренней сферы] +qвнешней сферы = 0 q К. О+q лигандов Правило! Заряд комплексного иона равен алгебраической сумме зарядов составляющих его простых ионов. Входящие в состав комплекса электронейтральные молекулы, например, NH 3, H 2 O, не влияют на величину его заряда. Поэтому при определении заряда комплексных ионов их можно не учитывать.

Алгоритм расчета заряда комплексного иона исходя из заряда комплексообразователя. [Cr 3+(H 2 O)4 Cl 2] 1. Проставить известные заряды простых ионов и нейтральных молекул [Cr 3+(H 2 O)04 Cl -2] 2. Произвести расчет, воспользовавшись правилом [Cr 3+(H 2 O)04 Cl -2]? 3+ 0 2= 1+ 3. Записать ответ [Cr 3+(H 2 O)04 Cl-2]+
![Упражнение № 1. Определите величину и знак заряда ионов: [Hg 2+Cl 4] , [Pt Упражнение № 1. Определите величину и знак заряда ионов: [Hg 2+Cl 4] , [Pt](https://present5.com/presentation/46cec31682923b39bc831c479a65bab2/image-7.jpg)
Упражнение № 1. Определите величину и знак заряда ионов: [Hg 2+Cl 4] , [Pt 4+(NH 3)3 Cl 3], [Mn 2+(OH)6], [Al 3+(H 2 O)2(OH)4]
![Алгоритм расчета заряда комплексообразователя исходя из заряда комплекса. K [Ptх (NH 3) Cl 5] Алгоритм расчета заряда комплексообразователя исходя из заряда комплекса. K [Ptх (NH 3) Cl 5]](https://present5.com/presentation/46cec31682923b39bc831c479a65bab2/image-8.jpg)
Алгоритм расчета заряда комплексообразователя исходя из заряда комплекса. K [Ptх (NH 3) Cl 5] 1. Проставить известный заряд внешней сферы K+ [Pt х (NH 3) Cl 5] 2. Определить заряд комплексного иона по известному заряду внешней сферы K+ [Ptх (NH 3) Cl 5] 3. Проставить значения зарядов всех частиц внутренней сферы [Pt х (NH 3)0 Cl - 5] 4. Произвести расчет, воспользовавшись правилом [Pt х (NH 3)0 Cl - 5] ? 0 5= 14+ 0 5= 15. Записать ответ К+ [Pt 4+ (NH 3)0 Cl -5]-

Упражнение № 2. Исходя из электронейтральности молекулы комплексного соединения, определите заряды комплексообразователей в солях: K[Au Cl 4], [Pt(NH 3)2]Cl 2, [Cu(NH 3)4](OH)2

Существует ряд методов установления координационных формул комплексных соединений: Co. Cl 3 * 6 NH 3 p в растворе не удавалось обнаружить ни ионов кобальта, ни молекул аммиака p ионы хлора легко и полностью осаждались из раствора [Co(NH 3)6]Cl 3 [Co(NH 3)6]3+ + 3 Clпервичная диссоциация большинство комплексных соединений - электролиты и по составу внешней сферы являются солями, кислотами или основаниями
![вторичная диссоциация является обратимой. [Co(NH 3)6]3+ ⇄ Co 3+ + 6 NH 3 Основные вторичная диссоциация является обратимой. [Co(NH 3)6]3+ ⇄ Co 3+ + 6 NH 3 Основные](https://present5.com/presentation/46cec31682923b39bc831c479a65bab2/image-11.jpg)
вторичная диссоциация является обратимой. [Co(NH 3)6]3+ ⇄ Co 3+ + 6 NH 3 Основные типы комплексных соединений 1. Аминокомплексные соединения– соединения, в которых лигандами служат молекулы аммиака, например: [Cu(NH 3)4]SO 4, [Pt(NH 3)6]Cl 4. Cu(OH)2 + 4 : NH 3 [Cu(NH 3)4]2+(OH)2 акцептор донор
![2. Аквакомплексные соединения – соединения, в которых лигандом выступает вода, например: [Al(H 2 O)6]Cl 2. Аквакомплексные соединения – соединения, в которых лигандом выступает вода, например: [Al(H 2 O)6]Cl](https://present5.com/presentation/46cec31682923b39bc831c479a65bab2/image-12.jpg)
2. Аквакомплексные соединения – соединения, в которых лигандом выступает вода, например: [Al(H 2 O)6]Cl 3, [Cr(H 2 O)6]Cl 3 и др. Соединения, содержащие воду как во внутренней, так и во внешней сфере, называют гидратами. Например: [Cu(H 2 O)4]SO 4*H 2 O Кристаллизационная вода связана менее прочно, чем координированная, и легче отдается при нагревании.

3. Гидроксокомплексы. Способность к образованию устойчивых гидроксокомплексов обусловливает амфотерные свойства соответствующих гидроксидов например Cu. SO 4 + 2 KOH K 2 SO 4 + Cu(OH)2↓ а) как основание Cu(OH)2 + 2 HCl Cu. Cl 2 + 2 H 2 O б) как кислота Cu(OH)2 + 2 KOH K 2[Cu(OH)4]

Принцип построения названия комплексной частицы: число одинаковых- название-название центрального лигандов атома Дополнительные данные для построения систематических названий комплексных соединений. 1 -моно, 2 -ди, 3 -три, 4 -тетра, 5 -пента, 6 -гекса Названия анионных лигандов: F--фторо, Cl--хлоро, S 2 -- тио, ОН--гидроксо, CN-- циано, NCS--тиоцианато, NO 2 - – нитро, CO 32 - – карбонато, PO 43 --фосфато, Н-- гидридо Названия катионных лигандов: H 3 O+ – оксоний, NH 4+ – аммоний Названия нейтральных лигандов: H 2 O – аква, NH 3 – аммин, СО – карбонил, NO – нитрозил

Номенклатура комплексных соединений Название строится по аналогии со средними солями, но с указанием лигандов. Число одинаковых лигандов указывают греческими числительными. Построим название комплексного соединения медного купороса: [Cu(H 2 O)4]SO 4*H 2 O моногидрат сульфата тетрааквамеди(II)
![[ Pt (NH 3)4 (OH)2]SO 4 Тест. 1 вариант А 1. Комплексообразователем в указанном [ Pt (NH 3)4 (OH)2]SO 4 Тест. 1 вариант А 1. Комплексообразователем в указанном](https://present5.com/presentation/46cec31682923b39bc831c479a65bab2/image-16.jpg)
[ Pt (NH 3)4 (OH)2]SO 4 Тест. 1 вариант А 1. Комплексообразователем в указанном соединении является атом: а) S б) Pt в) N г)H А 2. КЧ комплексообразователя в указанном соединении равно: а) 2 б) 4 в) 5 г) 6 д) 8 А 3. Лигандами в данном соединении являются: а) ион платины и сульфат-ион б) сульфат-ион, молекулы аммиака и гидроксид-ионы в) молекулы аммиака и сульфат-ион д) гидроксид-ионы и молекулы аммиака А 4. Ионы, относящиеся к внешней сфере - это: а) гидроксид-ионы б) ион платины в) сульфат-ион г)сульфат-ион и гидроксид-ионы А 5 Заряд комплексообразователя в указанной соли равен: а) 1+ б) 2+ в) 3+ г) 4+ А 6. Правильное название данного комплексного соединения а) гидроксид тетраамминплатины(IV) б) гидроксид и сульфат амминплатины(IV) в) гидроксид сульфаттетраамминплатины(IV) г) сульфат дигидроксотетраамминплатины(IV)

В 1. Запишите структурную формулу данного комплексного соединения. В 2. Запишите уравнение диссоциации данного соединения на ионы по первой ступени.
![Упр. 1 Определите величину и знак заряда ионов: [Сr 3+(H 2 O)4 Cl 2], Упр. 1 Определите величину и знак заряда ионов: [Сr 3+(H 2 O)4 Cl 2],](https://present5.com/presentation/46cec31682923b39bc831c479a65bab2/image-18.jpg)
Упр. 1 Определите величину и знак заряда ионов: [Сr 3+(H 2 O)4 Cl 2], [Ag+(CN)2], [Co 3+(NO 2)6], [Cr 3+(NH 3)5 Cl], [Pt 4+Cl 6] Упр. 2 Координационное число Co 3+=6. Запишите формулы комплексных ионов в солях: Co. Cl 3*6 H 2 O Co. Cl 3*5 NH 3 Упр. 3 Как распределяются молекулы воды в Ni. Cl 2*6 H 2 O, если К. Ч. Ni 2+ = 6

Упр. 4 Зная, что комплексообразователи Co 3+ и Pt 2+, составьте координационные структурные формулы комплексных солей: Ba. Pt(CN)4, Na 3 Co(NO 2)6 Упр. 5 Напишите уравнения диссоциации солей, зная что К. Ч. Co 3+=Cr 3+=6 Cr(NH 3)5 Cl 3, Co(NH 3)5(NO 2)3, KCo(NH 3)2(NO 2)4 Упр. 6 (На дом) Составьте формулы комплексных ионов, если К. О. - Cd 2+, его К. Ч. =6, лиганды- молекулы аммиака и цианид-ионы. Приведите примеры натриевых и кальциевых солей, хлоридов и сульфатов.

Упр. 7 Известны две комплексные соли трехзарядного кобальта, отвечающие составу Co. Cl. SO 4*5 NH 3. Раствор одной из них дает с хлоридом бария осадок, но не дает осадка с нитратом серебра. Другой – наоборот. Запишите комплексные соединения и укажите К. Ч. кобальта. Приведите уравнения указанных реакций. Упр. 8 Определите заряды К. О. в солях: K 2[Pt. Cl 6], K 4[Fe(CN)6], K 2[Pt. Cl 4], K 3[Fe(CN)6] Укажите названия солей.

Упр. 9 На какие ионы диссоциирует соединение гидроксид тетрамминмеди (II)? Упр. 10 Запишите уравнение реакции взаимодействия гидроксида меди (II) со щелочью, зная что в результате образуется комплексное соединение.
46cec31682923b39bc831c479a65bab2.ppt