лекция 8 изомерия-2014.pptx
- Количество слайдов: 31
 Комплексные соединения Лекция 8
Комплексные соединения Лекция 8
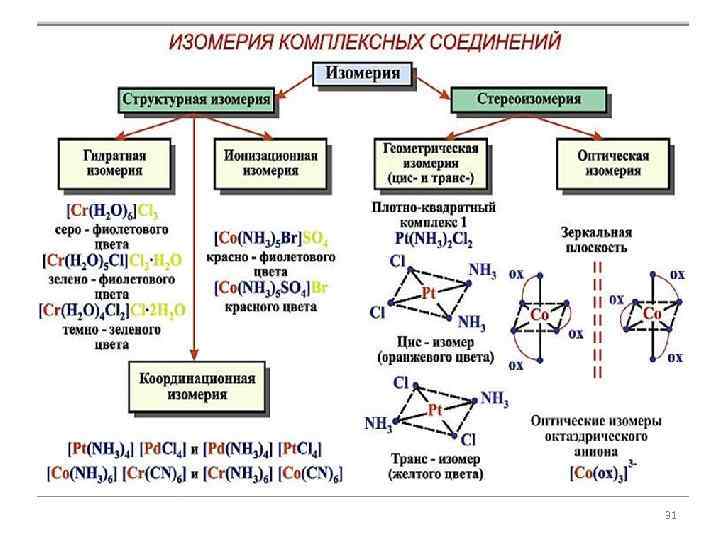
 Изомерия • (от греч. izos - равный, meros - мера) • способность веществ образовывать несколько соединений одинакового состава, отличающихся взаимным расположением атомов в молекуле, а следовательно, различных по свойствам. 2
Изомерия • (от греч. izos - равный, meros - мера) • способность веществ образовывать несколько соединений одинакового состава, отличающихся взаимным расположением атомов в молекуле, а следовательно, различных по свойствам. 2
 Изомерия комплексов обусловлена: • различиями в строении и координации лигандов, • различиями в строении внутренней координационной сферы, • разным распределением частиц между внутренней и внешней сферой. 3
Изомерия комплексов обусловлена: • различиями в строении и координации лигандов, • различиями в строении внутренней координационной сферы, • разным распределением частиц между внутренней и внешней сферой. 3
 Ионизационная изомерия • Cвязана с различным распределением заряженных лигандов между внешней и внутренней сферами комплексного соединения; • Лиганды во внутренней и внешней координационной сфере меняются местами. • [Co(NH 3)4 Cl 2]NO 3 и [Co(NH 3)4 Cl(NO 3)]Cl; • [Pt(NH 3)4 Cl 2]Br 2 и [Pt(NH 3)4 Br 2]Cl 2
Ионизационная изомерия • Cвязана с различным распределением заряженных лигандов между внешней и внутренней сферами комплексного соединения; • Лиганды во внутренней и внешней координационной сфере меняются местами. • [Co(NH 3)4 Cl 2]NO 3 и [Co(NH 3)4 Cl(NO 3)]Cl; • [Pt(NH 3)4 Cl 2]Br 2 и [Pt(NH 3)4 Br 2]Cl 2
 Сольватная (гидратная) изомерия – частный случай ионизационной изомерии • заключается в различном распределении молекул растворителя между внутренней и внешней сферами комплексного соединения, в различном характере химической связи молекул растворителя с комплексообразователем. 5
Сольватная (гидратная) изомерия – частный случай ионизационной изомерии • заключается в различном распределении молекул растворителя между внутренней и внешней сферами комплексного соединения, в различном характере химической связи молекул растворителя с комплексообразователем. 5
 Гидратная изомерия Cr. Cl 3. 6 H 2 O – три изомера Соединение Цвет [Cr(H 2 O)6]Cl 3 Фиолетовый [Cr(H 2 O)5 Cl]Cl 2. H 2 O Светло-зеленый [Cr(H 2 O)4 Cl 2]Cl. 2 H 2 O Темно-зеленый 6
Гидратная изомерия Cr. Cl 3. 6 H 2 O – три изомера Соединение Цвет [Cr(H 2 O)6]Cl 3 Фиолетовый [Cr(H 2 O)5 Cl]Cl 2. H 2 O Светло-зеленый [Cr(H 2 O)4 Cl 2]Cl. 2 H 2 O Темно-зеленый 6
 Связевая (солевая) изомерия • характерна для комплексов с амбидентатными лигандами. • Амбидентатный лиганд – лиганд, который может быть связан с комплексообразователем через разные атомы, входящие в его состав. 7
Связевая (солевая) изомерия • характерна для комплексов с амбидентатными лигандами. • Амбидентатный лиганд – лиганд, который может быть связан с комплексообразователем через разные атомы, входящие в его состав. 7
 Связевая (солевая) изомерия • тиоцианатный лиганд NCS- (роданид-анион) может присоединяться к центральному атому комплекса через атом азота и через атом серы: • если донорный атом S – тиоцианато-лиганд, • если донорный атом N – изотиоцианатолиганд 8
Связевая (солевая) изомерия • тиоцианатный лиганд NCS- (роданид-анион) может присоединяться к центральному атому комплекса через атом азота и через атом серы: • если донорный атом S – тиоцианато-лиганд, • если донорный атом N – изотиоцианатолиганд 8
![Связевая изомерия нитро- и нитрито-комплексы кобальта(III) Нитро- K 3[Co(NO 2)6] Нитрито- K 3[Co(ONO)6] 9 Связевая изомерия нитро- и нитрито-комплексы кобальта(III) Нитро- K 3[Co(NO 2)6] Нитрито- K 3[Co(ONO)6] 9](https://present5.com/presentation/1/138597551_327424295.pdf-img/138597551_327424295.pdf-9.jpg) Связевая изомерия нитро- и нитрито-комплексы кобальта(III) Нитро- K 3[Co(NO 2)6] Нитрито- K 3[Co(ONO)6] 9
Связевая изомерия нитро- и нитрито-комплексы кобальта(III) Нитро- K 3[Co(NO 2)6] Нитрито- K 3[Co(ONO)6] 9
 Лигандная изомерия • обусловлена существованием комплексов с изомерными формами лиганда. 10
Лигандная изомерия • обусловлена существованием комплексов с изомерными формами лиганда. 10
 Координационная изомерия • для комплексных солей, в которых и катион и анион являются комплексными • u. Pt (NH 3)4 Cl 4) (C • [Cu(NH 3)4][Pt. Cl 4] – фиолетовый цвет • [Pt(NH 3)4][Cu. Cl 4] – желто-коричневый цвет 11
Координационная изомерия • для комплексных солей, в которых и катион и анион являются комплексными • u. Pt (NH 3)4 Cl 4) (C • [Cu(NH 3)4][Pt. Cl 4] – фиолетовый цвет • [Pt(NH 3)4][Cu. Cl 4] – желто-коричневый цвет 11
 Координационная полимерия • связана с изменение молекулярной массы комплексного соединения (Pt. Cl 2(NH 3)2)n 12
Координационная полимерия • связана с изменение молекулярной массы комплексного соединения (Pt. Cl 2(NH 3)2)n 12
![(Pt. Cl 2(NH 3)2)n • Мономер [Pt(NH 3)2 Cl 2] – соль Пейроне, оба (Pt. Cl 2(NH 3)2)n • Мономер [Pt(NH 3)2 Cl 2] – соль Пейроне, оба](https://present5.com/presentation/1/138597551_327424295.pdf-img/138597551_327424295.pdf-13.jpg) (Pt. Cl 2(NH 3)2)n • Мономер [Pt(NH 3)2 Cl 2] – соль Пейроне, оба изомера (цис- и транс) желтого цвета; • Димеры [Pt(NH 3)4][Pt. Cl 4] – соль Магнуса, зеленого цвета; [Pt(NH 3)3 Cl][Pt(NH 3)Cl 3] • Тример [Pt(NH 3)3 Cl]2[Pt. Cl 4] – золотистый цвет 13
(Pt. Cl 2(NH 3)2)n • Мономер [Pt(NH 3)2 Cl 2] – соль Пейроне, оба изомера (цис- и транс) желтого цвета; • Димеры [Pt(NH 3)4][Pt. Cl 4] – соль Магнуса, зеленого цвета; [Pt(NH 3)3 Cl][Pt(NH 3)Cl 3] • Тример [Pt(NH 3)3 Cl]2[Pt. Cl 4] – золотистый цвет 13
 Геометрическая изомерия • вызвана неодинаковым размещением лигандов во внутренней сфере относительно друга; • необходимо наличие во внутренней координационной сфере не менее двух различных лигандов; 14
Геометрическая изомерия • вызвана неодинаковым размещением лигандов во внутренней сфере относительно друга; • необходимо наличие во внутренней координационной сфере не менее двух различных лигандов; 14
 Геометрическая изомерия • Комплексные соединения с тетраэдрическим, треугольным и линейным строением геометрических изомеров не имеют, поскольку места расположения лигандов двух разных видов вокруг центрального атома равноценны. 15
Геометрическая изомерия • Комплексные соединения с тетраэдрическим, треугольным и линейным строением геометрических изомеров не имеют, поскольку места расположения лигандов двух разных видов вокруг центрального атома равноценны. 15
 Геометрическая изомерия • проявляется преимущественно у комплексных соединений, имеющих октаэдрическое строение, строение плоского квадрата или квадратной пирамиды. 16
Геометрическая изомерия • проявляется преимущественно у комплексных соединений, имеющих октаэдрическое строение, строение плоского квадрата или квадратной пирамиды. 16
 Геометрическая изомерия • Изомер, в котором одинаковые лиганды расположены по одному ребру квадрата, называется цис-формой, а если по диагонали, это транс-изомер (от лат. cis - вместе, trans напротив). 17
Геометрическая изомерия • Изомер, в котором одинаковые лиганды расположены по одному ребру квадрата, называется цис-формой, а если по диагонали, это транс-изомер (от лат. cis - вместе, trans напротив). 17
![Геометрическая изомерия • Цисдихлородиамминплатина(II) [Pt(NH 3)2 Cl 2] оранжевожелтые кристаллы, хорошо растворимые в воде; Геометрическая изомерия • Цисдихлородиамминплатина(II) [Pt(NH 3)2 Cl 2] оранжевожелтые кристаллы, хорошо растворимые в воде;](https://present5.com/presentation/1/138597551_327424295.pdf-img/138597551_327424295.pdf-18.jpg) Геометрическая изомерия • Цисдихлородиамминплатина(II) [Pt(NH 3)2 Cl 2] оранжевожелтые кристаллы, хорошо растворимые в воде; обладает отчетливо выраженными противоопухолевыми свойствами. (цис-платин) • трансдихлородиамминплатина(II) – кристаллы бледно-желтого цвета, растворимость которых в воде несколько ниже, чем у цис-изомера. 18
Геометрическая изомерия • Цисдихлородиамминплатина(II) [Pt(NH 3)2 Cl 2] оранжевожелтые кристаллы, хорошо растворимые в воде; обладает отчетливо выраженными противоопухолевыми свойствами. (цис-платин) • трансдихлородиамминплатина(II) – кристаллы бледно-желтого цвета, растворимость которых в воде несколько ниже, чем у цис-изомера. 18
![Геометрическая изомерия Глицин (аминоуксусная кислота) [Pt(Gly)2] – диглицинатоплатина (II) Транс – менее растворим в Геометрическая изомерия Глицин (аминоуксусная кислота) [Pt(Gly)2] – диглицинатоплатина (II) Транс – менее растворим в](https://present5.com/presentation/1/138597551_327424295.pdf-img/138597551_327424295.pdf-19.jpg) Геометрическая изомерия Глицин (аминоуксусная кислота) [Pt(Gly)2] – диглицинатоплатина (II) Транс – менее растворим в воде, чем цис – изомер
Геометрическая изомерия Глицин (аминоуксусная кислота) [Pt(Gly)2] – диглицинатоплатина (II) Транс – менее растворим в воде, чем цис – изомер
![Катион дигидроксотетраамминкобальта(III) [Co(NH 3)4(OH)2]+ 20 Катион дигидроксотетраамминкобальта(III) [Co(NH 3)4(OH)2]+ 20](https://present5.com/presentation/1/138597551_327424295.pdf-img/138597551_327424295.pdf-20.jpg) Катион дигидроксотетраамминкобальта(III) [Co(NH 3)4(OH)2]+ 20
Катион дигидроксотетраамминкобальта(III) [Co(NH 3)4(OH)2]+ 20
![[Pt(NH 3)2 Cl 4] цис- (cis-) транс- (trans-) 21 [Pt(NH 3)2 Cl 4] цис- (cis-) транс- (trans-) 21](https://present5.com/presentation/1/138597551_327424295.pdf-img/138597551_327424295.pdf-21.jpg) [Pt(NH 3)2 Cl 4] цис- (cis-) транс- (trans-) 21
[Pt(NH 3)2 Cl 4] цис- (cis-) транс- (trans-) 21
 Геометрическая изомерия • Конфигурация с тремя одинаковыми лигандами, которые находятся по одному меридиану, получила название merизомер(ос-), (от англ. meridional – меридиональный) • если лиганды расположены на лицевой стороне, fac-изомер (гран-). ( от англ. facial лицевой). 22
Геометрическая изомерия • Конфигурация с тремя одинаковыми лигандами, которые находятся по одному меридиану, получила название merизомер(ос-), (от англ. meridional – меридиональный) • если лиганды расположены на лицевой стороне, fac-изомер (гран-). ( от англ. facial лицевой). 22
![Геометрическая изомерия [Co(NH 3)3 Cl 3] ос- (mer-) реберный гран- (fac-) граневой 23 Геометрическая изомерия [Co(NH 3)3 Cl 3] ос- (mer-) реберный гран- (fac-) граневой 23](https://present5.com/presentation/1/138597551_327424295.pdf-img/138597551_327424295.pdf-23.jpg) Геометрическая изомерия [Co(NH 3)3 Cl 3] ос- (mer-) реберный гран- (fac-) граневой 23
Геометрическая изомерия [Co(NH 3)3 Cl 3] ос- (mer-) реберный гран- (fac-) граневой 23
 Оптическая изомерия • связана со способностью некоторых комплексных соединений существовать в виде двух форм, не совмещаемых в трехмерном пространстве и являющихся зеркальным отображением друга
Оптическая изомерия • связана со способностью некоторых комплексных соединений существовать в виде двух форм, не совмещаемых в трехмерном пространстве и являющихся зеркальным отображением друга
 Оптическая изомерия • Оптические изомеры отличаются тем, что их растворы способны вращать плоскость поляризации светового луча. Один изомер вращает плоскость поляризации влево и поэтому называется L-изомером, другой – вправо и называется D-изомером. Два зеркальных изомера образуют пару энантиомеров. • (Аналогичная система обозначений применяется для изомеров органических соединений. ) 25
Оптическая изомерия • Оптические изомеры отличаются тем, что их растворы способны вращать плоскость поляризации светового луча. Один изомер вращает плоскость поляризации влево и поэтому называется L-изомером, другой – вправо и называется D-изомером. Два зеркальных изомера образуют пару энантиомеров. • (Аналогичная система обозначений применяется для изомеров органических соединений. ) 25
![Тригидрат триоксалатокобальтата(III) аммония (NH 4)3[Co(ox)3]. 3 H 2 O 26 Тригидрат триоксалатокобальтата(III) аммония (NH 4)3[Co(ox)3]. 3 H 2 O 26](https://present5.com/presentation/1/138597551_327424295.pdf-img/138597551_327424295.pdf-26.jpg) Тригидрат триоксалатокобальтата(III) аммония (NH 4)3[Co(ox)3]. 3 H 2 O 26
Тригидрат триоксалатокобальтата(III) аммония (NH 4)3[Co(ox)3]. 3 H 2 O 26
 Пример оптических изомеров трискомплекса M: Cr(III), Co(III), Rh(III) или Ir(III). 27
Пример оптических изомеров трискомплекса M: Cr(III), Co(III), Rh(III) или Ir(III). 27
![Оптическая изомерия • оптические изомеры комплекса [Ru(dipy)3]Cl 2 (dipy - обозначение 2, 2'-дипиридила): один Оптическая изомерия • оптические изомеры комплекса [Ru(dipy)3]Cl 2 (dipy - обозначение 2, 2'-дипиридила): один](https://present5.com/presentation/1/138597551_327424295.pdf-img/138597551_327424295.pdf-28.jpg) Оптическая изомерия • оптические изомеры комплекса [Ru(dipy)3]Cl 2 (dipy - обозначение 2, 2'-дипиридила): один из них, правовращающий, - сильный мышиный яд, а другой, левовращающий, действует как противоядие. 28
Оптическая изомерия • оптические изомеры комплекса [Ru(dipy)3]Cl 2 (dipy - обозначение 2, 2'-дипиридила): один из них, правовращающий, - сильный мышиный яд, а другой, левовращающий, действует как противоядие. 28
 Конформационная изомерия • способность комплексов изменять форму координационного полиэдра. • Эту разновидность изомерии, специфическую и весьма редкую, называют еще аллогональной (от греч. allos - различный, gonios - угол). 29
Конформационная изомерия • способность комплексов изменять форму координационного полиэдра. • Эту разновидность изомерии, специфическую и весьма редкую, называют еще аллогональной (от греч. allos - различный, gonios - угол). 29
 Спиновая изомерия • Спиновые изомеры - это координационные соединения, у которых в зависимости от температуры или какихлибо иных факторов изменяется лишь число неспаренных электронов, тогда как все остальное одинаково. Изомер, который содержит один неспаренный электрон, существует при низкой (<270 К) температуре, а второй, с пятью такими электронами, - при высокой. 30
Спиновая изомерия • Спиновые изомеры - это координационные соединения, у которых в зависимости от температуры или какихлибо иных факторов изменяется лишь число неспаренных электронов, тогда как все остальное одинаково. Изомер, который содержит один неспаренный электрон, существует при низкой (<270 К) температуре, а второй, с пятью такими электронами, - при высокой. 30
 31
31


