Комплексные соединения ива.ppt
- Количество слайдов: 38
 Комплексные соединения
Комплексные соединения
 Комплексные соединения – это соединения, в состав молекул которых входят ионы, устойчивые как в узлах кристаллической решетки, так же в растворе и расплаве.
Комплексные соединения – это соединения, в состав молекул которых входят ионы, устойчивые как в узлах кристаллической решетки, так же в растворе и расплаве.
 КООРДИНАЦИОННАЯ ТЕОРИЯ А. Вернер 1883 г. • 1: у атомов помимо главных валентностей существуют побочные, которые проявляют себя при некоторых реакциях. • 2: насыщением главных валентностей образуются соединения первого порядка, например NH 3, H 2 O, Cu. SO 4. • 3: насыщением побочных валентностей образуются соединения высшего порядка. Cu. SO 4 + 4 NH 3 → [Cu( NH 3)4]SO 4 Сульфат меди (II) соединение первого порядка Аммиак соединение первого порядка Сульфат тетрааминомеди (II) сочетание соединений первых порядков
КООРДИНАЦИОННАЯ ТЕОРИЯ А. Вернер 1883 г. • 1: у атомов помимо главных валентностей существуют побочные, которые проявляют себя при некоторых реакциях. • 2: насыщением главных валентностей образуются соединения первого порядка, например NH 3, H 2 O, Cu. SO 4. • 3: насыщением побочных валентностей образуются соединения высшего порядка. Cu. SO 4 + 4 NH 3 → [Cu( NH 3)4]SO 4 Сульфат меди (II) соединение первого порядка Аммиак соединение первого порядка Сульфат тетрааминомеди (II) сочетание соединений первых порядков
 Структура комплексных соединений • Комплексные соединения (КС) состоят из комплексообразователя (M) и лигандов (L), образующих внутреннюю сферу, и внешней сферы, состоящей из ионов, компенсирующих заряд внутренней сферы. • Общая формула комплексного соединения [ M L n ] Xm Внутренняя и внешняя сферы
Структура комплексных соединений • Комплексные соединения (КС) состоят из комплексообразователя (M) и лигандов (L), образующих внутреннюю сферу, и внешней сферы, состоящей из ионов, компенсирующих заряд внутренней сферы. • Общая формула комплексного соединения [ M L n ] Xm Внутренняя и внешняя сферы
 • М – Комплексообразователь ( центральный атом или ион) , является акцептором электронных пар. • В качестве комплексообразователя, чаще всего выступают катионы металлов. • По комплексообразующей способности они располагаются в ряд: f > d > p >> s • Для жизнедеятельности важное значение имеют комплексные соединения металлов: Fe, Mn, Co, Zn, Mo
• М – Комплексообразователь ( центральный атом или ион) , является акцептором электронных пар. • В качестве комплексообразователя, чаще всего выступают катионы металлов. • По комплексообразующей способности они располагаются в ряд: f > d > p >> s • Для жизнедеятельности важное значение имеют комплексные соединения металлов: Fe, Mn, Co, Zn, Mo
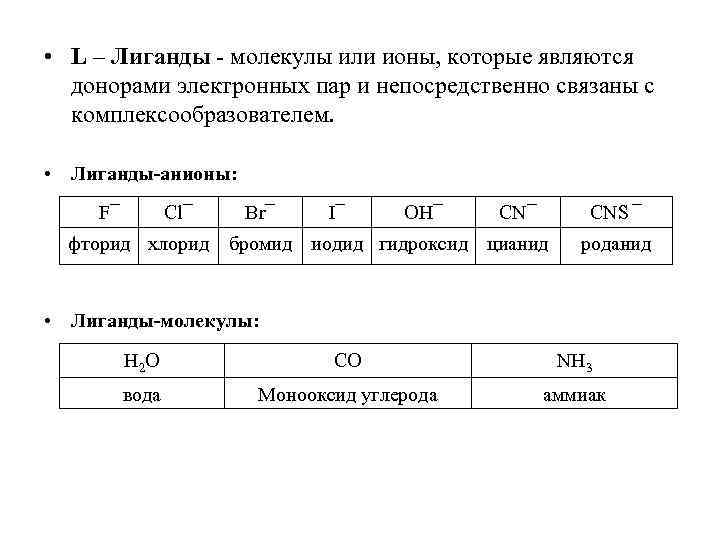 • L – Лиганды - молекулы или ионы, которые являются донорами электронных пар и непосредственно связаны с комплексообразователем. • Лиганды-анионы: F¯ Cl¯ Br¯ I¯ OH¯ CNS ¯ фторид хлорид бромид иодид гидроксид цианид роданид • Лиганды-молекулы: Н 2 О CO NH 3 вода Монооксид углерода аммиак
• L – Лиганды - молекулы или ионы, которые являются донорами электронных пар и непосредственно связаны с комплексообразователем. • Лиганды-анионы: F¯ Cl¯ Br¯ I¯ OH¯ CNS ¯ фторид хлорид бромид иодид гидроксид цианид роданид • Лиганды-молекулы: Н 2 О CO NH 3 вода Монооксид углерода аммиак
 n – Координационное число (КЧ) Обычно оно равно удвоенному заряду иона-комплексообразователя. Наиболее характерными КЧ являются 2, 4 и 6. 2: Ag+ 4: Cu²+ Zn²+ 6: Fe³+ Co³+
n – Координационное число (КЧ) Обычно оно равно удвоенному заряду иона-комплексообразователя. Наиболее характерными КЧ являются 2, 4 и 6. 2: Ag+ 4: Cu²+ Zn²+ 6: Fe³+ Co³+
![[M Ln] - Внутренняя сфера или комплексный ион, представляет совокупность центрального атома и лигандов. [M Ln] - Внутренняя сфера или комплексный ион, представляет совокупность центрального атома и лигандов.](https://present5.com/presentation/18788323_135632867/image-8.jpg) [M Ln] - Внутренняя сфера или комплексный ион, представляет совокупность центрального атома и лигандов. Заряд внутренней сферы равен алгебраической сумме зарядов комплексообразователя и всех лигандов: [Cu(NH 3)4] z Z=+2+4× 0=+2 [Co³+(NH 3)4(CN)2] z Z = + 3 + 4 × 0 + 2 (- 1) = + 1
[M Ln] - Внутренняя сфера или комплексный ион, представляет совокупность центрального атома и лигандов. Заряд внутренней сферы равен алгебраической сумме зарядов комплексообразователя и всех лигандов: [Cu(NH 3)4] z Z=+2+4× 0=+2 [Co³+(NH 3)4(CN)2] z Z = + 3 + 4 × 0 + 2 (- 1) = + 1
 Xm – Внешняя сфера – это положительно или отрицательно заряженные ионы, нейтрализующие заряд комплексного иона Суммарный заряд ионов внешней сферы всегда равен по значению и противоположен по знаку заряду внутренней сферы: [Cu 2+(NH 3)4] SО 42 - внутренняя внешняя сфера K+ [Ag+ (CN)2]- внешняя внутренняя сфера [Pt(NH 3)2 Cl 2]0 внутренняя сфера
Xm – Внешняя сфера – это положительно или отрицательно заряженные ионы, нейтрализующие заряд комплексного иона Суммарный заряд ионов внешней сферы всегда равен по значению и противоположен по знаку заряду внутренней сферы: [Cu 2+(NH 3)4] SО 42 - внутренняя внешняя сфера K+ [Ag+ (CN)2]- внешняя внутренняя сфера [Pt(NH 3)2 Cl 2]0 внутренняя сфера
 Классификация комплексных соединений 1. По принадлежности к классу соединений: • Кислоты - это комплексные соединения, внешняя сфера которых содержит ионы Н+ : H 2[Si. F 6], H [BF 4], H[Au. Cl 4] – водорода тетрахлороаурат (III) • Основания – это комплексные соединения , внешней сферой которых являются ионы OHˉ: [Ag(NH 3)2]OH], [Cu(NH 3)4](OH)2 – гидроксид тетраамминмедь (II) • Соли – это комплексные соединения, внешней сферой которых являются кислотные остатки: [Cu(NH 3)4]SO 4 - сульфат тетраамминмедь (II) или катионы металлов: К 4[Fe(CN)6] - гексацианоферрат (II) калия.
Классификация комплексных соединений 1. По принадлежности к классу соединений: • Кислоты - это комплексные соединения, внешняя сфера которых содержит ионы Н+ : H 2[Si. F 6], H [BF 4], H[Au. Cl 4] – водорода тетрахлороаурат (III) • Основания – это комплексные соединения , внешней сферой которых являются ионы OHˉ: [Ag(NH 3)2]OH], [Cu(NH 3)4](OH)2 – гидроксид тетраамминмедь (II) • Соли – это комплексные соединения, внешней сферой которых являются кислотные остатки: [Cu(NH 3)4]SO 4 - сульфат тетраамминмедь (II) или катионы металлов: К 4[Fe(CN)6] - гексацианоферрат (II) калия.
 2. По заряду комплексного иона: • Катионные - внутренняя сфера комплексного соединения заряжена положительно: [Cu(NH 3)4]2+, [Cd(NH 3)2]2+, [ Cr(H 2 O)6]3+ • Анионные - внутренняя сфера заряжена отрицательно: [Fe(CN)6]3 -, [Al. F 4]-, [Al(OH)6]3 • Электронейтральные - внутренняя сфера не имеет заряда. [Fe(CO)5]0, [Pt(NH 3)2 Br 4]0
2. По заряду комплексного иона: • Катионные - внутренняя сфера комплексного соединения заряжена положительно: [Cu(NH 3)4]2+, [Cd(NH 3)2]2+, [ Cr(H 2 O)6]3+ • Анионные - внутренняя сфера заряжена отрицательно: [Fe(CN)6]3 -, [Al. F 4]-, [Al(OH)6]3 • Электронейтральные - внутренняя сфера не имеет заряда. [Fe(CO)5]0, [Pt(NH 3)2 Br 4]0
![3. По природе лигандов: L - лиганд NH 3 Название аммиакаты Пример [Zn(NH 3)4]2+ 3. По природе лигандов: L - лиганд NH 3 Название аммиакаты Пример [Zn(NH 3)4]2+](https://present5.com/presentation/18788323_135632867/image-12.jpg) 3. По природе лигандов: L - лиганд NH 3 Название аммиакаты Пример [Zn(NH 3)4]2+ H 2 O CO аквакомплексы карбонилы [Cr(H 2 O)6]3+ [Fe(CO)5] OH- An. Анионы кислот гидрокси Ацидоком плексы [Zn(OH)4]2 - [Hg. I 4]2 -
3. По природе лигандов: L - лиганд NH 3 Название аммиакаты Пример [Zn(NH 3)4]2+ H 2 O CO аквакомплексы карбонилы [Cr(H 2 O)6]3+ [Fe(CO)5] OH- An. Анионы кислот гидрокси Ацидоком плексы [Zn(OH)4]2 - [Hg. I 4]2 -
 4. По дентатности лиганда (по числу атомов доноров) • Монодентатные лиганды ( «однозубые» ) - выступают донорами одной пары электронов: . . Cl-, F-, NH 3, H 2 O, CO
4. По дентатности лиганда (по числу атомов доноров) • Монодентатные лиганды ( «однозубые» ) - выступают донорами одной пары электронов: . . Cl-, F-, NH 3, H 2 O, CO
 • Полидентатные лиганды – имеют несколько донорных атомов. Бидентатные L: . . . . H 2 N-CH 2 - NH 2 ˉ OOC – COO ˉ Этилендиамин Дианион щавелевой кислоты Шестидентатный L: . . ˉ OOC- CH 2 COOˉ / : N-CH 2 -N: / . . ˉ OOC-CH 2 COOˉ Тетраанион этилендиаминтетрауксусной кислоты
• Полидентатные лиганды – имеют несколько донорных атомов. Бидентатные L: . . . . H 2 N-CH 2 - NH 2 ˉ OOC – COO ˉ Этилендиамин Дианион щавелевой кислоты Шестидентатный L: . . ˉ OOC- CH 2 COOˉ / : N-CH 2 -N: / . . ˉ OOC-CH 2 COOˉ Тетраанион этилендиаминтетрауксусной кислоты
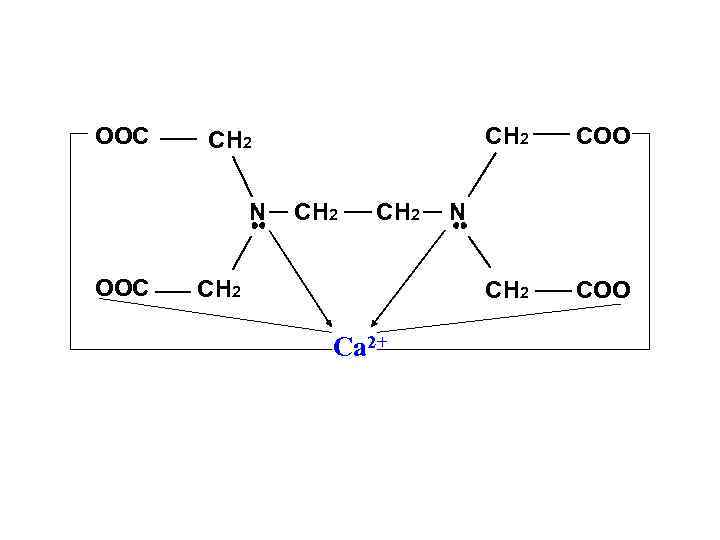
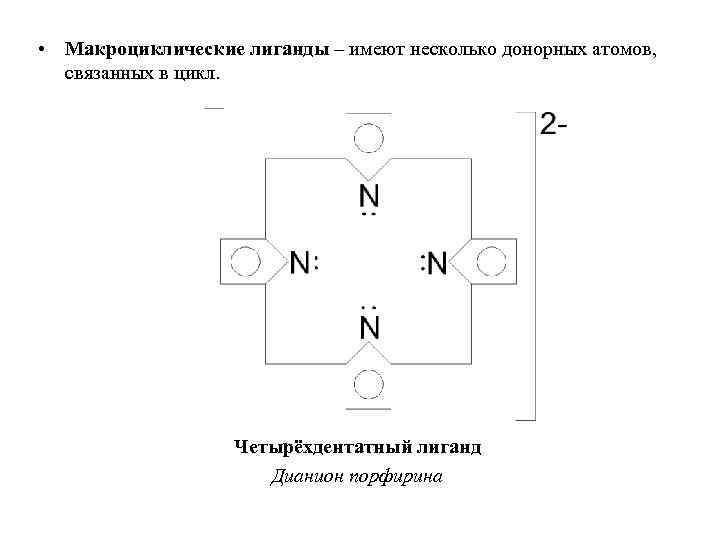 • Макроциклические лиганды – имеют несколько донорных атомов, связанных в цикл. Четырёхдентатный лиганд Дианион порфирина
• Макроциклические лиганды – имеют несколько донорных атомов, связанных в цикл. Четырёхдентатный лиганд Дианион порфирина
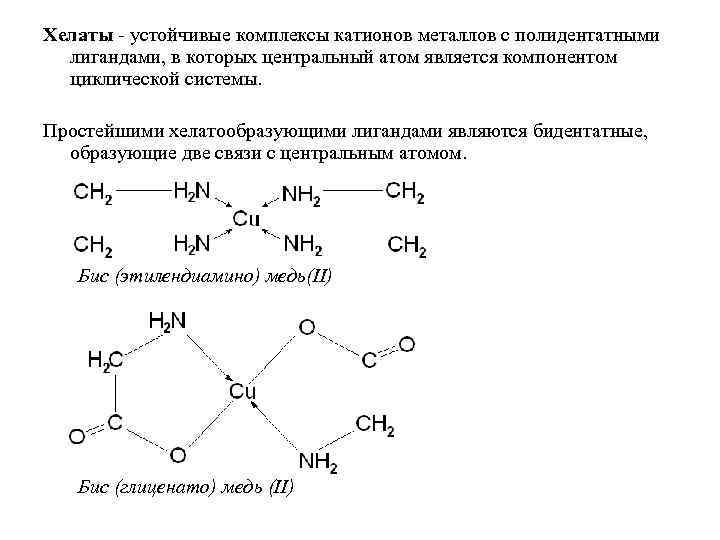 Хелаты - устойчивые комплексы катионов металлов с полидентатными лигандами, в которых центральный атом является компонентом циклической системы. Простейшими хелатообразующими лигандами являются бидентатные, образующие две связи с центральным атомом. Бис (этилендиамино) медь(II) Бис (глиценато) медь (II)
Хелаты - устойчивые комплексы катионов металлов с полидентатными лигандами, в которых центральный атом является компонентом циклической системы. Простейшими хелатообразующими лигандами являются бидентатные, образующие две связи с центральным атомом. Бис (этилендиамино) медь(II) Бис (глиценато) медь (II)
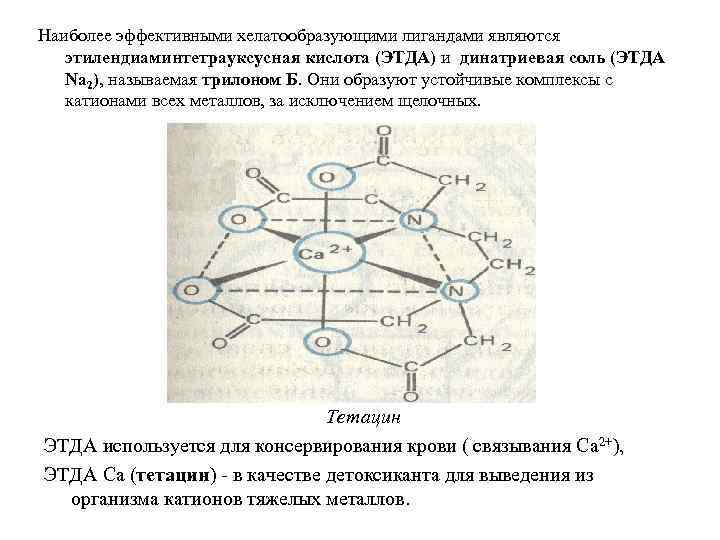 Наиболее эффективными хелатообразующими лигандами являются этилендиаминтетрауксусная кислота (ЭТДА) и динатриевая соль (ЭТДА Na 2), называемая трилоном Б. Они образуют устойчивые комплексы с катионами всех металлов, за исключением щелочных. Тетацин ЭТДА используется для консервирования крови ( связывания Ca 2+), ЭТДА Са (тетацин) - в качестве детоксиканта для выведения из организма катионов тяжелых металлов.
Наиболее эффективными хелатообразующими лигандами являются этилендиаминтетрауксусная кислота (ЭТДА) и динатриевая соль (ЭТДА Na 2), называемая трилоном Б. Они образуют устойчивые комплексы с катионами всех металлов, за исключением щелочных. Тетацин ЭТДА используется для консервирования крови ( связывания Ca 2+), ЭТДА Са (тетацин) - в качестве детоксиканта для выведения из организма катионов тяжелых металлов.
 OOC N OOC CH 2 Ca 2+ COO CH 2 COO N
OOC N OOC CH 2 Ca 2+ COO CH 2 COO N
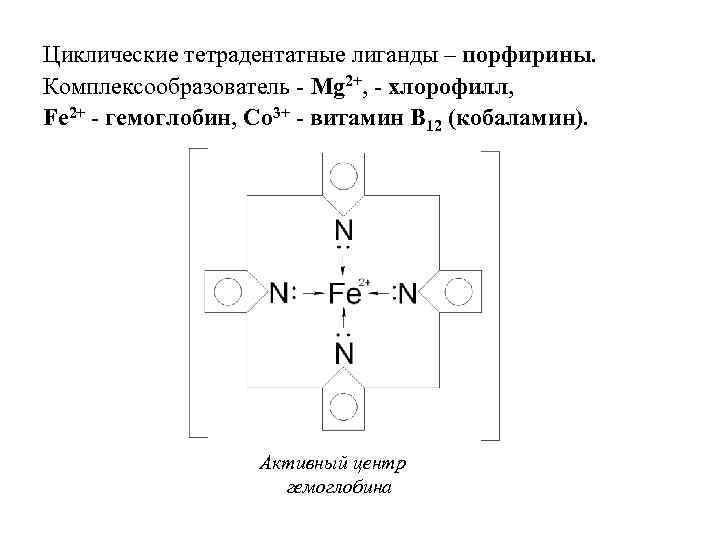 Циклические тетрадентатные лиганды – порфирины. Комплексообразователь - Mg 2+, - хлорофилл, Fe 2+ - гемоглобин, Со 3+ - витамин В 12 (кобаламин). Активный центр гемоглобина
Циклические тетрадентатные лиганды – порфирины. Комплексообразователь - Mg 2+, - хлорофилл, Fe 2+ - гемоглобин, Со 3+ - витамин В 12 (кобаламин). Активный центр гемоглобина
 Химическая связь в комплексных соединениях Связь: между центральным атомом и лигандами во внутренней сфере – донорно-акцепторная, между внутренней и внешней сферой – ионная. Cu 2+ + 4 NH 3 → [Cu(NH 3)4]2+ акцептор донор
Химическая связь в комплексных соединениях Связь: между центральным атомом и лигандами во внутренней сфере – донорно-акцепторная, между внутренней и внешней сферой – ионная. Cu 2+ + 4 NH 3 → [Cu(NH 3)4]2+ акцептор донор
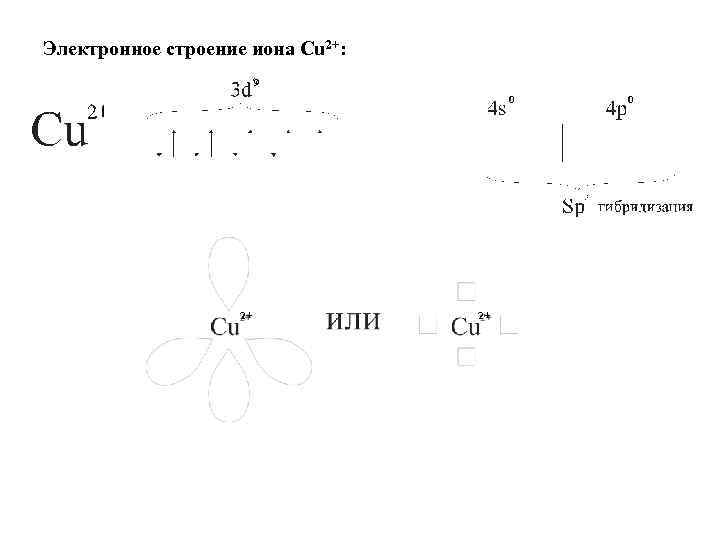 Электронное строение иона Сu 2+: 9 0 2+ 2+ 0
Электронное строение иона Сu 2+: 9 0 2+ 2+ 0
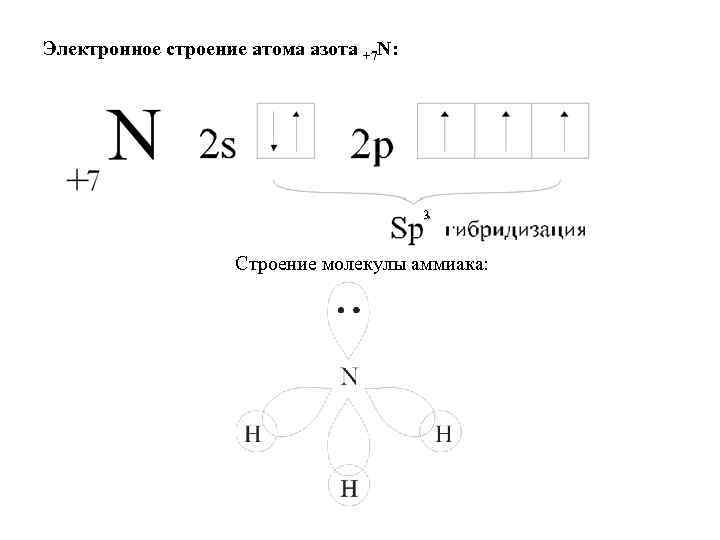 Электронное строение атома азота +7 N: 3 Строение молекулы аммиака:
Электронное строение атома азота +7 N: 3 Строение молекулы аммиака:
 4 sp 3 -АО азота с неподеленной парой электронов перекрываются с 4 свободными АО иона меди, образуя 4 равноценные двухэлектронные σ-связи N - Cu 2+ по донорно-акцепторному механизму
4 sp 3 -АО азота с неподеленной парой электронов перекрываются с 4 свободными АО иона меди, образуя 4 равноценные двухэлектронные σ-связи N - Cu 2+ по донорно-акцепторному механизму
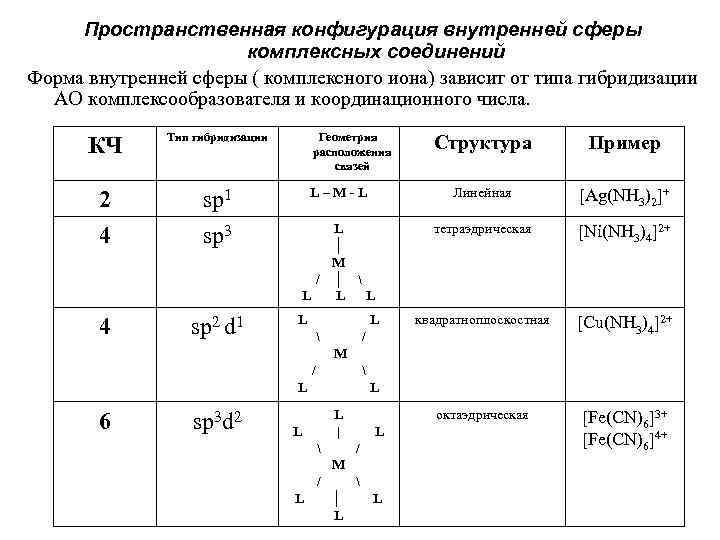 Пространственная конфигурация внутренней сферы комплексных соединений Форма внутренней сферы ( комплексного иона) зависит от типа гибридизации АО комплексообразователя и координационного числа. КЧ Тип гибридизации 2 4 sp 1 sp 3 4 sp 2 d 1 Геометрия расположения связей Структура Пример L–M-L Линейная [Ag(NH 3)2]+ L │ M / │ L L L тетраэдрическая [Ni(NH 3)4]2+ квадратноплоскостная [Cu(NH 3)4]2+ октаэдрическая [Fe(CN)6]3+ [Fe(CN)6]4+ L L / M / L 6 sp 3 d 2 L L | L L / M / L │ L L
Пространственная конфигурация внутренней сферы комплексных соединений Форма внутренней сферы ( комплексного иона) зависит от типа гибридизации АО комплексообразователя и координационного числа. КЧ Тип гибридизации 2 4 sp 1 sp 3 4 sp 2 d 1 Геометрия расположения связей Структура Пример L–M-L Линейная [Ag(NH 3)2]+ L │ M / │ L L L тетраэдрическая [Ni(NH 3)4]2+ квадратноплоскостная [Cu(NH 3)4]2+ октаэдрическая [Fe(CN)6]3+ [Fe(CN)6]4+ L L / M / L 6 sp 3 d 2 L L | L L / M / L │ L L
![Диссоциация комплексных соединений • Первая ступень: [Cu(NH 3)4]SO 4 → [Cu(NH 3)4]2+ + SO Диссоциация комплексных соединений • Первая ступень: [Cu(NH 3)4]SO 4 → [Cu(NH 3)4]2+ + SO](https://present5.com/presentation/18788323_135632867/image-25.jpg) Диссоциация комплексных соединений • Первая ступень: [Cu(NH 3)4]SO 4 → [Cu(NH 3)4]2+ + SO 42 В водных растворах диссоциация по первой ступени связана с разрывом ионной связи, она практически необратима.
Диссоциация комплексных соединений • Первая ступень: [Cu(NH 3)4]SO 4 → [Cu(NH 3)4]2+ + SO 42 В водных растворах диссоциация по первой ступени связана с разрывом ионной связи, она практически необратима.
![• Вторая ступень: [Cu(NH 3)4]2+ ↔ Cu 2+ + 4 NH 3 Диссоциация • Вторая ступень: [Cu(NH 3)4]2+ ↔ Cu 2+ + 4 NH 3 Диссоциация](https://present5.com/presentation/18788323_135632867/image-26.jpg) • Вторая ступень: [Cu(NH 3)4]2+ ↔ Cu 2+ + 4 NH 3 Диссоциация по второй ступени – это распад внутренней сферы комплекса. Вторая ступень диссоциации, как всякий равновесный процесс характеризуется константой равновесия, называется константой нестойкости (Кн) [Cu 2+] [NH 3]4 1 Кн = ─────── Ку = ── [[Cu(NH 3)4]2+] Кн • Ку – константа устойчивости • Чем меньше Кн и больше Ку, тем прочнее комплекс.
• Вторая ступень: [Cu(NH 3)4]2+ ↔ Cu 2+ + 4 NH 3 Диссоциация по второй ступени – это распад внутренней сферы комплекса. Вторая ступень диссоциации, как всякий равновесный процесс характеризуется константой равновесия, называется константой нестойкости (Кн) [Cu 2+] [NH 3]4 1 Кн = ─────── Ку = ── [[Cu(NH 3)4]2+] Кн • Ку – константа устойчивости • Чем меньше Кн и больше Ку, тем прочнее комплекс.
 Разрушение комплексных соединений • Разрушение комплексных соединений происходит в тех случаях , когда компоненты внутренней сферы, вступая во взаимодействие с добавленным реагентом связываются с образованием : а) более устойчивого комплекса б) малодиссоциирующего соединения в) малорастворимого соединения: [Ag(NH 3)2]Cl + HNO 3 → Ag. Cl ↓+ NH 4 NO 3
Разрушение комплексных соединений • Разрушение комплексных соединений происходит в тех случаях , когда компоненты внутренней сферы, вступая во взаимодействие с добавленным реагентом связываются с образованием : а) более устойчивого комплекса б) малодиссоциирующего соединения в) малорастворимого соединения: [Ag(NH 3)2]Cl + HNO 3 → Ag. Cl ↓+ NH 4 NO 3
 Металло-лигандная патология I. Токсичность солей тяжелых металлов. Загрязнение окружающей среды катионами тяжелых металлов Hg, Cd, Pb, Cr, Ni Ведёт к отравлению
Металло-лигандная патология I. Токсичность солей тяжелых металлов. Загрязнение окружающей среды катионами тяжелых металлов Hg, Cd, Pb, Cr, Ni Ведёт к отравлению
 Механизм токсического действия катионов тяжелых Me: Мб. L + Mт↔Мб + Мm. L Мб. L- комплекс иона биогенного металла (Fe, Zn, Cu, Co) c , биолигандами Мт- ион тяжелого (токсического) металла Куст. Мт. L > Куст Мб. L=> Нарушение жизнедеятельности, токсикоз
Механизм токсического действия катионов тяжелых Me: Мб. L + Mт↔Мб + Мm. L Мб. L- комплекс иона биогенного металла (Fe, Zn, Cu, Co) c , биолигандами Мт- ион тяжелого (токсического) металла Куст. Мт. L > Куст Мб. L=> Нарушение жизнедеятельности, токсикоз
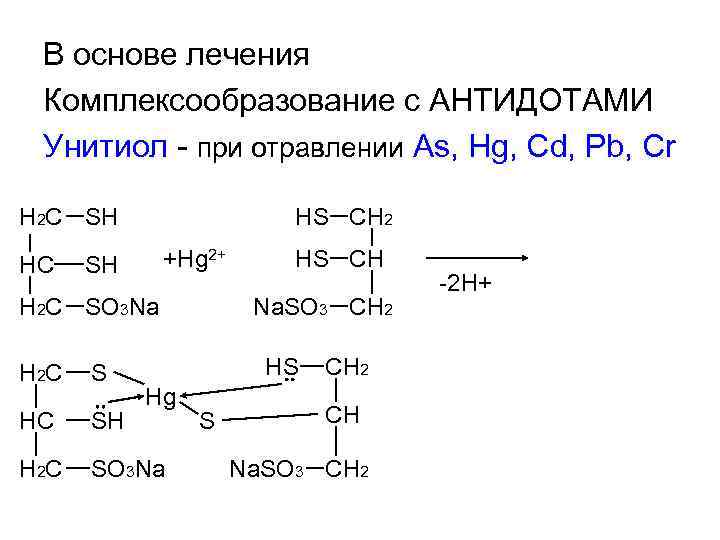 В основе лечения Комплексообразование с АНТИДОТАМИ Унитиол - при отравлении As, Hg, Cd, Pb, Cr H 2 C SH HC HS CH 2 +Hg 2+ SH H 2 C SO 3 Na HS CH Na. SO 3 CH 2 HS H 2 C S HC SH H 2 C SO 3 Na Hg S CH 2 CH Na. SO 3 CH 2 -2 H+
В основе лечения Комплексообразование с АНТИДОТАМИ Унитиол - при отравлении As, Hg, Cd, Pb, Cr H 2 C SH HC HS CH 2 +Hg 2+ SH H 2 C SO 3 Na HS CH Na. SO 3 CH 2 HS H 2 C S HC SH H 2 C SO 3 Na Hg S CH 2 CH Na. SO 3 CH 2 -2 H+
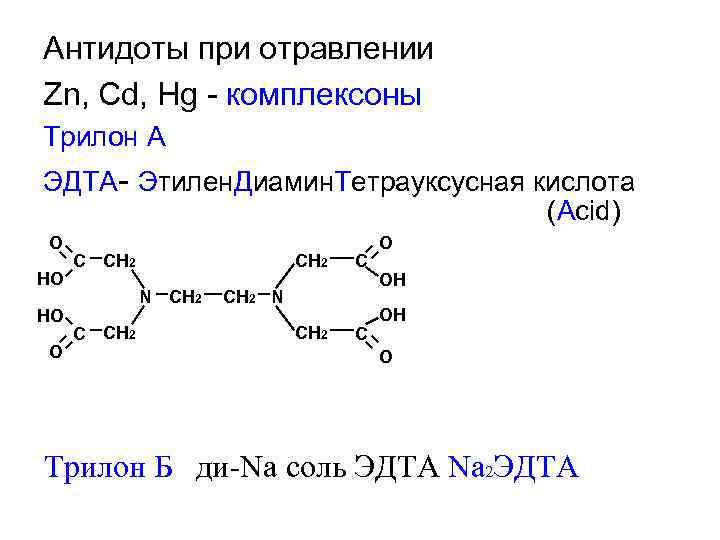 Антидоты при отравлении Zn, Cd, Hg - комплексоны Трилон А ЭДТА- Этилен. Диамин. Тетрауксусная кислота (Acid) O HO HO O C CH 2 N CH 2 C O OH OH O Трилон Б ди-Na соль ЭДТА Na 2 ЭДТА
Антидоты при отравлении Zn, Cd, Hg - комплексоны Трилон А ЭДТА- Этилен. Диамин. Тетрауксусная кислота (Acid) O HO HO O C CH 2 N CH 2 C O OH OH O Трилон Б ди-Na соль ЭДТА Na 2 ЭДТА
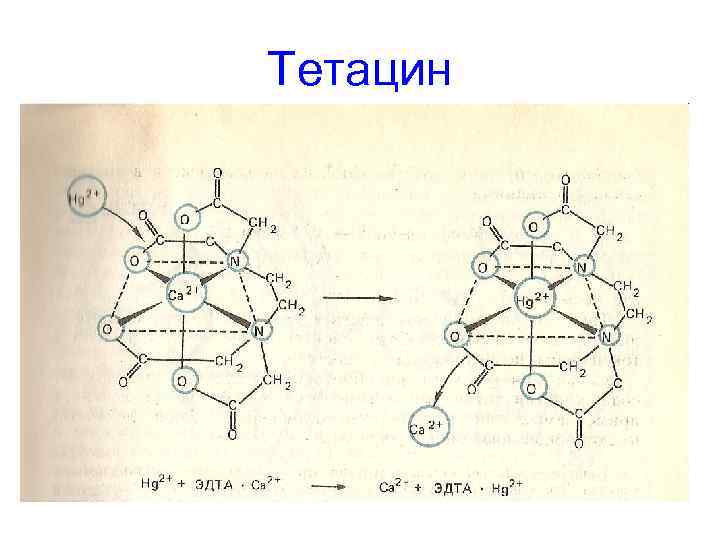 Тетацин
Тетацин
 Сd образует с О и N более прочные связи, чем Са. Соединение с Cd в организме не разрушается, легко выводится через почки
Сd образует с О и N более прочные связи, чем Са. Соединение с Cd в организме не разрушается, легко выводится через почки
 Применение комплексонов 1. Количественное определение микроэлементов в органах и тканях. 2. Очистка лекарственных препаратов от тяжёлых металлов. 3. Растворение камней в почках, желчном пузыре.
Применение комплексонов 1. Количественное определение микроэлементов в органах и тканях. 2. Очистка лекарственных препаратов от тяжёлых металлов. 3. Растворение камней в почках, желчном пузыре.
 II. Токсичность лигандов Cu. Lб + LT ↔ Cu. LT + Lб Cu. Lб – лизилоксидаза LT – лекарственный препарат в роли токсического лиганда Cu. LT – более прочный комплекс меди с токсичным лигандом Lб – инактивированный фермент
II. Токсичность лигандов Cu. Lб + LT ↔ Cu. LT + Lб Cu. Lб – лизилоксидаза LT – лекарственный препарат в роли токсического лиганда Cu. LT – более прочный комплекс меди с токсичным лигандом Lб – инактивированный фермент
![III. Недостаток биогенного металла в пище [Fe 2+] => синтез гемоглобина => железнодифицитная анемия III. Недостаток биогенного металла в пище [Fe 2+] => синтез гемоглобина => железнодифицитная анемия](https://present5.com/presentation/18788323_135632867/image-36.jpg) III. Недостаток биогенного металла в пище [Fe 2+] => синтез гемоглобина => железнодифицитная анемия
III. Недостаток биогенного металла в пище [Fe 2+] => синтез гемоглобина => железнодифицитная анемия
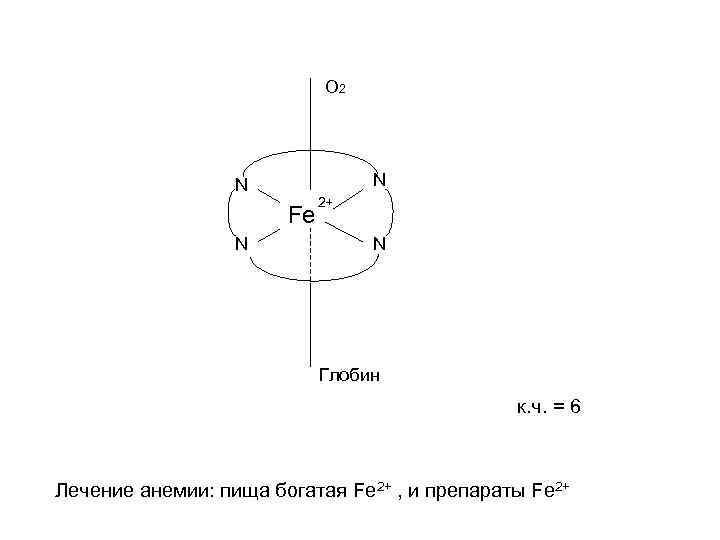 O 2 N N Fe N 2+ N Глобин к. ч. = 6 Лечение анемии: пища богатая Fe 2+ , и препараты Fe 2+
O 2 N N Fe N 2+ N Глобин к. ч. = 6 Лечение анемии: пища богатая Fe 2+ , и препараты Fe 2+
![[Нв Fe 2+] + O 2 ↔ [Hв Fe 2+ O 2] Дезоксигемоглабин оксигемоглобин [Нв Fe 2+] + O 2 ↔ [Hв Fe 2+ O 2] Дезоксигемоглабин оксигемоглобин](https://present5.com/presentation/18788323_135632867/image-38.jpg) [Нв Fe 2+] + O 2 ↔ [Hв Fe 2+ O 2] Дезоксигемоглабин оксигемоглобин [Нв Fe 2+] + СO ↔ [Hв Fe 2+ СО] Карбонилгемоглобин Куст. в 200 раз > Kуст. оксигемоглобина => При вдыхании СО нарушается транспорт О 2 => асфиксия, летальный исход
[Нв Fe 2+] + O 2 ↔ [Hв Fe 2+ O 2] Дезоксигемоглабин оксигемоглобин [Нв Fe 2+] + СO ↔ [Hв Fe 2+ СО] Карбонилгемоглобин Куст. в 200 раз > Kуст. оксигемоглобина => При вдыхании СО нарушается транспорт О 2 => асфиксия, летальный исход


