ХИМИЯ. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ.ppt
- Количество слайдов: 21
 КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
 Комплексные, или координационные, соединения относятся к многочисленному классу соединений, в состав которых могут входить как неорганические, так и органические соединения в виде нейтральных или заряженных частиц. По своей многочисленности они занимают второе место после органических соединений.
Комплексные, или координационные, соединения относятся к многочисленному классу соединений, в состав которых могут входить как неорганические, так и органические соединения в виде нейтральных или заряженных частиц. По своей многочисленности они занимают второе место после органических соединений.
 n Современная координационная химия связана с именем швейцарского химика А. Вернера, сформулировавшего основные положения координационной теории (1893 г. ). n По этой теории центром комплексного соединения является ион метала, как правило, d - элемента, реже p - элемента.
n Современная координационная химия связана с именем швейцарского химика А. Вернера, сформулировавшего основные положения координационной теории (1893 г. ). n По этой теории центром комплексного соединения является ион метала, как правило, d - элемента, реже p - элемента.
![Центральный ион (атом) комплексного соединения называется комплексообразователем. n В комплексных ионах [Cu(NH 3)4]2+, [Si. Центральный ион (атом) комплексного соединения называется комплексообразователем. n В комплексных ионах [Cu(NH 3)4]2+, [Si.](https://present5.com/presentation/3/-34950989_50597660.pdf-img/-34950989_50597660.pdf-4.jpg) Центральный ион (атом) комплексного соединения называется комплексообразователем. n В комплексных ионах [Cu(NH 3)4]2+, [Si. F 6]2 - , [Fe(CN)6]4 - , [BF 4]- комплексообразователями являются медь(II), кремний(IV), железо(II), бор(III). n Чаще всего комплексообразователем служит атом элемента в положительной степени окисления. n Атом-комплексообразователь может обладать нулевой степенью окисления. Так, карбонильные комплексы никеля и железа, имеющие состав [Ni(CO)4] и [Fe(CO)5], содержат атомы никеля(0) и железа(0).
Центральный ион (атом) комплексного соединения называется комплексообразователем. n В комплексных ионах [Cu(NH 3)4]2+, [Si. F 6]2 - , [Fe(CN)6]4 - , [BF 4]- комплексообразователями являются медь(II), кремний(IV), железо(II), бор(III). n Чаще всего комплексообразователем служит атом элемента в положительной степени окисления. n Атом-комплексообразователь может обладать нулевой степенью окисления. Так, карбонильные комплексы никеля и железа, имеющие состав [Ni(CO)4] и [Fe(CO)5], содержат атомы никеля(0) и железа(0).
 n Координационные (комплексные) соединения – это соединения, существующие как в кристаллическом состоянии, так и в растворах, особенностями которых являются наличие центрального иона или атомаакцептора электронов, окруженного лигандамидонорами электронов. n Лигандами могут быть ионы (OH-, NO 2 - и др. ) или нейтральные молекулы (NH 3, H 2 O, CO), , определенным образом расположенные вокруг центрального атома. n Лиганды характеризуются наличием: 1) донорных центров - нуклеофильных атомов, способных участвовать в координации; 2) дентатностью – количеством донорных центров лиганда, которые участвуют в координации (в этой связи различают моно- и полидентатные лиганды).
n Координационные (комплексные) соединения – это соединения, существующие как в кристаллическом состоянии, так и в растворах, особенностями которых являются наличие центрального иона или атомаакцептора электронов, окруженного лигандамидонорами электронов. n Лигандами могут быть ионы (OH-, NO 2 - и др. ) или нейтральные молекулы (NH 3, H 2 O, CO), , определенным образом расположенные вокруг центрального атома. n Лиганды характеризуются наличием: 1) донорных центров - нуклеофильных атомов, способных участвовать в координации; 2) дентатностью – количеством донорных центров лиганда, которые участвуют в координации (в этой связи различают моно- и полидентатные лиганды).
![Примеры лигандов n В комплексных ионах [Sn. Cl 6]2 - и [Fe(CN)6]4 - лигандами Примеры лигандов n В комплексных ионах [Sn. Cl 6]2 - и [Fe(CN)6]4 - лигандами](https://present5.com/presentation/3/-34950989_50597660.pdf-img/-34950989_50597660.pdf-6.jpg) Примеры лигандов n В комплексных ионах [Sn. Cl 6]2 - и [Fe(CN)6]4 - лигандами являются ионы Cl- и CN-, а в нейтральном комплексе [Cr(NH 3)3(NCS)3] лиганды – молекулы NH 3 и ионы NCS-. n Лиганды, как правило, не связаны друг с другом, и между ними действуют силы отталкивания. В отдельных случаях наблюдается межмолекулярное взаимодействие лигандов с образованием водородных связей.
Примеры лигандов n В комплексных ионах [Sn. Cl 6]2 - и [Fe(CN)6]4 - лигандами являются ионы Cl- и CN-, а в нейтральном комплексе [Cr(NH 3)3(NCS)3] лиганды – молекулы NH 3 и ионы NCS-. n Лиганды, как правило, не связаны друг с другом, и между ними действуют силы отталкивания. В отдельных случаях наблюдается межмолекулярное взаимодействие лигандов с образованием водородных связей.
 Внутренняя сфера n Комплексообразователь с лигандами образуют (внутреннюю сферу комплексного соединения), или комплексный ион. n Обозначается внутренняя сфера квадратными скобками: [Fe(CN)6]3 -, [Hg. I 4]2 -, [Sn. Cl 6]2 -. n В зависимости от соотношения суммарного заряда лигандов и комплексообразователя внутренняя сфера может иметь: n положительный заряд, например, [Al(H 2 O)6]3+, n либо отрицательный, например, [Ag(СN)2]-, n или нулевой заряд, например, как для [Cr(NH 3)3(NCS)3]0. n Заряд комплексного иона представляет собой алгебраическую сумму зарядов комплексообразователя и лигандов.
Внутренняя сфера n Комплексообразователь с лигандами образуют (внутреннюю сферу комплексного соединения), или комплексный ион. n Обозначается внутренняя сфера квадратными скобками: [Fe(CN)6]3 -, [Hg. I 4]2 -, [Sn. Cl 6]2 -. n В зависимости от соотношения суммарного заряда лигандов и комплексообразователя внутренняя сфера может иметь: n положительный заряд, например, [Al(H 2 O)6]3+, n либо отрицательный, например, [Ag(СN)2]-, n или нулевой заряд, например, как для [Cr(NH 3)3(NCS)3]0. n Заряд комплексного иона представляет собой алгебраическую сумму зарядов комплексообразователя и лигандов.
 Внешняя сфера n Ионы, нейтрализующие заряд внутренней сферы, но не связанные с комплексообразователем ковалентно, образуют внешнюю сферу комплексного соединения. Например, в комплексном соединении [Zn(NH 3)4]Cl 2 два иона Cl- находятся во внешней сфере:
Внешняя сфера n Ионы, нейтрализующие заряд внутренней сферы, но не связанные с комплексообразователем ковалентно, образуют внешнюю сферу комплексного соединения. Например, в комплексном соединении [Zn(NH 3)4]Cl 2 два иона Cl- находятся во внешней сфере:
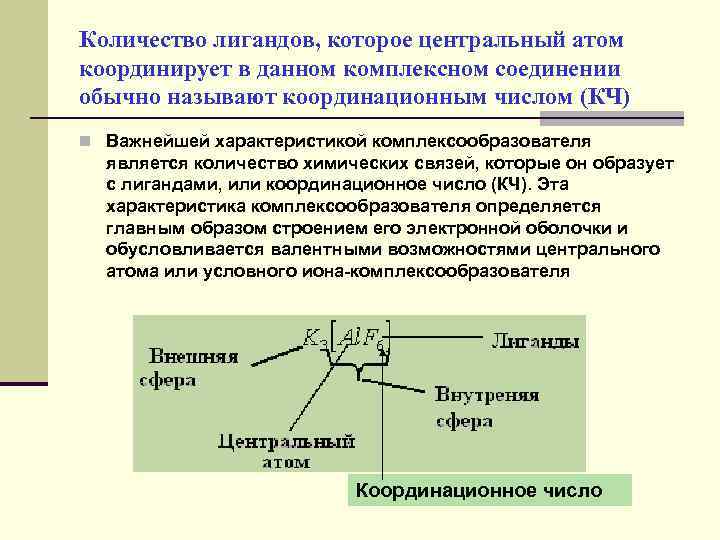 Количество лигандов, которое центральный атом координирует в данном комплексном соединении обычно называют координационным числом (КЧ) n Важнейшей характеристикой комплексообразователя является количество химических связей, которые он образует с лигандами, или координационное число (КЧ). Эта характеристика комплексообразователя определяется главным образом строением его электронной оболочки и обусловливается валентными возможностями центрального атома или условного иона-комплексообразователя Координационное число
Количество лигандов, которое центральный атом координирует в данном комплексном соединении обычно называют координационным числом (КЧ) n Важнейшей характеристикой комплексообразователя является количество химических связей, которые он образует с лигандами, или координационное число (КЧ). Эта характеристика комплексообразователя определяется главным образом строением его электронной оболочки и обусловливается валентными возможностями центрального атома или условного иона-комплексообразователя Координационное число
 Значение координационного числа n Значение координационного числа комплексообразователя зависит от его природы, степени окисления, природы лигандов и условий (температуры, природы растворителя, концентрации комплексообразователя и лигандов и др. ), при которых протекает реакция комплексообразования. Значение КЧ может меняться в различных комплексных соединениях от 2 до 8 и даже выше. n Наиболее распространенными координационными числами являются 4 и 6. n Координационные числа 3, 5, 7, 8 и 9 встречаются сравнительно редко. Есть всего несколько соединений, в которых КЧ равно 12 – например, таких как K 9[Bi(NCS)12].
Значение координационного числа n Значение координационного числа комплексообразователя зависит от его природы, степени окисления, природы лигандов и условий (температуры, природы растворителя, концентрации комплексообразователя и лигандов и др. ), при которых протекает реакция комплексообразования. Значение КЧ может меняться в различных комплексных соединениях от 2 до 8 и даже выше. n Наиболее распространенными координационными числами являются 4 и 6. n Координационные числа 3, 5, 7, 8 и 9 встречаются сравнительно редко. Есть всего несколько соединений, в которых КЧ равно 12 – например, таких как K 9[Bi(NCS)12].
 Зависимость между значениями координационного числа и степенью окисления элемента-комплексообразователя n Для элементов-комплексообразователей, имеющих степень окисления +I (Ag. I, Cu. I, Au. I, II и др. ) наиболее характерно координационное число 2 – например, в комплексах типа [Ag(NH 3)2]+, [Cu(CN)2]-, [IBr 2]-. n Элементы-комплексообразователи со степенью окисления +II (Zn. II, Pt. II, Pd. II, Cu. II и др. ) часто образуют комплексы, в которых проявляют координационное число 4, такие как [Zn(NH 3)4]2+, [Pt. Cl 4]2 -, [Pd(NH 3)2 Cl 2]0, [Zn. I 4]2 -, [Cu(NH 3)4]2+. n В аквакомплексах координационное число комплексообразователя в степени окисления +II чаще всего равно 6: [Fe(H 2 O)6]2+, [Mg(H 2 O)6]2+, [Ni(H 2 O)6]2+. n Элементы-комплексообразователи, обладающие степенью окисления +III и +IV (Pt. IV, Al. III, Co. III, Cr. III, Fe. III), имеют в комплексах, как правило, КЧ 6. Например, [Co(NH 3)6]3+, [Cr(OH)6]3 -, [Pt. Cl 6]2 - , [Al. F 6]3 -, [Fe(CN)6]3 -.
Зависимость между значениями координационного числа и степенью окисления элемента-комплексообразователя n Для элементов-комплексообразователей, имеющих степень окисления +I (Ag. I, Cu. I, Au. I, II и др. ) наиболее характерно координационное число 2 – например, в комплексах типа [Ag(NH 3)2]+, [Cu(CN)2]-, [IBr 2]-. n Элементы-комплексообразователи со степенью окисления +II (Zn. II, Pt. II, Pd. II, Cu. II и др. ) часто образуют комплексы, в которых проявляют координационное число 4, такие как [Zn(NH 3)4]2+, [Pt. Cl 4]2 -, [Pd(NH 3)2 Cl 2]0, [Zn. I 4]2 -, [Cu(NH 3)4]2+. n В аквакомплексах координационное число комплексообразователя в степени окисления +II чаще всего равно 6: [Fe(H 2 O)6]2+, [Mg(H 2 O)6]2+, [Ni(H 2 O)6]2+. n Элементы-комплексообразователи, обладающие степенью окисления +III и +IV (Pt. IV, Al. III, Co. III, Cr. III, Fe. III), имеют в комплексах, как правило, КЧ 6. Например, [Co(NH 3)6]3+, [Cr(OH)6]3 -, [Pt. Cl 6]2 - , [Al. F 6]3 -, [Fe(CN)6]3 -.
 Система названий комплексных соединений n Название комплексного соединения зависит от n n n n того, катионом или анионом является внутренняя сфера. Число лигандов каждого вида обозначается греческими числительными: 1 -моно, 2 -ди, 3 -три, 4 -тетра, 5 -пента, 6 - гекса.
Система названий комплексных соединений n Название комплексного соединения зависит от n n n n того, катионом или анионом является внутренняя сфера. Число лигандов каждого вида обозначается греческими числительными: 1 -моно, 2 -ди, 3 -три, 4 -тетра, 5 -пента, 6 - гекса.
 Названия наиболее распространенных лигандов: NH 3 - аммин, Н 2 О - аква, Сl- - хлоро, NO 2 - - нитрито, CN- - циано, S 2 O 32 - - тиосульфато, F- - фторо.
Названия наиболее распространенных лигандов: NH 3 - аммин, Н 2 О - аква, Сl- - хлоро, NO 2 - - нитрито, CN- - циано, S 2 O 32 - - тиосульфато, F- - фторо.
 Если комплексный ион является катионом, то название соединения формируется следующим образом: 1. Анион внешней сферы. 2. Катион внутренней сферы: координационное число, лиганды, комплексообразователь (русское название элемента в родительном падеже), заряд комплексообразователя. Отсюда: [H(NH 3)2]Cl - хлорид диаммин водорода, [Cu(NH 3)4](OH)2 - гидроксид тетрааммин меди (II).
Если комплексный ион является катионом, то название соединения формируется следующим образом: 1. Анион внешней сферы. 2. Катион внутренней сферы: координационное число, лиганды, комплексообразователь (русское название элемента в родительном падеже), заряд комплексообразователя. Отсюда: [H(NH 3)2]Cl - хлорид диаммин водорода, [Cu(NH 3)4](OH)2 - гидроксид тетрааммин меди (II).
 Если комплексный ион является анионом, то название соединения формируется следующим образом: 1. Комплексный анион: координационное число, лиганды, комплексообразователь (латинское название элемента, в котором окончание "ум" заменено на окончание "ат“), заряд комплексообразователя. 2. Катион внешней сферы. n. Например: n. К 3[Bi. I 4] - тетраиодовисмутат (III) калия.
Если комплексный ион является анионом, то название соединения формируется следующим образом: 1. Комплексный анион: координационное число, лиганды, комплексообразователь (латинское название элемента, в котором окончание "ум" заменено на окончание "ат“), заряд комплексообразователя. 2. Катион внешней сферы. n. Например: n. К 3[Bi. I 4] - тетраиодовисмутат (III) калия.
 Примеры: - дибромдиамминплатина (II). - гексафтороалюминат калия. - хлорид гексаамминокобальта (III). - трихлорамминоплатинат (II) калия.
Примеры: - дибромдиамминплатина (II). - гексафтороалюминат калия. - хлорид гексаамминокобальта (III). - трихлорамминоплатинат (II) калия.
 КЛАССИФИКАЦИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ 1) Аммины, или амминокомплексы, или аммиакаты, или аммиачные комплексы металлов координационные соединения металлов, содержащие молекулы координированного аммиака. Молекулу аммиака, выступающую в роли лиганда, называют аммин. Аммины могут быть комплексами катионного типа, например [Ag(NH 3)2]NO 3 , [Pt(NH 3)4]Cl 2 ; часто к амминам относят также комплексы, содержащие, кроме аммиака, другие лиганды, например [Pt. Cl 2(NH 3)2]. Широко используются в химическом анализе.
КЛАССИФИКАЦИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ 1) Аммины, или амминокомплексы, или аммиакаты, или аммиачные комплексы металлов координационные соединения металлов, содержащие молекулы координированного аммиака. Молекулу аммиака, выступающую в роли лиганда, называют аммин. Аммины могут быть комплексами катионного типа, например [Ag(NH 3)2]NO 3 , [Pt(NH 3)4]Cl 2 ; часто к амминам относят также комплексы, содержащие, кроме аммиака, другие лиганды, например [Pt. Cl 2(NH 3)2]. Широко используются в химическом анализе.
 КЛАССИФИКАЦИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ 2) Ацидокомплексы - координационные соединения, содержащие во внутренней сфере только ацидогруппы, т. е. отрицательно заряженные лиганды, в роли которых обычно выступают анионы кислот. Ацидокомплексы чаще всего относятся к комплексам анионного типа, например: K 4[Fe(CN)6], Na 3[Co(NO 2)6], K[Sb(OH)6] и т. д.
КЛАССИФИКАЦИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ 2) Ацидокомплексы - координационные соединения, содержащие во внутренней сфере только ацидогруппы, т. е. отрицательно заряженные лиганды, в роли которых обычно выступают анионы кислот. Ацидокомплексы чаще всего относятся к комплексам анионного типа, например: K 4[Fe(CN)6], Na 3[Co(NO 2)6], K[Sb(OH)6] и т. д.
 КЛАССИФИКАЦИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ 3) К комплексным соединениям относят (до некоторой степени условно) также изополикислоты и гетерополикислоты. Примером солей изополикислот могут служить калиевые соли дихромовой кислоты K 2 Cr 2 O 7 и трихромовой кислоты K 3 Cr 3 O 10. К гетерополикислотам относятся такие соединения, как фосфорномолибденовая H 3[PO 4(Mo. O 3)12], фосфорновольфрамовая H 3[PO 4(WO 3)12], мышьяковомолибденовая H 3[As. O 4(Mo. O 3)12] кислоты и т. д.
КЛАССИФИКАЦИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ 3) К комплексным соединениям относят (до некоторой степени условно) также изополикислоты и гетерополикислоты. Примером солей изополикислот могут служить калиевые соли дихромовой кислоты K 2 Cr 2 O 7 и трихромовой кислоты K 3 Cr 3 O 10. К гетерополикислотам относятся такие соединения, как фосфорномолибденовая H 3[PO 4(Mo. O 3)12], фосфорновольфрамовая H 3[PO 4(WO 3)12], мышьяковомолибденовая H 3[As. O 4(Mo. O 3)12] кислоты и т. д.
 Диссоциация комплексных соединений и ионов n Между ионом внешней и внутренней сфер возникает ионная связь, поэтому комплексные соединения в водных растворах необратимо диссоциируют на ионы : K 3[Fe(CN)6]=3 K++[Fe(CN)6]3 -. n Между комплексообразователем и лигандами возникает донорно-акцепторная связь (комплексообразователь - акцептор, лиганды доноры), поэтому комплексный ион диссоциирует как слабый электролит: [Fe(CN)6]3 -→ Fe 3+ +6 CN-
Диссоциация комплексных соединений и ионов n Между ионом внешней и внутренней сфер возникает ионная связь, поэтому комплексные соединения в водных растворах необратимо диссоциируют на ионы : K 3[Fe(CN)6]=3 K++[Fe(CN)6]3 -. n Между комплексообразователем и лигандами возникает донорно-акцепторная связь (комплексообразователь - акцептор, лиганды доноры), поэтому комплексный ион диссоциирует как слабый электролит: [Fe(CN)6]3 -→ Fe 3+ +6 CN-
 Константа нестойкости n. Диссоциация комплексных ионов имеет количественную характеристику - константу нестойкости (Кн): например, для реакции [Fe(CN)6]3 - → Fe 3+ +6 CN- n. В зависимости от константы нестойкости комплексные ионы подразделяются на нестойкие, устойчивые, очень устойчивые.
Константа нестойкости n. Диссоциация комплексных ионов имеет количественную характеристику - константу нестойкости (Кн): например, для реакции [Fe(CN)6]3 - → Fe 3+ +6 CN- n. В зависимости от константы нестойкости комплексные ионы подразделяются на нестойкие, устойчивые, очень устойчивые.


