 КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
 Цель: • Сформировать представление о составе, строении, номенклатуре, видах и классификации комплексных соединений. • Научить давать названия комплексным соединениям по формулам, составлять формулы по названиям.
Цель: • Сформировать представление о составе, строении, номенклатуре, видах и классификации комплексных соединений. • Научить давать названия комплексным соединениям по формулам, составлять формулы по названиям.
 Комплексными называют соединения, содержащие сложные ионы и молекулы, способные к существованию как в кристаллическом виде, так и в растворе.
Комплексными называют соединения, содержащие сложные ионы и молекулы, способные к существованию как в кристаллическом виде, так и в растворе.
 Швейцарский химик Альфред Вернер, лауреат Нобелевской премии. Его научная деятельность проходила в Цюрихском университете. Ученый синтезировал много новых комплексных соединений, систематизировал ранее известные и вновь полученные комплексные соединения и разработал экспериментальные методы доказательства его строения
Швейцарский химик Альфред Вернер, лауреат Нобелевской премии. Его научная деятельность проходила в Цюрихском университете. Ученый синтезировал много новых комплексных соединений, систематизировал ранее известные и вновь полученные комплексные соединения и разработал экспериментальные методы доказательства его строения
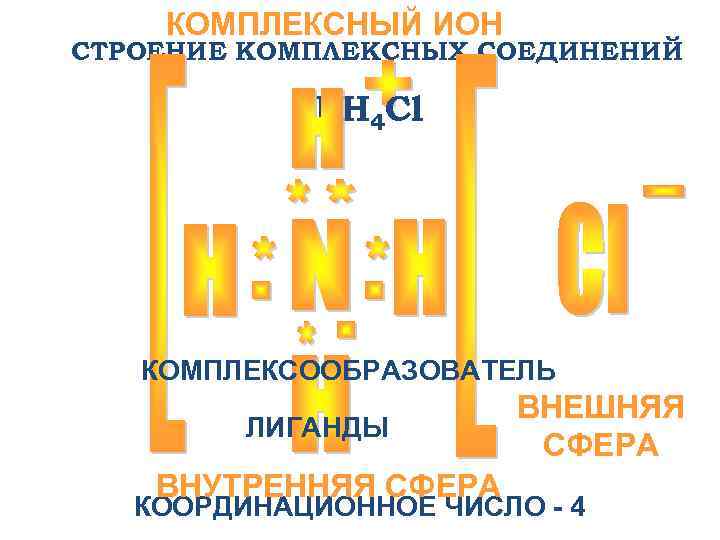 КОМПЛЕКСНЫЙ ИОН СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ NH 4 Cl КОМПЛЕКСООБРАЗОВАТЕЛЬ ВНЕШНЯЯ ЛИГАНДЫ СФЕРА ВНУТРЕННЯЯ СФЕРА КООРДИНАЦИОННОЕ ЧИСЛО - 4
КОМПЛЕКСНЫЙ ИОН СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ NH 4 Cl КОМПЛЕКСООБРАЗОВАТЕЛЬ ВНЕШНЯЯ ЛИГАНДЫ СФЕРА ВНУТРЕННЯЯ СФЕРА КООРДИНАЦИОННОЕ ЧИСЛО - 4
![[N -3 H+1 ]Cl-1 4 ВНУТРЕННЯЯ СФЕРА: КОМПЛЕКСНЫЙ ИОН [NH 4] + КОМПЛЕКСООБРАЗОВАТЕЛЬ [N -3 H+1 ]Cl-1 4 ВНУТРЕННЯЯ СФЕРА: КОМПЛЕКСНЫЙ ИОН [NH 4] + КОМПЛЕКСООБРАЗОВАТЕЛЬ](https://present5.com/presentation/3/-102690132_437442110.pdf-img/-102690132_437442110.pdf-6.jpg) [N -3 H+1 ]Cl-1 4 ВНУТРЕННЯЯ СФЕРА: КОМПЛЕКСНЫЙ ИОН [NH 4] + КОМПЛЕКСООБРАЗОВАТЕЛЬ N -3 ЛИГАНДЫ H+ ВНЕШНЯЯ СФЕРА АНИОН Cl-
[N -3 H+1 ]Cl-1 4 ВНУТРЕННЯЯ СФЕРА: КОМПЛЕКСНЫЙ ИОН [NH 4] + КОМПЛЕКСООБРАЗОВАТЕЛЬ N -3 ЛИГАНДЫ H+ ВНЕШНЯЯ СФЕРА АНИОН Cl-
 Лигандами могут быть: а) полярные молекулы NH 3 ; H 2 O ; CO ; NO б) простые ионы CI - ; Br- ; I- в) сложные ионы CN - ; SCN- ; NO - ; OH- 2
Лигандами могут быть: а) полярные молекулы NH 3 ; H 2 O ; CO ; NO б) простые ионы CI - ; Br- ; I- в) сложные ионы CN - ; SCN- ; NO - ; OH- 2
![Na+2 [Zn+x (OH)- ] 4 (+1) · 2 + x + (-1) · Na+2 [Zn+x (OH)- ] 4 (+1) · 2 + x + (-1) ·](https://present5.com/presentation/3/-102690132_437442110.pdf-img/-102690132_437442110.pdf-8.jpg) Na+2 [Zn+x (OH)- ] 4 (+1) · 2 + x + (-1) · 4 = 0 x = 0 -2+4 x = +2 Na+[Zn+2(OH)-4]
Na+2 [Zn+x (OH)- ] 4 (+1) · 2 + x + (-1) · 4 = 0 x = 0 -2+4 x = +2 Na+[Zn+2(OH)-4]
![РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ: Na 3[Al. F 6] Ответ: Na+3[Al+3 F-6] K[Mg. РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ: Na 3[Al. F 6] Ответ: Na+3[Al+3 F-6] K[Mg.](https://present5.com/presentation/3/-102690132_437442110.pdf-img/-102690132_437442110.pdf-9.jpg) РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ: Na 3[Al. F 6] Ответ: Na+3[Al+3 F-6] K[Mg. Cl 3] Ответ: K+[Mg+2 Cl-3] Na[Al(OH)4] Ответ: Na+[Al+3(OH)-4] Na 4[Fe(CN)6] Ответ: Na+4[Fe+2(CN)-6]
РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ: Na 3[Al. F 6] Ответ: Na+3[Al+3 F-6] K[Mg. Cl 3] Ответ: K+[Mg+2 Cl-3] Na[Al(OH)4] Ответ: Na+[Al+3(OH)-4] Na 4[Fe(CN)6] Ответ: Na+4[Fe+2(CN)-6]
 НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ ЧИСЛИТЕЛЬНЫЕ: НАЗВАНИЯ ЛИГАНДОВ: 2 - ди- H 2 O - аква 3 - три- NH 3 - амин 4 - тетра- СO - карбонил 5 - пента - OН- - гидроксо- 6 - гекса- (СN)- - циано (NO 3)- - нитро F-, Cl-, Br-, I- - фторо-, хлоро-, бромо-, йодо-
НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ ЧИСЛИТЕЛЬНЫЕ: НАЗВАНИЯ ЛИГАНДОВ: 2 - ди- H 2 O - аква 3 - три- NH 3 - амин 4 - тетра- СO - карбонил 5 - пента - OН- - гидроксо- 6 - гекса- (СN)- - циано (NO 3)- - нитро F-, Cl-, Br-, I- - фторо-, хлоро-, бромо-, йодо-
 НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ НАЗВАНИЯ АНИОНОВ: Fe - феррат Cu - купрат Ag - аргентат Au - аурат Hg - меркурат Zn - цинкат Al - алюминат
НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ НАЗВАНИЯ АНИОНОВ: Fe - феррат Cu - купрат Ag - аргентат Au - аурат Hg - меркурат Zn - цинкат Al - алюминат
![НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Na+2[Zn+2 (OH)-4] гидроксо натрия цинкат тетра [Cr+3(H 2 O)06] Cl-3 хлорид НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Na+2[Zn+2 (OH)-4] гидроксо натрия цинкат тетра [Cr+3(H 2 O)06] Cl-3 хлорид](https://present5.com/presentation/3/-102690132_437442110.pdf-img/-102690132_437442110.pdf-12.jpg) НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Na+2[Zn+2 (OH)-4] гидроксо натрия цинкат тетра [Cr+3(H 2 O)06] Cl-3 хлорид гексааква xрома (III) K+2 [Hg+2 I- 4] тетрайодомеркурат(II) калия
НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Na+2[Zn+2 (OH)-4] гидроксо натрия цинкат тетра [Cr+3(H 2 O)06] Cl-3 хлорид гексааква xрома (III) K+2 [Hg+2 I- 4] тетрайодомеркурат(II) калия
![НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Na 3[Al. F 6] Гексафтороалюминат натрия Na[Al(OH)4] Тетрагидроксоалюминат натрия K 4[Fe(CN)6] НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Na 3[Al. F 6] Гексафтороалюминат натрия Na[Al(OH)4] Тетрагидроксоалюминат натрия K 4[Fe(CN)6]](https://present5.com/presentation/3/-102690132_437442110.pdf-img/-102690132_437442110.pdf-13.jpg) НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Na 3[Al. F 6] Гексафтороалюминат натрия Na[Al(OH)4] Тетрагидроксоалюминат натрия K 4[Fe(CN)6] Гексационоферрат (II) калия
НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Na 3[Al. F 6] Гексафтороалюминат натрия Na[Al(OH)4] Тетрагидроксоалюминат натрия K 4[Fe(CN)6] Гексационоферрат (II) калия
![НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ [Cu(NH 3)4]SO 4 Сульфат тетраамминмеди (II) [Ag(NH 3)2]Cl Хлорид диамминсеребра [Cr(H НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ [Cu(NH 3)4]SO 4 Сульфат тетраамминмеди (II) [Ag(NH 3)2]Cl Хлорид диамминсеребра [Cr(H](https://present5.com/presentation/3/-102690132_437442110.pdf-img/-102690132_437442110.pdf-14.jpg) НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ [Cu(NH 3)4]SO 4 Сульфат тетраамминмеди (II) [Ag(NH 3)2]Cl Хлорид диамминсеребра [Cr(H 2 O)6]Cl 3 Хлорид гексааквахрома (III)
НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ [Cu(NH 3)4]SO 4 Сульфат тетраамминмеди (II) [Ag(NH 3)2]Cl Хлорид диамминсеребра [Cr(H 2 O)6]Cl 3 Хлорид гексааквахрома (III)
![СОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВ Гексахлороплатинат (IV) калия Ответ: K 2[Pt. Cl 6] Гексагидроксохромат (III) СОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВ Гексахлороплатинат (IV) калия Ответ: K 2[Pt. Cl 6] Гексагидроксохромат (III)](https://present5.com/presentation/3/-102690132_437442110.pdf-img/-102690132_437442110.pdf-15.jpg) СОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВ Гексахлороплатинат (IV) калия Ответ: K 2[Pt. Cl 6] Гексагидроксохромат (III) натрия Ответ: Na 3[Cr(OH)6]
СОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВ Гексахлороплатинат (IV) калия Ответ: K 2[Pt. Cl 6] Гексагидроксохромат (III) натрия Ответ: Na 3[Cr(OH)6]
![ХИМИЧЕСКИЕ СВОЙСТВА • 1. Диссоциация комплексных соединений [Cu(NH 3)4]SO 4 ↔ [Cu(NH 3)4]2+ ХИМИЧЕСКИЕ СВОЙСТВА • 1. Диссоциация комплексных соединений [Cu(NH 3)4]SO 4 ↔ [Cu(NH 3)4]2+](https://present5.com/presentation/3/-102690132_437442110.pdf-img/-102690132_437442110.pdf-16.jpg) ХИМИЧЕСКИЕ СВОЙСТВА • 1. Диссоциация комплексных соединений [Cu(NH 3)4]SO 4 ↔ [Cu(NH 3)4]2+ + SO 42 - комплексный ион внешн. среды
ХИМИЧЕСКИЕ СВОЙСТВА • 1. Диссоциация комплексных соединений [Cu(NH 3)4]SO 4 ↔ [Cu(NH 3)4]2+ + SO 42 - комплексный ион внешн. среды
 Практическое применение комплексных соединений • 1) в аналитической химии для определения многих ионов • 2) для разделения некоторых металлов • 3) для получения металлов высокой степени чистоты (золота, серебра, никеля и др. ) • 4) в качестве красителей • 5) для устранения жесткости воды
Практическое применение комплексных соединений • 1) в аналитической химии для определения многих ионов • 2) для разделения некоторых металлов • 3) для получения металлов высокой степени чистоты (золота, серебра, никеля и др. ) • 4) в качестве красителей • 5) для устранения жесткости воды