02 Компартменты клетки-Bio.ppt
- Количество слайдов: 76


Компартменты растительной клетки Наружная мембрана (плазмалема) Клеточная стенка (апопласт) ЭПР Пластида Ядро Вакуоль Цитозоль (симпласт) Пероксисома Мембрана вакуоли (тонопласт) Митохондрия Плазмодесмы


Полисахариды клеточной стенки построены всего из 11 моносахаридов

Строение микрофибрилл целлюлозы

Строение целлюлозосинтазы

Электронные фотографии КС с целлюлозосинтазой

Сшивочные гликаны (cross-linking glycans) Ксилоглюканы (Xy. Gs) Фуко-Xy. Gs XXXG: XXFG (двудольные, некоммелиноидн. ) Гликаны со смешанной связью (злаки) Арабино-Xy. Gs AXGG, XAGG, AAGG Пасленовые, мята Нерегулярные Xy. Gs (коммелиноидные) Глюкуроноарабиноксиланы (GAXs) Коммелиноидные Ara: O-3, Glc. A: O-2 Некоммелин. Ara, Glc. A: O-2 Обозначения: Gl X: Gl-Xyl L: Gl-Xyl-Gal F: Gl-Xyl-Gal-Fuc A: Gl-Xyl-Ara

Гемицеллюлозы: ксилоглюкан двудольных (фуко-галакто-Xy. Gs)

Гемицеллюлозы: ксилоглюкан двудольных (арабино-Xy. Gs пасленовых и мяты)

Гемицеллюлозы: глюкуроно-арабиноксиланы двудольных и коммелинид (сем. Злаковые, Имбирные, Коммелиновые и др. )

Гемицеллюлозы: глюкан злаковых

Пектины Галактуронаны Гомогалактуронаны Ксилогалактуронаны Рамногалактуронаны II Рамногалактуронаны I

Пектины: галактоктуронаны (гомо- и ксило-галактуронаны)

Пектины: рамногалактуронаны II к цепи гомогалактуронана присоединены различные боковые цепочки по разным гидроксилам

Пектины: рамногалактуронаны I гетерополимер: линейная цепь из чередующихся остатков Gal. A и Rha с различными боковыми фрагментами

Пектины: димер рамногалактуронана II (мономеры RGII 4200 k. Da связаны диэфирными связями остатками апиозы через бор)

Кальций: «Замковые зоны» пектиновой сети

Пектины: зоны «Ca 2+-застежек» и количество нейтральных боковых цепочек RGI регулируют размер пор клеточной стенки

Пектины: варенье, джем и повидло

Структурные белки клеточной стенки: HGRPs (гидроксипролин-), PRPs (пролин-) и GRPs (глицин- обогащенные)

Структурные белки клеточной стенки: AGPs (арабино-галактановые белки - протеогликаны)

Структурные белки клеточной стенки: AGPs (арабино-галактановые белки - протеогликаны)

Трехмерная модель двух типов клеточной стенки: тип I (двудольные) и тип II (коммелиниды)

Участие ХЕТ (ксилоглюкан-эндотрансгликозилазы) и экспансина в росте клеток растяжением


Низкая «цена» ATP: Заряд на мембранах 1. Апопласт (клеточная стенка и межклетники) 2. Вакуоль Плазмалема: -120 – H+ 3. + Межмембранное + H + + H+ H+ -160 m. V H + H H пространство митохондрий H + + H+ – – – H H + –– – – – 4. Внутритилакоидный люмен – – H+ H H+ – + – 5. Некоторые участки ЭПР H H H+ – – – H+ + H – H+ + – – H – + H H+ Вакуоль H+– H+ H+ Δp. H=3 – – H+ H+ – – – H+ + H – – – H + H+ – + H+ + – H + – H+ H H + + + – H– – – H – H H – + Тонопласт: + 30 m. V H+ – – – H+ + H+ – H H – H+ – -200 m. V – H+ Активное использование АТР: – H+ + + H+ H H+ 1. H Цитозоль H+ – H+ H+ + H – H+ – – 2. Нуклеоплазма H+ + – – – H+ H 3. Матрикс митохондрий + H+ + H H+ H+ 4. Строма пластид 5. Некоторые участки ЭПР

Три типа H+-АТФаз растительной клетки Н+- АТФаза плазматической мембраны (p-тип) АТФ-синтазы митохондрий и хлоропластов (F-тип) Н+- АТФаза вакуолярная (V-тип)

Заряд на мембранах Плазмалема: -120 – -160 m. V H+-АТФаза (р-тип) Са 2+-АТФазы + H+ H+ H H+ + + H+ H H + H+ H+ H H+ + + H H H+ H+ + Вакуоль H H+ H+ Δp. H=3 H+ АТФ-синтаза H+ (СF-тип) H+ Тонопласт: + 30 m. V H+ H+ H+ + + + H H+ H+ H+ + + +-Пирофосфатаза (р-тип) H H+ H Н + + + H+ + H H Са 2+-АТФазы + H H+ H+-АТФаза (V-тип) H+ -200 m. V H+ АВС-транспортёры АТФ-синтаза H+ + H (F-тип) H H H+ H+ H+ + H H+ H+

• Один большой полипептид 100 - 106 к. Да • Регулируется по принципу «фосфорилирование/дефосфорилирование» по серину протенкиназами • Образует промежуточный фосфорилированный интермедиат (по аспартиловому концу фермента) • Ингибируется ванадатом (блокирует фосфорилирование по аспартиловому концу фермента) • Ингибируется сульфгидрильными реагентами • Сходна с АТФазами животных клеток: Na, K-АТФаза; H, K-АТФаза; Ca-АТФаза) • Зависит от градиента Н+ • К+-зависимая

Домен связывания Mg. АТФ Е 1 связывает Н (in) Е 2 освобождает Н (out) Стехиометрия переноса: 1 АТФ : 1 Н+

Симптомы поражения грибом Fusicoccum amygdali на персике Метаболит гриба – фузикокцин – необратимо активирует АТФазу плазмалеммы

• 64 – 67 к. Да • катионзависимая (стимулируется К+, ингибируется Na+, Са 2+) • высокоспецифична к пирофосфату • зависит от концентрации магния • зависит от градиента Н+ • ингибируется сульфгидрильными реагентами Входит в состав тонопласта. Стехиометрия переноса: 1 пирофосфат : 1 Н+ Уменьшает концентрацию пирофосфата в цитозоле (? )

Са 2+АТФазы принадлежат к большому семейству АТФаз р-типа Са 2+АТФазы ПМ Са 2+АТФазы ЭР У растений в отличие от животных Са 2+-АТФазы ПМ-типа локализованы не только на плазмалемме, но и на эндомембранах

Домен связывания Mg-АТФ

Компартментация Са 2+ в растительной клетке Клеточная стенка (апопласт) Са 2+: 1000– 10000 мк. М ЭПР Са 2+: 1000– 10000 мк. М Пластида Са 2+: 1000 мк. М 0, 01– 0, 05 Цитозоль мк. М (симпласт) Са 2+: 0, 1– 0, 2 мк. М Вакуоль Пероксисома Са 2+: 1000 – 10000 мк. М Са 2+: 1000 мк. М Митохондрия

Транспорт кальция в растительной клетке

Транспортные белки, которые используют энергию гидролиза АТФ для транспорта через мембраны самых разных химических агентов. Содержат ATP-Binding Casette (ABC). Представлены у всех организмов Очень многочисленное семейство Арабидопсис : 131 различных белков 3 основных мультисемейства: pleiotropic drug resistance (PDR), multidrug resistance (MDR), multidrug resistance-associated protein (MRP)

АВС-транспортёры GS-herbicide АТР АDР+P Примеры: активный транспорт в вакуоль конъюгатов гербицидов или тяжёлых металлов с глутатионом

Вакуоль Мембрана (тонопласт) АТФ-связывающий домен Цитозоль

Расход энергоносителей (АТФ, ФФ) на создание градиента на мембранах Н+ Н+-АТФаза плазмалеммы (P-типа) Н+-АТФаза тонопласта (V-типа) Пирофосфатаза тонопласта Ca 2+ Са 2+-АТФаза ПМ (P-типа) Са 2+-АТФаза ЭР (P-типа) Na+ Ионы тяжелых металлов Аминокислоты Органические кислоты Пептиды Липиды Ксенобиотики Nа+-АТФаза плазмалеммы АВС-транспортёры
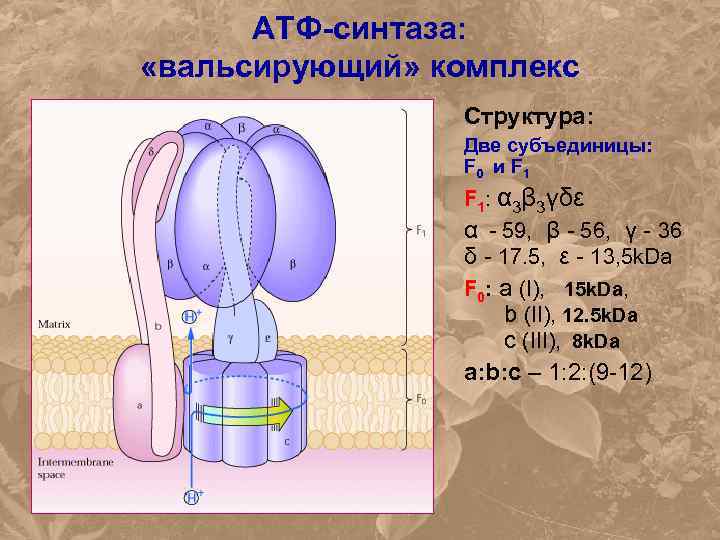
АТФ-синтаза: «вальсирующий» комплекс Структура: Две субъединицы: F 0 и F 1: α 3β 3γδε α - 59, β - 56, γ - 36 δ - 17. 5, ε - 13, 5 k. Da F 0: а (I), 15 k. Da, b (II), 12. 5 k. Da c (III), 8 k. Da а: b: с – 1: 2: (9 -12)

АТФаза вакуолярная (V-тип) 3 каталитических центра связывания АТФ 6 -9 субъединиц, связывающих протон

Н-АТФаза тонопласта (V – типа) • Мультисубъединичная структура: 7 -10 типов субъединиц (70 к. Да, 60 к. Да, 16 к. Да и др. ) • Анионзависимая (нитрат ингибирует, хлорид стимулирует) • Нечувствительна к ванадату, азиду, олигомицину • Зависит от градиента Н+

По градиенту электрохимического потенциала, без затраты энергии Без специальных структур на мембране Против градиента электрохимического потенциала, с затратой энергии Первично активный Переносится одно вещество, используются макроэргические связи АТФ, пирофосфат и др. Вторично активный Два вещества переносятся в одном направлении, используется электрохимический потенциал одного из веществ Вторично Специальные белковые на мембране активный комплексы, обладающие Два вещества переносятся в разных разной специфичностью направлениях, используется электрохимический к переносимому веществу потенциал одного из веществ

«Пинг-понг» -механизм Изменение конформации Одновременный перенос двух веществ Изменение конформации

6 АЛЬФА-СПИРАЛЬНЫХ ДОМЕНОВ, СОБРАНЫ В ДИМЕР или: 12 АЛЬФА-СПИРАЛЬНЫХ ДОМЕНОВ, ДВУПОРОВЫЕ

Транспорт веществ через мембрану митохондрии

Транспорт интермедиатов через хлоропластную мембрану

Транспорт интермедиатов через хлоропластную мембрану

Транспортёры есть и на плазмалемме H+ H+ H+ – К+ H+ – – Na+ – – – H+ H+ H+ 2 H+ Сахароза H+ – – H+ H+ NO 3 - H+ 3 H+ SO 42 - H+ H+ – –

Структура аквапоринов NPA-бокс: Asp-Pro-Ala

Регуляция активности аквапоринов много воды в клетке мало воды в клетке Аквапорины облегчают диффузию многих небольших незаряженных молекул: Вода Углекислый газ Этанол Глицерин и др. аквапорины открыты, движение воды по градиенту водного потенциала

1. Катионные и анионные 2. “Входящие” (in) и “выходящие” (out) 3. Селективность: специфические и неспецифические 4. Потенциал-зависимые и рецептор-управляемые 5. Быстрые и медленные

Метод Patch-Clump

Калиевые каналы Shaker-типа работают в составе тетрамеров: схема, вид сбоку и сверху Модель «Мяч на привязи» R O I


Ионом клетки и иономика

Неспецифические переносчики относительно крупных молекул Бета-слой с чередующимися гидрофильными и гидрофобными аминокислотами (через одну)



Компартменты растительной клетки ЭПР Вакуоль Ядро Порин ы


Два пути сортировки белков: цитоплазматический и секреторный (ЭПР) Не совсем свободны: связь с цитоскелетом

Секреторный путь транспорта белков: гликозилирование в люмене ЭПР

Транспорт ядерно-кодируемых белков в хлоропласт TOC TIC Translocase of Outer Chloroplast membrane (TOC) Translocase of Inner Chloroplast membrane (TIC)
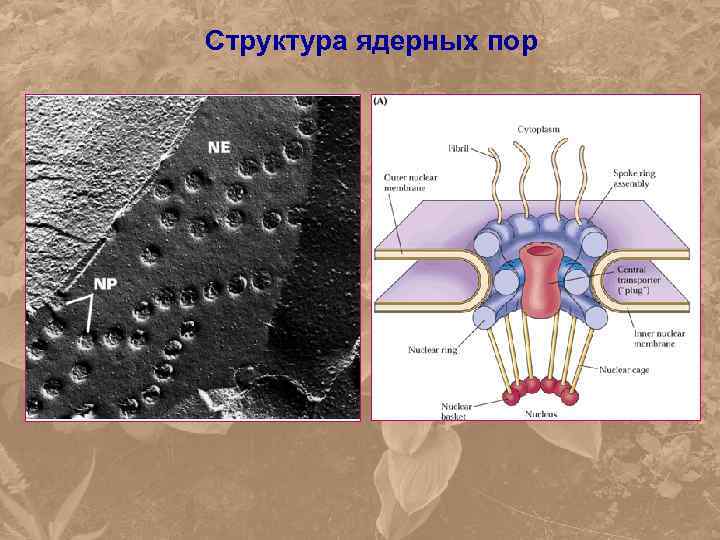
Структура ядерных пор

Ядерные поры – «пропускные фильтры» NLS – Nuclear Location Signal

Сигнальные последовательности для транспорта белков в растительной клетке Целевая органелла Сигнальная последовательность Характеристика Хлоропласты: строма N-концевой лидерный пептид ( «стромальный» ) Последовательность из 40 -50 аминокислот Хлоропласты: люмен и мембраны тилакоидов Два последовательных N-концевых лидерных пептида Первый пептид - «стромальный» , второй – «люменальный» Митохондрии: матрикс N-концевой пресиквенс формирует положительно амфипатическую α-спираль. Митохондрии: внутренняя мембрана, межмембранное пространство Два последовательных N-концевых пресиквенса Первый пресиквенс - как для белков матрикса, второй состоит из остатков гидрофобных аминокислот Пероксисомы: ТРАНСПОРТ БЕЗ ШАПЕРОНОВ! Сигналы пероксисомальной локализации PTS 1 и PTS 2 PTS 1 – С-концевой трипептид – Ser-Lys-Leu PTS 2 локализован на N-конце. Ядро Сигналы ядерной локализации NLS. Не отщепляются после переноса белка в ядро NLS типа 1: Pro-Lys-Lys-Arg-Lys. NLS типа 2: две последовательности, разделенные спейсером NLS типа 3: Lys-Ile-Pro-Ile-Lys Сигнальный пептид секреторного пути N-концевой лидерный пептид 10 -15 остатков гидрофобных формирующих α-спираль. ЭР Сигнал локализации в ЭР С-концевой тетрапептид KDEL (Lys-Asp-Glu-Leu) Вакуоль. Сигналы локализации в вакуолях: NTPP, CTPP, внутрибелковый сигнал. NTPP - N-концевой сигнал: Asn-Pro-lle-Arg CTPP – С-концевой сигнал. заряженную аминокислот,

Компартменты растительной клетки Наружная мембрана (плазмалема) Клеточная стенка (апопласт) ЭПР Пластида Ядро Вакуоль Цитозоль (симпласт) Пероксисома Мембрана вакуоли (тонопласт) Митохондрия Плазмодесмы

Структура и работа плазмодесм

• Белок FT (Flowering Locus T) – синтезируется в клетках листа и по флоэме направляется в меристему побега • Высокомолекулярные сигналы для образования клубней: синтез в листе и транспорт по флоэме в подземные побеги • Белок KN 1 (knotted 1) обнаруживается в эпидермальных клетках, а синтез соответствующей РНК KN 1 – в нижележащих слоях • Малые интерферирующие РНК (si. RNA), участвующие в сайленсинге • Возможна компенсация мутантного фенотипа при экспрессии нормального аллеля не во всём растении, а только в определенных группах клеток • Перемещение вирусов и вироидов

Структура и работа плазмодесм Транспортируемая макромолекула Комплекс: рецептор+шаперон узнаёт и «разматывает» макромолекулу Комплекс шаперонов, восстанавливающих структуру макромолекулы

Функциональные симпластические домены Короткий день (формирование катафиллов) Из: Rinne, van der Schoot, 1998

Каллозные «пробки»

• Транспорт минеральных веществ • Транспорт низкомолекулярных органических соединений по системе ЭПР-вакуоли (сахара, аминокислоты и др. ) • Концентрирование веществ за счет разветвления плазмодесм и активного везикулярного транспорта • Обеспечение механических контактов с клеточной стенкой. Симпластический рост органов (без разрывов) • Объединение клеток в единую электрическую среду. Согласованное изменение потенциала соседних клеток • Транспорт сигнальных веществ (гормонов) в активной или неактивной форме • Обмен макромолекулами
02 Компартменты клетки-Bio.ppt