10-3- архитектоника ядра.ppt
- Количество слайдов: 80
 Компактизация ДНК лекция 1
Компактизация ДНК лекция 1
 Компактность генома эукариот • Компактность - другое принципиальное отличие генома эукариот от прокариотического генома. • При средней разнице размеров геномов на 3 порядка, линейные размеры эукариотических хромосом соизмеримы с длиной ДНК прокариот. • Выделяют, по крайней мере, 4 уровня компактизации ДНК. При этом нить ДНК "укорачивается" в 10 000 раз. • Это все равно, что нить, длиной с Останкинскую башню (500 м), уложить в спичечный коробок (5 см). • Два первых уровня компактизации эукариотического генома обеспечиваются гистонами. 2
Компактность генома эукариот • Компактность - другое принципиальное отличие генома эукариот от прокариотического генома. • При средней разнице размеров геномов на 3 порядка, линейные размеры эукариотических хромосом соизмеримы с длиной ДНК прокариот. • Выделяют, по крайней мере, 4 уровня компактизации ДНК. При этом нить ДНК "укорачивается" в 10 000 раз. • Это все равно, что нить, длиной с Останкинскую башню (500 м), уложить в спичечный коробок (5 см). • Два первых уровня компактизации эукариотического генома обеспечиваются гистонами. 2
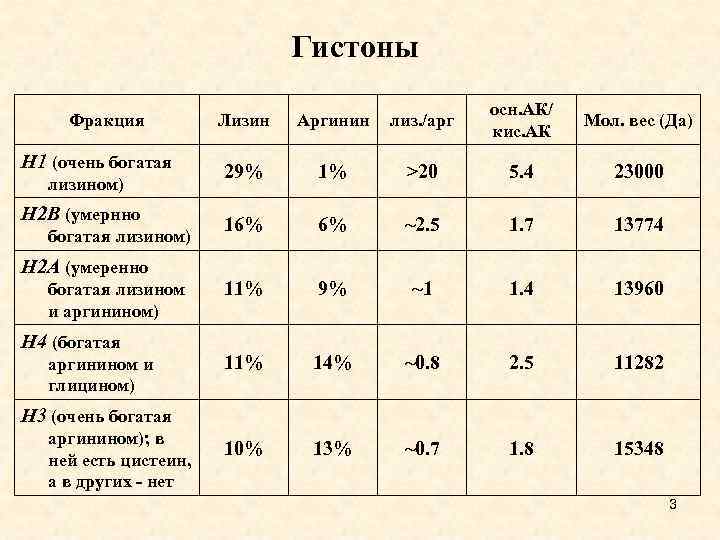 Гистоны Фракция Н 1 (очень богатая лизином) Н 2 В (умернно богатая лизином) Н 2 А (умеренно богатая лизином и аргинином) Н 4 (богатая аргинином и глицином) Лизин Аргинин лиз. /арг осн. АК/ кис. АК Мол. вес (Да) 29% 1% >20 5. 4 23000 16% 6% ~2. 5 1. 7 13774 11% 9% ~1 1. 4 13960 11% 14% ~0. 8 2. 5 11282 10% 13% ~0. 7 1. 8 15348 Н 3 (очень богатая аргинином); в ней есть цистеин, а в других - нет 3
Гистоны Фракция Н 1 (очень богатая лизином) Н 2 В (умернно богатая лизином) Н 2 А (умеренно богатая лизином и аргинином) Н 4 (богатая аргинином и глицином) Лизин Аргинин лиз. /арг осн. АК/ кис. АК Мол. вес (Да) 29% 1% >20 5. 4 23000 16% 6% ~2. 5 1. 7 13774 11% 9% ~1 1. 4 13960 11% 14% ~0. 8 2. 5 11282 10% 13% ~0. 7 1. 8 15348 Н 3 (очень богатая аргинином); в ней есть цистеин, а в других - нет 3
 • Гистоны - основные белки. Все они обогащены лизином и аргинином - положительно заряженными аминокислотами. Выделяют 5 фракций гистонов. Нарабатывается их очень много - 60 млн. молекул каждой фракции на клетку. • Все гистоны, кроме Н 1, черезвычайно консервативны в эволюционном отношении (у коровы и клевера разница в Н 2 А всего в одну аминокислоту!). • Следовательно, эти белки выполняют принципиальную функцию, которая у всех эукариот обеспечивается одинаково. • Любая мутация в гистоновых генах летальна. • Н 1 - очень вариабельная фракция. Этот гистон различен не только у видов, но даже у одного организма, в зависимости от стадий онтогенеза. • В гистонах лизин и аргинин кластированы. Средняя часть гистона содержит гидрофобные аминокислоты. • Положительно заряженные аминокислоты гистонов обеспечивают электростатические взаимодействия с ДНК. Центральная часть необходима для взаимодействия гистонов между 4 собой.
• Гистоны - основные белки. Все они обогащены лизином и аргинином - положительно заряженными аминокислотами. Выделяют 5 фракций гистонов. Нарабатывается их очень много - 60 млн. молекул каждой фракции на клетку. • Все гистоны, кроме Н 1, черезвычайно консервативны в эволюционном отношении (у коровы и клевера разница в Н 2 А всего в одну аминокислоту!). • Следовательно, эти белки выполняют принципиальную функцию, которая у всех эукариот обеспечивается одинаково. • Любая мутация в гистоновых генах летальна. • Н 1 - очень вариабельная фракция. Этот гистон различен не только у видов, но даже у одного организма, в зависимости от стадий онтогенеза. • В гистонах лизин и аргинин кластированы. Средняя часть гистона содержит гидрофобные аминокислоты. • Положительно заряженные аминокислоты гистонов обеспечивают электростатические взаимодействия с ДНК. Центральная часть необходима для взаимодействия гистонов между 4 собой.
 • Genomic structures of histone gene (a) and ubiquitin gene repeats (b). The red square box in human histone gene repeats represents a pseudogene. Expressed histone genes are shown in blue, and an arrow indicates the direction of transcription when known. • Each box in the poly-u gene complex represents one copy of ubiquitin gene. PolyuΨ shows a poly-u pseudogene. A monomeric ubiquitin locus is composed of a ubiquitin gene and a ribosomal protein gene with 52 codons (Mono 52) or 80 codons (Mono 80). (Nei & 5 Roony, 2006)
• Genomic structures of histone gene (a) and ubiquitin gene repeats (b). The red square box in human histone gene repeats represents a pseudogene. Expressed histone genes are shown in blue, and an arrow indicates the direction of transcription when known. • Each box in the poly-u gene complex represents one copy of ubiquitin gene. PolyuΨ shows a poly-u pseudogene. A monomeric ubiquitin locus is composed of a ubiquitin gene and a ribosomal protein gene with 52 codons (Mono 52) or 80 codons (Mono 80). (Nei & 5 Roony, 2006)
 Четыре уровня компактизации ДНК: • 1. Нуклеосомный • 2. Супербидный, или соленоидный • 3. Петлевой уровень • 4. Метафазная хромосома 6
Четыре уровня компактизации ДНК: • 1. Нуклеосомный • 2. Супербидный, или соленоидный • 3. Петлевой уровень • 4. Метафазная хромосома 6
 • 1. Нуклеосомный • В основе нуклеосомы лежит гистоновый октамер. • Расположение гистонов не случайно. Каждая молекула представлена дважды. Они образуют кор (серцевину) нуклеосомы. На кор наматывается ДНК - 1. 75 левых витка спирали. 7
• 1. Нуклеосомный • В основе нуклеосомы лежит гистоновый октамер. • Расположение гистонов не случайно. Каждая молекула представлена дважды. Они образуют кор (серцевину) нуклеосомы. На кор наматывается ДНК - 1. 75 левых витка спирали. 7
 • нуклеосомой называется повторяющийся структурный элемент хроматина, содержащий гистоновый октамер и ~180 п. н. ДНК. • Непосредственно с октамером контактирует 145 п. н. и 20 -3040 п. н. между нуклеосомными корами. • Нуклеосомный уровень упаковки свойственен всей эукариотической ДНК, он дает укорочение в 7 раз. Диаметр увеличивается с 20 Å до 110 Å. • Гистоновые октамеры "скользят" по ДНК. • При репликации снимается и этот уровень компактизации. • При транскрипции нуклеосомы сохраняются. 8
• нуклеосомой называется повторяющийся структурный элемент хроматина, содержащий гистоновый октамер и ~180 п. н. ДНК. • Непосредственно с октамером контактирует 145 п. н. и 20 -3040 п. н. между нуклеосомными корами. • Нуклеосомный уровень упаковки свойственен всей эукариотической ДНК, он дает укорочение в 7 раз. Диаметр увеличивается с 20 Å до 110 Å. • Гистоновые октамеры "скользят" по ДНК. • При репликации снимается и этот уровень компактизации. • При транскрипции нуклеосомы сохраняются. 8
 • Структура нуклеосомы (человек) • Нуклеосома состоит из 4 пар гистонов, которые образуют её кор (ядро). Две пары димеров H 2 A-H 2 B и тетрамер из 2 пар гистонов H 3 и H 4. Сначала с ДНК ассоциируется тетрамер, а после - два димера. ДНК делает вокруг нуклеосомы 1. 75 оборота. При обработке микрококковой нуклеазой можно получить минимальное количество оснований на нуклеосоме - 146. Реально на одну нуклеосому приходиться примерно 180 bp. Кроме того, в организацию нуклеосомной последовательности вовлечён гистон H 1. Считается, что он ассоциирован с линкерной ДНК. • У коровых гистонов выраженая доменная структура: неструктурированный C - конец, центральная глобулярная часть, положительно заряженный N - конец. На N - концах примерно каждый четвёртый остаток лизин или аргинин. Взаимодействуя с ними, отрицательно заряженная ДНК, фиксируется на нуклеосоме. Гистоны могут быть ацетилированы, метилированы, фосфорилированы, ADP - рибозилированы. 9
• Структура нуклеосомы (человек) • Нуклеосома состоит из 4 пар гистонов, которые образуют её кор (ядро). Две пары димеров H 2 A-H 2 B и тетрамер из 2 пар гистонов H 3 и H 4. Сначала с ДНК ассоциируется тетрамер, а после - два димера. ДНК делает вокруг нуклеосомы 1. 75 оборота. При обработке микрококковой нуклеазой можно получить минимальное количество оснований на нуклеосоме - 146. Реально на одну нуклеосому приходиться примерно 180 bp. Кроме того, в организацию нуклеосомной последовательности вовлечён гистон H 1. Считается, что он ассоциирован с линкерной ДНК. • У коровых гистонов выраженая доменная структура: неструктурированный C - конец, центральная глобулярная часть, положительно заряженный N - конец. На N - концах примерно каждый четвёртый остаток лизин или аргинин. Взаимодействуя с ними, отрицательно заряженная ДНК, фиксируется на нуклеосоме. Гистоны могут быть ацетилированы, метилированы, фосфорилированы, ADP - рибозилированы. 9
 • Состав хроматина • Хроматин состоит из примерно одинакового по массе количества ДНК и белка. Половину белков составляют негистоновые белки, например, HMG - белки (High Mobility Group). Конкретные функции HMG - белков не известны. Предполагается, что они выполняют структурные и регуляторные функции в процессе транскрипции и поддержании определённых структур хроматина. 10
• Состав хроматина • Хроматин состоит из примерно одинакового по массе количества ДНК и белка. Половину белков составляют негистоновые белки, например, HMG - белки (High Mobility Group). Конкретные функции HMG - белков не известны. Предполагается, что они выполняют структурные и регуляторные функции в процессе транскрипции и поддержании определённых структур хроматина. 10
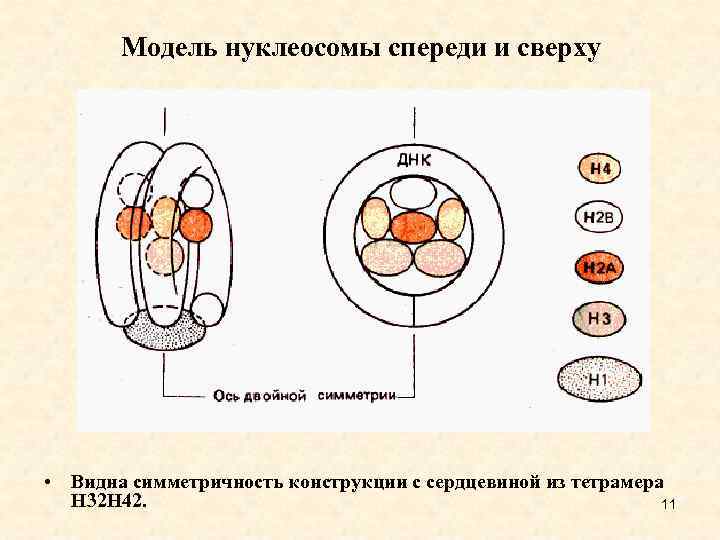 Модель нуклеосомы спереди и сверху • Видна симметричность конструкции с сердцевиной из тетрамера Н 32 Н 42. 11
Модель нуклеосомы спереди и сверху • Видна симметричность конструкции с сердцевиной из тетрамера Н 32 Н 42. 11
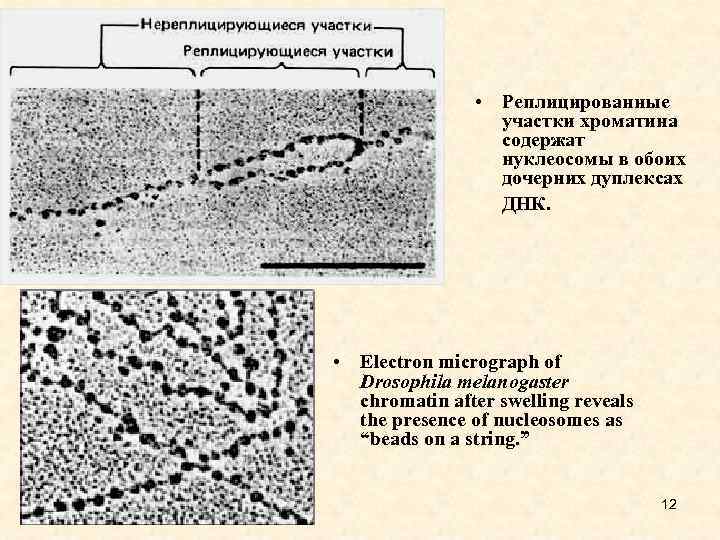 • Реплицированные участки хроматина содержат нуклеосомы в обоих дочерних дуплексах ДНК. • Electron micrograph of Drosophila melanogaster chromatin after swelling reveals the presence of nucleosomes as “beads on a string. ” 12
• Реплицированные участки хроматина содержат нуклеосомы в обоих дочерних дуплексах ДНК. • Electron micrograph of Drosophila melanogaster chromatin after swelling reveals the presence of nucleosomes as “beads on a string. ” 12
 Гистоновый октамер • Four orthogonal views of the histone octamer as determined by X-ray crystallography: (a) front view; (b) top view; and (c) disk view, that is, as viewed down the long axis of the chromatin fiber. In the (c) perspective, the DNA duplex would wrap around the octamer, with the axis of the DNA supercoil perpendicular to the plane of the picture. (d) Suggested appearance of the nucleosome when wrapped with DNA. 13
Гистоновый октамер • Four orthogonal views of the histone octamer as determined by X-ray crystallography: (a) front view; (b) top view; and (c) disk view, that is, as viewed down the long axis of the chromatin fiber. In the (c) perspective, the DNA duplex would wrap around the octamer, with the axis of the DNA supercoil perpendicular to the plane of the picture. (d) Suggested appearance of the nucleosome when wrapped with DNA. 13
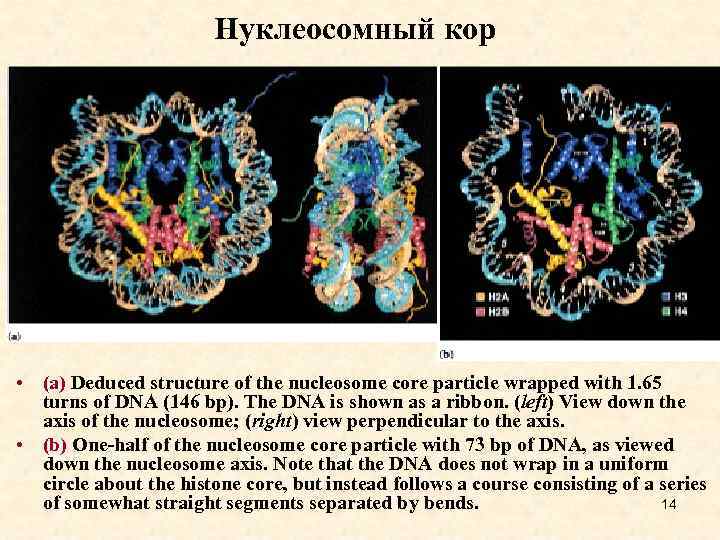 Нуклеосомный кор • (a) Deduced structure of the nucleosome core particle wrapped with 1. 65 turns of DNA (146 bp). The DNA is shown as a ribbon. (left) View down the axis of the nucleosome; (right) view perpendicular to the axis. • (b) One-half of the nucleosome core particle with 73 bp of DNA, as viewed down the nucleosome axis. Note that the DNA does not wrap in a uniform circle about the histone core, but instead follows a course consisting of a series of somewhat straight segments separated by bends. 14
Нуклеосомный кор • (a) Deduced structure of the nucleosome core particle wrapped with 1. 65 turns of DNA (146 bp). The DNA is shown as a ribbon. (left) View down the axis of the nucleosome; (right) view perpendicular to the axis. • (b) One-half of the nucleosome core particle with 73 bp of DNA, as viewed down the nucleosome axis. Note that the DNA does not wrap in a uniform circle about the histone core, but instead follows a course consisting of a series of somewhat straight segments separated by bends. 14
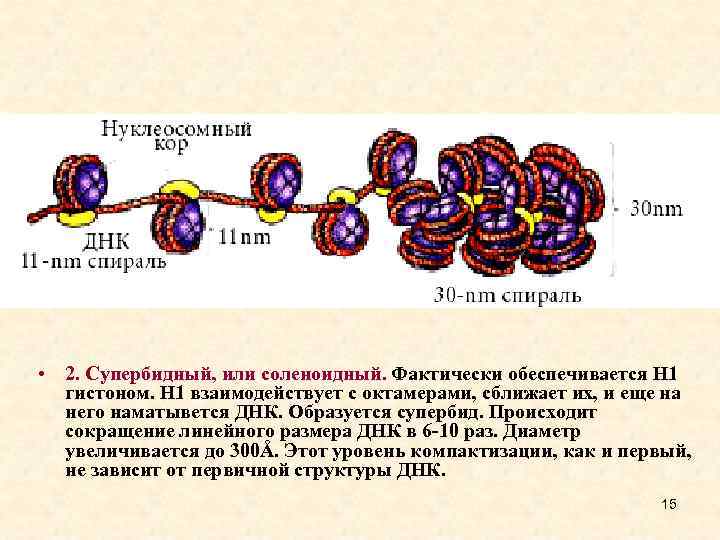 • 2. Супербидный, или соленоидный. Фактически обеспечивается Н 1 гистоном. Н 1 взаимодействует с октамерами, сближает их, и еще на него наматывется ДНК. Образуется супербид. Происходит сокращение линейного размера ДНК в 6 -10 раз. Диаметр увеличивается до 300Å. Этот уровень компактизации, как и первый, не зависит от первичной структуры ДНК. 15
• 2. Супербидный, или соленоидный. Фактически обеспечивается Н 1 гистоном. Н 1 взаимодействует с октамерами, сближает их, и еще на него наматывется ДНК. Образуется супербид. Происходит сокращение линейного размера ДНК в 6 -10 раз. Диаметр увеличивается до 300Å. Этот уровень компактизации, как и первый, не зависит от первичной структуры ДНК. 15
 • 3. Петлевой уровень. Обеспечивается негистоновыми белками. Они узнают определенные последовательности ДНК и связываются с ними и другом, образуя петли по 20 -80 тыс. п. н. • Петля обеспечивает экспрессию гена, т. е петля является не только структурным, но и функциональным образованием. • Есть участки, в которых нет петель. Укорочение за счет петель проходит в 20 -30 раз. Образуются и петлевые домены. Диаметр увеличивается до 700Å. 16
• 3. Петлевой уровень. Обеспечивается негистоновыми белками. Они узнают определенные последовательности ДНК и связываются с ними и другом, образуя петли по 20 -80 тыс. п. н. • Петля обеспечивает экспрессию гена, т. е петля является не только структурным, но и функциональным образованием. • Есть участки, в которых нет петель. Укорочение за счет петель проходит в 20 -30 раз. Образуются и петлевые домены. Диаметр увеличивается до 700Å. 16
 4. Метафазная хромосома уже удвоена. Она состоит из двух хроматид. Каждая из них содержит одну молекулу ДНК. Сюда входят белки ядерной ламины, серия белковых нитей, сопряженных с ядерной оболочкой и пронизывающих все ядро. Модификации гистонов очень сильно влияют на компактизацию ДНК. Гистоны могут метилироваться, фосфорилироваться (по серину, треонину, тирозину), т. е. аминокислотные остатки легко модифицируются. Кроме того, возможно алкилирование и ацетилирование гистонов 17
4. Метафазная хромосома уже удвоена. Она состоит из двух хроматид. Каждая из них содержит одну молекулу ДНК. Сюда входят белки ядерной ламины, серия белковых нитей, сопряженных с ядерной оболочкой и пронизывающих все ядро. Модификации гистонов очень сильно влияют на компактизацию ДНК. Гистоны могут метилироваться, фосфорилироваться (по серину, треонину, тирозину), т. е. аминокислотные остатки легко модифицируются. Кроме того, возможно алкилирование и ацетилирование гистонов 17
 Структура хроматина • A model for chromosome structure, human chromosome 4. The 2 -nm DNA helix is wound twice around histone octamers to form 10 -nm nucleosomes, each of which contains 160 bp (80 per turn). These nucleosomes are then wound in solenoid fashion with six nucleosomes per turn to form a 30 nm filament. In this model, the 30 nm filament forms long DNA loops, each containing about 60, 000 bp, which are attached at their base to the nuclear matrix. Eighteen of these loops are then wound radially around the circumference of a single turn to form a miniband unit of a chromosome. Approximately 10 6 of these minibands occur in each chromatid of human chromosome 4 at mitosis. 18
Структура хроматина • A model for chromosome structure, human chromosome 4. The 2 -nm DNA helix is wound twice around histone octamers to form 10 -nm nucleosomes, each of which contains 160 bp (80 per turn). These nucleosomes are then wound in solenoid fashion with six nucleosomes per turn to form a 30 nm filament. In this model, the 30 nm filament forms long DNA loops, each containing about 60, 000 bp, which are attached at their base to the nuclear matrix. Eighteen of these loops are then wound radially around the circumference of a single turn to form a miniband unit of a chromosome. Approximately 10 6 of these minibands occur in each chromatid of human chromosome 4 at mitosis. 18
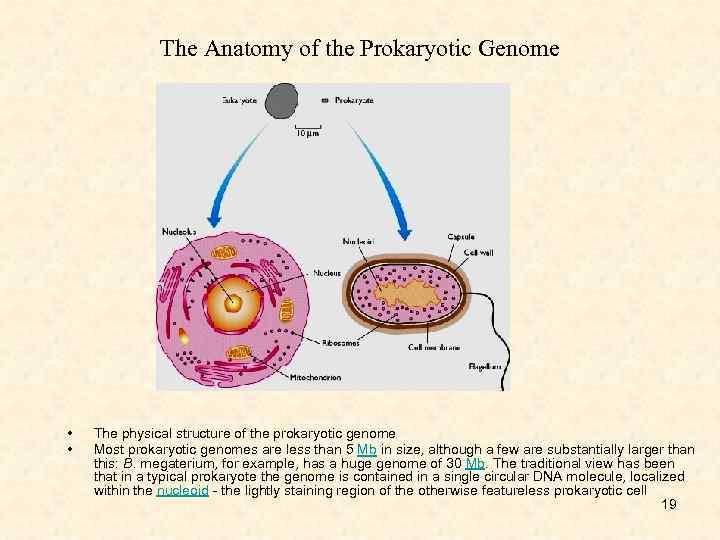 The Anatomy of the Prokaryotic Genome • • The physical structure of the prokaryotic genome Most prokaryotic genomes are less than 5 Mb in size, although a few are substantially larger than this: B. megaterium, for example, has a huge genome of 30 Mb. The traditional view has been that in a typical prokaryote the genome is contained in a single circular DNA molecule, localized within the nucleoid - the lightly staining region of the otherwise featureless prokaryotic cell 19
The Anatomy of the Prokaryotic Genome • • The physical structure of the prokaryotic genome Most prokaryotic genomes are less than 5 Mb in size, although a few are substantially larger than this: B. megaterium, for example, has a huge genome of 30 Mb. The traditional view has been that in a typical prokaryote the genome is contained in a single circular DNA molecule, localized within the nucleoid - the lightly staining region of the otherwise featureless prokaryotic cell 19
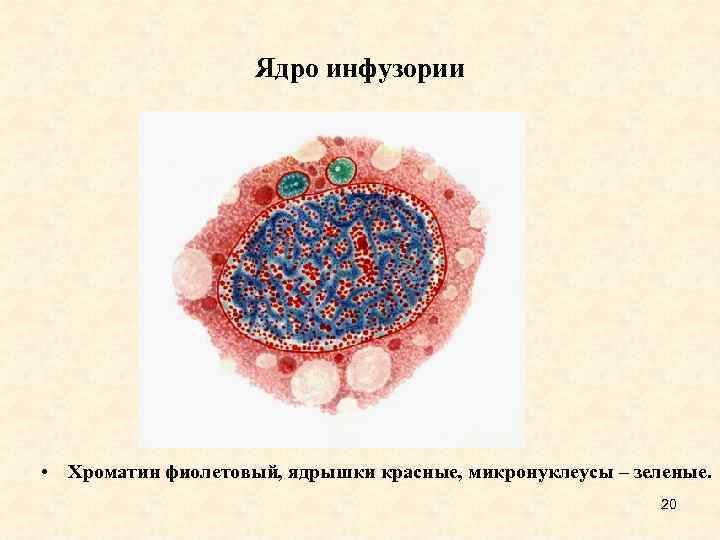 Ядро инфузории • Хроматин фиолетовый, ядрышки красные, микронуклеусы – зеленые. 20
Ядро инфузории • Хроматин фиолетовый, ядрышки красные, микронуклеусы – зеленые. 20
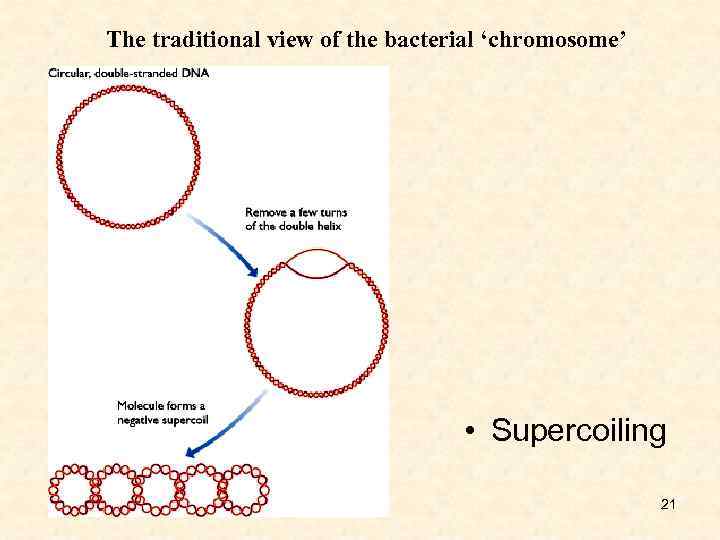 The traditional view of the bacterial ‘chromosome’ • Supercoiling 21
The traditional view of the bacterial ‘chromosome’ • Supercoiling 21
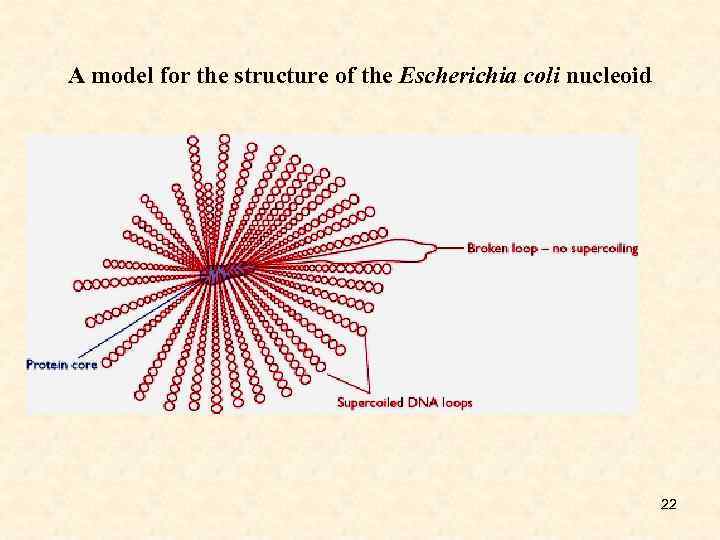 A model for the structure of the Escherichia coli nucleoid 22
A model for the structure of the Escherichia coli nucleoid 22
 Examples of genome organization in prokaryotes Genome organization Species DNA molecules Escherichia coli K-12 One circular molecule Vibrio cholerae El Tor N 16961 Size (Mb) Number of genes Two circular molecules 4397 Main chromosome 2. 961 2770 Megaplasmid Deinococcus radiodurans R 1 4. 639 1. 073 1115 Chromosome 1 2. 649 2633 Chromosome 2 0. 412 369 Megaplasmid 0. 177 145 Plasmid 0. 046 40 Four circular molecules 23
Examples of genome organization in prokaryotes Genome organization Species DNA molecules Escherichia coli K-12 One circular molecule Vibrio cholerae El Tor N 16961 Size (Mb) Number of genes Two circular molecules 4397 Main chromosome 2. 961 2770 Megaplasmid Deinococcus radiodurans R 1 4. 639 1. 073 1115 Chromosome 1 2. 649 2633 Chromosome 2 0. 412 369 Megaplasmid 0. 177 145 Plasmid 0. 046 40 Four circular molecules 23
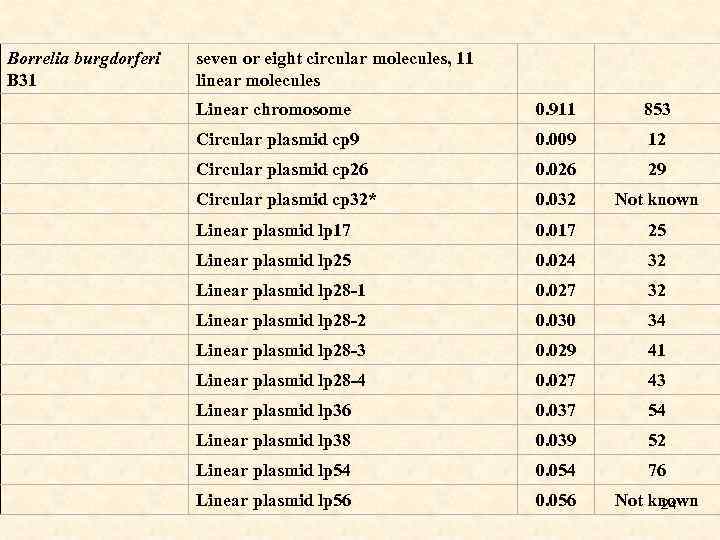 Borrelia burgdorferi B 31 seven or eight circular molecules, 11 linear molecules Linear chromosome 0. 911 853 Circular plasmid cp 9 0. 009 12 Circular plasmid cp 26 0. 026 29 Circular plasmid cp 32* 0. 032 Not known Linear plasmid lp 17 0. 017 25 Linear plasmid lp 25 0. 024 32 Linear plasmid lp 28 -1 0. 027 32 Linear plasmid lp 28 -2 0. 030 34 Linear plasmid lp 28 -3 0. 029 41 Linear plasmid lp 28 -4 0. 027 43 Linear plasmid lp 36 0. 037 54 Linear plasmid lp 38 0. 039 52 Linear plasmid lp 54 0. 054 76 Linear plasmid lp 56 0. 056 Not known 24
Borrelia burgdorferi B 31 seven or eight circular molecules, 11 linear molecules Linear chromosome 0. 911 853 Circular plasmid cp 9 0. 009 12 Circular plasmid cp 26 0. 026 29 Circular plasmid cp 32* 0. 032 Not known Linear plasmid lp 17 0. 017 25 Linear plasmid lp 25 0. 024 32 Linear plasmid lp 28 -1 0. 027 32 Linear plasmid lp 28 -2 0. 030 34 Linear plasmid lp 28 -3 0. 029 41 Linear plasmid lp 28 -4 0. 027 43 Linear plasmid lp 36 0. 037 54 Linear plasmid lp 38 0. 039 52 Linear plasmid lp 54 0. 054 76 Linear plasmid lp 56 0. 056 Not known 24
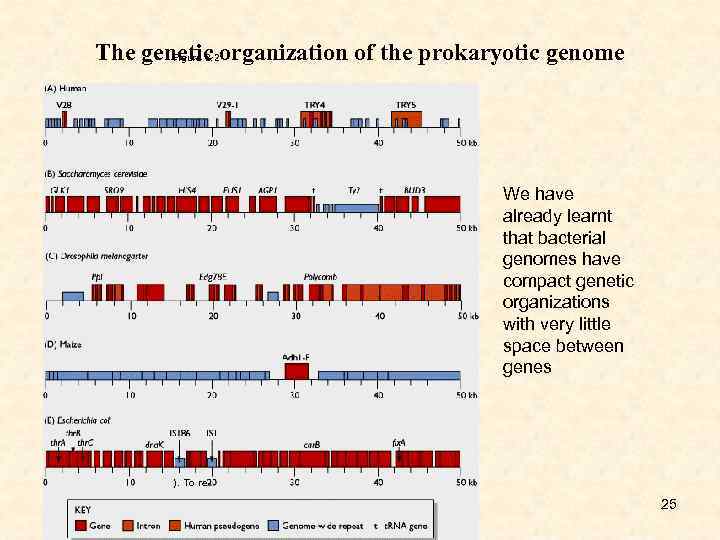 The genetic organization of the prokaryotic genome Figure 2. 2 We have already learnt that bacterial genomes have compact genetic organizations with very little space between genes ). To re- 25
The genetic organization of the prokaryotic genome Figure 2. 2 We have already learnt that bacterial genomes have compact genetic organizations with very little space between genes ). To re- 25
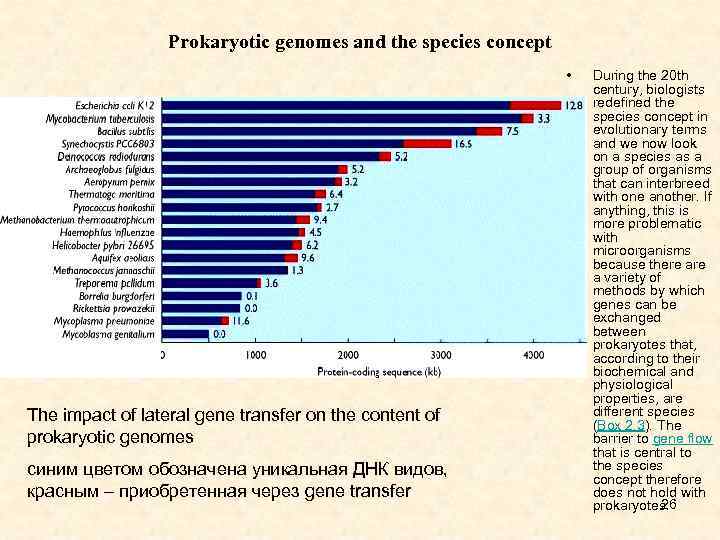 Prokaryotic genomes and the species concept • The impact of lateral gene transfer on the content of prokaryotic genomes синим цветом обозначена уникальная ДНК видов, красным – приобретенная через gene transfer During the 20 th century, biologists redefined the species concept in evolutionary terms and we now look on a species as a group of organisms that can interbreed with one another. If anything, this is more problematic with microorganisms because there a variety of methods by which genes can be exchanged between prokaryotes that, according to their biochemical and physiological properties, are different species (Box 2. 3). The barrier to gene flow that is central to the species concept therefore does not hold with 26 prokaryotes.
Prokaryotic genomes and the species concept • The impact of lateral gene transfer on the content of prokaryotic genomes синим цветом обозначена уникальная ДНК видов, красным – приобретенная через gene transfer During the 20 th century, biologists redefined the species concept in evolutionary terms and we now look on a species as a group of organisms that can interbreed with one another. If anything, this is more problematic with microorganisms because there a variety of methods by which genes can be exchanged between prokaryotes that, according to their biochemical and physiological properties, are different species (Box 2. 3). The barrier to gene flow that is central to the species concept therefore does not hold with 26 prokaryotes.
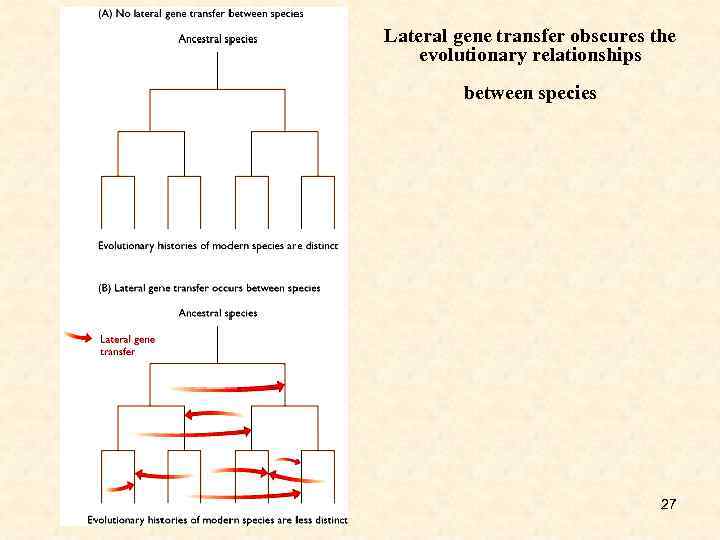 Lateral gene transfer obscures the evolutionary relationships between species 27
Lateral gene transfer obscures the evolutionary relationships between species 27
 28
28
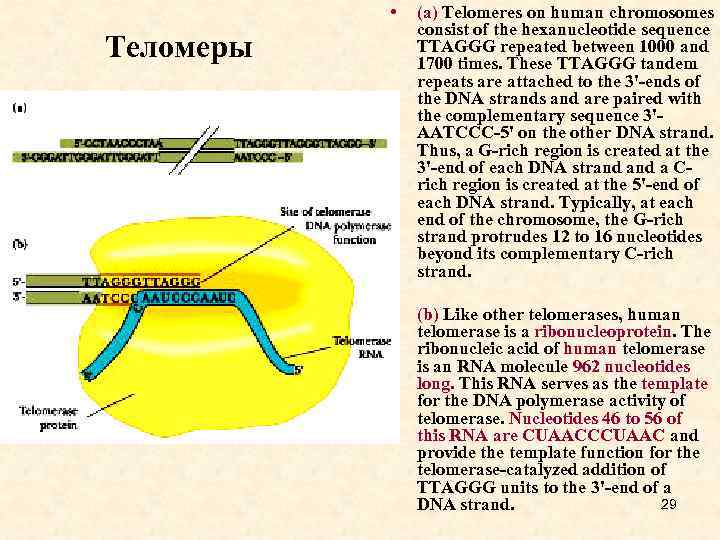 • (a) Telomeres on human chromosomes consist of the hexanucleotide sequence TTAGGG repeated between 1000 and 1700 times. These TTAGGG tandem repeats are attached to the 3'-ends of the DNA strands and are paired with the complementary sequence 3'AATCCC-5' on the other DNA strand. Thus, a G-rich region is created at the 3'-end of each DNA strand a Crich region is created at the 5'-end of each DNA strand. Typically, at each end of the chromosome, the G-rich strand protrudes 12 to 16 nucleotides beyond its complementary C-rich strand. • (b) Like other telomerases, human telomerase is a ribonucleoprotein. The ribonucleic acid of human telomerase is an RNA molecule 962 nucleotides long. This RNA serves as the template for the DNA polymerase activity of telomerase. Nucleotides 46 to 56 of this RNA are CUAACCCUAAC and provide the template function for the telomerase-catalyzed addition of TTAGGG units to the 3'-end of a 29 DNA strand. Теломеры
• (a) Telomeres on human chromosomes consist of the hexanucleotide sequence TTAGGG repeated between 1000 and 1700 times. These TTAGGG tandem repeats are attached to the 3'-ends of the DNA strands and are paired with the complementary sequence 3'AATCCC-5' on the other DNA strand. Thus, a G-rich region is created at the 3'-end of each DNA strand a Crich region is created at the 5'-end of each DNA strand. Typically, at each end of the chromosome, the G-rich strand protrudes 12 to 16 nucleotides beyond its complementary C-rich strand. • (b) Like other telomerases, human telomerase is a ribonucleoprotein. The ribonucleic acid of human telomerase is an RNA molecule 962 nucleotides long. This RNA serves as the template for the DNA polymerase activity of telomerase. Nucleotides 46 to 56 of this RNA are CUAACCCUAAC and provide the template function for the telomerase-catalyzed addition of TTAGGG units to the 3'-end of a 29 DNA strand. Теломеры
 Size of DNA Molecules • Because of the double helical nature of DNA molecules, their size can be represented in terms of the numbers of nucleotide base pairs they contain. For example, the E. coli chromosome consists of 4. 64 x 106 base pairs (abbreviated bp) or 4. 64 x 103 kilobase pairs (kbp). DNA is a threadlike molecule. The diameter of the DNA double helix is only 2 nm, but the length of the DNA molecule forming the E. coli chromosome is over 1. 6 x 106 nm (1. 6 mm). Because the long dimension of an E. coli cell is only 2000 nm (0. 002 mm), its chromosome must be highly folded. Because of their long, threadlike nature, DNA molecules are easily sheared into shorter fragments during isolation procedures, and it is difficult to obtain intact chromosomes even from the simple cells of prokaryotes. 30
Size of DNA Molecules • Because of the double helical nature of DNA molecules, their size can be represented in terms of the numbers of nucleotide base pairs they contain. For example, the E. coli chromosome consists of 4. 64 x 106 base pairs (abbreviated bp) or 4. 64 x 103 kilobase pairs (kbp). DNA is a threadlike molecule. The diameter of the DNA double helix is only 2 nm, but the length of the DNA molecule forming the E. coli chromosome is over 1. 6 x 106 nm (1. 6 mm). Because the long dimension of an E. coli cell is only 2000 nm (0. 002 mm), its chromosome must be highly folded. Because of their long, threadlike nature, DNA molecules are easily sheared into shorter fragments during isolation procedures, and it is difficult to obtain intact chromosomes even from the simple cells of prokaryotes. 30
 • Ацетилирование гистонов (человек) • 30 nm структура не всегда гомогенна. В зависимости от состояния транскрипционной активности, структура может сворачиваться и разбираться. Такая мобильность хроматина достигается при помощи действия гистонацетилтрансфераз (HAС) и гистондеацетилтрансфераз (HDAС). HAС ацетилируют N - концы гистонов. Тем самым нейтрализуется избыточный положительный заряд положительно заряженных концов гистонов и ослабляется взаимодействие ДНК с нуклеосомным кором. • В пользу того, что действие HAС направлено на облегчение процесса транскрипции указывает множество фактов. Вот некоторые из них, полученные в экспериментах с дрожжами S. cervisiae. – HAС не могут ацетилировать специфически мутированный гистон H 4. При этом транскрипция уменьшается. – Ингибирование HDAС приводит к повышению уровня транскрипции. – Ацетилирование HMG - белков имеет структурное и cis - регуляторное значение. 31
• Ацетилирование гистонов (человек) • 30 nm структура не всегда гомогенна. В зависимости от состояния транскрипционной активности, структура может сворачиваться и разбираться. Такая мобильность хроматина достигается при помощи действия гистонацетилтрансфераз (HAС) и гистондеацетилтрансфераз (HDAС). HAС ацетилируют N - концы гистонов. Тем самым нейтрализуется избыточный положительный заряд положительно заряженных концов гистонов и ослабляется взаимодействие ДНК с нуклеосомным кором. • В пользу того, что действие HAС направлено на облегчение процесса транскрипции указывает множество фактов. Вот некоторые из них, полученные в экспериментах с дрожжами S. cervisiae. – HAС не могут ацетилировать специфически мутированный гистон H 4. При этом транскрипция уменьшается. – Ингибирование HDAС приводит к повышению уровня транскрипции. – Ацетилирование HMG - белков имеет структурное и cis - регуляторное значение. 31
 • Один из наиболее известных комплексов, обладающий ацетилтрансферазной активностью - SAGA - комплекс. Один из белков, входящих в состав этого комплекса у дрожжей, Gsn 5, является HAC. Однако каким образом осуществляется взаимодействие указанного комплекса с другими комплексами и белками транскрипционной машины до конца не известно. • Другие известные белки, обладающие HAC - активностями: – TAFII 130, TAFII 250 - факторы активации транскрипции; – P 300/CBP - HAC, взаимодействует с энхансерами и ассоциирован с РНК - полимеразой II; – P-CAF; • Про HDAC в настоящее время известно достаточно мало. Одна из наиболее изученных - Rpd 3. Предполагается, что она ингибирует действие SAGA - комплекса. 32
• Один из наиболее известных комплексов, обладающий ацетилтрансферазной активностью - SAGA - комплекс. Один из белков, входящих в состав этого комплекса у дрожжей, Gsn 5, является HAC. Однако каким образом осуществляется взаимодействие указанного комплекса с другими комплексами и белками транскрипционной машины до конца не известно. • Другие известные белки, обладающие HAC - активностями: – TAFII 130, TAFII 250 - факторы активации транскрипции; – P 300/CBP - HAC, взаимодействует с энхансерами и ассоциирован с РНК - полимеразой II; – P-CAF; • Про HDAC в настоящее время известно достаточно мало. Одна из наиболее изученных - Rpd 3. Предполагается, что она ингибирует действие SAGA - комплекса. 32
 Схема уровня активации хроматина, предложенная Kadonaga Состояние активности гена Структура гена Активированное 1. Промотор- и энхансер-связывающиеся факторы с базовой РНК полимеразной машиной находящейся в активированном состоянии на промоторе; 2. In vitro: базовые факторы транскрипции и активаторы. Истинная активация Дерепрессированное 1. Матрица, доступная транскрипционным факторам; 2. 10 nm или слабо уложенная 30 nm хроматиновая фибрилла; 3. Возможно, что гистоны удалены; 4. In vitro: голая ДНК с базовыми факторами транскрипции. Антирепрессия Неактивное базовое. 1. 30 nm или 10 nm хроматиновая фибрилла репрессированная позиционированными нуклеосомами; 2. Ингибирование негистоновыми репрессорами; 3. In vitro: хроматиновая матрица или 33 голая ДНК с негистоновыми репрессорами.
Схема уровня активации хроматина, предложенная Kadonaga Состояние активности гена Структура гена Активированное 1. Промотор- и энхансер-связывающиеся факторы с базовой РНК полимеразной машиной находящейся в активированном состоянии на промоторе; 2. In vitro: базовые факторы транскрипции и активаторы. Истинная активация Дерепрессированное 1. Матрица, доступная транскрипционным факторам; 2. 10 nm или слабо уложенная 30 nm хроматиновая фибрилла; 3. Возможно, что гистоны удалены; 4. In vitro: голая ДНК с базовыми факторами транскрипции. Антирепрессия Неактивное базовое. 1. 30 nm или 10 nm хроматиновая фибрилла репрессированная позиционированными нуклеосомами; 2. Ингибирование негистоновыми репрессорами; 3. In vitro: хроматиновая матрица или 33 голая ДНК с негистоновыми репрессорами.
 • ATP - зависимые хроматин-ремоделирующие системы (человек) • Было обнаружено, что в дрожжах ацетилирование гистонов SAGA - комплексами в генах под HO - промоторами происходит при участии комплекса SWI/SNF. Этот комплекс взаимодействует с сигнальной молекулой Swi 5, которая, узнав и связавшись со специфическим местом на ДНК, становиться способной провзаимодействовать с SWI/SNF. После этого активность комплекса SAGA направлена на ацетилирование коровых гистонов, находящихся рядом с Swi 5 и SWI/SNF. При этом Swi 5 перестаёт быть связанной с хроматином. • SWI/SNF обладает ATP - азной активностью. Однако известны примеры, когда транскрипция наблюдается без одной из активностей: либо ацетилазной, либо ATP - азной. • ATP - зависимая активность рассматриваемых комплексов направлена на изменение структуры хроматина - изменение структуры укладки нуклеосом для создания условий работы РНК - полимеразы II. • Известно множество комплексов, способных изменять структуру нуклеосом. Например, в дрожжах SWI/SNF, RSC, ISW 1, ISW 2; у человека: h. SWI/SNF, NURD, RSF; у дрозофилы: d. SWI/SNF, NURF, CHRAC, ACF. Все они в основе своей имеют субъединицу, обладающую ATP - зависимой активностью. Таких субъединиц всего две и они гомологичны от комплека к комплексу. 34
• ATP - зависимые хроматин-ремоделирующие системы (человек) • Было обнаружено, что в дрожжах ацетилирование гистонов SAGA - комплексами в генах под HO - промоторами происходит при участии комплекса SWI/SNF. Этот комплекс взаимодействует с сигнальной молекулой Swi 5, которая, узнав и связавшись со специфическим местом на ДНК, становиться способной провзаимодействовать с SWI/SNF. После этого активность комплекса SAGA направлена на ацетилирование коровых гистонов, находящихся рядом с Swi 5 и SWI/SNF. При этом Swi 5 перестаёт быть связанной с хроматином. • SWI/SNF обладает ATP - азной активностью. Однако известны примеры, когда транскрипция наблюдается без одной из активностей: либо ацетилазной, либо ATP - азной. • ATP - зависимая активность рассматриваемых комплексов направлена на изменение структуры хроматина - изменение структуры укладки нуклеосом для создания условий работы РНК - полимеразы II. • Известно множество комплексов, способных изменять структуру нуклеосом. Например, в дрожжах SWI/SNF, RSC, ISW 1, ISW 2; у человека: h. SWI/SNF, NURD, RSF; у дрозофилы: d. SWI/SNF, NURF, CHRAC, ACF. Все они в основе своей имеют субъединицу, обладающую ATP - зависимой активностью. Таких субъединиц всего две и они гомологичны от комплека к комплексу. 34
 • Активное состояние хроматина (человек) • После того, как произошло ремоделирование структуры хроматина HAC, SWI/SNF, ISWI комплексами, наступает время работы РНК - полимеразы II. Существует несколько моделей того, как это происходит: – На первом этапе с зарепрессированным хроматином связываются активаторы, которые способствуют работе над всей последовательностью гена ремоделирующих комплексов, которые, в свою очередь, делают ДНК доступной для работы РНК - полимеразы II. • С зарепрессированным хроматином связываются активаторы. После этого вдоль последовательности гена проходит "первичная" РНК - полимераза, которая тащит на себе всё необходимое для ремоделирования хроматина. При этом полимераза транскрибирует ген. Имеются экспериментальные данные, указывающие на то, что первичный транскрипт отличается от последующих транскриптов с данного гена в данном активном состоянии. Вслед за "первичной" полимеразой начинает работать РНК - полимераза II, которая движется уже по ремоделированному хроматину вдоль последовательности гена. 35
• Активное состояние хроматина (человек) • После того, как произошло ремоделирование структуры хроматина HAC, SWI/SNF, ISWI комплексами, наступает время работы РНК - полимеразы II. Существует несколько моделей того, как это происходит: – На первом этапе с зарепрессированным хроматином связываются активаторы, которые способствуют работе над всей последовательностью гена ремоделирующих комплексов, которые, в свою очередь, делают ДНК доступной для работы РНК - полимеразы II. • С зарепрессированным хроматином связываются активаторы. После этого вдоль последовательности гена проходит "первичная" РНК - полимераза, которая тащит на себе всё необходимое для ремоделирования хроматина. При этом полимераза транскрибирует ген. Имеются экспериментальные данные, указывающие на то, что первичный транскрипт отличается от последующих транскриптов с данного гена в данном активном состоянии. Вслед за "первичной" полимеразой начинает работать РНК - полимераза II, которая движется уже по ремоделированному хроматину вдоль последовательности гена. 35
 Chromosome Territories, Nuclear Architecture and Gene Regulation in Mammalian Cells (Thomas Cremer and Christoph Cremer, 2001) 36
Chromosome Territories, Nuclear Architecture and Gene Regulation in Mammalian Cells (Thomas Cremer and Christoph Cremer, 2001) 36
 • • • Chromosomes occupy discrete territories in the cell nucleus and contain distinct chromosome-arm and chromosome-band domains. Chromosome territories (CTs) with different gene densities occupy distinct nuclear positions. Gene-poor, mid-to-late-replicating chromatin is enriched in nuclear compartments that are located at the nuclear periphery and at the perinucleolar region. A compartment for gene-dense, early-replicating chromatin is separated from the compartments for mid-to-late-replicating chromatin. Chromatin domains with a DNA content of ~1 Mb can be detected in nuclei during interphase and in non-cycling cells. The interchromatin compartment (IC) contains various types of non-chromatin domains with factors for transcription, splicing, DNA replication and repair. The CT-IC model predicts that a specific topological relationship between the IC and chromatin domains is essential for gene regulation. The transcriptional status of genes correlates with gene positioning in CTs. A dynamic repositioning of genes with respect to centromeric heterochromatin has a role in gene silencing and activation. Various computer models of CTs and nuclear architecture make different predictions that can be validated by experimental tests. Comprehensive understanding of gene regulation requires much more detailed knowledge of gene expression in the context of nuclear architecture and organization. 37
• • • Chromosomes occupy discrete territories in the cell nucleus and contain distinct chromosome-arm and chromosome-band domains. Chromosome territories (CTs) with different gene densities occupy distinct nuclear positions. Gene-poor, mid-to-late-replicating chromatin is enriched in nuclear compartments that are located at the nuclear periphery and at the perinucleolar region. A compartment for gene-dense, early-replicating chromatin is separated from the compartments for mid-to-late-replicating chromatin. Chromatin domains with a DNA content of ~1 Mb can be detected in nuclei during interphase and in non-cycling cells. The interchromatin compartment (IC) contains various types of non-chromatin domains with factors for transcription, splicing, DNA replication and repair. The CT-IC model predicts that a specific topological relationship between the IC and chromatin domains is essential for gene regulation. The transcriptional status of genes correlates with gene positioning in CTs. A dynamic repositioning of genes with respect to centromeric heterochromatin has a role in gene silencing and activation. Various computer models of CTs and nuclear architecture make different predictions that can be validated by experimental tests. Comprehensive understanding of gene regulation requires much more detailed knowledge of gene expression in the context of nuclear architecture and organization. 37
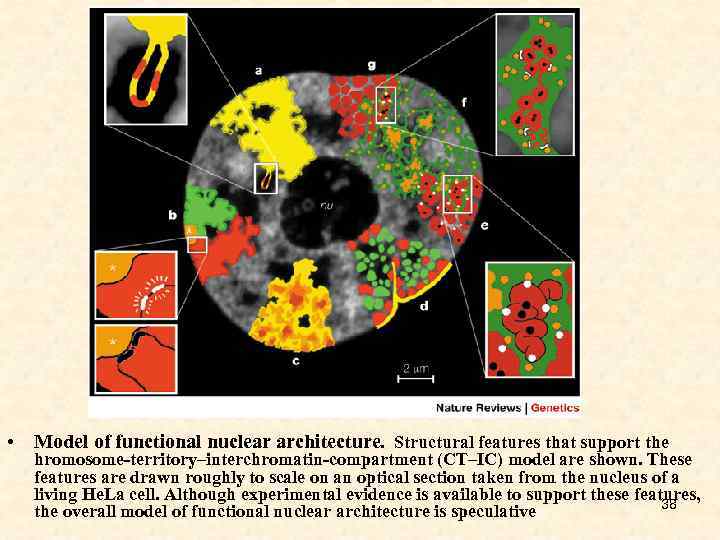 • Model of functional nuclear architecture. Structural features that support the hromosome-territory–interchromatin-compartment (CT–IC) model are shown. These features are drawn roughly to scale on an optical section taken from the nucleus of a living He. La cell. Although experimental evidence is available to support these features, 38 the overall model of functional nuclear architecture is speculative
• Model of functional nuclear architecture. Structural features that support the hromosome-territory–interchromatin-compartment (CT–IC) model are shown. These features are drawn roughly to scale on an optical section taken from the nucleus of a living He. La cell. Although experimental evidence is available to support these features, 38 the overall model of functional nuclear architecture is speculative
 • a: CTs have complex folded surfaces. Inset: topological model of gene regulation 23. A giant chromatin loop with several active genes (red) expands from the CT surface into the IC space. • b: CTs contain separate arm domains for the short (p) and long chromosome arms (q), and a centromeric domain (asterisks). Inset: topological model of gene regulation 78, 79. Top, actively transcribed genes (white) are located on a chromatin loop that is remote from centromeric heterochromatin. Bottom, recruitment of the same genes (black) to the centromeric heterochromatin leads to their silencing. • c: CTs have variable chromatin density (dark brown, high density; light yellow, low density). Loose chromatin expands into the IC, whereas the most dense chromatin is remote from the IC. • d: CT showing early-replicating chromatin domains (green) and mid-to-late-replicating chromatin domains (red). Each domain comprises 1 Mb. Gene-poor chromatin (red), is preferentially located at the nuclear periphery and in close contact with the nuclear lamina (yellow), as well as with infoldings of the lamina and around the nucleolus (nu). Gene-rich chromatin (green) is located between the gene-poor compartments. e: Higher-order chromatin structures built up from a hierarchy of chromatin fibres 88. Inset: this topological view of gene regulation 27, 68 indicates that active genes (white dots) are at the surface of convoluted chromatin fibres. Silenced genes (black dots) may be located towards the interior of the chromatin structure. f : The CT–IC model predicts that the IC (green) contains complexes (orange dots) and larger non-chromatin domains (aggregations of orange dots) for transcription, splicing, DNA replication and repair. • • • g: CT with 1 -Mb chromatin domains (red) and IC (green) expanding between these domains. Inset: the topological relationships between the IC, and active and inactive genes 72. The finest branches of the IC end between 100 -kb chromatin domains. Top: active genes (white dots) are 39 located at the surface of these domains, whereas silenced genes (black dots) are located in the interior. Bottom: alternatively, closed 100 -kb chromatin domains with silenced genes are
• a: CTs have complex folded surfaces. Inset: topological model of gene regulation 23. A giant chromatin loop with several active genes (red) expands from the CT surface into the IC space. • b: CTs contain separate arm domains for the short (p) and long chromosome arms (q), and a centromeric domain (asterisks). Inset: topological model of gene regulation 78, 79. Top, actively transcribed genes (white) are located on a chromatin loop that is remote from centromeric heterochromatin. Bottom, recruitment of the same genes (black) to the centromeric heterochromatin leads to their silencing. • c: CTs have variable chromatin density (dark brown, high density; light yellow, low density). Loose chromatin expands into the IC, whereas the most dense chromatin is remote from the IC. • d: CT showing early-replicating chromatin domains (green) and mid-to-late-replicating chromatin domains (red). Each domain comprises 1 Mb. Gene-poor chromatin (red), is preferentially located at the nuclear periphery and in close contact with the nuclear lamina (yellow), as well as with infoldings of the lamina and around the nucleolus (nu). Gene-rich chromatin (green) is located between the gene-poor compartments. e: Higher-order chromatin structures built up from a hierarchy of chromatin fibres 88. Inset: this topological view of gene regulation 27, 68 indicates that active genes (white dots) are at the surface of convoluted chromatin fibres. Silenced genes (black dots) may be located towards the interior of the chromatin structure. f : The CT–IC model predicts that the IC (green) contains complexes (orange dots) and larger non-chromatin domains (aggregations of orange dots) for transcription, splicing, DNA replication and repair. • • • g: CT with 1 -Mb chromatin domains (red) and IC (green) expanding between these domains. Inset: the topological relationships between the IC, and active and inactive genes 72. The finest branches of the IC end between 100 -kb chromatin domains. Top: active genes (white dots) are 39 located at the surface of these domains, whereas silenced genes (black dots) are located in the interior. Bottom: alternatively, closed 100 -kb chromatin domains with silenced genes are
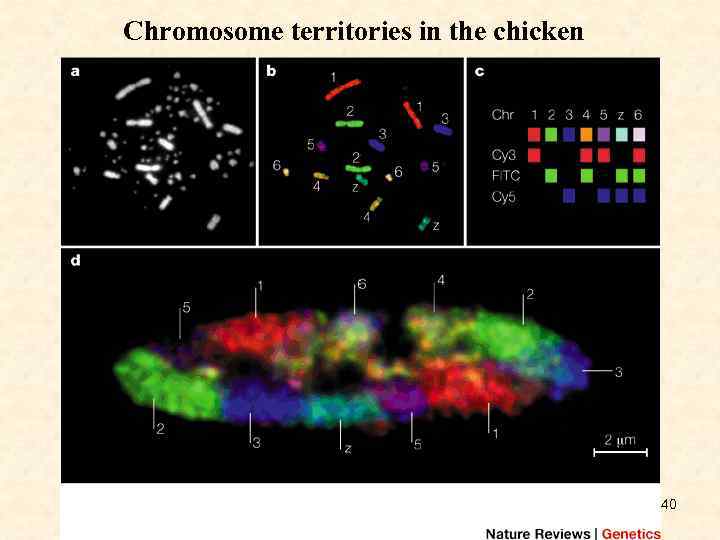 Chromosome territories in the chicken 40
Chromosome territories in the chicken 40
 • a: 4, 6 -diamidino-2 -phenylindole (DAPI)-stained, diploid, chicken metaphase spread with macro- and microchromosomes. • b: The same metaphase spread after multicolour fluorescence in situ hybridization with pseudocoloured chromosomes. Chicken chromosome paint probes (image courtesy of Johannes Wienberg) were labelled by a combinatorial scheme with oestradiol (1, 4, 5, 6), digoxigenin (2, 4, 6, Z) and biotin (3, 5, 6, Z). • c: Oestradiol- and digoxigenin-labelled probes were detected using secondary antibodies labelled with Cy 3 and fluorescein isothiocyanate (FITC); biotinylated probes were detected with Cy 5 -conjugated streptavidin. • d: Mid-plane light optical section through a chicken fibroblast nucleus shows mutually exclusive chromosome territories (CTs) with homologous chromosomes seen in separate locations. (Note that only one of the two CTs for each of 4 and 6 is displayed in this section. ) (Image courtesy of F. Habermann. ) 41
• a: 4, 6 -diamidino-2 -phenylindole (DAPI)-stained, diploid, chicken metaphase spread with macro- and microchromosomes. • b: The same metaphase spread after multicolour fluorescence in situ hybridization with pseudocoloured chromosomes. Chicken chromosome paint probes (image courtesy of Johannes Wienberg) were labelled by a combinatorial scheme with oestradiol (1, 4, 5, 6), digoxigenin (2, 4, 6, Z) and biotin (3, 5, 6, Z). • c: Oestradiol- and digoxigenin-labelled probes were detected using secondary antibodies labelled with Cy 3 and fluorescein isothiocyanate (FITC); biotinylated probes were detected with Cy 5 -conjugated streptavidin. • d: Mid-plane light optical section through a chicken fibroblast nucleus shows mutually exclusive chromosome territories (CTs) with homologous chromosomes seen in separate locations. (Note that only one of the two CTs for each of 4 and 6 is displayed in this section. ) (Image courtesy of F. Habermann. ) 41
 Features of human chromosome territories 42
Features of human chromosome territories 42
 • • • a: Two-colour painting of the p-arm (red) and the q-arm (green) of human chromosome 1 in a lymphocyte metaphase spread. b: Visualization of the two arms in a light optical section through a human diploid fibroblast nucleus (bottom) shows two distinct, mutually exclusive arm domains 20. ( Image courtesy of Steffen Dietzel). c: Painting of the human X chromosome (red) and several distal bands of its parm and q-arm (green) using MICRODISSECTION PROBES 20. d: Visualization of the active and inactive X-chromosome territories (Xa and Xi, respectively) together with the respective distal-band domains in a light optical section through a female human fibroblast nucleus. (Image courtesy of Joachim Karpf and Irina Solovei). e: Three-dimensional reconstructions of the Xa and Xi territories from a human female fibroblast nucleus (Reproduced with permission from Ref. 22). The three-dimensional positions of the ANT 2 and ANT 3 (adenosine nucleotide translocase) genes are noted as green and blue spheres, respectively. Note that active ANT genes can be seen at the territory surface (two on Xa and one on Xi). The white box provides a transparent view of the Xi territory (pink), indicating the location of the inactive ANT 2 gene in the territory interior. f: Three-dimensonal reconstructions of two chromosome-17 territories, established from light optical serial sections through a human diploid fibroblast nucleus, show complex territory surfaces. 43
• • • a: Two-colour painting of the p-arm (red) and the q-arm (green) of human chromosome 1 in a lymphocyte metaphase spread. b: Visualization of the two arms in a light optical section through a human diploid fibroblast nucleus (bottom) shows two distinct, mutually exclusive arm domains 20. ( Image courtesy of Steffen Dietzel). c: Painting of the human X chromosome (red) and several distal bands of its parm and q-arm (green) using MICRODISSECTION PROBES 20. d: Visualization of the active and inactive X-chromosome territories (Xa and Xi, respectively) together with the respective distal-band domains in a light optical section through a female human fibroblast nucleus. (Image courtesy of Joachim Karpf and Irina Solovei). e: Three-dimensional reconstructions of the Xa and Xi territories from a human female fibroblast nucleus (Reproduced with permission from Ref. 22). The three-dimensional positions of the ANT 2 and ANT 3 (adenosine nucleotide translocase) genes are noted as green and blue spheres, respectively. Note that active ANT genes can be seen at the territory surface (two on Xa and one on Xi). The white box provides a transparent view of the Xi territory (pink), indicating the location of the inactive ANT 2 gene in the territory interior. f: Three-dimensonal reconstructions of two chromosome-17 territories, established from light optical serial sections through a human diploid fibroblast nucleus, show complex territory surfaces. 43
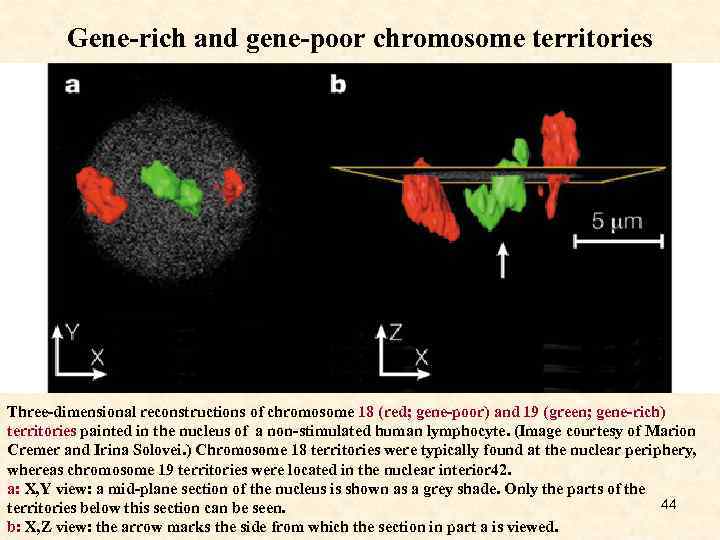 Gene-rich and gene-poor chromosome territories Three-dimensional reconstructions of chromosome 18 (red; gene-poor) and 19 (green; gene-rich) territories painted in the nucleus of a non-stimulated human lymphocyte. (Image courtesy of Marion Cremer and Irina Solovei. ) Chromosome 18 territories were typically found at the nuclear periphery, whereas chromosome 19 territories were located in the nuclear interior 42. a: X, Y view: a mid-plane section of the nucleus is shown as a grey shade. Only the parts of the 44 territories below this section can be seen. b: X, Z view: the arrow marks the side from which the section in part a is viewed.
Gene-rich and gene-poor chromosome territories Three-dimensional reconstructions of chromosome 18 (red; gene-poor) and 19 (green; gene-rich) territories painted in the nucleus of a non-stimulated human lymphocyte. (Image courtesy of Marion Cremer and Irina Solovei. ) Chromosome 18 territories were typically found at the nuclear periphery, whereas chromosome 19 territories were located in the nuclear interior 42. a: X, Y view: a mid-plane section of the nucleus is shown as a grey shade. Only the parts of the 44 territories below this section can be seen. b: X, Z view: the arrow marks the side from which the section in part a is viewed.
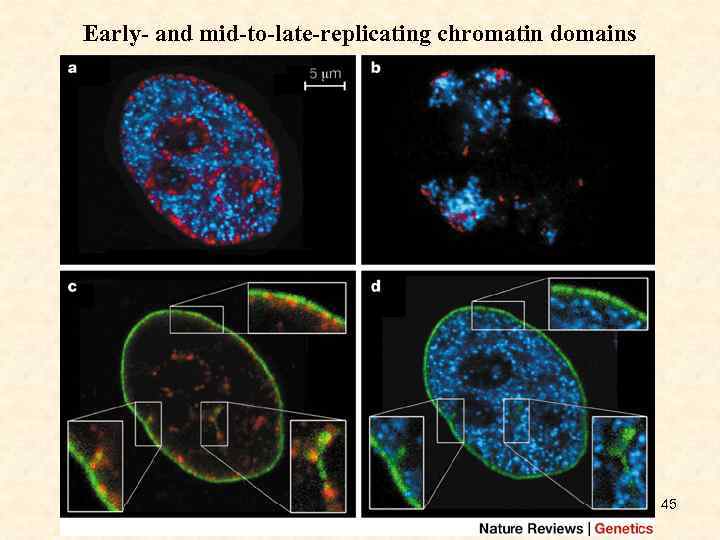 Early- and mid-to-late-replicating chromatin domains 45
Early- and mid-to-late-replicating chromatin domains 45
 • • • a: Mid-plane light optical section through the nucleus of an SH-EP N 14 neuroblastoma cell fixed 20 h after direct two-colour labelling of DNA with Cy 3 - and Cy 5 -conjugated nucleotides at early and mid-S-phase, respectively, shows typical early- (blue) and mid-replicated chromatin (red)115. The cell shown is a daughter of the labelled cell produced after one cell division. The experiment shows that the arrangement of early- and mid-replicating chromatin domains is maintained from one cell cycle to the next. b: Light optical mid-section through the nucleus of an SH-EP N 14 cell fixed three days after two-colour DNA labelling at early- and mid-S-phase shows several chromosome territories (CTs) with typical early-(blue) and mid-(red) replicated 1 -Mb chromatin domains 115. Only a minority of CTs is labelled, which indicates that fixation was carried out after at least three post-labelling cell cycles. Note that the topology of mid-replicating chromatin (at the nuclear periphery and around the nucleoli) and early-replicating chromatin (in the interior nuclear compartment) was maintained through several post-labelling cell cycles. c, d: Mid-plane light optical section through the same cell nucleus shown in a immunostained with lamin B (green). A comparison of c and d shows that midreplicating 1 -Mb chromatin domains (c, red) are closely associated with the lamina, in contrast to the early-replicating domains (d, blue). (Images courtesy of Lothar Schermelleh. ) (Adapted with permission from Ref. 115. ) 46
• • • a: Mid-plane light optical section through the nucleus of an SH-EP N 14 neuroblastoma cell fixed 20 h after direct two-colour labelling of DNA with Cy 3 - and Cy 5 -conjugated nucleotides at early and mid-S-phase, respectively, shows typical early- (blue) and mid-replicated chromatin (red)115. The cell shown is a daughter of the labelled cell produced after one cell division. The experiment shows that the arrangement of early- and mid-replicating chromatin domains is maintained from one cell cycle to the next. b: Light optical mid-section through the nucleus of an SH-EP N 14 cell fixed three days after two-colour DNA labelling at early- and mid-S-phase shows several chromosome territories (CTs) with typical early-(blue) and mid-(red) replicated 1 -Mb chromatin domains 115. Only a minority of CTs is labelled, which indicates that fixation was carried out after at least three post-labelling cell cycles. Note that the topology of mid-replicating chromatin (at the nuclear periphery and around the nucleoli) and early-replicating chromatin (in the interior nuclear compartment) was maintained through several post-labelling cell cycles. c, d: Mid-plane light optical section through the same cell nucleus shown in a immunostained with lamin B (green). A comparison of c and d shows that midreplicating 1 -Mb chromatin domains (c, red) are closely associated with the lamina, in contrast to the early-replicating domains (d, blue). (Images courtesy of Lothar Schermelleh. ) (Adapted with permission from Ref. 115. ) 46
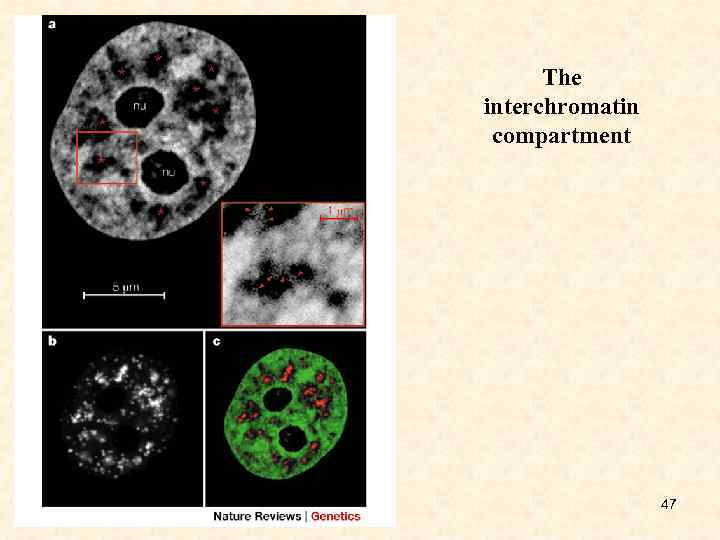 The interchromatin compartment 47
The interchromatin compartment 47
 • LASER CONFOCAL sections through a He. La cell nucleus with greenfluorescent-protein (GFP)-tagged H 2 B (cells kindly supplied by Ken Sullivan)56, and staining of speckles (image courtesy of Irina Solovei). • a: Section showing GFP-tagged chromatin (high density, white; low density, grey), two nucleoli (nu) and the interchromatin compartment (IC) space (black). Note the variability in the width of this space with examples of IC lacunas (asterisks). The inset shows expansions of lesscondensed chromatin into the IC space at higher magnification. • b: Speckles visualized in the same section using antibodies to the nonsn. RNP splicing factor SC-35. • c: Overlay of sections (chromatin, green; speckles, red) shows that speckles form clusters in IC lacunas. These lacunas are only partially filled by the speckles, leaving space for other non-chromatin domains. 48
• LASER CONFOCAL sections through a He. La cell nucleus with greenfluorescent-protein (GFP)-tagged H 2 B (cells kindly supplied by Ken Sullivan)56, and staining of speckles (image courtesy of Irina Solovei). • a: Section showing GFP-tagged chromatin (high density, white; low density, grey), two nucleoli (nu) and the interchromatin compartment (IC) space (black). Note the variability in the width of this space with examples of IC lacunas (asterisks). The inset shows expansions of lesscondensed chromatin into the IC space at higher magnification. • b: Speckles visualized in the same section using antibodies to the nonsn. RNP splicing factor SC-35. • c: Overlay of sections (chromatin, green; speckles, red) shows that speckles form clusters in IC lacunas. These lacunas are only partially filled by the speckles, leaving space for other non-chromatin domains. 48
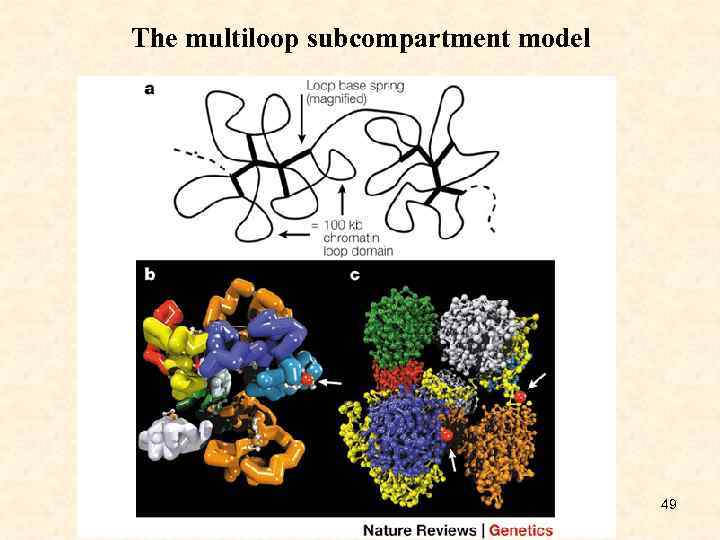 The multiloop subcompartment model 49
The multiloop subcompartment model 49
 • • a: Two 1 -Mb chromatin domains or 'subcompartments' are shown linked by a chromatin fibre (redrawn with permission from Ref. 72). Each 1 -Mb chromatin domain is built up as a rosette of looped 100 -kb chromatin fibres. At the centre, loops are held together by a magnified LOOP BASE SPRING, which simulates the function of CHROMOSOME TERRITORY ANCHOR PROTEINS 116. b, c: Two three-dimensional models of the internal ultrastructure of a 1 -Mb chromatin domain (image courtesy of Gregor Kreth; models redrawn with permission from Ref. 12 © Begell House, Inc. (2000)). b: The nucleosome chain is compacted into a 30 -nm chromatin fibre (visualized by cylinder segments) and folded into ten 100 -kb-sized loop domains according to the multiloop subcompartment model. Occasionally, 30 nm fibres are interrupted by short regions of individual nucleosomes (small white dots). The arrow points to a red sphere, with a diameter of 30 nm, that represents a transcription factor complex. c: Each of the ten 100 -kb chromatin domains was modelled under the assumption of a restricted random walk (zig-zag) nucleosome chain. Each dot represents an individual nucleosome. Nine 100 -kb chromatin domains are shown in a closed configuration and one in an open chromatin configuration with a relaxed chain structure that expands at the periphery of the 1 -Mb domain. The open domain will have enhanced accessibility to partial transcription complexes preformed in the interchromatin compartment. By contrast, most of the chromatin in the nine closed domains remains inaccessible to larger factor complexes (arrows). 50
• • a: Two 1 -Mb chromatin domains or 'subcompartments' are shown linked by a chromatin fibre (redrawn with permission from Ref. 72). Each 1 -Mb chromatin domain is built up as a rosette of looped 100 -kb chromatin fibres. At the centre, loops are held together by a magnified LOOP BASE SPRING, which simulates the function of CHROMOSOME TERRITORY ANCHOR PROTEINS 116. b, c: Two three-dimensional models of the internal ultrastructure of a 1 -Mb chromatin domain (image courtesy of Gregor Kreth; models redrawn with permission from Ref. 12 © Begell House, Inc. (2000)). b: The nucleosome chain is compacted into a 30 -nm chromatin fibre (visualized by cylinder segments) and folded into ten 100 -kb-sized loop domains according to the multiloop subcompartment model. Occasionally, 30 nm fibres are interrupted by short regions of individual nucleosomes (small white dots). The arrow points to a red sphere, with a diameter of 30 nm, that represents a transcription factor complex. c: Each of the ten 100 -kb chromatin domains was modelled under the assumption of a restricted random walk (zig-zag) nucleosome chain. Each dot represents an individual nucleosome. Nine 100 -kb chromatin domains are shown in a closed configuration and one in an open chromatin configuration with a relaxed chain structure that expands at the periphery of the 1 -Mb domain. The open domain will have enhanced accessibility to partial transcription complexes preformed in the interchromatin compartment. By contrast, most of the chromatin in the nine closed domains remains inaccessible to larger factor complexes (arrows). 50
 Диминуция хроматина • Диминуция (уменьшение) хроматина открыта выдающимся немецким биологом Т. Бовери в 1887 г. у аскариды: на самых ранних этапах развития из зародышевых клеток, которые потом станут соматическими, выбрасывается та или иная часть генетического материала. Диминуция хроматина довольно редка, тем не менее сегодня она известна не только у аскарид, а еще у циклопов, миксин, сциарид. 51
Диминуция хроматина • Диминуция (уменьшение) хроматина открыта выдающимся немецким биологом Т. Бовери в 1887 г. у аскариды: на самых ранних этапах развития из зародышевых клеток, которые потом станут соматическими, выбрасывается та или иная часть генетического материала. Диминуция хроматина довольно редка, тем не менее сегодня она известна не только у аскарид, а еще у циклопов, миксин, сциарид. 51
 • Решающий вклад в открытие и детальное изучение диминуции хроматина у простейших внес Д. Прескотт. В начале 70 -х годов прошлого века американский ученый выявил этот феномен у брюхоресничных инфузорий при созревании вегетативных (т. е. выполняющих соматические функции) ядер - макронуклеусов. У представителей родов Stylonуchia, Oxytricha, Euplotes эти ядра в процессе созревания теряют 96 -98% нуклеотидных последовательностей, которые в генеративном ядре, микронуклеусе (аналоге клеток зародышевого пути у многоклеточных животных), сохраняются. Во время диминуции хромосомы макронуклеуса претерпевают фантастические изменения - попросту распадаются на отдельные гены, которые затем многократно копируются (амплифицируются), а некодирующие последовательности выбрасываются из ядра. Макронуклеус, оставшийся без “классических” хромосом, теряет способность делиться митозом и переходит к амитозу (прямому делению ядра перетяжкой 52
• Решающий вклад в открытие и детальное изучение диминуции хроматина у простейших внес Д. Прескотт. В начале 70 -х годов прошлого века американский ученый выявил этот феномен у брюхоресничных инфузорий при созревании вегетативных (т. е. выполняющих соматические функции) ядер - макронуклеусов. У представителей родов Stylonуchia, Oxytricha, Euplotes эти ядра в процессе созревания теряют 96 -98% нуклеотидных последовательностей, которые в генеративном ядре, микронуклеусе (аналоге клеток зародышевого пути у многоклеточных животных), сохраняются. Во время диминуции хромосомы макронуклеуса претерпевают фантастические изменения - попросту распадаются на отдельные гены, которые затем многократно копируются (амплифицируются), а некодирующие последовательности выбрасываются из ядра. Макронуклеус, оставшийся без “классических” хромосом, теряет способность делиться митозом и переходит к амитозу (прямому делению ядра перетяжкой 52
 • Впервые диминуцию хроматина у циклопов изучала С. Берман в Диминуции хроматина у середине 60 -х годов. Немецкая исследовательница обратила циклопов внимание на то, что число хромосом у тех трех видов циклопов, с которыми она работала, было одинаковым как до диминуции, так и после нее. Конечно, за счет этого события размеры хромосом уменьшались в зависимости от доли потерянной ДНК. Берман предложила молекулярную модель диминуции: избыточная ДНК выводится из хромосом подобно тому, как профаг исключается из хромосом лизогенных бактерий, т. е. путем выпетливания и внутрихроматидной рекомбинации с образованием колец из ДНК. Кольца Берман и обнаружила при электронно-микроскопическом исследовании разрушенных клеток циклопов в стадии диминуции. К сожалению, работы Берман прервались в 1984 г. 53
• Впервые диминуцию хроматина у циклопов изучала С. Берман в Диминуции хроматина у середине 60 -х годов. Немецкая исследовательница обратила циклопов внимание на то, что число хромосом у тех трех видов циклопов, с которыми она работала, было одинаковым как до диминуции, так и после нее. Конечно, за счет этого события размеры хромосом уменьшались в зависимости от доли потерянной ДНК. Берман предложила молекулярную модель диминуции: избыточная ДНК выводится из хромосом подобно тому, как профаг исключается из хромосом лизогенных бактерий, т. е. путем выпетливания и внутрихроматидной рекомбинации с образованием колец из ДНК. Кольца Берман и обнаружила при электронно-микроскопическом исследовании разрушенных клеток циклопов в стадии диминуции. К сожалению, работы Берман прервались в 1984 г. 53
 • А. К. Гришанин обнаружил, что у рачка Cyclops kolensis в процессе диминуции из соматических клеток зародыша элиминируется рекордное для многоклеточных количество ДНК - 94%. Это совсем ненамного меньше, чем у абсолютных рекордсменов - брюхоресничных инфузорий. Однако потеря огромной части ДНК не сказывается на числе хромосом: оно остается постоянным и равным 22 (столько же и в клетках зародышевого пути). Поразительно, как в одном организме циклопа могут одновременно существовать два типа клеток со столь разным содержанием ДНК! • Какие же наиболее важные выводы, касающиеся роли избыточной ДНК, можно сделать из исследования диминуции хромосом у циклопов? • В действительности диминуция - весьма сложный, многоэтапный процесс, который Дж. Шапиро справедливо отнес к наиболее ярким примерам природной генной инженерии. Главное заключение, которое следует из феномена диминуции, очевидно: гены, участвующие в индивидуальном развитии, и обслуживающие их регуляторные участки ни в коем случае не должны быть ни потеряны, ни даже повреждены. • Разрезают и сшивают хромосомную ДНК ферменты диминуции. Они безошибочно осуществляют свои функции, поскольку места разрывов весьма точно помечены, т. е. участки ДНК заранее подготовлены. По масштабности и точности манипуляций, которые производят клеточные ферменты в ходе диминуции, подобная генно-инженерная операция пока недоступна исследователям, работающим в самой современной 54 лаборатории.
• А. К. Гришанин обнаружил, что у рачка Cyclops kolensis в процессе диминуции из соматических клеток зародыша элиминируется рекордное для многоклеточных количество ДНК - 94%. Это совсем ненамного меньше, чем у абсолютных рекордсменов - брюхоресничных инфузорий. Однако потеря огромной части ДНК не сказывается на числе хромосом: оно остается постоянным и равным 22 (столько же и в клетках зародышевого пути). Поразительно, как в одном организме циклопа могут одновременно существовать два типа клеток со столь разным содержанием ДНК! • Какие же наиболее важные выводы, касающиеся роли избыточной ДНК, можно сделать из исследования диминуции хромосом у циклопов? • В действительности диминуция - весьма сложный, многоэтапный процесс, который Дж. Шапиро справедливо отнес к наиболее ярким примерам природной генной инженерии. Главное заключение, которое следует из феномена диминуции, очевидно: гены, участвующие в индивидуальном развитии, и обслуживающие их регуляторные участки ни в коем случае не должны быть ни потеряны, ни даже повреждены. • Разрезают и сшивают хромосомную ДНК ферменты диминуции. Они безошибочно осуществляют свои функции, поскольку места разрывов весьма точно помечены, т. е. участки ДНК заранее подготовлены. По масштабности и точности манипуляций, которые производят клеточные ферменты в ходе диминуции, подобная генно-инженерная операция пока недоступна исследователям, работающим в самой современной 54 лаборатории.
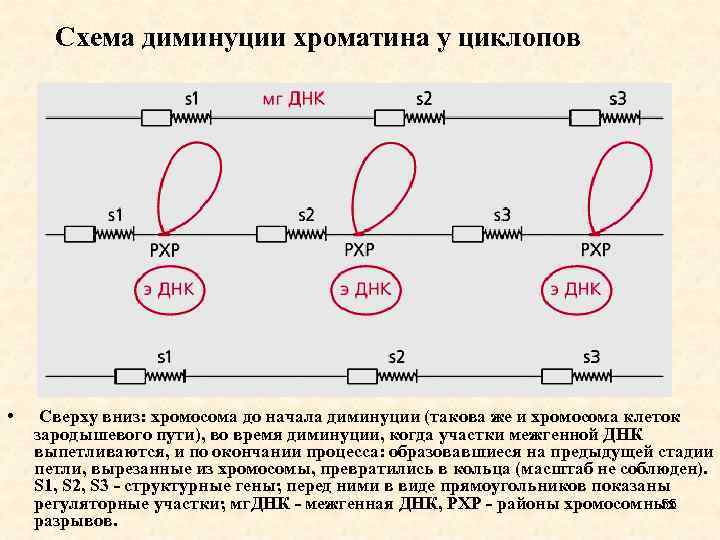 Схема диминуции хроматина у циклопов • Сверху вниз: хромосома до начала диминуции (такова же и хромосома клеток зародышевого пути), во время диминуции, когда участки межгенной ДНК выпетливаются, и по окончании процесса: образовавшиеся на предыдущей стадии петли, вырезанные из хромосомы, превратились в кольца (масштаб не соблюден). S 1, S 2, S 3 - структурные гены; перед ними в виде прямоугольников показаны регуляторные участки; мг. ДНК - межгенная ДНК, РХР - районы хромосомных 55 разрывов.
Схема диминуции хроматина у циклопов • Сверху вниз: хромосома до начала диминуции (такова же и хромосома клеток зародышевого пути), во время диминуции, когда участки межгенной ДНК выпетливаются, и по окончании процесса: образовавшиеся на предыдущей стадии петли, вырезанные из хромосомы, превратились в кольца (масштаб не соблюден). S 1, S 2, S 3 - структурные гены; перед ними в виде прямоугольников показаны регуляторные участки; мг. ДНК - межгенная ДНК, РХР - районы хромосомных 55 разрывов.
 • Примечательно, что диминуция происходит очень рано: у C. kolensis, например, на четвертом делении дробления, т. е. на 8 клеточной стадии, причем лишь в семи клетках, а восьмая, дающая начало зародышевой линии, остается с исходными хромосомами. • Число спонтанных хромосомных перестроек в раннем развитии циклопов поразительно мало: примерно в 100 раз меньше, чем у такого классического объекта для тестирования хромосомного мутагенеза, как лимфоциты человека. Этот факт свидетельствует о наличии мощной защитной системы против мутаций, действующей по крайней мере тогда, когда в клетке высока активность ферментов диминуции. Они должны атаковать только предназначенные для этого районы ДНК, иначе могут появиться поврежденные участки, которые окажутся чувствительными к таким ферментам и будут ими разрезаны. Следовательно, подобная возможность, грозящая катастрофическими последствиями, должна быть сведена до минимума. 56
• Примечательно, что диминуция происходит очень рано: у C. kolensis, например, на четвертом делении дробления, т. е. на 8 клеточной стадии, причем лишь в семи клетках, а восьмая, дающая начало зародышевой линии, остается с исходными хромосомами. • Число спонтанных хромосомных перестроек в раннем развитии циклопов поразительно мало: примерно в 100 раз меньше, чем у такого классического объекта для тестирования хромосомного мутагенеза, как лимфоциты человека. Этот факт свидетельствует о наличии мощной защитной системы против мутаций, действующей по крайней мере тогда, когда в клетке высока активность ферментов диминуции. Они должны атаковать только предназначенные для этого районы ДНК, иначе могут появиться поврежденные участки, которые окажутся чувствительными к таким ферментам и будут ими разрезаны. Следовательно, подобная возможность, грозящая катастрофическими последствиями, должна быть сведена до минимума. 56
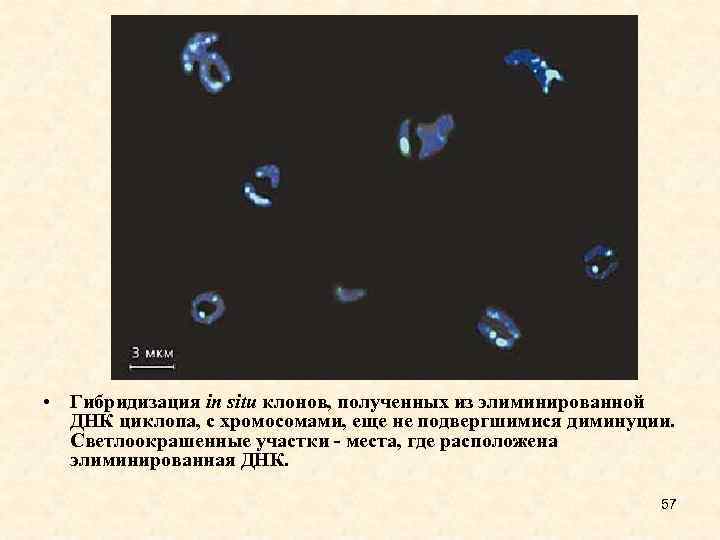 • Гибридизация in situ клонов, полученных из элиминированной ДНК циклопа, с хромосомами, еще не подвергшимися диминуции. Светлоокрашенные участки - места, где расположена элиминированная ДНК. 57
• Гибридизация in situ клонов, полученных из элиминированной ДНК циклопа, с хромосомами, еще не подвергшимися диминуции. Светлоокрашенные участки - места, где расположена элиминированная ДНК. 57
 Схема расположения повторов в разных фрагментах элиминированной ДНК Cyclops kolensis. Последовательности принадлежат 24 семействам, их номера указаны числами, знаком “+” отмечена прямая ориентация повтора, знаком “–” - обратная. В первом столбце - номера клонов. Шкала градуирована по количеству пар нуклеотидов. Праймерные последовательности, необходимые для клонирования, обозначены цифрой 1. 58
Схема расположения повторов в разных фрагментах элиминированной ДНК Cyclops kolensis. Последовательности принадлежат 24 семействам, их номера указаны числами, знаком “+” отмечена прямая ориентация повтора, знаком “–” - обратная. В первом столбце - номера клонов. Шкала градуирована по количеству пар нуклеотидов. Праймерные последовательности, необходимые для клонирования, обозначены цифрой 1. 58
 • Эти данные по молекулярной структуре элиминируемой ДНК полученны впервые, их следует считать предварительными. Тем не менее они довольно ясно указывают на высокую степень упорядоченности организации той части генома циклопа, которая изымается при диминуции и которая могла бы считаться образцом молекулярного “мусора”. 59
• Эти данные по молекулярной структуре элиминируемой ДНК полученны впервые, их следует считать предварительными. Тем не менее они довольно ясно указывают на высокую степень упорядоченности организации той части генома циклопа, которая изымается при диминуции и которая могла бы считаться образцом молекулярного “мусора”. 59
 • Каково же значение избыточной ДНК? Наличие этой ДНК в клетках зародышевого пути создает уникальный геномный портрет вида и, следовательно, может служить надежным механизмом его генетической изоляции. Если бы такой портрет не сохранялся в ряду поколений, синапсис гомологичных хромосом в мейозе нарушался бы, и потомство становилось анеуплоидным (т. е. с некратным гаплоидному числом хромосом), без каких-либо шансов на выживание. • Благодаря чему может быстро уменьшаться размер генома? Объяснением этого наиболее трудного аспекта эволюционной проблемы служит диминуция хроматина. Если изъятию подвергнется ДНК клеткиродоначальницы зародышевого пути и процесс не будет сопровождаться летальным событием, поскольку коснется лишь некодирующей ДНК, то все гаметы данного организма окажутся обладательницами нового - редуцированного - генома. Его получат сразу многие десятки особей, а это может быстро создать изолированную группу. • Неужели циклопы, чей онтогенез сопровождается диминуцией хроматина, так сильно отличаются от других животных, у которых нет такого же способа физически исключить избыточную для соматических клеток часть генома? Едва ли это можно утверждать. У других видов существуют иные способы инактивировать, т. е. в конечном счете заставить замолчать, эту ДНК. Известно, что у человека около 50% генома вообще не участвует в экспрессии. Целые районы генома оказываются недоступными для транскрипции чаще всего из-за сверхкомпактной укладки участков хромосом. Способ другой, но результат тот же 60 изоляция участков генома.
• Каково же значение избыточной ДНК? Наличие этой ДНК в клетках зародышевого пути создает уникальный геномный портрет вида и, следовательно, может служить надежным механизмом его генетической изоляции. Если бы такой портрет не сохранялся в ряду поколений, синапсис гомологичных хромосом в мейозе нарушался бы, и потомство становилось анеуплоидным (т. е. с некратным гаплоидному числом хромосом), без каких-либо шансов на выживание. • Благодаря чему может быстро уменьшаться размер генома? Объяснением этого наиболее трудного аспекта эволюционной проблемы служит диминуция хроматина. Если изъятию подвергнется ДНК клеткиродоначальницы зародышевого пути и процесс не будет сопровождаться летальным событием, поскольку коснется лишь некодирующей ДНК, то все гаметы данного организма окажутся обладательницами нового - редуцированного - генома. Его получат сразу многие десятки особей, а это может быстро создать изолированную группу. • Неужели циклопы, чей онтогенез сопровождается диминуцией хроматина, так сильно отличаются от других животных, у которых нет такого же способа физически исключить избыточную для соматических клеток часть генома? Едва ли это можно утверждать. У других видов существуют иные способы инактивировать, т. е. в конечном счете заставить замолчать, эту ДНК. Известно, что у человека около 50% генома вообще не участвует в экспрессии. Целые районы генома оказываются недоступными для транскрипции чаще всего из-за сверхкомпактной укладки участков хромосом. Способ другой, но результат тот же 60 изоляция участков генома.
 • Уместно вспомнить слова знаменитого П. Тейяра де Шардена из его книги “Феномен человека” (1965): • “Природная аномалия - это всегда лишь преувеличение до ощутимости какого-либо свойства, всюду распространенного в неосязаемом виде. Какой-либо феномен, точно установленный хотя бы в одном месте, в силу фундаментального единства мира имеет повсеместные корни и всеобщее значение”. 61
• Уместно вспомнить слова знаменитого П. Тейяра де Шардена из его книги “Феномен человека” (1965): • “Природная аномалия - это всегда лишь преувеличение до ощутимости какого-либо свойства, всюду распространенного в неосязаемом виде. Какой-либо феномен, точно установленный хотя бы в одном месте, в силу фундаментального единства мира имеет повсеместные корни и всеобщее значение”. 61
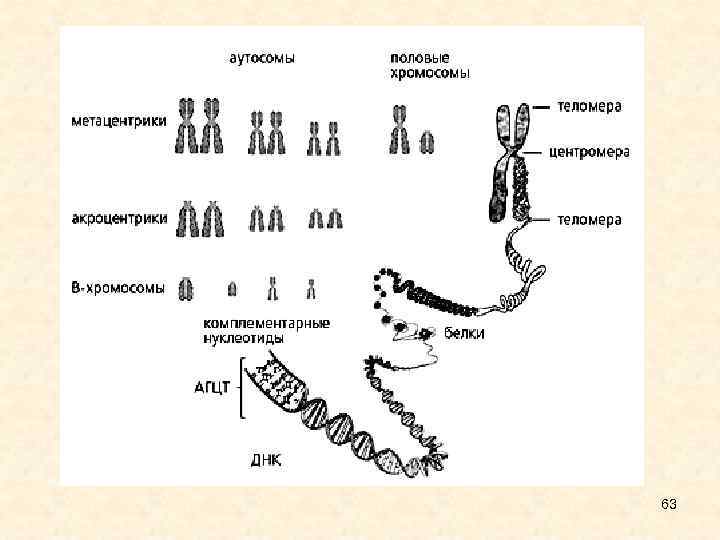
 В хромосомы азиатской лесной мыши: молекулярная природа • Количество В-хромосом у азиатской лесной мыши Apodemus peninsulae варьирует от 0 до 24; это самые высокие значения для млекопитающих. • Известно около 500 видов животных с В-хромосомами. В кариотипах млекопитающих В-хромосомы обнаружены у многих видов грызунов, некоторых хищников и копытных. У человека, как и у остальных приматов, В-хромосом нет. Наличие или отсутствие добавочных хромосом, как правило, никак не сказывается на фенотипе - внешнем виде и других свойствах животного. 62
В хромосомы азиатской лесной мыши: молекулярная природа • Количество В-хромосом у азиатской лесной мыши Apodemus peninsulae варьирует от 0 до 24; это самые высокие значения для млекопитающих. • Известно около 500 видов животных с В-хромосомами. В кариотипах млекопитающих В-хромосомы обнаружены у многих видов грызунов, некоторых хищников и копытных. У человека, как и у остальных приматов, В-хромосом нет. Наличие или отсутствие добавочных хромосом, как правило, никак не сказывается на фенотипе - внешнем виде и других свойствах животного. 62
 63
63
 • Применение методов молекулярной генетики к анализу А- и Вхромосом показало, что и те и другие содержат огромное количество многократно повторенных и, видимо, не кодирующих белки последовательностей ДНК. Вся разница между ними состоит в том, что в А-хромосомах наряду с некодирующими повторами довольно много функциональных генов (хотя и не так много, как думали), а в В-хромосомах они вовсе отсутствуют или их число ничтожно мало. • Выяснилось, что А-хромосомы животных и растений насыщены паразитическими элементами, а В-хромосомы практически целиком состоят из них. Поэтому В-хромосомы можно рассматривать как шайку геномных паразитов. В таком случае вопрос о том, для чего нужны В-хромосомы, теряет актуальность: паразиты они и есть паразиты, и с этим ничего не поделаешь. 64
• Применение методов молекулярной генетики к анализу А- и Вхромосом показало, что и те и другие содержат огромное количество многократно повторенных и, видимо, не кодирующих белки последовательностей ДНК. Вся разница между ними состоит в том, что в А-хромосомах наряду с некодирующими повторами довольно много функциональных генов (хотя и не так много, как думали), а в В-хромосомах они вовсе отсутствуют или их число ничтожно мало. • Выяснилось, что А-хромосомы животных и растений насыщены паразитическими элементами, а В-хромосомы практически целиком состоят из них. Поэтому В-хромосомы можно рассматривать как шайку геномных паразитов. В таком случае вопрос о том, для чего нужны В-хромосомы, теряет актуальность: паразиты они и есть паразиты, и с этим ничего не поделаешь. 64
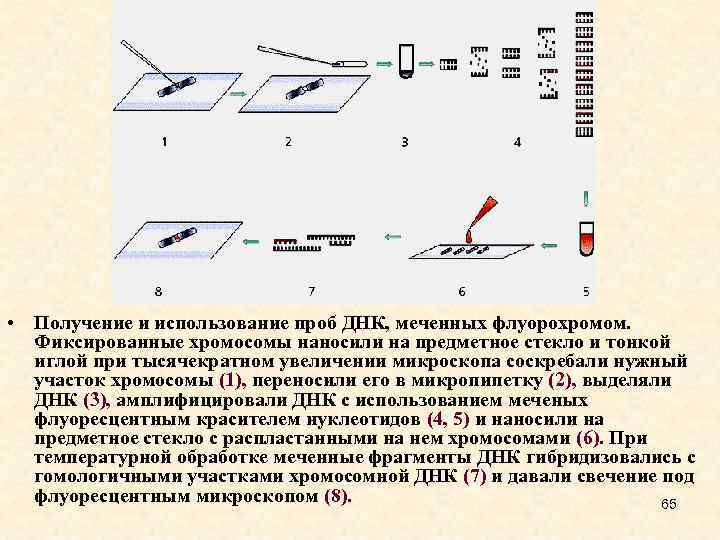 • Получение и использование проб ДНК, меченных флуорохромом. Фиксированные хромосомы наносили на предметное стекло и тонкой иглой при тысячекратном увеличении микроскопа соскребали нужный участок хромосомы (1), переносили его в микропипетку (2), выделяли ДНК (3), амплифицировали ДНК с использованием меченых флуоресцентным красителем нуклеотидов (4, 5) и наносили на предметное стекло с распластанными на нем хромосомами (6). При температурной обработке меченные фрагменты ДНК гибридизовались с гомологичными участками хромосомной ДНК (7) и давали свечение под флуоресцентным микроскопом (8). 65
• Получение и использование проб ДНК, меченных флуорохромом. Фиксированные хромосомы наносили на предметное стекло и тонкой иглой при тысячекратном увеличении микроскопа соскребали нужный участок хромосомы (1), переносили его в микропипетку (2), выделяли ДНК (3), амплифицировали ДНК с использованием меченых флуоресцентным красителем нуклеотидов (4, 5) и наносили на предметное стекло с распластанными на нем хромосомами (6). При температурной обработке меченные фрагменты ДНК гибридизовались с гомологичными участками хромосомной ДНК (7) и давали свечение под флуоресцентным микроскопом (8). 65
 • Результаты окрашивания хромосом лесной мыши Вхромосомными пробами показывают, что в геноме этого вида присутствуют по крайней мере три класса повторов: • один локализован в прицентромерных районах аутосом и Вхромосом, а так же в двух районах половых хромосом; • другой составляет основную массу плеч В-хромосом, а в Ахромосомах содержится в значительно меньших количествах; • третий обнаруживается на концах некоторых В-хромосом и ведет себя странно, образуя нимбы (или метелки, если этот образ вам больше нравится). • Все три класса повторов встречаются в В-хромосомах не только у тех животных, из которых получали пробы, но и у других изученных нами лесных мышей Apodemus peninsulae. Следовательно, они общие для данного вида, а может, и всего рода Apodemus. 66
• Результаты окрашивания хромосом лесной мыши Вхромосомными пробами показывают, что в геноме этого вида присутствуют по крайней мере три класса повторов: • один локализован в прицентромерных районах аутосом и Вхромосом, а так же в двух районах половых хромосом; • другой составляет основную массу плеч В-хромосом, а в Ахромосомах содержится в значительно меньших количествах; • третий обнаруживается на концах некоторых В-хромосом и ведет себя странно, образуя нимбы (или метелки, если этот образ вам больше нравится). • Все три класса повторов встречаются в В-хромосомах не только у тех животных, из которых получали пробы, но и у других изученных нами лесных мышей Apodemus peninsulae. Следовательно, они общие для данного вида, а может, и всего рода Apodemus. 66
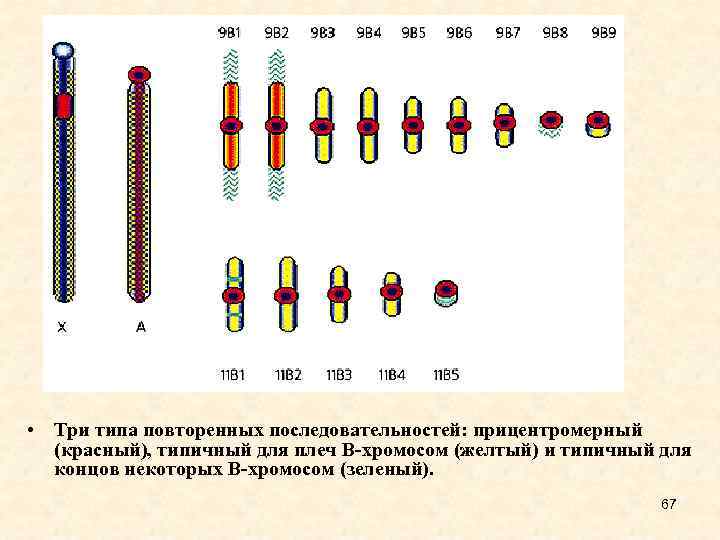 • Три типа повторенных последовательностей: прицентромерный (красный), типичный для плеч В-хромосом (желтый) и типичный для концов некоторых В-хромосом (зеленый). 67
• Три типа повторенных последовательностей: прицентромерный (красный), типичный для плеч В-хромосом (желтый) и типичный для концов некоторых В-хромосом (зеленый). 67
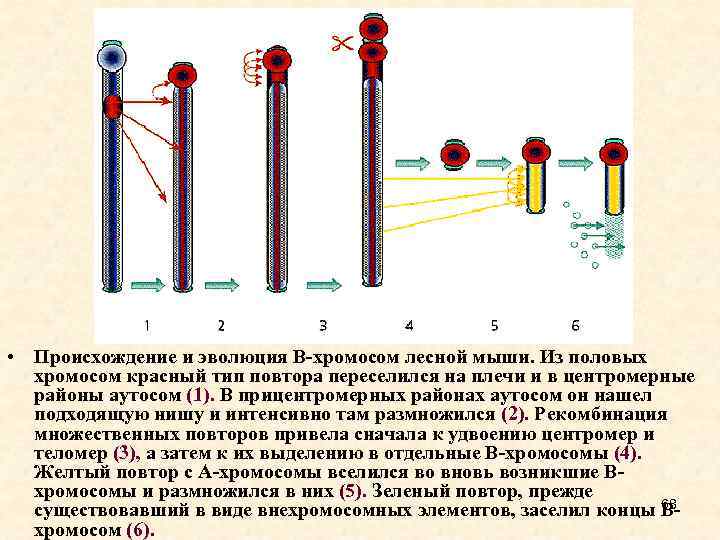 • Происхождение и эволюция В-хромосом лесной мыши. Из половых хромосом красный тип повтора переселился на плечи и в центромерные районы аутосом (1). В прицентромерных районах аутосом он нашел подходящую нишу и интенсивно там размножился (2). Рекомбинация множественных повторов привела сначала к удвоению центромер и теломер (3), а затем к их выделению в отдельные В-хромосомы (4). Желтый повтор с А-хромосомы вселился во вновь возникшие Вхромосомы и размножился в них (5). Зеленый повтор, прежде 68 существовавший в виде внехромосомных элементов, заселил концы Вхромосом (6).
• Происхождение и эволюция В-хромосом лесной мыши. Из половых хромосом красный тип повтора переселился на плечи и в центромерные районы аутосом (1). В прицентромерных районах аутосом он нашел подходящую нишу и интенсивно там размножился (2). Рекомбинация множественных повторов привела сначала к удвоению центромер и теломер (3), а затем к их выделению в отдельные В-хромосомы (4). Желтый повтор с А-хромосомы вселился во вновь возникшие Вхромосомы и размножился в них (5). Зеленый повтор, прежде 68 существовавший в виде внехромосомных элементов, заселил концы Вхромосом (6).
 • Итак, в геноме Apodemus peninsulae паразитическим мобильным элементам сильно повезло. Они проникли в прицентромерные последовательности и в ходе своего размножения захватили специфические последовательности хозяйской ДНК - центромерные и теломерные. Это открыло дорогу для возникновения Вхромосом. Ведь что нужно фрагменту ДНК, чтобы стать хромосомой? Иметь центромеру, дабы на равных с нормальными хромосомами участвовать в клеточном делении, и две теломеры, дабы защитить свои концы от разрушения. Некоторые из В-хромосом Apodemus peninsulae (самые мелкие) состоят в основном из центромеры с прицентромерными повторами и пары теломер - и очень хорошо себя чувствуют. Это - или самые молодые из В-хромосом, или реликты ранних этапов хромосомной эволюции. • Как только В-хромосомы возникли в такой примитивной форме, они стали “землей обетованной”, куда устремились и другие мобильные паразитические элементы, влачившие до той поры жалкое существование в составе плеч аутосом или за пределами хромосомной ДНК. Последовательности, которые составляют основную массу ДНК плеч В-хромосом Apodemus peninsulae, присутствуют в небольших количествах и в плечах аутосом обоих видов мышей. Но там их размножение сдерживается естественным отбором. Иное дело в В-хромосомах - здесь им живется и размножается гораздо вольготнее. У большинства В-хромосом прицентромерные и плечевые последовательности ДНК четко разграничены. Однако в некоторых В-хромосомах (самых старых или самых эволюционно продвинутых? ) они оказались перемешанными. 69
• Итак, в геноме Apodemus peninsulae паразитическим мобильным элементам сильно повезло. Они проникли в прицентромерные последовательности и в ходе своего размножения захватили специфические последовательности хозяйской ДНК - центромерные и теломерные. Это открыло дорогу для возникновения Вхромосом. Ведь что нужно фрагменту ДНК, чтобы стать хромосомой? Иметь центромеру, дабы на равных с нормальными хромосомами участвовать в клеточном делении, и две теломеры, дабы защитить свои концы от разрушения. Некоторые из В-хромосом Apodemus peninsulae (самые мелкие) состоят в основном из центромеры с прицентромерными повторами и пары теломер - и очень хорошо себя чувствуют. Это - или самые молодые из В-хромосом, или реликты ранних этапов хромосомной эволюции. • Как только В-хромосомы возникли в такой примитивной форме, они стали “землей обетованной”, куда устремились и другие мобильные паразитические элементы, влачившие до той поры жалкое существование в составе плеч аутосом или за пределами хромосомной ДНК. Последовательности, которые составляют основную массу ДНК плеч В-хромосом Apodemus peninsulae, присутствуют в небольших количествах и в плечах аутосом обоих видов мышей. Но там их размножение сдерживается естественным отбором. Иное дело в В-хромосомах - здесь им живется и размножается гораздо вольготнее. У большинства В-хромосом прицентромерные и плечевые последовательности ДНК четко разграничены. Однако в некоторых В-хромосомах (самых старых или самых эволюционно продвинутых? ) они оказались перемешанными. 69
 • • Последними в В-хромосомы пришли концевые повторы, те самые, что образуют метелки. Именно эта способность, а вернее, неспособность плотно упаковываться в момент клеточного деления выдает их экстрахромосомное происхождение. Повидимому, они еще не успели включить в свой состав те последовательности хромосомной ДНК, с которыми связываются белки компактизации. Как вы помните, тот же класс повторов мы обнаружили внутри плеч одной из Вхромосом, где он был нормально упакован. Может быть именно потому он и был упакован, что находился внутри, а не на конце хромосомы. Белки склеивали и соседние с ним районы, и его заодно. А может быть, он попал в середину хромосомы уже давно и успел за счет рекомбинации приобрести последовательности, необходимые для связывания с упаковочными белками. Таким образом, вполне вероятно, что В-хромосомы, которые мы нашли в геноме лесной мыши, возникли не одновременно. Одни появились раньше, другие позже, да и сами пути их эволюции были разными. Можно ли выяснить, когда это произошло? 70
• • Последними в В-хромосомы пришли концевые повторы, те самые, что образуют метелки. Именно эта способность, а вернее, неспособность плотно упаковываться в момент клеточного деления выдает их экстрахромосомное происхождение. Повидимому, они еще не успели включить в свой состав те последовательности хромосомной ДНК, с которыми связываются белки компактизации. Как вы помните, тот же класс повторов мы обнаружили внутри плеч одной из Вхромосом, где он был нормально упакован. Может быть именно потому он и был упакован, что находился внутри, а не на конце хромосомы. Белки склеивали и соседние с ним районы, и его заодно. А может быть, он попал в середину хромосомы уже давно и успел за счет рекомбинации приобрести последовательности, необходимые для связывания с упаковочными белками. Таким образом, вполне вероятно, что В-хромосомы, которые мы нашли в геноме лесной мыши, возникли не одновременно. Одни появились раньше, другие позже, да и сами пути их эволюции были разными. Можно ли выяснить, когда это произошло? 70
 • До сих пор мы рассматривали только два вида рода Apodemus. Но в нем много видов, и В-хромосомы часто встречаются не только у Apodemus peninsulae. Они обнаруживаются и во многих (хотя и не во всех) популяциях европейской лесной мыши Apodemus flavicollis. Не значит ли это, что оба вида унаследовали Вхромосомы от общего предка? Нет, не значит. Дело в том, что Apodemus peninsulae и Apodemus flavicollis принадлежат к разным подродам, которые разделились 10 -8 млн лет назад. Внутри каждого подрода большинство видов не имеют В-хромосом вовсе. Да и популяции Apodemus peninsulae и Apodemus flavicollis и особи внутри этих популяций очень сильно отличаются друг от друга по числу и форме Вхромосом. Логичнее предположить, что эти виды унаследовали от общего предка не сами В-хромосомы, а способность создавать их de novo и толерантность к их присутствию. • Платят ли они за эту свою способность? Насколько дорого им обходится содержание геномных паразитов, и оправдывается ли оно? На эти вопросы пока нет ответа. Видимо, не слишком дорого, если некоторые особи имеют до 17 лишних хромосом в каждой клетке. Может быть, это даже выгодно, образно говоря, содержать нахлебников (мобильные элементы) вместе в чуланах (в В-хромосомах), не позволяя им портить обстановку в хозяйских комнатах (А-хромосомах). А может быть, они и не нахлебники, а постояльцы, которые исправно вносят квартплату? Гуляя с места на место по геному, мобильные элементы могут случайно прихватить какой-нибудь полезный ген и потом размножить его в составе В-хромосом. Оказалось, что некоторые В-хромосомы лесной мыши содержат гены, отвечающие за синтез рибосомальной РНК. Это действительно важный и полезный для клетки продукт. Кто знает, какие еще полезные гены уже есть или со временем появятся на В-хромосомах. И может быть, со временем Вхромосомы превратятся в А-хромосомы. 71
• До сих пор мы рассматривали только два вида рода Apodemus. Но в нем много видов, и В-хромосомы часто встречаются не только у Apodemus peninsulae. Они обнаруживаются и во многих (хотя и не во всех) популяциях европейской лесной мыши Apodemus flavicollis. Не значит ли это, что оба вида унаследовали Вхромосомы от общего предка? Нет, не значит. Дело в том, что Apodemus peninsulae и Apodemus flavicollis принадлежат к разным подродам, которые разделились 10 -8 млн лет назад. Внутри каждого подрода большинство видов не имеют В-хромосом вовсе. Да и популяции Apodemus peninsulae и Apodemus flavicollis и особи внутри этих популяций очень сильно отличаются друг от друга по числу и форме Вхромосом. Логичнее предположить, что эти виды унаследовали от общего предка не сами В-хромосомы, а способность создавать их de novo и толерантность к их присутствию. • Платят ли они за эту свою способность? Насколько дорого им обходится содержание геномных паразитов, и оправдывается ли оно? На эти вопросы пока нет ответа. Видимо, не слишком дорого, если некоторые особи имеют до 17 лишних хромосом в каждой клетке. Может быть, это даже выгодно, образно говоря, содержать нахлебников (мобильные элементы) вместе в чуланах (в В-хромосомах), не позволяя им портить обстановку в хозяйских комнатах (А-хромосомах). А может быть, они и не нахлебники, а постояльцы, которые исправно вносят квартплату? Гуляя с места на место по геному, мобильные элементы могут случайно прихватить какой-нибудь полезный ген и потом размножить его в составе В-хромосом. Оказалось, что некоторые В-хромосомы лесной мыши содержат гены, отвечающие за синтез рибосомальной РНК. Это действительно важный и полезный для клетки продукт. Кто знает, какие еще полезные гены уже есть или со временем появятся на В-хромосомах. И может быть, со временем Вхромосомы превратятся в А-хромосомы. 71
 72
72
 73
73
 74
74
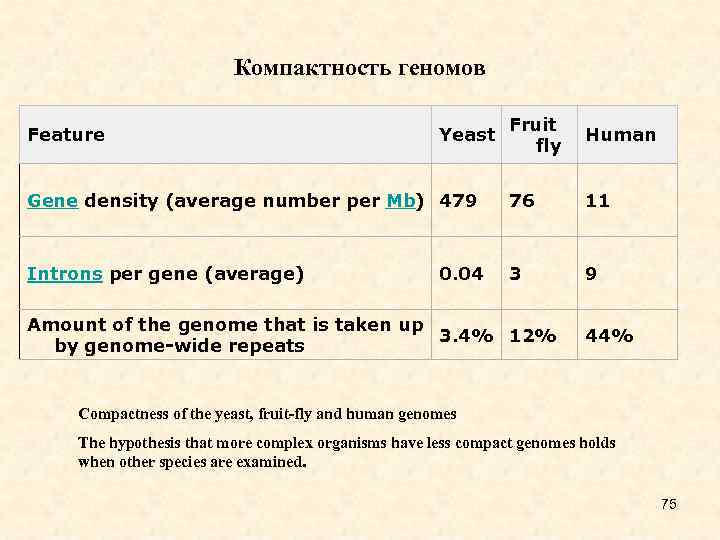 Компактность геномов Fruit fly Human Gene density (average number per Mb) 479 76 11 Introns per gene (average) 3 9 Feature Yeast 0. 04 Amount of the genome that is taken up 3. 4% 12% by genome-wide repeats 44% Compactness of the yeast, fruit-fly and human genomes The hypothesis that more complex organisms have less compact genomes holds when other species are examined. 75
Компактность геномов Fruit fly Human Gene density (average number per Mb) 479 76 11 Introns per gene (average) 3 9 Feature Yeast 0. 04 Amount of the genome that is taken up 3. 4% 12% by genome-wide repeats 44% Compactness of the yeast, fruit-fly and human genomes The hypothesis that more complex organisms have less compact genomes holds when other species are examined. 75
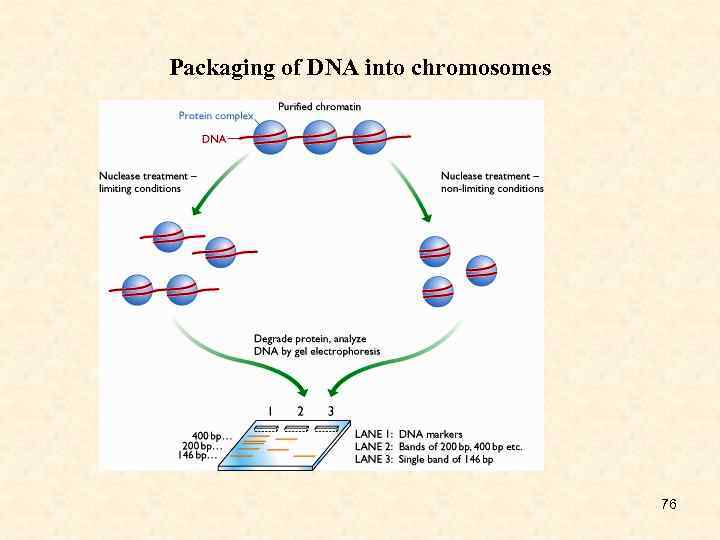 Packaging of DNA into chromosomes 76
Packaging of DNA into chromosomes 76
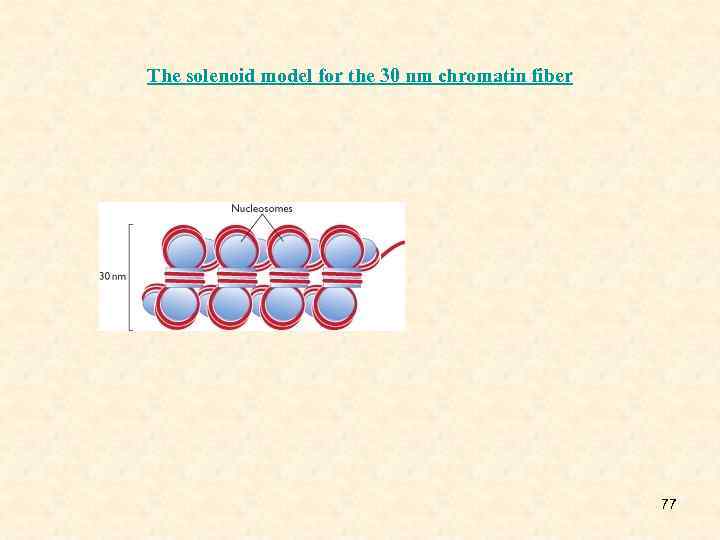 The solenoid model for the 30 nm chromatin fiber 77
The solenoid model for the 30 nm chromatin fiber 77
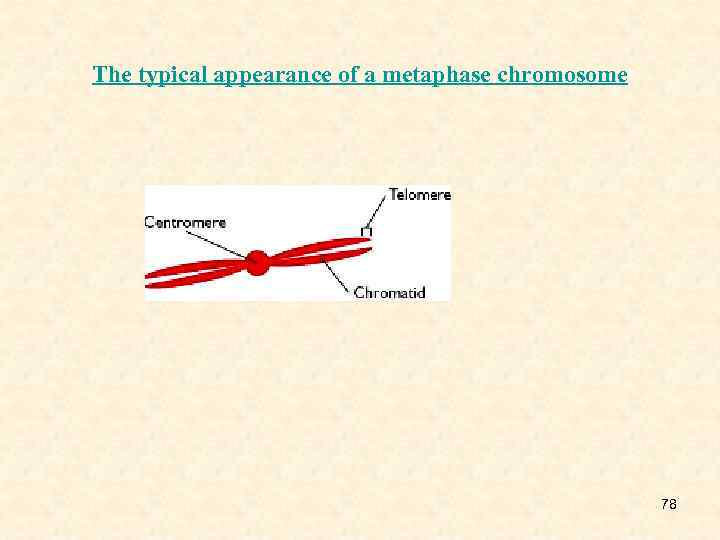 The typical appearance of a metaphase chromosome 78
The typical appearance of a metaphase chromosome 78
 Staining techniques used to produce chromosome banding patterns Technique Procedure Banding pattern G-banding Mild proteolysis followed by staining with Giemsa Dark bands are AT-rich Pale bands are GC-rich R-banding Heat denaturation followed by staining with Giemsa Dark bands are GC-rich Pale bands are AT-rich Q-banding Stain with quinacrine Dark bands are AT-rich Pale bands are GC-rich C-banding Denature with barium hydroxide and then stain with Giemsa Dark bands contain constitutive heterochromatin (see Section 8. 1. 2) 79
Staining techniques used to produce chromosome banding patterns Technique Procedure Banding pattern G-banding Mild proteolysis followed by staining with Giemsa Dark bands are AT-rich Pale bands are GC-rich R-banding Heat denaturation followed by staining with Giemsa Dark bands are GC-rich Pale bands are AT-rich Q-banding Stain with quinacrine Dark bands are AT-rich Pale bands are GC-rich C-banding Denature with barium hydroxide and then stain with Giemsa Dark bands contain constitutive heterochromatin (see Section 8. 1. 2) 79
 The human karyogram 80
The human karyogram 80


