КОЛЛОИДНЫЕ СИСТЕМЫ И РАСТВОРЫ 1









![. ] A [ { } n J g m 3 O N x . ] A [ { } n J g m 3 O N x](https://present5.com/presentation/3/178551639_160528813.pdf-img/178551639_160528813.pdf-14.jpg)



















Коллоидные системы Лекция.ppt
- Количество слайдов: 35
 КОЛЛОИДНЫЕ СИСТЕМЫ И РАСТВОРЫ 1
КОЛЛОИДНЫЕ СИСТЕМЫ И РАСТВОРЫ 1
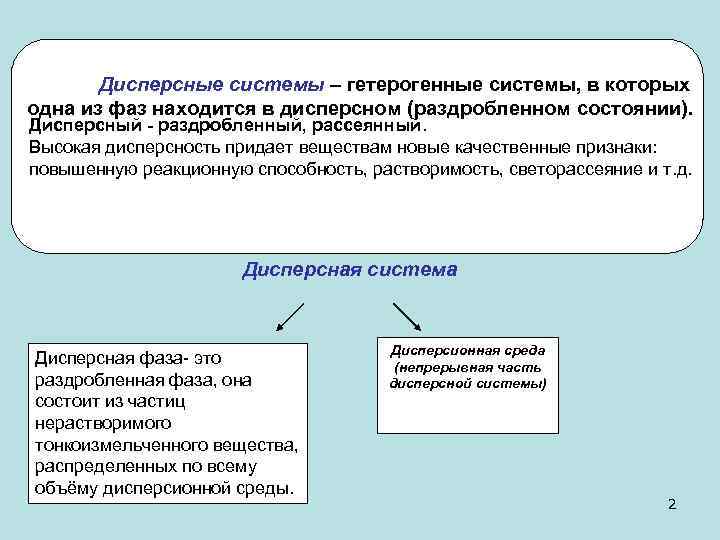
 Дисперсные системы – гетерогенные системы, в которых одна из фаз находится в дисперсном (раздробленном состоянии). Дисперсный - раздробленный, рассеянный. Высокая дисперсность придает веществам новые качественные признаки: повышенную реакционную способность, растворимость, светорассеяние и т. д. Дисперсная система Дисперсионная среда Дисперсная фаза- это (непрерывная часть раздробленная фаза, она дисперсной системы) состоит из частиц нерастворимого тонкоизмельченного вещества, распределенных по всему объёму дисперсионной среды. 2
Дисперсные системы – гетерогенные системы, в которых одна из фаз находится в дисперсном (раздробленном состоянии). Дисперсный - раздробленный, рассеянный. Высокая дисперсность придает веществам новые качественные признаки: повышенную реакционную способность, растворимость, светорассеяние и т. д. Дисперсная система Дисперсионная среда Дисперсная фаза- это (непрерывная часть раздробленная фаза, она дисперсной системы) состоит из частиц нерастворимого тонкоизмельченного вещества, распределенных по всему объёму дисперсионной среды. 2
 Признаки объектов коллоидной химии 1. Гетерогенность (многофазность). 2. Дисперсность (раздробленность). 3
Признаки объектов коллоидной химии 1. Гетерогенность (многофазность). 2. Дисперсность (раздробленность). 3
 интенсивное броуновское движение делятся на: лиофильные лиофобные
интенсивное броуновское движение делятся на: лиофильные лиофобные
 Эффект Тиндаля рассеяние света при прохождении светового пучка через оптически неоднородную среду. Обычно наблюдается в виде светящегося конуса (конус Тиндаля), видимого на тёмном фоне. Характерен для растворов коллоидных систем (например, золей металлов, разбавленных латексов, табачного дыма), в которых частицы и окружающая их среда различаются по преломления показателю. На Т. э. основан ряд оптических методов определения размеров, формы и концентрации коллоидных частиц и макромолекул. Назван по имени открывшего Дж. Тиндаля. Слева – раствор крахмала, справа - вода
Эффект Тиндаля рассеяние света при прохождении светового пучка через оптически неоднородную среду. Обычно наблюдается в виде светящегося конуса (конус Тиндаля), видимого на тёмном фоне. Характерен для растворов коллоидных систем (например, золей металлов, разбавленных латексов, табачного дыма), в которых частицы и окружающая их среда различаются по преломления показателю. На Т. э. основан ряд оптических методов определения размеров, формы и концентрации коллоидных частиц и макромолекул. Назван по имени открывшего Дж. Тиндаля. Слева – раствор крахмала, справа - вода
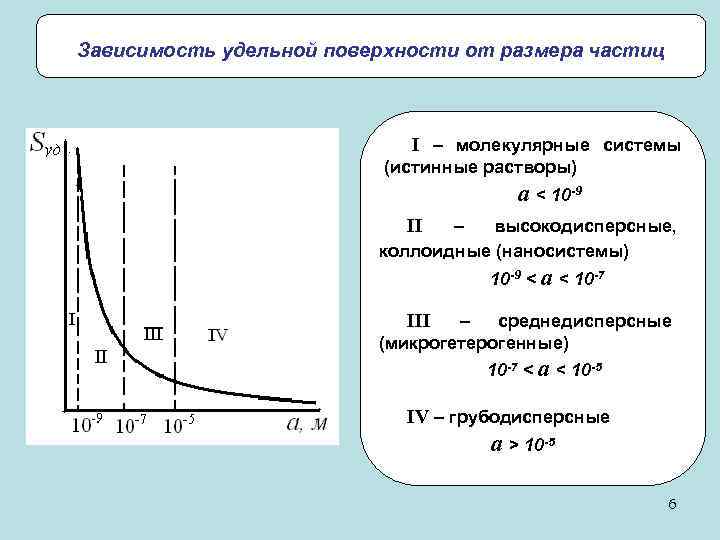
 Зависимость удельной поверхности от размера частиц I – молекулярные системы (истинные растворы) a < 10 -9 II – высокодисперсные, коллоидные (наносистемы) 10 -9 < a < 10 -7 III – среднедисперсные (микрогетерогенные) 10 -7 < a < 10 -5 IV – грубодисперсные a > 10 -5 6
Зависимость удельной поверхности от размера частиц I – молекулярные системы (истинные растворы) a < 10 -9 II – высокодисперсные, коллоидные (наносистемы) 10 -9 < a < 10 -7 III – среднедисперсные (микрогетерогенные) 10 -7 < a < 10 -5 IV – грубодисперсные a > 10 -5 6
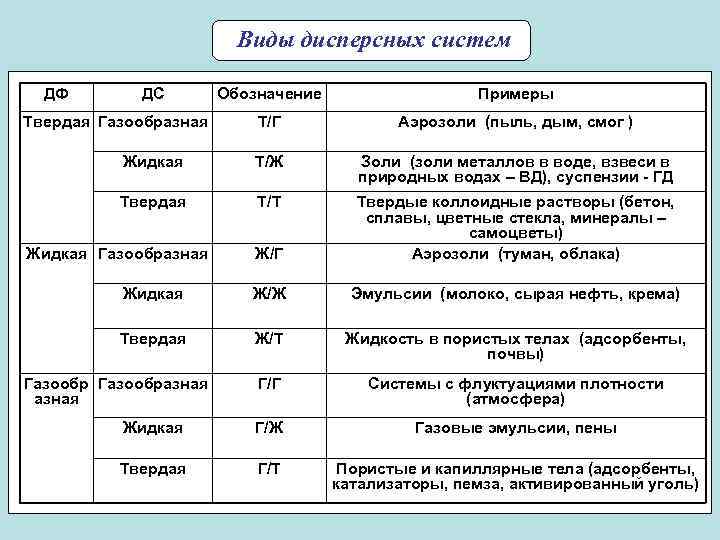
 Виды дисперсных систем ДФ ДС Обозначение Примеры Твердая Газообразная Т/Г Аэрозоли (пыль, дым, смог ) Жидкая Т/Ж Золи (золи металлов в воде, взвеси в природных водах – ВД), суспензии - ГД Твердая Т/Т Твердые коллоидные растворы (бетон, сплавы, цветные стекла, минералы – самоцветы) Жидкая Газообразная Ж/Г Аэрозоли (туман, облака) Жидкая Ж/Ж Эмульсии (молоко, сырая нефть, крема) Твердая Ж/Т Жидкость в пористых телах (адсорбенты, почвы) Газообразная Г/Г Системы с флуктуациями плотности азная (атмосфера) Жидкая Г/Ж Газовые эмульсии, пены Твердая Г/Т Пористые и капиллярные тела (адсорбенты, катализаторы, пемза, активированный уголь) 7
Виды дисперсных систем ДФ ДС Обозначение Примеры Твердая Газообразная Т/Г Аэрозоли (пыль, дым, смог ) Жидкая Т/Ж Золи (золи металлов в воде, взвеси в природных водах – ВД), суспензии - ГД Твердая Т/Т Твердые коллоидные растворы (бетон, сплавы, цветные стекла, минералы – самоцветы) Жидкая Газообразная Ж/Г Аэрозоли (туман, облака) Жидкая Ж/Ж Эмульсии (молоко, сырая нефть, крема) Твердая Ж/Т Жидкость в пористых телах (адсорбенты, почвы) Газообразная Г/Г Системы с флуктуациями плотности азная (атмосфера) Жидкая Г/Ж Газовые эмульсии, пены Твердая Г/Т Пористые и капиллярные тела (адсорбенты, катализаторы, пемза, активированный уголь) 7
 Дисперсная среда: ГАЗ Дисперсная фаза: ГАЗ Всегда гомогенная смесь (воздух, природный газ) Дисперсная фаза: Жидкость Туман, попутный газ с капельками нефти, карбюраторная смесь в двигателях автомобилей, аэрозоли Дисперсная фаза: Твёрдое вещ-во Пыль в воздухе, дым, смог, пыльные и песчаные бури
Дисперсная среда: ГАЗ Дисперсная фаза: ГАЗ Всегда гомогенная смесь (воздух, природный газ) Дисперсная фаза: Жидкость Туман, попутный газ с капельками нефти, карбюраторная смесь в двигателях автомобилей, аэрозоли Дисперсная фаза: Твёрдое вещ-во Пыль в воздухе, дым, смог, пыльные и песчаные бури
 Дисперсная среда: Жидкость Дисперсная фаза: ГАЗ Шипучие напитки, пены Дисперсная фаза: Жидкость Эмульсии. Жидкие среды организма (плазма крови, лимфа, пищеварительные соки), жидкое содержимое клеток (цитоплазма, кариоплазма) Дисперсная фаза: Твёрдое вещ-во Золи, гели, пасты (кисели, студни, клеи) Речной и морской ил, взвешенные в воде; Строительные растворы
Дисперсная среда: Жидкость Дисперсная фаза: ГАЗ Шипучие напитки, пены Дисперсная фаза: Жидкость Эмульсии. Жидкие среды организма (плазма крови, лимфа, пищеварительные соки), жидкое содержимое клеток (цитоплазма, кариоплазма) Дисперсная фаза: Твёрдое вещ-во Золи, гели, пасты (кисели, студни, клеи) Речной и морской ил, взвешенные в воде; Строительные растворы
 Дисперсная среда: Твёрдое вещество Дисперсная фаза: ГАЗ Снежный наст с пузырьками воздуха в нём, почва, кирпич и керамика, пористый шоколад, порошок Дисперсная фаза: Жидкость Влажная почва, медицинские и косметические средства (мази, тушь, помада и т. д. ) Дисперсная фаза: Твёрдое вещ-во Горные породы, цветные стёкла, некоторые сплавы
Дисперсная среда: Твёрдое вещество Дисперсная фаза: ГАЗ Снежный наст с пузырьками воздуха в нём, почва, кирпич и керамика, пористый шоколад, порошок Дисперсная фаза: Жидкость Влажная почва, медицинские и косметические средства (мази, тушь, помада и т. д. ) Дисперсная фаза: Твёрдое вещ-во Горные породы, цветные стёкла, некоторые сплавы
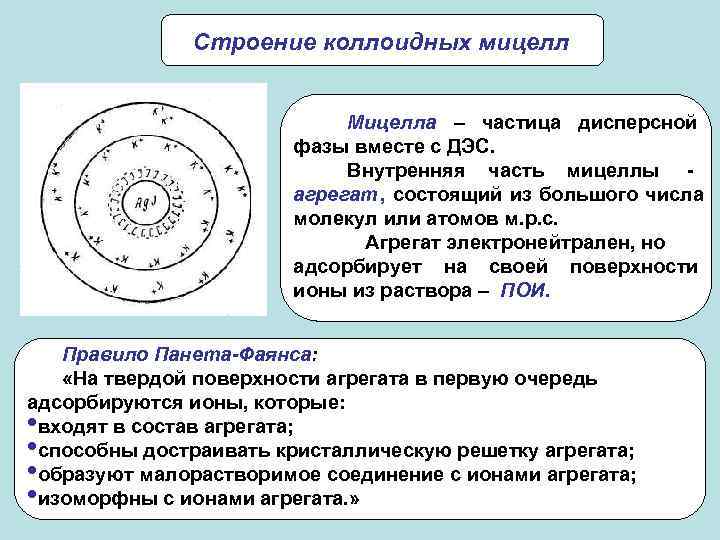
 Строение коллоидных мицелл Мицелла – частица дисперсной фазы вместе с ДЭС. Внутренняя часть мицеллы - агрегат, состоящий из большого числа молекул или атомов м. р. с. Агрегат электронейтрален, но адсорбирует на своей поверхности ионы из раствора – ПОИ. Правило Панета-Фаянса: «На твердой поверхности агрегата в первую очередь адсорбируются ионы, которые: • входят в состав агрегата; • способны достраивать кристаллическую решетку агрегата; • образуют малорастворимое соединение с ионами агрегата; • изоморфны с ионами агрегата. » 11
Строение коллоидных мицелл Мицелла – частица дисперсной фазы вместе с ДЭС. Внутренняя часть мицеллы - агрегат, состоящий из большого числа молекул или атомов м. р. с. Агрегат электронейтрален, но адсорбирует на своей поверхности ионы из раствора – ПОИ. Правило Панета-Фаянса: «На твердой поверхности агрегата в первую очередь адсорбируются ионы, которые: • входят в состав агрегата; • способны достраивать кристаллическую решетку агрегата; • образуют малорастворимое соединение с ионами агрегата; • изоморфны с ионами агрегата. » 11
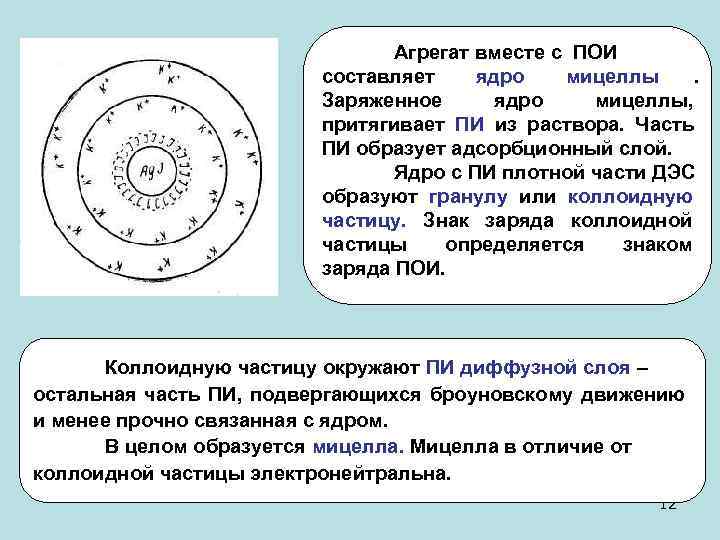
 Агрегат вместе с ПОИ составляет ядро мицеллы . Заряженное ядро мицеллы, притягивает ПИ из раствора. Часть ПИ образует адсорбционный слой. Ядро с ПИ плотной части ДЭС образуют гранулу или коллоидную частицу. Знак заряда коллоидной частицы определяется знаком заряда ПОИ. Коллоидную частицу окружают ПИ диффузной слоя – остальная часть ПИ, подвергающихся броуновскому движению и менее прочно связанная с ядром. В целом образуется мицелла. Мицелла в отличие от коллоидной частицы электронейтральна. 12
Агрегат вместе с ПОИ составляет ядро мицеллы . Заряженное ядро мицеллы, притягивает ПИ из раствора. Часть ПИ образует адсорбционный слой. Ядро с ПИ плотной части ДЭС образуют гранулу или коллоидную частицу. Знак заряда коллоидной частицы определяется знаком заряда ПОИ. Коллоидную частицу окружают ПИ диффузной слоя – остальная часть ПИ, подвергающихся броуновскому движению и менее прочно связанная с ядром. В целом образуется мицелла. Мицелла в отличие от коллоидной частицы электронейтральна. 12
 Ag. NO 3 – электролит-стабилизатор Ag+ – ПОИ, – ПИ 13
Ag. NO 3 – электролит-стабилизатор Ag+ – ПОИ, – ПИ 13
![>. ] A [ { } n J g m 3 O N x >. ] A [ { } n J g m 3 O N x](https://present5.com/presentation/3/178551639_160528813.pdf-img/178551639_160528813.pdf-14.jpg) . ] A [ { } n J g m 3 O N x - + д я п т е р г а ф й б в ы щ ю з и л о к м ) у ( ц с ч н KI– электролит-стабилизатор K+ – ПОИ, I- - ПИ {m[ Ag. I ] n I- (n-x) K+}x-x K+ 14
. ] A [ { } n J g m 3 O N x - + д я п т е р г а ф й б в ы щ ю з и л о к м ) у ( ц с ч н KI– электролит-стабилизатор K+ – ПОИ, I- - ПИ {m[ Ag. I ] n I- (n-x) K+}x-x K+ 14
 Получение дисперсных систем Диспергационные методы измельчение крупных образцов вещества до частиц дисперсных размеров; химический состав и агрегатное состояние вещества не меняется; затрачивается внешняя работа; используют для получения грубодисперсных систем – производство цемента (1 млрд. т в год), измельчении руд полезных ископаемых, помол муки и т. д. 15
Получение дисперсных систем Диспергационные методы измельчение крупных образцов вещества до частиц дисперсных размеров; химический состав и агрегатное состояние вещества не меняется; затрачивается внешняя работа; используют для получения грубодисперсных систем – производство цемента (1 млрд. т в год), измельчении руд полезных ископаемых, помол муки и т. д. 15
 Конденсационные методы • основаны на ассоциации молекул в агрегаты из истинных растворов; • используют для получения высокодисперсных систем; • не требуют затраты внешней работы; • появление новой фазы происходит при пересыщении среды. 16
Конденсационные методы • основаны на ассоциации молекул в агрегаты из истинных растворов; • используют для получения высокодисперсных систем; • не требуют затраты внешней работы; • появление новой фазы происходит при пересыщении среды. 16
 Стадии конденсации 1. Зародышеобразование - возникновение центров кристаллизации в пересыщенном растворе; зародыши образуются тем легче, чем больше чужеродных частиц. 2. Рост зародышей. 3. Формирование слоя стабилизатора (ДЭС). 17
Стадии конденсации 1. Зародышеобразование - возникновение центров кристаллизации в пересыщенном растворе; зародыши образуются тем легче, чем больше чужеродных частиц. 2. Рост зародышей. 3. Формирование слоя стабилизатора (ДЭС). 17
 Физические конденсационные методы 1. Метод конденсации из паров – образование тумана в газовой фазе при понижении температуры. Образование тумана, облаков, производство H 2 SO 4, H 3 PO 4. 2. Метод замены растворителя – раствор вещества приливают к жидкости, в которой это вещество практически не растворимо. Получение гидрозолей серы, холестерина, канифоли и др. 18
Физические конденсационные методы 1. Метод конденсации из паров – образование тумана в газовой фазе при понижении температуры. Образование тумана, облаков, производство H 2 SO 4, H 3 PO 4. 2. Метод замены растворителя – раствор вещества приливают к жидкости, в которой это вещество практически не растворимо. Получение гидрозолей серы, холестерина, канифоли и др. 18
 Химические конденсационные методы Методы основаны на образовании м. р. с. в результате протекания химических реакций. 1. Реакции восстановления (получение золей Au, Ag, Pt). Восстановление аурата натрия формальдегидом. 2 Na. Au. O 2 + 3 HCOH + Na 2 CO 3 = 2 Au + 3 HCOONa +Na. HCO 3 + H 2 O Строение мицеллы : 19
Химические конденсационные методы Методы основаны на образовании м. р. с. в результате протекания химических реакций. 1. Реакции восстановления (получение золей Au, Ag, Pt). Восстановление аурата натрия формальдегидом. 2 Na. Au. O 2 + 3 HCOH + Na 2 CO 3 = 2 Au + 3 HCOONa +Na. HCO 3 + H 2 O Строение мицеллы : 19
 2. Реакции обмена. Получение золя иодида серебра. Ag. NO 3 + KJ(изб. ) = Ag. J↓ + KNO 3 Строение мицеллы: 20
2. Реакции обмена. Получение золя иодида серебра. Ag. NO 3 + KJ(изб. ) = Ag. J↓ + KNO 3 Строение мицеллы: 20
 3. Реакции окисления Образование золя серы. 2 H 2 Sр-р + O 2 = 2 S ↓+ 2 H 2 O Строение мицеллы: 21
3. Реакции окисления Образование золя серы. 2 H 2 Sр-р + O 2 = 2 S ↓+ 2 H 2 O Строение мицеллы: 21
 4. Реакции гидролиза Получение золя гидроксида железа. Fe. Cl 3 + 3 H 2 O = Fe(OH)3 ↓ + 3 HCl Cтроение мицеллы: 22
4. Реакции гидролиза Получение золя гидроксида железа. Fe. Cl 3 + 3 H 2 O = Fe(OH)3 ↓ + 3 HCl Cтроение мицеллы: 22
 Метод пептизации Пептизация – метод, основанный на переводе в коллоидный раствор осадков, первичные размеры которых уже имеют размеры высокодисперсных систем. Суть метода: свежевыпавший рыхлый осадок переводят в золь путем обработки пептизаторами (растворами электролитов, ПАВ, растворителем). 23
Метод пептизации Пептизация – метод, основанный на переводе в коллоидный раствор осадков, первичные размеры которых уже имеют размеры высокодисперсных систем. Суть метода: свежевыпавший рыхлый осадок переводят в золь путем обработки пептизаторами (растворами электролитов, ПАВ, растворителем). 23
 Методы очистки дисперсных систем Низкомолекулярные примеси (чужеродные электролиты) разрушают коллоидные системы. Диализ – отделение золей от низкомолекулярных примесей с помощью полупроницаемой мембраны. Электродиализ – диализ, ускоренный внешним электрическим полем. Ультрафильтрация – электродиализ под давлением (гемодиализ). 24
Методы очистки дисперсных систем Низкомолекулярные примеси (чужеродные электролиты) разрушают коллоидные системы. Диализ – отделение золей от низкомолекулярных примесей с помощью полупроницаемой мембраны. Электродиализ – диализ, ускоренный внешним электрическим полем. Ультрафильтрация – электродиализ под давлением (гемодиализ). 24
 Особенности коллоидных растворов 1. Опалесценция (светорассеяние) наблюдается когда λ > d. Чем короче длина волны падающего света, тем больше рассеяние. 400 нм - синий, 780 нм - красный При боковом свечении дисперсные системы имеют голубоватую окраску (атмосфера Земли), а в проходящем свете – красноватую (восход и закат Солнца). Светомаскировка - синий свет. Сигнализация – красный, оранжевый свет. Окраска драгоценных камней и самоцветов Рубин – коллоидный раствор Cr или Au в Al 2 O 3, Сапфир - коллоидный раствор Ti в Al 2 O 3, Аметист – коллоидный раствор Mn в Si. O 2. 25
Особенности коллоидных растворов 1. Опалесценция (светорассеяние) наблюдается когда λ > d. Чем короче длина волны падающего света, тем больше рассеяние. 400 нм - синий, 780 нм - красный При боковом свечении дисперсные системы имеют голубоватую окраску (атмосфера Земли), а в проходящем свете – красноватую (восход и закат Солнца). Светомаскировка - синий свет. Сигнализация – красный, оранжевый свет. Окраска драгоценных камней и самоцветов Рубин – коллоидный раствор Cr или Au в Al 2 O 3, Сапфир - коллоидный раствор Ti в Al 2 O 3, Аметист – коллоидный раствор Mn в Si. O 2. 25
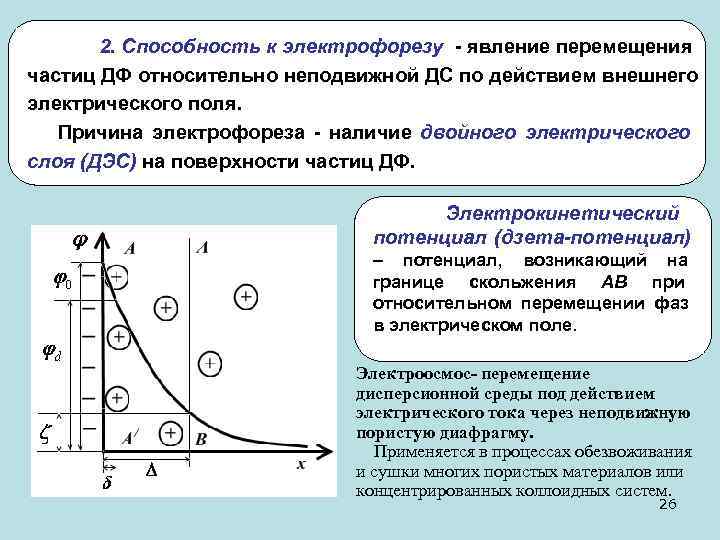
 2. Способность к электрофорезу - явление перемещения частиц ДФ относительно неподвижной ДС по действием внешнего электрического поля. Причина электрофореза - наличие двойного электрического слоя (ДЭС) на поверхности частиц ДФ. Электрокинетический потенциал (дзета-потенциал) – потенциал, возникающий на границе скольжения АВ при относительном перемещении фаз в электрическом поле. Электроосмос- перемещение дисперсионной среды под действием электрического тока через неподвижную пористую диафрагму. Применяется в процессах обезвоживания и сушки многих пористых материалов или концентрированных коллоидных систем. 26
2. Способность к электрофорезу - явление перемещения частиц ДФ относительно неподвижной ДС по действием внешнего электрического поля. Причина электрофореза - наличие двойного электрического слоя (ДЭС) на поверхности частиц ДФ. Электрокинетический потенциал (дзета-потенциал) – потенциал, возникающий на границе скольжения АВ при относительном перемещении фаз в электрическом поле. Электроосмос- перемещение дисперсионной среды под действием электрического тока через неподвижную пористую диафрагму. Применяется в процессах обезвоживания и сушки многих пористых материалов или концентрированных коллоидных систем. 26
 Устойчивость и коагуляция дисперсных систем Устойчивость – неизменность во времени основных параметров дисперсной системы: степени дисперсности и равномерного распределения частиц дисперсной фазы в дисперсионной среде. Различают агрегативную и кинетическую устойчивость. Коагуляция – процесс разрушения коллоидных систем за счет слипания частиц, образования более крупных агрегатов с потерей устойчивости и последующим разделением фаз. 27
Устойчивость и коагуляция дисперсных систем Устойчивость – неизменность во времени основных параметров дисперсной системы: степени дисперсности и равномерного распределения частиц дисперсной фазы в дисперсионной среде. Различают агрегативную и кинетическую устойчивость. Коагуляция – процесс разрушения коллоидных систем за счет слипания частиц, образования более крупных агрегатов с потерей устойчивости и последующим разделением фаз. 27
 Коагуляция золей электролитами Правила электролитной коагуляции • Все электролиты при определенной концентрации могут вызвать коагуляцию золя. • Правило знака заряда: коагуляцию золя вызывает тот ион электролита, знак заряда которого противоположен заряду коллоидной частицы (гранулы). Этот ион называют ионом-коагулятором. • Каждый электролит по отношению к коллоидному раствору обладает порогом коагуляции (коагулирующей способностью). 28
Коагуляция золей электролитами Правила электролитной коагуляции • Все электролиты при определенной концентрации могут вызвать коагуляцию золя. • Правило знака заряда: коагуляцию золя вызывает тот ион электролита, знак заряда которого противоположен заряду коллоидной частицы (гранулы). Этот ион называют ионом-коагулятором. • Каждый электролит по отношению к коллоидному раствору обладает порогом коагуляции (коагулирующей способностью). 28
 Порог коагуляции (γ, Спор) – наименьшая концентрация электролита, достаточная для того, чтобы вызвать коагуляцию золя Коагулирующая способность (Р) – величина, обратная порогу коагуляции • Влияние заряда иона-коагулятора (правило Шульце- Гарди): коагулирующая способность электролита возрастает с увеличением заряда иона – коагулятора 29
Порог коагуляции (γ, Спор) – наименьшая концентрация электролита, достаточная для того, чтобы вызвать коагуляцию золя Коагулирующая способность (Р) – величина, обратная порогу коагуляции • Влияние заряда иона-коагулятора (правило Шульце- Гарди): коагулирующая способность электролита возрастает с увеличением заряда иона – коагулятора 29
 Седиментация Седиментацией называют процесс оседания частиц дисперсной фазы в жидкой или газообразной среде под действием силы тяжести. Скорость оседания не зависит от природы, а определяется размером частиц, разностью плотностей частиц и среды, вязкостью среды. Седиментации противодействуют броуновское движение и диффузия. Через некоторое время устанавливается седиментационно- диффузионное равновесие.
Седиментация Седиментацией называют процесс оседания частиц дисперсной фазы в жидкой или газообразной среде под действием силы тяжести. Скорость оседания не зависит от природы, а определяется размером частиц, разностью плотностей частиц и среды, вязкостью среды. Седиментации противодействуют броуновское движение и диффузия. Через некоторое время устанавливается седиментационно- диффузионное равновесие.
 КОЛЛОИДНЫЕ СИСТЕМЫ В ОРГАНИЗМЕ Можно смело сказать, что весь человек – это ходячий коллоид, а все органы и системы организма – дисперсные системы. Рассмотрим некоторые из них…
КОЛЛОИДНЫЕ СИСТЕМЫ В ОРГАНИЗМЕ Можно смело сказать, что весь человек – это ходячий коллоид, а все органы и системы организма – дисперсные системы. Рассмотрим некоторые из них…
 Кости – это коллаген, насыщенный кальцием и фосфором.
Кости – это коллаген, насыщенный кальцием и фосфором.
 Кровь – это дисперсная система, в которой ферментные элементы эритроциты, тромбоциты, лейкоциты являются фазой, а плазма – дисперсной средой.
Кровь – это дисперсная система, в которой ферментные элементы эритроциты, тромбоциты, лейкоциты являются фазой, а плазма – дисперсной средой.
 Кожа, мышцы, ногти, волосы, кровеносные сосуды, легкие, весь желудочно-кишечный тракт и многое другое, без чего немыслима сама жизнь состоит из коллоидов, богатых белками соединительной ткани.
Кожа, мышцы, ногти, волосы, кровеносные сосуды, легкие, весь желудочно-кишечный тракт и многое другое, без чего немыслима сама жизнь состоит из коллоидов, богатых белками соединительной ткани.
 СПАСИБО ЗА ВНИМАНИЕ! 35
СПАСИБО ЗА ВНИМАНИЕ! 35

