Коллоидные растворы.ppt
- Количество слайдов: 7

Коллоидные растворы

Золь: Ag. J; стабилизатор Ag. NO 3 {m. Ag. J · n. Ag+ · (n-x)NO 3 - · y. H 2 O}x+ · x ·NO 3· z. H 2 O + n – n + x Золь синего золя берлинской лазури: 4 Fe. Cl 3 + 3 K 4[Fe(NC)6] = Fe 4[Fe(NC)6]3↓ + 12 KCl Стабилизатор {m Fe 4[Fe(NC)6]3 · n[Fe(NC)6]4 - · (n-x) · 4 K+ · y. H 2 O}4 x+ · 4 K+ · z. H 2 O – 4 n +4 n – 4 x-
![Зелёный золь берлинской лазури 4 Fe. Cl 3+3 K 4[Fe(NC)6]= Fe 4[Fe(NC)6]3↓+ 12 KCl Зелёный золь берлинской лазури 4 Fe. Cl 3+3 K 4[Fe(NC)6]= Fe 4[Fe(NC)6]3↓+ 12 KCl](https://present5.com/presentation/131912842_134030071/image-3.jpg)
Зелёный золь берлинской лазури 4 Fe. Cl 3+3 K 4[Fe(NC)6]= Fe 4[Fe(NC)6]3↓+ 12 KCl стабилизатор {m Fe 4[Fe(NC)6]3 · n. Fe. O+ · (n – x)Cl- · z. H 2 O}x+ · x. Cl- · z. H 2 O + n- n + x Fe 3+ + 3 Cl- + 2 HOH → Fe(OH)2 Cl + 2 HCl HOH + Fe. OCl Fe. O+ + Cl-
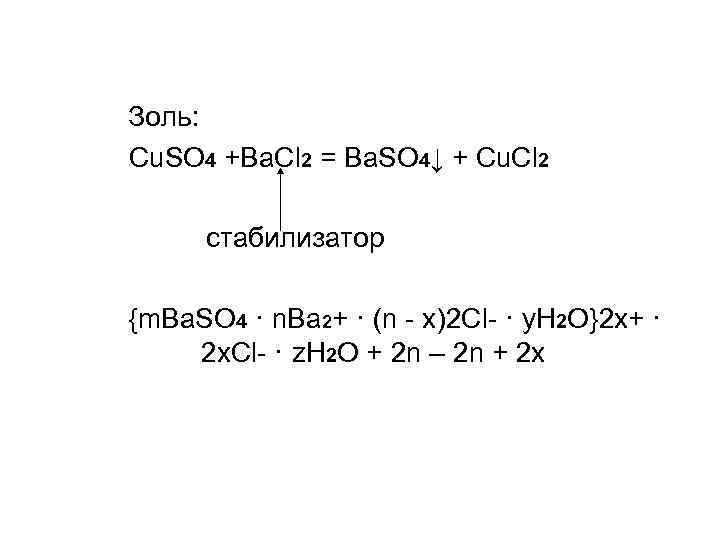
Золь: Cu. SO 4 +Ba. Cl 2 = Ba. SO 4↓ + Cu. Cl 2 стабилизатор {m. Ba. SO 4 · n. Ba 2+ · (n - x)2 Cl- · y. H 2 O}2 x+ · 2 x. Cl- · z. H 2 O + 2 n – 2 n + 2 x

Коагуляция коллоидных растворов Порог коагуляции: ⌡ Коагулирующая способность ионов – величина обратная порогу коагуляции , она зависит: • От заряда иона • От строения иона • От размеров ионов.

Дзета потенциал: Уравнение Гельмгольца – Смолуховского

- коэффициент, характеризующий форму коллоидной частицы: для шара = 6, для цилиндра = 4. = 3, 14. - вязкость растворителя. - электрофоретическая подвижность. - расстояние в м, которое проходит частица за время с. -расстояние между электродами в м. - диэлектрическая постоянная растворителя. -разность потенциалов на электродах
Коллоидные растворы.ppt