Почвенные коллоиды.ppt
- Количество слайдов: 44
 Коллоиднаяпочв твердой часть фазы почвы Соловьева Т. П. , доцент кафедры почвоведения и экологии почв ТГУ solovyevat@bio. tsu. ru
Коллоиднаяпочв твердой часть фазы почвы Соловьева Т. П. , доцент кафедры почвоведения и экологии почв ТГУ solovyevat@bio. tsu. ru
 Гранулометрические фракции Ø Камни – более 3 мм Ø Гравий – 3– 1 мм Песок: Ø Крупный – 1– 0, 5 мм Ø Средний – 0, 5– 0, 25 мм Ø Мелкий – 0, 25– 0, 05 мм Пыль: Ø Крупная – 0, 05– 0, 01 мм Ø Средняя – 0, 01– 0, 005 мм Ø Мелкая – 0, 005– 0, 001 Ил: Ø Глинистый (грубый) – 0, 001– 0, 0005 мм Ø Коллоидный (тонкий) – 0, 0005– 0, 0001 мм Ø Коллоиды – менее 0, 0001 мм. 2
Гранулометрические фракции Ø Камни – более 3 мм Ø Гравий – 3– 1 мм Песок: Ø Крупный – 1– 0, 5 мм Ø Средний – 0, 5– 0, 25 мм Ø Мелкий – 0, 25– 0, 05 мм Пыль: Ø Крупная – 0, 05– 0, 01 мм Ø Средняя – 0, 01– 0, 005 мм Ø Мелкая – 0, 005– 0, 001 Ил: Ø Глинистый (грубый) – 0, 001– 0, 0005 мм Ø Коллоидный (тонкий) – 0, 0005– 0, 0001 мм Ø Коллоиды – менее 0, 0001 мм. 2
 Образование почвенных коллоидов Ø Почвенные коллоиды образуются в процессе выветривания и почвообразования в результате дробления крупных частиц или путем соединения молекулярно раздробленных веществ. 3
Образование почвенных коллоидов Ø Почвенные коллоиды образуются в процессе выветривания и почвообразования в результате дробления крупных частиц или путем соединения молекулярно раздробленных веществ. 3
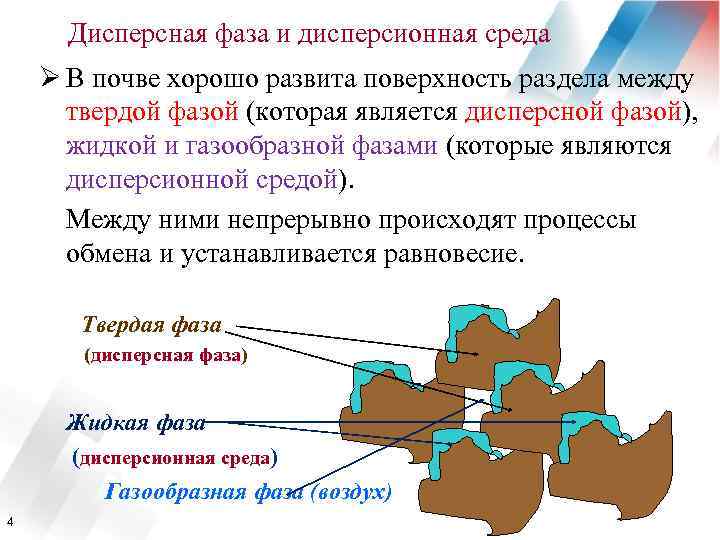 Дисперсная фаза и дисперсионная среда Ø В почве хорошо развита поверхность раздела между твердой фазой (которая является дисперсной фазой), жидкой и газообразной фазами (которые являются дисперсионной средой). Между ними непрерывно происходят процессы обмена и устанавливается равновесие. Твердая фаза (дисперсная фаза) Жидкая фаза (дисперсионная среда) Газообразная фаза (воздух) 4
Дисперсная фаза и дисперсионная среда Ø В почве хорошо развита поверхность раздела между твердой фазой (которая является дисперсной фазой), жидкой и газообразной фазами (которые являются дисперсионной средой). Между ними непрерывно происходят процессы обмена и устанавливается равновесие. Твердая фаза (дисперсная фаза) Жидкая фаза (дисперсионная среда) Газообразная фаза (воздух) 4
 Особенность коллоидов Ø Характерная особенность коллоидов – большая суммарная и удельная поверхность. Ø Удельная поверхность – это суммарная площадь поверхности почвенных частиц, отнесенная к единице массы или площади. Ø Удельная поверхность определяет химическую активность почв. Ø С увеличением дисперсности частиц их химическая активность возрастает. 5
Особенность коллоидов Ø Характерная особенность коллоидов – большая суммарная и удельная поверхность. Ø Удельная поверхность – это суммарная площадь поверхности почвенных частиц, отнесенная к единице массы или площади. Ø Удельная поверхность определяет химическую активность почв. Ø С увеличением дисперсности частиц их химическая активность возрастает. 5
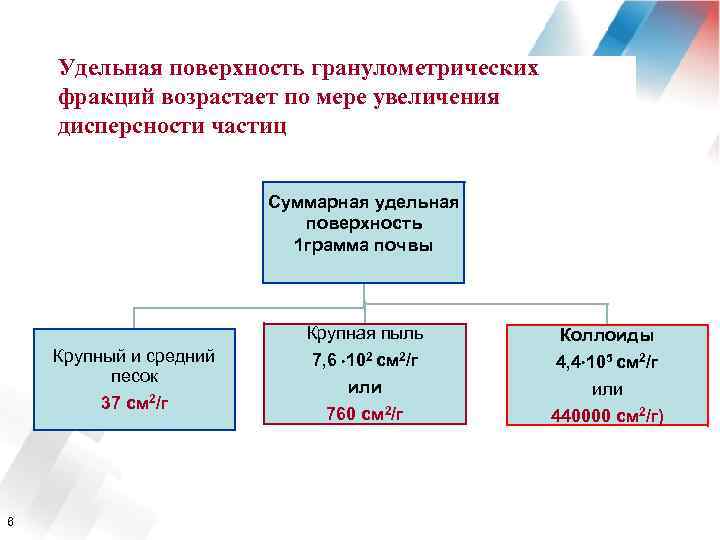 Удельная поверхность гранулометрических фракций возрастает по мере увеличения дисперсности частиц Суммарная удельная поверхность 1 грамма почвы Крупная пыль Крупный и средний песок 37 см 2/г 6 Коллоиды 7, 6 102 см 2/г или 760 см 2/г 4, 4 105 см 2/г или 440000 см 2/г)
Удельная поверхность гранулометрических фракций возрастает по мере увеличения дисперсности частиц Суммарная удельная поверхность 1 грамма почвы Крупная пыль Крупный и средний песок 37 см 2/г 6 Коллоиды 7, 6 102 см 2/г или 760 см 2/г 4, 4 105 см 2/г или 440000 см 2/г)
 Ø Почвенный поглощающий комплекс – это совокупность минеральных, органических, органоминеральных соединений высокой степени дисперсности, нерастворимых в воде и способных поглощать и обменивать поглощенные ионы. 7
Ø Почвенный поглощающий комплекс – это совокупность минеральных, органических, органоминеральных соединений высокой степени дисперсности, нерастворимых в воде и способных поглощать и обменивать поглощенные ионы. 7
 1. Состав и строение почвенных коллоидов 8
1. Состав и строение почвенных коллоидов 8
 9
9
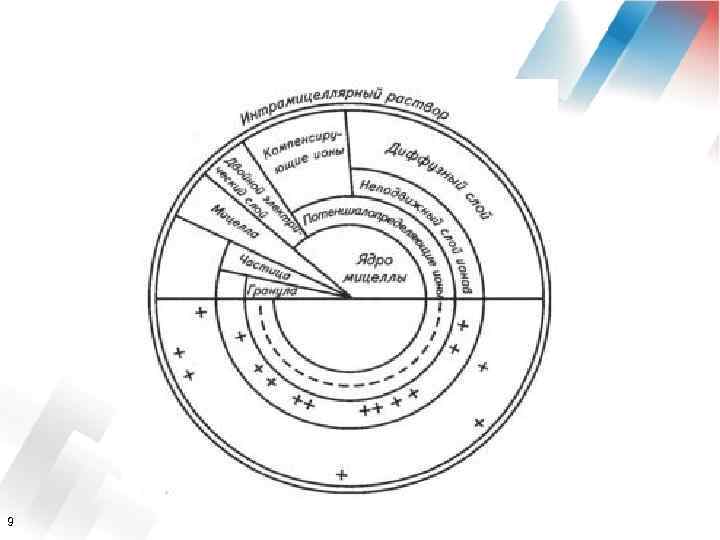
 Ø Коллоидная мицелла электронейтральна. Ø Основная масса ее принадлежит грануле, поэтому заряд гранулы рассматривается как заряд всего коллоида. Ø Коллоиды, имеющие в потенциалопределяющем слое отрицательно заряженные ионы и диссоциирующие в раствор Н-ионы, называются ацидоидами (кислотоподобными). Пример - гуминовая кислота. Ø Коллоиды, имеющие в потенциалопределяющем слое положительно заряженные ионы и посылающие в раствор ионы ОН, называются базоидами. 10
Ø Коллоидная мицелла электронейтральна. Ø Основная масса ее принадлежит грануле, поэтому заряд гранулы рассматривается как заряд всего коллоида. Ø Коллоиды, имеющие в потенциалопределяющем слое отрицательно заряженные ионы и диссоциирующие в раствор Н-ионы, называются ацидоидами (кислотоподобными). Пример - гуминовая кислота. Ø Коллоиды, имеющие в потенциалопределяющем слое положительно заряженные ионы и посылающие в раствор ионы ОН, называются базоидами. 10
 Ø Коллоиды, которые в зависимости от реакции среды ведут себя то, как кислоты (ацидоиды), то, как основания (базоиды) называются амфолитоидами. Пример - гидроксиды железа, алюминия, протеины Ø В условиях кислой реакции среды подавляется диссоциация Н-ионов, в раствор посылаются ОНионы, коллоид приобретает знак заряда +: Al(OH)3 ↔ Al(OH)2+ + OH– Ø При щелочной реакции гидроксид алюминия ведет себя как кислота и коллоид приобретает отрицательный знак заряда: Al(OH)3 ↔ Al. О(OH)2– + H+ 11
Ø Коллоиды, которые в зависимости от реакции среды ведут себя то, как кислоты (ацидоиды), то, как основания (базоиды) называются амфолитоидами. Пример - гидроксиды железа, алюминия, протеины Ø В условиях кислой реакции среды подавляется диссоциация Н-ионов, в раствор посылаются ОНионы, коллоид приобретает знак заряда +: Al(OH)3 ↔ Al(OH)2+ + OH– Ø При щелочной реакции гидроксид алюминия ведет себя как кислота и коллоид приобретает отрицательный знак заряда: Al(OH)3 ↔ Al. О(OH)2– + H+ 11
 По отношению к жидкой фазе коллоиды делятся на а) гидрофильные и б) гидрофобные. ОН– – Н+ ОН + – + Н+ Н+ ОН– ОН – Н + Н ОН – 12 Н ОН Н + Н+ – ОН ОН + Н ОН Гидрофильными называются коллоиды, способные поглощать молекулы воды, которые образуют на их поверхности многослойную пленку (гидратация коллоида).
По отношению к жидкой фазе коллоиды делятся на а) гидрофильные и б) гидрофобные. ОН– – Н+ ОН + – + Н+ Н+ ОН– ОН – Н + Н ОН – 12 Н ОН Н + Н+ – ОН ОН + Н ОН Гидрофильными называются коллоиды, способные поглощать молекулы воды, которые образуют на их поверхности многослойную пленку (гидратация коллоида).
 Ø Электрический заряд обусловливает электрокинетические свойства. Ø Коллоиды могут находиться в двух состояниях: 1) золя (коллоидного раствора) и 2) геля (коллоидного осадка). Ø В большинстве своем коллоиды в почве находятся в форме гелей. Ø Во влажной почве небольшое количество коллоидов может находиться в состоянии золя. 13
Ø Электрический заряд обусловливает электрокинетические свойства. Ø Коллоиды могут находиться в двух состояниях: 1) золя (коллоидного раствора) и 2) геля (коллоидного осадка). Ø В большинстве своем коллоиды в почве находятся в форме гелей. Ø Во влажной почве небольшое количество коллоидов может находиться в состоянии золя. 13
 Ø Раздельное существование коллоидных частиц в состоянии золя связано с наличием электрокинетического потенциала и водной (гидратационной) оболочки на поверхности частиц. Ø Одноименно заряженные частицы отталкиваются друг от друга, могут долго находиться в суспензии, не образуя осадка. Ø При падении электрокинетического потенциала разноименно заряженные коллоиды, сталкиваясь друг с другом при хаотическом движении, склеиваются, увеличиваются в размерах и выпадают в осадок. 14
Ø Раздельное существование коллоидных частиц в состоянии золя связано с наличием электрокинетического потенциала и водной (гидратационной) оболочки на поверхности частиц. Ø Одноименно заряженные частицы отталкиваются друг от друга, могут долго находиться в суспензии, не образуя осадка. Ø При падении электрокинетического потенциала разноименно заряженные коллоиды, сталкиваясь друг с другом при хаотическом движении, склеиваются, увеличиваются в размерах и выпадают в осадок. 14
 15 Ø Коагуляция – переход коллоида из состояния золя в состояние геля, дальнейшее осаждение называется седиментацией. Ø Коагулирующая способность электролитов неодинакова и зависит от валентности иона и его атомной массы. Ø Коагуляция коллоидов вызывается: а) действием электролитов, ионы которых несут противоположный знак заряда; б) при взаимодействии двух коллоидных систем, несущих противоположные заряды; в) высушиванием или замораживанием почвы, так как при этом происходит дегидратация (обезвоживание).
15 Ø Коагуляция – переход коллоида из состояния золя в состояние геля, дальнейшее осаждение называется седиментацией. Ø Коагулирующая способность электролитов неодинакова и зависит от валентности иона и его атомной массы. Ø Коагуляция коллоидов вызывается: а) действием электролитов, ионы которых несут противоположный знак заряда; б) при взаимодействии двух коллоидных систем, несущих противоположные заряды; в) высушиванием или замораживанием почвы, так как при этом происходит дегидратация (обезвоживание).
 Ø Наиболее легко коагулируют гидрофобные коллоиды. Ø Гели могут быть обратимыми и необратимыми. Обратимые гели возвращаются в состояние золя при удалении электролита. Ø Особым видом коагуляции является тиксотропия. Ø Явление тиксотропии широко распространено в почвах, формирующихся в зоне вечной мерзлоты. 16
Ø Наиболее легко коагулируют гидрофобные коллоиды. Ø Гели могут быть обратимыми и необратимыми. Обратимые гели возвращаются в состояние золя при удалении электролита. Ø Особым видом коагуляции является тиксотропия. Ø Явление тиксотропии широко распространено в почвах, формирующихся в зоне вечной мерзлоты. 16
 Ø Пептизация – это переход из состояния геля в золь. Ø Пептизация почвенных коллоидов происходит а) при удалении избытка электролита (в случае обратимых гелей) б) действием ионов ОН–, которые увеличивают заряд ацидоидов; в) при насыщении почвы высокогидратированными катионами. 17
Ø Пептизация – это переход из состояния геля в золь. Ø Пептизация почвенных коллоидов происходит а) при удалении избытка электролита (в случае обратимых гелей) б) действием ионов ОН–, которые увеличивают заряд ацидоидов; в) при насыщении почвы высокогидратированными катионами. 17
 Коллоиды, насыщенные одновалентными катионами, находятся в основном в состоянии золя Na+ Fe 3+ Ca 2+ При замене одновалентных катионов двух- и трехвалентными они переходят в гель 18 Mg 2+
Коллоиды, насыщенные одновалентными катионами, находятся в основном в состоянии золя Na+ Fe 3+ Ca 2+ При замене одновалентных катионов двух- и трехвалентными они переходят в гель 18 Mg 2+
 насыщение ППК натрием способствует образованию золя распылению почвы, и их гидратации. Na+ Fe 3+ Ca 2+ насыщение ППК кальцием способствует образованию геля агрегированию почвы 19 Mg 2+
насыщение ППК натрием способствует образованию золя распылению почвы, и их гидратации. Na+ Fe 3+ Ca 2+ насыщение ППК кальцием способствует образованию геля агрегированию почвы 19 Mg 2+
 Свойства коллоидов Ø Коллоиды обладают адсорбционными свойствами, т. е. способностью поглощать катионы, анионы и целые молекулы находящихся в почвенном растворе веществ. Различают ионную и молекулярную сорбцию. Ø Ионная сорбция носит обменный характер и заключается в обменной реакции между катионами диффузного слоя мицеллы и окружающего ее раствора. Ø Молекулярная сорбция – это поглощение (фиксация) на поверхности мицеллы молекул каких-либо соединений (например, молекул воды). 20
Свойства коллоидов Ø Коллоиды обладают адсорбционными свойствами, т. е. способностью поглощать катионы, анионы и целые молекулы находящихся в почвенном растворе веществ. Различают ионную и молекулярную сорбцию. Ø Ионная сорбция носит обменный характер и заключается в обменной реакции между катионами диффузного слоя мицеллы и окружающего ее раствора. Ø Молекулярная сорбция – это поглощение (фиксация) на поверхности мицеллы молекул каких-либо соединений (например, молекул воды). 20
 Состав почвенных коллоидов Ø Различают три группы коллоидов в почве: Ø – минеральные, Ø – органические, Ø – органоминеральные. 21
Состав почвенных коллоидов Ø Различают три группы коллоидов в почве: Ø – минеральные, Ø – органические, Ø – органоминеральные. 21
 Минеральные коллоиды 22 Ø Представлены а) глинистыми минералами, б) коллоидными формами кремнезема и полуторных оксидов железа и алюминия. Ø Все глинистые минералы имеют кристаллическое строение, пластинчатую форму и являются типичными ацидоидами Ø Емкость поглощения максимальна в минералах группы монтмориллонита и вермикулита, минимальной емкостью обменного поглощения катионов обладают минералы группы каолинита Ø Все глинистые минералы способны к коагуляции при воздействии 2 -х и 3 -х-валентных катионов и легко пептизируются.
Минеральные коллоиды 22 Ø Представлены а) глинистыми минералами, б) коллоидными формами кремнезема и полуторных оксидов железа и алюминия. Ø Все глинистые минералы имеют кристаллическое строение, пластинчатую форму и являются типичными ацидоидами Ø Емкость поглощения максимальна в минералах группы монтмориллонита и вермикулита, минимальной емкостью обменного поглощения катионов обладают минералы группы каолинита Ø Все глинистые минералы способны к коагуляции при воздействии 2 -х и 3 -х-валентных катионов и легко пептизируются.
 Органические коллоиды Ø Представлены в почве гумусовыми кислотами и их солями (гуматами, фульватами). Ø Все они типичные ацидоиды. Ø Гидрофильные коллоиды, легко меняют состояние – пептизируются при действии щелочных растворов и коагулируют под влиянием 2 -х и 3 -х-валентных катионов. Ø В почве находятся в состоянии гелей. Ø Характерная особенность гумусовых веществ – очень высокая емкость обменного поглощения катионов. Ø К группе органических коллоидов относятся также белковые вещества, представленные в почве плазмой микроорганизмов. Это типичные амфолитоиды, в кислой среде - базоиды, а в щелочной –ацидоиды. 23
Органические коллоиды Ø Представлены в почве гумусовыми кислотами и их солями (гуматами, фульватами). Ø Все они типичные ацидоиды. Ø Гидрофильные коллоиды, легко меняют состояние – пептизируются при действии щелочных растворов и коагулируют под влиянием 2 -х и 3 -х-валентных катионов. Ø В почве находятся в состоянии гелей. Ø Характерная особенность гумусовых веществ – очень высокая емкость обменного поглощения катионов. Ø К группе органических коллоидов относятся также белковые вещества, представленные в почве плазмой микроорганизмов. Это типичные амфолитоиды, в кислой среде - базоиды, а в щелочной –ацидоиды. 23
 Органоминеральные. Ø Комплекс переменного состава из высокодисперсных минералов и гумусовых веществ, покрытых пленками гумусовых кислот, гуматов, фульватов алюмо- и железогумусовых солей. Ø В состав этих коллоидов входят минералы монтмориллонитовой и гидрослюдистой групп, а также полуторные оксиды и кремнезем. Ø Формируются в почве в процессе склеивания (адгезии) гумусовых кислот и их производных с поверхностью минеральной частицы, вещества минеральной природы в них преобладают. Ø Являются ацидоидами и характеризуются относительно высокой емкостью обменного поглощения катионов. 24
Органоминеральные. Ø Комплекс переменного состава из высокодисперсных минералов и гумусовых веществ, покрытых пленками гумусовых кислот, гуматов, фульватов алюмо- и железогумусовых солей. Ø В состав этих коллоидов входят минералы монтмориллонитовой и гидрослюдистой групп, а также полуторные оксиды и кремнезем. Ø Формируются в почве в процессе склеивания (адгезии) гумусовых кислот и их производных с поверхностью минеральной частицы, вещества минеральной природы в них преобладают. Ø Являются ацидоидами и характеризуются относительно высокой емкостью обменного поглощения катионов. 24
 Ø !!! ØВ любой почве основная масса коллоидов находится в форме гелей. 25
Ø !!! ØВ любой почве основная масса коллоидов находится в форме гелей. 25
 2. Поглотительная способность почв 26
2. Поглотительная способность почв 26
 !!! Поглотительной способностью почвы называется ее свойство обменно либо необменно поглощать различные твердые, жидкие и газообразные вещества или увеличивать их концентрацию у поверхности содержащихся в почве коллоидных частиц. Ø Учение о поглотительной способности почв разработано в трудах К. К. Гедройца, Г. Вигнера, С. Маттсона, Е. Н. Гапона, Б. П. Никольского, Н. П. Ремезова, И. Н. Антипова-Каратаева, Н. И. Горбунова. 27
!!! Поглотительной способностью почвы называется ее свойство обменно либо необменно поглощать различные твердые, жидкие и газообразные вещества или увеличивать их концентрацию у поверхности содержащихся в почве коллоидных частиц. Ø Учение о поглотительной способности почв разработано в трудах К. К. Гедройца, Г. Вигнера, С. Маттсона, Е. Н. Гапона, Б. П. Никольского, Н. П. Ремезова, И. Н. Антипова-Каратаева, Н. И. Горбунова. 27
 Виды поглотительной способности К. К. Гедройц выделил пять видов поглотительной способности почв: Ø 1. механическую, Ø 2. биологическую, Ø 3. химическую, Ø 4. физическую Ø 5. физико-химическую. 28
Виды поглотительной способности К. К. Гедройц выделил пять видов поглотительной способности почв: Ø 1. механическую, Ø 2. биологическую, Ø 3. химическую, Ø 4. физическую Ø 5. физико-химическую. 28
 Механическая поглотительная способность Ø Механическая поглотительная способность – это свойство почв поглощать поступающие с водным или воздушным потоком твердые частицы, размеры которых превышают размеры почвенных пор. Ø Вода, проходящая сквозь толщу почвы, очищается от взвесей. Ø Это свойство используется для очистки сточных и питьевых вод. При строительстве оросительных систем свойство почв поглощать твердые частицы используют для заиливания дна и стенок каналов в целях уменьшения потерь воды на фильтрацию (кольматирование каналов и водохранилищ). 29
Механическая поглотительная способность Ø Механическая поглотительная способность – это свойство почв поглощать поступающие с водным или воздушным потоком твердые частицы, размеры которых превышают размеры почвенных пор. Ø Вода, проходящая сквозь толщу почвы, очищается от взвесей. Ø Это свойство используется для очистки сточных и питьевых вод. При строительстве оросительных систем свойство почв поглощать твердые частицы используют для заиливания дна и стенок каналов в целях уменьшения потерь воды на фильтрацию (кольматирование каналов и водохранилищ). 29
 Биологическая поглотительная способность Ø Биологическое поглощение вызвано способностью живых почвообитающих организмов (корни растений, микроорганизмы) поглощать различные элементы. Ø Характеризуется большой избирательностью поглощения, что обусловлено специфической потребностью разных видов живых организмов в элементах питания. 30
Биологическая поглотительная способность Ø Биологическое поглощение вызвано способностью живых почвообитающих организмов (корни растений, микроорганизмы) поглощать различные элементы. Ø Характеризуется большой избирательностью поглощения, что обусловлено специфической потребностью разных видов живых организмов в элементах питания. 30
 Химическая поглотительная способность 31 Ø Химическая поглотительная способность обусловлена образованием труднорастворимых соединений в результате химических реакций, проходящих в почве. Ø Поступающие в почву с атмосферными, грунтовыми или поливными водами катионы и анионы могут образовывать с солями почвенного раствора нерастворимые или труднорастворимые соединения. Например: [ППК 2–)Са 2+ + Na 2 SO 4 → [ППК 2–)2 Na + ↓Ca. SO 4 Al(OH)3 + H 3 PO 4 → ↓Al. PO 4 + 3 H 2 O Na 2 CO 3 + Ca. SO 4 → ↓Ca. CO 3 + Na 2 SO 4
Химическая поглотительная способность 31 Ø Химическая поглотительная способность обусловлена образованием труднорастворимых соединений в результате химических реакций, проходящих в почве. Ø Поступающие в почву с атмосферными, грунтовыми или поливными водами катионы и анионы могут образовывать с солями почвенного раствора нерастворимые или труднорастворимые соединения. Например: [ППК 2–)Са 2+ + Na 2 SO 4 → [ППК 2–)2 Na + ↓Ca. SO 4 Al(OH)3 + H 3 PO 4 → ↓Al. PO 4 + 3 H 2 O Na 2 CO 3 + Ca. SO 4 → ↓Ca. CO 3 + Na 2 SO 4
 Физическая поглотительная способность Ø Физическая поглотительная способность – способность почвы увеличивать концентрацию молекул различных веществ у поверхности тонкодисперсных частиц. 32
Физическая поглотительная способность Ø Физическая поглотительная способность – способность почвы увеличивать концентрацию молекул различных веществ у поверхности тонкодисперсных частиц. 32
 Физико-химическая поглотительная способность Ø Физико-химическая, или обменная, поглотительная способность – это способность почвы поглощать и обменивать ионы, находящиеся на поверхности коллоидных частиц, на эквивалентное количество ионов раствора, взаимодействующего с твердой фазой почвы. Ø Это свойство почвы обусловлено наличием в ее составе так называемого почвенного поглощающего комплекса (ППК), связанного с почвенными коллоидами. 33
Физико-химическая поглотительная способность Ø Физико-химическая, или обменная, поглотительная способность – это способность почвы поглощать и обменивать ионы, находящиеся на поверхности коллоидных частиц, на эквивалентное количество ионов раствора, взаимодействующего с твердой фазой почвы. Ø Это свойство почвы обусловлено наличием в ее составе так называемого почвенного поглощающего комплекса (ППК), связанного с почвенными коллоидами. 33
 Почвенный поглощающий комплекс (ППК) 34
Почвенный поглощающий комплекс (ППК) 34
 !!! Почвенный поглощающий комплекс – это совокупность минеральных, органических, органоминеральных соединений высокой степени дисперсности, нерастворимых в воде и способных поглощать и обменивать поглощенные ионы. 35
!!! Почвенный поглощающий комплекс – это совокупность минеральных, органических, органоминеральных соединений высокой степени дисперсности, нерастворимых в воде и способных поглощать и обменивать поглощенные ионы. 35
 Ø ППК в почвах зависит от: 1. гранулометрического состава 2. минералогического состава 3. содержания гумуса, то есть от общего содержания коллоидов. 36
Ø ППК в почвах зависит от: 1. гранулометрического состава 2. минералогического состава 3. содержания гумуса, то есть от общего содержания коллоидов. 36
 !!! Емкость катионного обмена (ЕКО) Емкость поглощения (ЕП) по К. К. Гедройцу - это максимальное количество обменных катионов, которое может удержать почва в обменнопоглощенном состоянии, выраженное в мг·экв/100 г почвы. 37
!!! Емкость катионного обмена (ЕКО) Емкость поглощения (ЕП) по К. К. Гедройцу - это максимальное количество обменных катионов, которое может удержать почва в обменнопоглощенном состоянии, выраженное в мг·экв/100 г почвы. 37
 Ø ЕКО в почвах зависит от: 1. гранулометрического состава 2. минералогического состава 3. содержания гумуса, то есть от общего содержания коллоидов. Ø Песчаные почвы– 1. . . 5 мг • экв/100 г почвы, Ø супесчаные – 7. . . 8, с Ø суглинистые – до 15. . . 18, Ø глинистые – 25. . . 30 мг· экв/100 г почвы и выше. 38
Ø ЕКО в почвах зависит от: 1. гранулометрического состава 2. минералогического состава 3. содержания гумуса, то есть от общего содержания коллоидов. Ø Песчаные почвы– 1. . . 5 мг • экв/100 г почвы, Ø супесчаные – 7. . . 8, с Ø суглинистые – до 15. . . 18, Ø глинистые – 25. . . 30 мг· экв/100 г почвы и выше. 38
 Состав поглощенных катионов Ø В состав ПК входят катионы кальция, магния, водорода, калия, натрия, аммония, железа и алюминия. Ø Энергия поглощения катионов зависит от валентности. Сильнее поглощаются двухвалентные катионы (Са 2+, Mg 2+), слабее – одновалентные (Na+, NH 4+, К+). Н+ составляет исключение. Его энергия поглощения во много раз превосходит энергию поглощения даже двухвалентных катионов. 39
Состав поглощенных катионов Ø В состав ПК входят катионы кальция, магния, водорода, калия, натрия, аммония, железа и алюминия. Ø Энергия поглощения катионов зависит от валентности. Сильнее поглощаются двухвалентные катионы (Са 2+, Mg 2+), слабее – одновалентные (Na+, NH 4+, К+). Н+ составляет исключение. Его энергия поглощения во много раз превосходит энергию поглощения даже двухвалентных катионов. 39
 Состав ППК в почвах разных типов Ø В черноземах ППК насыщен главным образом Са 2+ и Mg 2+. Ø Известно, что эти двухвалентные катионы вызывают коагуляцию коллоидов и способны удерживать одновременно две коллоидные частицы. А так как в черноземах содержится еще и достаточное количество гумуса, то в них формируется ценная структура. 40
Состав ППК в почвах разных типов Ø В черноземах ППК насыщен главным образом Са 2+ и Mg 2+. Ø Известно, что эти двухвалентные катионы вызывают коагуляцию коллоидов и способны удерживать одновременно две коллоидные частицы. А так как в черноземах содержится еще и достаточное количество гумуса, то в них формируется ценная структура. 40
 Ø В подзолистых почвах, находящихся к северу от черноземной зоны, кроме кальция и магния в ППК присутствует Н+, который создает кислую реакцию. Ø В каштановых почвах наряду с Са 2+ и Mg 2+ присутствует Na+. Ø В солонцах особенно много поглощенного Na+. Почвы, насыщенные натрием, во влажном состоянии набухают, а при высыхании сильно уменьшаются в объеме, в них возникают вертикальные трещины, образуя столбчатые отдельности. 41
Ø В подзолистых почвах, находящихся к северу от черноземной зоны, кроме кальция и магния в ППК присутствует Н+, который создает кислую реакцию. Ø В каштановых почвах наряду с Са 2+ и Mg 2+ присутствует Na+. Ø В солонцах особенно много поглощенного Na+. Почвы, насыщенные натрием, во влажном состоянии набухают, а при высыхании сильно уменьшаются в объеме, в них возникают вертикальные трещины, образуя столбчатые отдельности. 41
 Насыщенность основаниями Ø В зависимости от наличия поглощенного водорода почвы подразделяются на насыщенные и ненасыщенные основаниями. Ø Насыщенные основаниями - черноземы, каштановые, сероземы. В их поглощающем комплексе находятся только катионы Са 2+ , Mg 2+, Na+. Ø Ненасыщенные основаниями – подзолистые, дерново-подзолистые, серые лесные, болотные и другие почвы таежно-лесной и лесостепной зон. В них наряду с катионами Са 2+ и Mg 2+ содержатся катионы Н+ и А 13+. 42
Насыщенность основаниями Ø В зависимости от наличия поглощенного водорода почвы подразделяются на насыщенные и ненасыщенные основаниями. Ø Насыщенные основаниями - черноземы, каштановые, сероземы. В их поглощающем комплексе находятся только катионы Са 2+ , Mg 2+, Na+. Ø Ненасыщенные основаниями – подзолистые, дерново-подзолистые, серые лесные, болотные и другие почвы таежно-лесной и лесостепной зон. В них наряду с катионами Са 2+ и Mg 2+ содержатся катионы Н+ и А 13+. 42
 Экологическое значение поглотительной способности почв Ненасыщенные основаниями Насыщенные основаниями Ø Содержат и Ø Реакция среды близкая к нейтральной; Ø Хорошо оструктурены; Ø Прочная структура; Ø Обладают благоприятными физическими свойствами Са 2+ 43 Mg 2+ Ø Содержат Н+, Fe 3+ , Al 3+ Ø Реакция среды кислая; Ø Плохо оструктурены; Ø Слабая структура; Ø Обладают неблагоприятными физическими свойствами
Экологическое значение поглотительной способности почв Ненасыщенные основаниями Насыщенные основаниями Ø Содержат и Ø Реакция среды близкая к нейтральной; Ø Хорошо оструктурены; Ø Прочная структура; Ø Обладают благоприятными физическими свойствами Са 2+ 43 Mg 2+ Ø Содержат Н+, Fe 3+ , Al 3+ Ø Реакция среды кислая; Ø Плохо оструктурены; Ø Слабая структура; Ø Обладают неблагоприятными физическими свойствами
 почв Благодарю за внимание
почв Благодарю за внимание


