Презентация КХ. Введение. Пов. явления.pptx
- Количество слайдов: 17
 КОЛЛОИДНАЯ ХИМИЯ
КОЛЛОИДНАЯ ХИМИЯ
 Рекомендуемая литература 1. Щукин Е. Д. , Перцов А. В. , Амелина Е. А. Коллоидная химия. - М. : Высш. шк. , 2004. 2. Сумм Б. Д. Основы коллоидной химии. –М. : Академия, 2006. 3. Фридрихсберг Д. А. Курс коллоидной химии. - М. : Химия, 1995. 4. Фролов Ю. Г. Курс коллоидной химии. - М. : Химия, 1989. 5. Воюцкий С. С. Курс коллоидной химии. - М. : Химия 1976.
Рекомендуемая литература 1. Щукин Е. Д. , Перцов А. В. , Амелина Е. А. Коллоидная химия. - М. : Высш. шк. , 2004. 2. Сумм Б. Д. Основы коллоидной химии. –М. : Академия, 2006. 3. Фридрихсберг Д. А. Курс коллоидной химии. - М. : Химия, 1995. 4. Фролов Ю. Г. Курс коллоидной химии. - М. : Химия, 1989. 5. Воюцкий С. С. Курс коллоидной химии. - М. : Химия 1976.
 Дисперсные системы - это гетерогенные двух и многофазные системы, у которых одна из фаз находится в дисперсном состоянии. Дисперсная фаза – диспергирована до малых размеров. Дисперсионная среда – сплошная непрерывная фаза в которой распределены частицы дисперсной фазы. Важнейшая особенность дисперсных систем - наличие огромной суммарной поверхности раздела между фазами. Межфазная граница раздела обладает избытком свободной энергии (свободной поверхностной энергией).
Дисперсные системы - это гетерогенные двух и многофазные системы, у которых одна из фаз находится в дисперсном состоянии. Дисперсная фаза – диспергирована до малых размеров. Дисперсионная среда – сплошная непрерывная фаза в которой распределены частицы дисперсной фазы. Важнейшая особенность дисперсных систем - наличие огромной суммарной поверхности раздела между фазами. Межфазная граница раздела обладает избытком свободной энергии (свободной поверхностной энергией).
 Поверхностные явления - явления и процессы, которые протекают на поверхности раздела фаз и приводят к снижению избытка свободной поверхностной энергии. Коллоидная химия - это учение о свойствах веществ в дисперсном состоянии и поверхностных явлениях в дисперсных системах (или физикохимия дисперсных систем и поверхностных явлений) (П. А. Ребиндер). Признаки ДС - гетерогенность и дисперсность. Дисперсность – степень раздробленности. Дисперсность D = 1/d (м-1), где d - поперечный размер частицы. В случае сферических частиц d – диаметр. Удельная поверхность - суммарная поверхность дисперсной фазы к их суммарной массе m: Sуд=S/m, м 2/кг.
Поверхностные явления - явления и процессы, которые протекают на поверхности раздела фаз и приводят к снижению избытка свободной поверхностной энергии. Коллоидная химия - это учение о свойствах веществ в дисперсном состоянии и поверхностных явлениях в дисперсных системах (или физикохимия дисперсных систем и поверхностных явлений) (П. А. Ребиндер). Признаки ДС - гетерогенность и дисперсность. Дисперсность – степень раздробленности. Дисперсность D = 1/d (м-1), где d - поперечный размер частицы. В случае сферических частиц d – диаметр. Удельная поверхность - суммарная поверхность дисперсной фазы к их суммарной массе m: Sуд=S/m, м 2/кг.
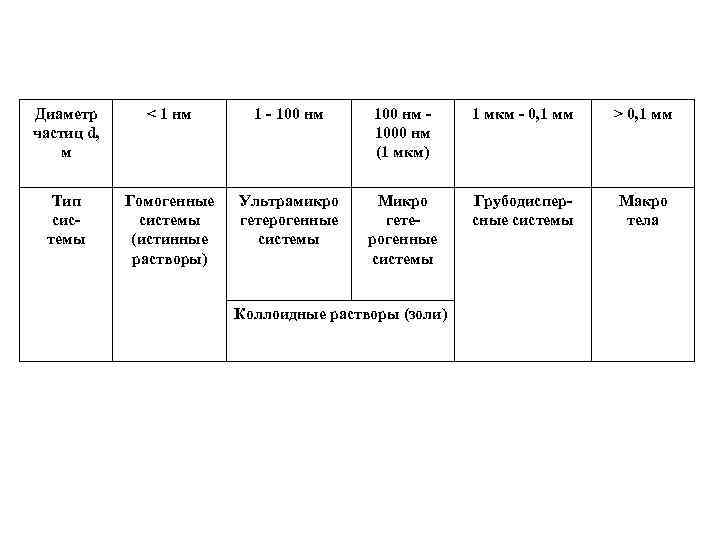 Диаметр частиц d, м < 1 нм 1 - 100 нм 1000 нм (1 мкм) 1 мкм - 0, 1 мм > 0, 1 мм Тип системы Гомогенные системы (истинные растворы) Ультрамикро гетерогенные системы Микро гетерогенные системы Грубодисперсные системы Макро тела Коллоидные растворы (золи)
Диаметр частиц d, м < 1 нм 1 - 100 нм 1000 нм (1 мкм) 1 мкм - 0, 1 мм > 0, 1 мм Тип системы Гомогенные системы (истинные растворы) Ультрамикро гетерогенные системы Микро гетерогенные системы Грубодисперсные системы Макро тела Коллоидные растворы (золи)
 Нижняя граница коллоидных размеров (~1 нм) обусловлена тем, что при дальнейшем дроблении утрачивается гетерогенность (переход к истинным растворам). Верхняя граница коллоидных размеров определяется качественным изменением молекулярно-кинетических свойств при переходе к грубодисперсным системам утрачивается свойственная коллоидным растворам способность к броуновскому движению частиц.
Нижняя граница коллоидных размеров (~1 нм) обусловлена тем, что при дальнейшем дроблении утрачивается гетерогенность (переход к истинным растворам). Верхняя граница коллоидных размеров определяется качественным изменением молекулярно-кинетических свойств при переходе к грубодисперсным системам утрачивается свойственная коллоидным растворам способность к броуновскому движению частиц.
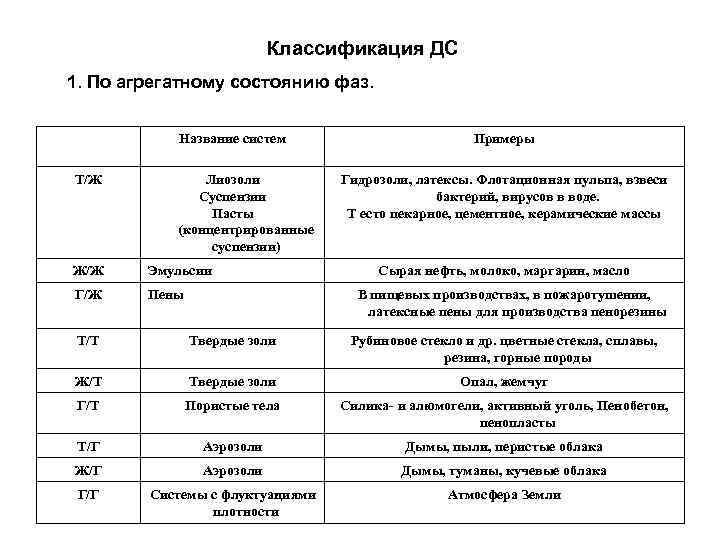 Классификация ДС 1. По агрегатному состоянию фаз. Название систем Т/Ж Лиозоли Суспензии Пасты (концентри ованные р суспензии) Ж/Ж Эмульсии Г/Ж Пены Примеры Гидрозоли, латексы. Флотационная пульпа, взвеси бактерий, вирусов в воде. Т есто пекарное, цементное, керамические массы Сырая нефть, молоко, маргарин, масло В пищевых производствах, в пожаротушении, латексные пены для производства пенорезины Т/Т Твердые золи Рубиновое стекло и др. цветные стекла, сплавы, резина, горные породы Ж/Т Твердые золи Опал, жемчуг Г/Т Пористые тела Силика- и алюмогели, активный уголь, Пенобетон, пенопласты Т/Г Аэрозоли Дымы, пыли, перистые облака Ж/Г Аэрозоли Дымы, туманы, кучевые облака Г/Г Системы с флуктуа иями ц плотности Атмосфера Земли
Классификация ДС 1. По агрегатному состоянию фаз. Название систем Т/Ж Лиозоли Суспензии Пасты (концентри ованные р суспензии) Ж/Ж Эмульсии Г/Ж Пены Примеры Гидрозоли, латексы. Флотационная пульпа, взвеси бактерий, вирусов в воде. Т есто пекарное, цементное, керамические массы Сырая нефть, молоко, маргарин, масло В пищевых производствах, в пожаротушении, латексные пены для производства пенорезины Т/Т Твердые золи Рубиновое стекло и др. цветные стекла, сплавы, резина, горные породы Ж/Т Твердые золи Опал, жемчуг Г/Т Пористые тела Силика- и алюмогели, активный уголь, Пенобетон, пенопласты Т/Г Аэрозоли Дымы, пыли, перистые облака Ж/Г Аэрозоли Дымы, туманы, кучевые облака Г/Г Системы с флуктуа иями ц плотности Атмосфера Земли
 2. По характеру межмолекулярного взаимодействия на границе раздела фаз ДС. Лиофобные системы. Весьма слабое межмолекулярное взаимодействие ДФ с ДС. Межмолекулярные силы сильно не скомпенсированы на поверхности раздела фаз. Поверхностная энергия велика, σ имеет высокое значение (σ >> 0). Такие системы не могут возникать самопроизвольно, они термодинамически неустойчивы, находятся в метастабильном состоянии, требуют специальной стабилизации. Лиофильные системы. Характеризуются сильным межмолекулярным взаимодействием между ДФ и ДС и весьма низким значением свободной поверхностной энергии (σ→ 0), при их образовании ΔG < 0, т. е. они способны образовываться в результате самопроизвольного диспергирования, являются термодинамически устойчивыми.
2. По характеру межмолекулярного взаимодействия на границе раздела фаз ДС. Лиофобные системы. Весьма слабое межмолекулярное взаимодействие ДФ с ДС. Межмолекулярные силы сильно не скомпенсированы на поверхности раздела фаз. Поверхностная энергия велика, σ имеет высокое значение (σ >> 0). Такие системы не могут возникать самопроизвольно, они термодинамически неустойчивы, находятся в метастабильном состоянии, требуют специальной стабилизации. Лиофильные системы. Характеризуются сильным межмолекулярным взаимодействием между ДФ и ДС и весьма низким значением свободной поверхностной энергии (σ→ 0), при их образовании ΔG < 0, т. е. они способны образовываться в результате самопроизвольного диспергирования, являются термодинамически устойчивыми.
 3. По структуре (концентрации) дисперсные системы Свободнодисперсные системы. Частицы не связаны между собой, совершают броуновское движение независимо друг от друга. Ведут себя как вязкие жидкости (лиозоли), газы (аэрозоли). Связнодисперсные системы. Частицы связаны друг с другом (обычно за счет межмолекулярных, иногда химических сил), образуя пространственную сетку, в ячейках которой удерживается дисперсионная среда. Гели, студни.
3. По структуре (концентрации) дисперсные системы Свободнодисперсные системы. Частицы не связаны между собой, совершают броуновское движение независимо друг от друга. Ведут себя как вязкие жидкости (лиозоли), газы (аэрозоли). Связнодисперсные системы. Частицы связаны друг с другом (обычно за счет межмолекулярных, иногда химических сил), образуя пространственную сетку, в ячейках которой удерживается дисперсионная среда. Гели, студни.
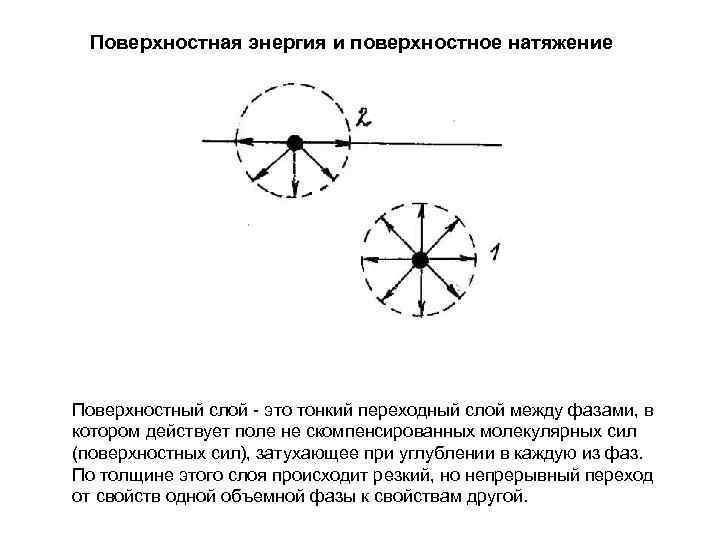 Поверхностная энергия и поверхностное натяжение Поверхностный слой это тонкий переходный слой между фазами, в котором действует поле не скомпенсированных молекулярных сил (поверхностных сил), затухающее при углублении в каждую из фаз. По толщине этого слоя происходит резкий, но непрерывный переход от свойств одной объемной фазы к свойствам другой.
Поверхностная энергия и поверхностное натяжение Поверхностный слой это тонкий переходный слой между фазами, в котором действует поле не скомпенсированных молекулярных сил (поверхностных сил), затухающее при углублении в каждую из фаз. По толщине этого слоя происходит резкий, но непрерывный переход от свойств одной объемной фазы к свойствам другой.
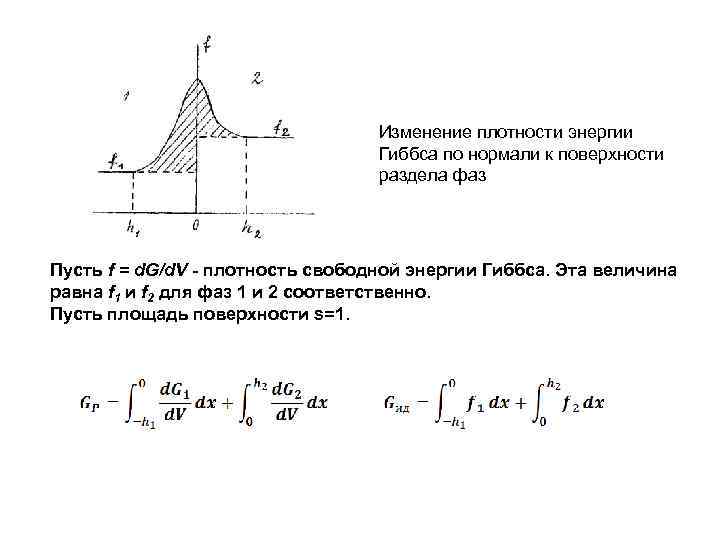 Изменение плотности энергии Гиббса по нормали к поверхности раздела фаз Пусть f = d. G/d. V - плотность свободной энергии Гиббса. Эта величина равна f 1 и f 2 для фаз 1 и 2 соответственно. Пусть площадь поверхности s=1.
Изменение плотности энергии Гиббса по нормали к поверхности раздела фаз Пусть f = d. G/d. V - плотность свободной энергии Гиббса. Эта величина равна f 1 и f 2 для фаз 1 и 2 соответственно. Пусть площадь поверхности s=1.
 Разность между ними (G(s) )представляет собой свободную поверхностную энергию гетерогенной системы, отнесенную к единице площади поверхности. G(s) удельная свободная поверхностная энергиия, она равна площади заштрихованной области Общая свободная энергия дисперсной системы с учетом поверхност ной энергии должна рассчитываться как сумма энергий смежных объемных фаз плюс свободная поверхностная энергия Gs: G = G 1 + G 2 + Gs. Gs = σs.
Разность между ними (G(s) )представляет собой свободную поверхностную энергию гетерогенной системы, отнесенную к единице площади поверхности. G(s) удельная свободная поверхностная энергиия, она равна площади заштрихованной области Общая свободная энергия дисперсной системы с учетом поверхност ной энергии должна рассчитываться как сумма энергий смежных объемных фаз плюс свободная поверхностная энергия Gs: G = G 1 + G 2 + Gs. Gs = σs.
 Поверхностное натяжение Наличие на поверхности избытка энергии означает, что для образования новой поверхности требуется совершить работу. Изменение поверхности на ds приводит к приращению энергии Гиббса на d. G: d. G = σds. Коэффициент пропорциональности σ называется поверхностным натяжением. Отсюда σ = (d. G/ds)P, T. Если совершается только полезная работа (образование поверхности), то работа равна δA = - d. G = - σds. Из последних двух выражений следует, что поверхностное натяжение σ - это работа обратимого процесса образования единицы межфазной поверхности. Для чистых индивидуальных жидкостей она численно равна удельной свободной поверхностной энергии.
Поверхностное натяжение Наличие на поверхности избытка энергии означает, что для образования новой поверхности требуется совершить работу. Изменение поверхности на ds приводит к приращению энергии Гиббса на d. G: d. G = σds. Коэффициент пропорциональности σ называется поверхностным натяжением. Отсюда σ = (d. G/ds)P, T. Если совершается только полезная работа (образование поверхности), то работа равна δA = - d. G = - σds. Из последних двух выражений следует, что поверхностное натяжение σ - это работа обратимого процесса образования единицы межфазной поверхности. Для чистых индивидуальных жидкостей она численно равна удельной свободной поверхностной энергии.
 G - энергия Гиббса; S - энтропия; Т - температура; V - объем; р - давление; σ - поверхностное натяжение; s — площадь поверхности; μi - химический потенциал компонента i; n - число молей компонента i; φ - электрический потенциал; q — количество электричества. Возможные процессы превращения поверхностной энергии; а) в энергию Гиббса; б) в теплоту; в) в механическую энергию; г) в химическую энергию; д) в электрическую энергию.
G - энергия Гиббса; S - энтропия; Т - температура; V - объем; р - давление; σ - поверхностное натяжение; s — площадь поверхности; μi - химический потенциал компонента i; n - число молей компонента i; φ - электрический потенциал; q — количество электричества. Возможные процессы превращения поверхностной энергии; а) в энергию Гиббса; б) в теплоту; в) в механическую энергию; г) в химическую энергию; д) в электрическую энергию.
 Опыт Дюпре Действием силы F + d. F растянем пленку на бесконечно малую величину dh. Совершена работа δА = -Fdh, в результате чего свободная энергия пленки возросла на величину численно равную совершенной работе d. G = σds = σ2 ldh, Т. к. d. G = -δА, то Fdh = σ2 ldh и, следовательно, σ = F/2 l. Поверхностное натяжение численно равно силе σ, сокращающей поверхность и отнесенной к единице длины контура, ограничивающего поверхность.
Опыт Дюпре Действием силы F + d. F растянем пленку на бесконечно малую величину dh. Совершена работа δА = -Fdh, в результате чего свободная энергия пленки возросла на величину численно равную совершенной работе d. G = σds = σ2 ldh, Т. к. d. G = -δА, то Fdh = σ2 ldh и, следовательно, σ = F/2 l. Поверхностное натяжение численно равно силе σ, сокращающей поверхность и отнесенной к единице длины контура, ограничивающего поверхность.
 Размерности σ в обоих случаях совпадают: Дж/м 2 = Н • м/м 2 = Н/м. Оба определения поверхностного натяжения (энергетическое и силовое) эквивалентны, их численные значения совпадают.
Размерности σ в обоих случаях совпадают: Дж/м 2 = Н • м/м 2 = Н/м. Оба определения поверхностного натяжения (энергетическое и силовое) эквивалентны, их численные значения совпадают.
 Факторы, влияющие на поверхностное натяжение
Факторы, влияющие на поверхностное натяжение


