Коллоидная химия.ppt
- Количество слайдов: 66
 Коллоидная химия - наука о дисперсных системах и поверхностных явлениях. Объектами современной коллоидной химии служат дисперсные системы.
Коллоидная химия - наука о дисперсных системах и поверхностных явлениях. Объектами современной коллоидной химии служат дисперсные системы.
 Основные термины и понятия • Дисперсная система • Фаза • Дисперсная фаза • Дисперсионная среда • Раздробленность • Гетерогенность • Классификация
Основные термины и понятия • Дисперсная система • Фаза • Дисперсная фаза • Дисперсионная среда • Раздробленность • Гетерогенность • Классификация
 Роль дисперсных систем • Они окружают нас всюду. Земля, по которой мы ходим, и которая • нас кормит, состоит из отдельных частиц. Земная атмосфера и разнообразные водоемы, почва и космическая пыль, облака и гранит, дерево и одежда, строительные материалы, продукты питания - хлеб, молоко, мясо, масло, рыба, сахар др. - дисперсные системы. Да и сам человек состоит из частиц, образующих кровь, кости и ткани, которые являются сложными дисперсными системами. Поэтому не без основания известный ученыйколлоидник И. И. Жуков отмечал, что «человек-ходячий коллоид» . Пожалуй, нет ни одной сферы деятельности человека, которая в той или иной мере не связана c многочисленными дисперсными системами.
Роль дисперсных систем • Они окружают нас всюду. Земля, по которой мы ходим, и которая • нас кормит, состоит из отдельных частиц. Земная атмосфера и разнообразные водоемы, почва и космическая пыль, облака и гранит, дерево и одежда, строительные материалы, продукты питания - хлеб, молоко, мясо, масло, рыба, сахар др. - дисперсные системы. Да и сам человек состоит из частиц, образующих кровь, кости и ткани, которые являются сложными дисперсными системами. Поэтому не без основания известный ученыйколлоидник И. И. Жуков отмечал, что «человек-ходячий коллоид» . Пожалуй, нет ни одной сферы деятельности человека, которая в той или иной мере не связана c многочисленными дисперсными системами.
 Классификация • Kлассификация дисперсных систем в • зависимости от агрегатного состояния дисперсной фазы и дисперсионной среды Kлассификация дисперспых систем в зависимости от размеров частиц дисперсной фазы
Классификация • Kлассификация дисперсных систем в • зависимости от агрегатного состояния дисперсной фазы и дисперсионной среды Kлассификация дисперспых систем в зависимости от размеров частиц дисперсной фазы
 Особенности дисперсных систем в связи с раздробленностью дисперсной фазы • Большая удельная поверхность (В удел. ) • Избыток поверхностной энергии Дополнительный избыток поверхностной энергии на выпуклой поверхности
Особенности дисперсных систем в связи с раздробленностью дисперсной фазы • Большая удельная поверхность (В удел. ) • Избыток поверхностной энергии Дополнительный избыток поверхностной энергии на выпуклой поверхности
 Возмoжность самопроизвольного процесса для дисперсных систём характеризуется изменением энергии Гиббса ∆G. • Стремление поверхностной энергии к снижению выражается изменением энергии Гиббса, которое равно ∆G ≤ σ∆B + B∆σ • поверхностная энергия дисперсной системы зависит от поверхностного натяжения, эквивалентного удельной поверхностной энергии, и суммарной поверхности раздела между дисперсной фазой и дисперсионной средой.
Возмoжность самопроизвольного процесса для дисперсных систём характеризуется изменением энергии Гиббса ∆G. • Стремление поверхностной энергии к снижению выражается изменением энергии Гиббса, которое равно ∆G ≤ σ∆B + B∆σ • поверхностная энергия дисперсной системы зависит от поверхностного натяжения, эквивалентного удельной поверхностной энергии, и суммарной поверхности раздела между дисперсной фазой и дисперсионной средой.
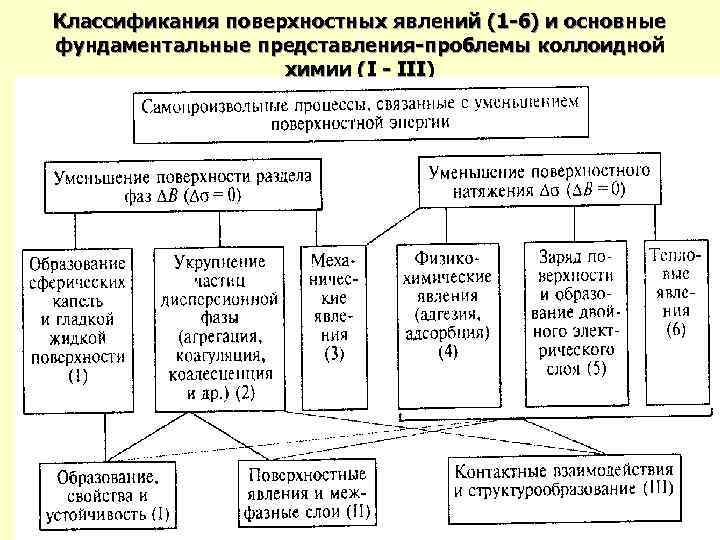 Классификания поверхностных явлений (1 -6) и основные фундаментальные представления-пpоблемы коллоидной химии (I - III)
Классификания поверхностных явлений (1 -6) и основные фундаментальные представления-пpоблемы коллоидной химии (I - III)
 Стремление к снижению площади раздела фаз проявляется в самопроизвольном укрупнении частиц дисперсной фазы. Слипание частиц твердой дисперсной фазы ведет к образованию агрегатов. Чем мельче частицы, тем интенсивнее они стремятся к укрупнению.
Стремление к снижению площади раздела фаз проявляется в самопроизвольном укрупнении частиц дисперсной фазы. Слипание частиц твердой дисперсной фазы ведет к образованию агрегатов. Чем мельче частицы, тем интенсивнее они стремятся к укрупнению.
 Относительно крупные частицы пшена и риса обычно не слипаются. В сравнительно высокодисперсных системах, например в растворимом кофе, какао, муке и др. , наблюдается образование агрегатов и даже комков, состоящих из большого числа частиц. Процесс укрупнения твердых частиц в жидкой среде называют коагуляцией.
Относительно крупные частицы пшена и риса обычно не слипаются. В сравнительно высокодисперсных системах, например в растворимом кофе, какао, муке и др. , наблюдается образование агрегатов и даже комков, состоящих из большого числа частиц. Процесс укрупнения твердых частиц в жидкой среде называют коагуляцией.
 Для дисперсных систем, y которых дисперсной фазой является жидкость, при определенных условиях (в частности, при отсутствии граничных слоев, препятствующих взаимодействию капель) может происходить слияние капель. Процесс слияния капель, укрупнение капель называют коалесценцией.
Для дисперсных систем, y которых дисперсной фазой является жидкость, при определенных условиях (в частности, при отсутствии граничных слоев, препятствующих взаимодействию капель) может происходить слияние капель. Процесс слияния капель, укрупнение капель называют коалесценцией.
 • В результате коалесценции образуются капли, размер котоpых больше исходных, a величина поверхностной энергии снижается. Укрупнение капель идет самопроизвольно, причем их поверхность стремится к минимальному значению.
• В результате коалесценции образуются капли, размер котоpых больше исходных, a величина поверхностной энергии снижается. Укрупнение капель идет самопроизвольно, причем их поверхность стремится к минимальному значению.
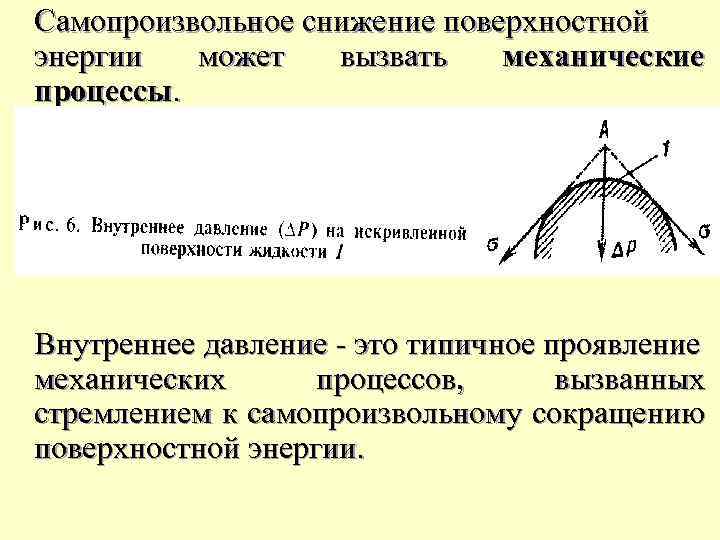 Самопроизвольное снижение поверхностной энеpгии может вызвать механические процессы. Внутреннее давление - это типичное проявление механических процессов, вызванных стремлением к самопроизвольному сокращению поверхностной энергии.
Самопроизвольное снижение поверхностной энеpгии может вызвать механические процессы. Внутреннее давление - это типичное проявление механических процессов, вызванных стремлением к самопроизвольному сокращению поверхностной энергии.
 Внутреннее давленое капли воды диаметром 1 мкм составляет oколо 3 атм (3*105 Па). Чем меньше размеры капель и выше поверхностное натяжение, тем интенсивнее внутреннее давление и ближе формa капель к сферической даже в условиях земного тяготения. Форма небольших капель росы и относительно крупных капель ртути-тому подтверждение.
Внутреннее давленое капли воды диаметром 1 мкм составляет oколо 3 атм (3*105 Па). Чем меньше размеры капель и выше поверхностное натяжение, тем интенсивнее внутреннее давление и ближе формa капель к сферической даже в условиях земного тяготения. Форма небольших капель росы и относительно крупных капель ртути-тому подтверждение.
 На границе между дисперсной фазой и дисперсионной средой могут происходить такие физико-химические явления, как адгезия и адсорбция. Адсорбция и адгезия идут самопроизвольно и обусловлены снижением поверхностного нaтяжения.
На границе между дисперсной фазой и дисперсионной средой могут происходить такие физико-химические явления, как адгезия и адсорбция. Адсорбция и адгезия идут самопроизвольно и обусловлены снижением поверхностного нaтяжения.
 «Адгезия» в переводе с лат. означает прилипание. АДГЕЗИЕЙ называют взаимодействие разнородных конденсированных тел при их молекулярном контакте, для нарушения которого необходимо внешнее воздействие. К конденсированным телам относятся жидкость и твердые вещества.
«Адгезия» в переводе с лат. означает прилипание. АДГЕЗИЕЙ называют взаимодействие разнородных конденсированных тел при их молекулярном контакте, для нарушения которого необходимо внешнее воздействие. К конденсированным телам относятся жидкость и твердые вещества.
 Она относится к поверхностным явлениям и характерна для любых дисперсных систем: Т-Т, Ж-Ж, Ж-Т. ПРИМЕРЫ: оседающие из воздуха частицы пыли закрепляются на любой поверхности; капли дождя, впитывающиеся одеждой; загрязнение кочегаров, шахтеров углем, сажей; автослесарей маслом, бензином; крашение твердой поверхности краской.
Она относится к поверхностным явлениям и характерна для любых дисперсных систем: Т-Т, Ж-Ж, Ж-Т. ПРИМЕРЫ: оседающие из воздуха частицы пыли закрепляются на любой поверхности; капли дождя, впитывающиеся одеждой; загрязнение кочегаров, шахтеров углем, сажей; автослесарей маслом, бензином; крашение твердой поверхности краской.
 Адгезионное взаимодействие возникает при непосредственном контакте двух тел, когда расстояние между ними становится соизмеримым с молекулярным. Между телами возникает химическая связь. Величина этого взаимодействия определяется свойствами контактирующих поверхностей: их энергетической неоднородностью, наличием реакционно способных групп молекул.
Адгезионное взаимодействие возникает при непосредственном контакте двух тел, когда расстояние между ними становится соизмеримым с молекулярным. Между телами возникает химическая связь. Величина этого взаимодействия определяется свойствами контактирующих поверхностей: их энергетической неоднородностью, наличием реакционно способных групп молекул.
 ПРИМЕРЫ: биоклей термита – вязкая структурированная масса, прижимается насекомыми к поверхности с усилием 1, 4 кг/см 2 (или 1, 4∙ 105 Па); синтетические клеи, адгезия которых соизмерима с прочностью стали – 200 -300 кг/см 2 (200 -300∙ 105 Па).
ПРИМЕРЫ: биоклей термита – вязкая структурированная масса, прижимается насекомыми к поверхности с усилием 1, 4 кг/см 2 (или 1, 4∙ 105 Па); синтетические клеи, адгезия которых соизмерима с прочностью стали – 200 -300 кг/см 2 (200 -300∙ 105 Па).
 Адгезия и смачивание – это две стороны одного и того же явления, возникающего при взаимодействии Ж с Т. Краевой угол определяет способность твердых тел смачиваться. По величине краевого угла все поверхности, контактирующие с Н 2 О, принято делить на две группы. Если θ от 0 до 90◦, то поверхности гидрофильные; если θ >90 ~180◦, то гидрофобные. Примеры: капля воды на стекле и фторопласте.
Адгезия и смачивание – это две стороны одного и того же явления, возникающего при взаимодействии Ж с Т. Краевой угол определяет способность твердых тел смачиваться. По величине краевого угла все поверхности, контактирующие с Н 2 О, принято делить на две группы. Если θ от 0 до 90◦, то поверхности гидрофильные; если θ >90 ~180◦, то гидрофобные. Примеры: капля воды на стекле и фторопласте.
 АДСОРБЦИЕЙ называют концентрирование (сгущение) газообразных или растворенных веществ на поверхности раздела фаз. Адсорбирующееся вещество является адсорбатом, адсорбирующее вещество – адсорбентом.
АДСОРБЦИЕЙ называют концентрирование (сгущение) газообразных или растворенных веществ на поверхности раздела фаз. Адсорбирующееся вещество является адсорбатом, адсорбирующее вещество – адсорбентом.
 ПРИМЕРЫ: очистка, осушка, разделение газов; очистка растительных масел от красящих веществ с помощью бентонитовых глин (процесс отбеливания масел); очистка и осветление воды; закрепление молекул красок на тканях; восприятие человеком запаха и вкуса зависит от адсорбции молекул соответствующих веществ в носовой полости и на языке.
ПРИМЕРЫ: очистка, осушка, разделение газов; очистка растительных масел от красящих веществ с помощью бентонитовых глин (процесс отбеливания масел); очистка и осветление воды; закрепление молекул красок на тканях; восприятие человеком запаха и вкуса зависит от адсорбции молекул соответствующих веществ в носовой полости и на языке.
 Химический потенциал ∆µ Погашение избытка поверхностного натяжения обусловлено неодинаковым значением химического потенциала вещества в объёме и на поверхности. Химический потенциал определяет влияние какого-либо компонента на свойства системы, зависящие от количества этого компонента. Например, ∆G = G 2 – G 1. Хим. потенциал является фактором интенсивности любого физико-химического процесса.
Химический потенциал ∆µ Погашение избытка поверхностного натяжения обусловлено неодинаковым значением химического потенциала вещества в объёме и на поверхности. Химический потенциал определяет влияние какого-либо компонента на свойства системы, зависящие от количества этого компонента. Например, ∆G = G 2 – G 1. Хим. потенциал является фактором интенсивности любого физико-химического процесса.
 Химический потенциал ∆µ В случае адсорбции ∆µ = (µ 2 - µ 1) ≤ 0. Величина адсорбции Г равна избыточному количеству адсорбата, поглощенного адсорбентом. [Моль/ м 2], [Моль/ кг]
Химический потенциал ∆µ В случае адсорбции ∆µ = (µ 2 - µ 1) ≤ 0. Величина адсорбции Г равна избыточному количеству адсорбата, поглощенного адсорбентом. [Моль/ м 2], [Моль/ кг]
 Химический потенциал ∆µ Фундаментальное уравнение адсорбции Гиббса. Г = -dσ/dµ. Оно справедливо для всех видов адсорбции и показывает, что при адсорбции происходит снижение поверхностного натяжения по мере изменения µ. Только ∆µ может вызвать адсорбцию. Г положительная, а ∆µ отрицательная величины. Адсорбция означает концентрирование адсорбата и обуславливает ∆µ. Все величины взаимосвязаны. Г = f (с, σ, Т)
Химический потенциал ∆µ Фундаментальное уравнение адсорбции Гиббса. Г = -dσ/dµ. Оно справедливо для всех видов адсорбции и показывает, что при адсорбции происходит снижение поверхностного натяжения по мере изменения µ. Только ∆µ может вызвать адсорбцию. Г положительная, а ∆µ отрицательная величины. Адсорбция означает концентрирование адсорбата и обуславливает ∆µ. Все величины взаимосвязаны. Г = f (с, σ, Т)
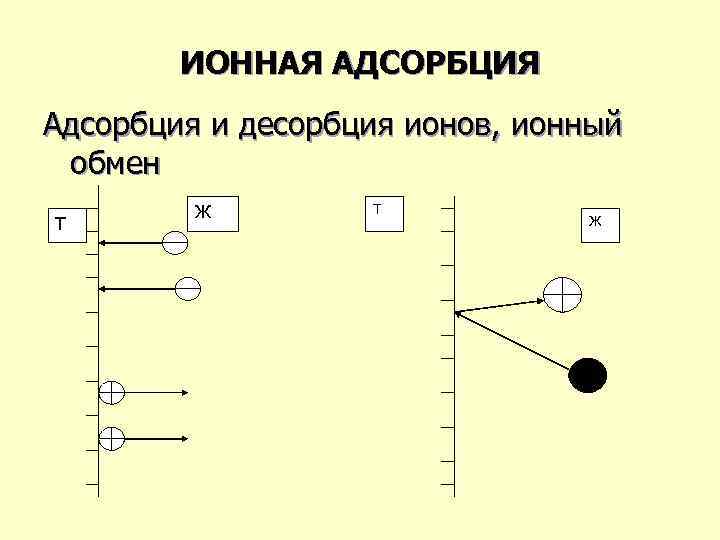 ИОННАЯ АДСОРБЦИЯ Адсорбция и десорбция ионов, ионный обмен Т Ж
ИОННАЯ АДСОРБЦИЯ Адсорбция и десорбция ионов, ионный обмен Т Ж
 Ионообменная адсорбция. Ионный обмен – это обратимый процесс эквивалентного (стехиометрического) обмена ионами между раствором электролита и твердым телом, которое является ионитом. И. О. связан с адсорбцией ионов из раствора электролита на твердой поверхности, и десорбцией ионов из твердой поверхности в раствор.
Ионообменная адсорбция. Ионный обмен – это обратимый процесс эквивалентного (стехиометрического) обмена ионами между раствором электролита и твердым телом, которое является ионитом. И. О. связан с адсорбцией ионов из раствора электролита на твердой поверхности, и десорбцией ионов из твердой поверхности в раствор.
 Ионообменная адсорбция. С И. О. мы сталкиваемся ежедневно, порой не подозревая этого. Питание растений. Восстановление плодородия почв. Обессоливание природной и водопроводной воды (устранение жесткости воды). Формирование рудных месторождений. Ионы тяжелых металлов выносятся гидротермальными водами из глубины на поверхность земли, затем они поглощаются алюмосиликатными породами, ионы легких металлов переходят в раствор.
Ионообменная адсорбция. С И. О. мы сталкиваемся ежедневно, порой не подозревая этого. Питание растений. Восстановление плодородия почв. Обессоливание природной и водопроводной воды (устранение жесткости воды). Формирование рудных месторождений. Ионы тяжелых металлов выносятся гидротермальными водами из глубины на поверхность земли, затем они поглощаются алюмосиликатными породами, ионы легких металлов переходят в раствор.
 ИОНИТЫ Ионит состоит из матрицы, которая обладает собственным зарядом, и ионами, способными к обмену. По знаку обменивающихся ионов различают катиониты и аниониты. Каt содержат Kt+ обменивающиеся с катионитами (катионы H, Na, K, Ca, Mg), матрица несет отрицательный заряд. Aниониты обмен анионами (ОН-, Cl-, SO 42 -), матрица несет положительный заряд.
ИОНИТЫ Ионит состоит из матрицы, которая обладает собственным зарядом, и ионами, способными к обмену. По знаку обменивающихся ионов различают катиониты и аниониты. Каt содержат Kt+ обменивающиеся с катионитами (катионы H, Na, K, Ca, Mg), матрица несет отрицательный заряд. Aниониты обмен анионами (ОН-, Cl-, SO 42 -), матрица несет положительный заряд.
![ИОНИТЫ Обозначим матрицу [ ] Типичные реакции: катионного обмена: Ка+[An]- + P+ = P+[An]- ИОНИТЫ Обозначим матрицу [ ] Типичные реакции: катионного обмена: Ка+[An]- + P+ = P+[An]-](https://present5.com/presentation/3/8047698_143293546.pdf-img/8047698_143293546.pdf-29.jpg) ИОНИТЫ Обозначим матрицу [ ] Типичные реакции: катионного обмена: Ка+[An]- + P+ = P+[An]- + Ка+ анионного обмена: [Ка+]An- + P- = [Ка+]P- + An-
ИОНИТЫ Обозначим матрицу [ ] Типичные реакции: катионного обмена: Ка+[An]- + P+ = P+[An]- + Ка+ анионного обмена: [Ка+]An- + P- = [Ка+]P- + An-
 МОДЕЛЬ МАТРИЦЫ КАТИОНИТА 1 – каркас, включающий фиксированные ионы одного знака. 2 – фиксированный анион. 3 – подвижный катион.
МОДЕЛЬ МАТРИЦЫ КАТИОНИТА 1 – каркас, включающий фиксированные ионы одного знака. 2 – фиксированный анион. 3 – подвижный катион.
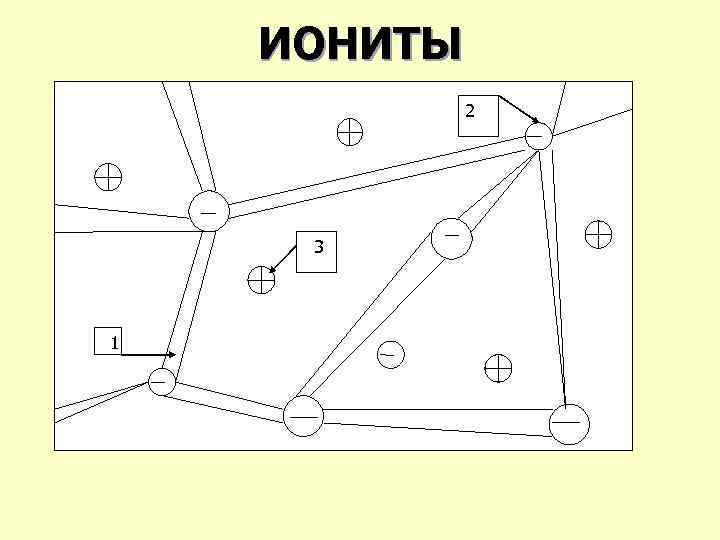 ИОНИТЫ 2 33 11
ИОНИТЫ 2 33 11
 ПРИМЕРЫ ПРИМЕНЕНИЯ Различают синтетические и природные иониты. К природным относятся почва, алюмосиликаты (глина, гидрослюда, цеолиты), а к синтетическим – ионообменные смолы, сульфированные угли (сульфоуголь), ионообменные целлюлозы.
ПРИМЕРЫ ПРИМЕНЕНИЯ Различают синтетические и природные иониты. К природным относятся почва, алюмосиликаты (глина, гидрослюда, цеолиты), а к синтетическим – ионообменные смолы, сульфированные угли (сульфоуголь), ионообменные целлюлозы.
 ПРИМЕРЫ ПРИМЕНЕНИЯ Почва – коллоидная почва – почвенный поглощающий комплекс. Составной частью являются высокодисперсные частицы от 0, 001 до 0, 2 мкм.
ПРИМЕРЫ ПРИМЕНЕНИЯ Почва – коллоидная почва – почвенный поглощающий комплекс. Составной частью являются высокодисперсные частицы от 0, 001 до 0, 2 мкм.
![Примеры применения Почвенный комплекс Ca 2+[An]2 - + 2 H+ --------H 2+[An]2 - + Примеры применения Почвенный комплекс Ca 2+[An]2 - + 2 H+ --------H 2+[An]2 - +](https://present5.com/presentation/3/8047698_143293546.pdf-img/8047698_143293546.pdf-34.jpg) Примеры применения Почвенный комплекс Ca 2+[An]2 - + 2 H+ --------H 2+[An]2 - + Ca 2+ Растение
Примеры применения Почвенный комплекс Ca 2+[An]2 - + 2 H+ --------H 2+[An]2 - + Ca 2+ Растение
 При контакте конденсированных тел стремление к уменьшению поверхностнoго натяжения может вызвать oпределенную ориентацию молекул, ионов и электронов в поверхностном слое. Следствием такой ориентации может оказaться возникновение электpического зaрядa поверхности частиц, образование двойного электрического слоя и протекание обусловленных этим слоем процессов.
При контакте конденсированных тел стремление к уменьшению поверхностнoго натяжения может вызвать oпределенную ориентацию молекул, ионов и электронов в поверхностном слое. Следствием такой ориентации может оказaться возникновение электpического зaрядa поверхности частиц, образование двойного электрического слоя и протекание обусловленных этим слоем процессов.
 Электрокинетические явления Э. Я. Возникают при действии электрополя на дисперсные системы и в результате относительного перемещения дисперсной фазы и дисперсионной среды. Например, электрофорез и электроосмос. Несмотря на различия, все Э. Я. связаны с наличием ДЭС (двойного электрического слоя) и определяются величиной ζ (дзэта) – потенциала, который называют электрокинетическим.
Электрокинетические явления Э. Я. Возникают при действии электрополя на дисперсные системы и в результате относительного перемещения дисперсной фазы и дисперсионной среды. Например, электрофорез и электроосмос. Несмотря на различия, все Э. Я. связаны с наличием ДЭС (двойного электрического слоя) и определяются величиной ζ (дзэта) – потенциала, который называют электрокинетическим.
 ЭЛЕКТРОКИНЕТИЧЕСКИЕ ЯВЛЕНИЯ ДЭС представляет собой своеобразный конденсатор, обкладки которого состоят из противоположных зарядов. Структура ДЭС определяется природой твердого тела: строением кристаллов, присутствием окисной пленки для металлов и неметаллов, т. е. неравномерностей поверхностей. Примеры: Электрокардиограмма – биопотенциалы, снятые с поверхности тела и характеризующие состояние сердца.
ЭЛЕКТРОКИНЕТИЧЕСКИЕ ЯВЛЕНИЯ ДЭС представляет собой своеобразный конденсатор, обкладки которого состоят из противоположных зарядов. Структура ДЭС определяется природой твердого тела: строением кристаллов, присутствием окисной пленки для металлов и неметаллов, т. е. неравномерностей поверхностей. Примеры: Электрокардиограмма – биопотенциалы, снятые с поверхности тела и характеризующие состояние сердца.
 Дзета – потенциал определяет возможность и интенсивность движения фазы и среды. ζ = 0 – полная компенсация зарядов потенциалобразующего слоя ионов изоэлектрическая точка. В точке 0 Э. Я. не наблюдаются. ζ в Э. Я. обычно не более 100 м. В. Чем больше электрокинетический потенциал и напряженность внешнего электрополя, тем интенсивнее Э. Я.
Дзета – потенциал определяет возможность и интенсивность движения фазы и среды. ζ = 0 – полная компенсация зарядов потенциалобразующего слоя ионов изоэлектрическая точка. В точке 0 Э. Я. не наблюдаются. ζ в Э. Я. обычно не более 100 м. В. Чем больше электрокинетический потенциал и напряженность внешнего электрополя, тем интенсивнее Э. Я.
 Причины возникновения ДЭС 1. На любой твердой поверхности при её контакте с жидкостью возникает избыточный электрозаряд (+ или -). 2. Этот заряд компенсируется находящимися в жидкой фазе ионами противоположного знака (противоионами). 3. Образование ДЭС происходит самопроизвольно по принципу минимума энергии. Избыточный заряд возникает 1) ионная адсорбция (осадок соли в воде – хим. реакция), поверхностная ионизация (стекло в воде), 3) ориентация полярных молекул в поверхностном слое (уголь в воде).
Причины возникновения ДЭС 1. На любой твердой поверхности при её контакте с жидкостью возникает избыточный электрозаряд (+ или -). 2. Этот заряд компенсируется находящимися в жидкой фазе ионами противоположного знака (противоионами). 3. Образование ДЭС происходит самопроизвольно по принципу минимума энергии. Избыточный заряд возникает 1) ионная адсорбция (осадок соли в воде – хим. реакция), поверхностная ионизация (стекло в воде), 3) ориентация полярных молекул в поверхностном слое (уголь в воде).
 ДЭС ДЛЯ ПЛОСКОЙ И СФЕРИЧЕСКОЙ ПОВЕРХНОСТЕЙ 1. Потенциалобразующие ионы. 2. Противоионы в адсорбционном слое. 3. Противоионы в диффузном слое. А – А граница скольжения. δ (дельта) – толщина адсорбционного слоя. λ (лямбда) – толщина диффузного слоя.
ДЭС ДЛЯ ПЛОСКОЙ И СФЕРИЧЕСКОЙ ПОВЕРХНОСТЕЙ 1. Потенциалобразующие ионы. 2. Противоионы в адсорбционном слое. 3. Противоионы в диффузном слое. А – А граница скольжения. δ (дельта) – толщина адсорбционного слоя. λ (лямбда) – толщина диффузного слоя.
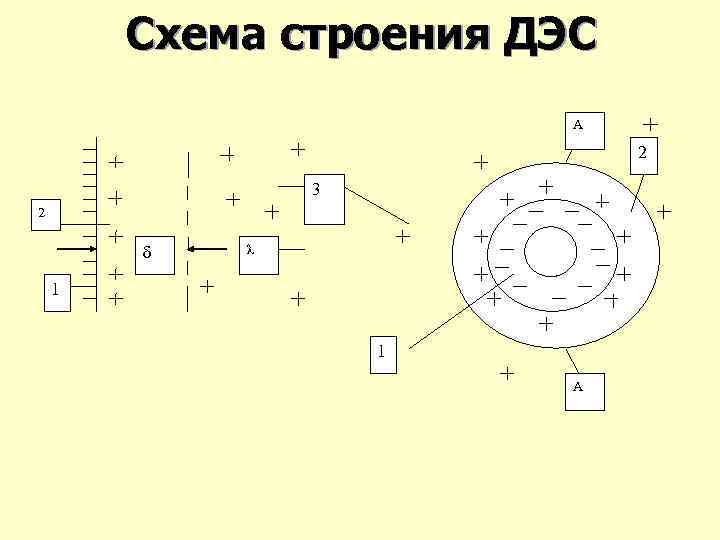 Схема строения ДЭС А 2 3 2 δ λ 1 1 А
Схема строения ДЭС А 2 3 2 δ λ 1 1 А
 Золи (коллоидные р-ры) – высокодисперсные системы с жидкой дисперсионной средой, размер частиц фазы 10 -7 – 10 -5. Если фаза не взаимодействует со средой, т. е. не растворяется в ней , то золи называют лиофобные. Многие важные свойства золей (устойчивость) объясняются возникновением на поверхности ДЭС. Пример, гидрофобный золь хлорида железа в воде. Кристаллик вместе с прочно удерживаемыми на его поверхности ионами адсорбционного слоя – коллоидная частица. Кристаллик нерастворимого вещества, окруженный ДЭС – мицелла. Мицелла электронейтральна.
Золи (коллоидные р-ры) – высокодисперсные системы с жидкой дисперсионной средой, размер частиц фазы 10 -7 – 10 -5. Если фаза не взаимодействует со средой, т. е. не растворяется в ней , то золи называют лиофобные. Многие важные свойства золей (устойчивость) объясняются возникновением на поверхности ДЭС. Пример, гидрофобный золь хлорида железа в воде. Кристаллик вместе с прочно удерживаемыми на его поверхности ионами адсорбционного слоя – коллоидная частица. Кристаллик нерастворимого вещества, окруженный ДЭС – мицелла. Мицелла электронейтральна.
 Для ионной адсорбции характерны особенности: 1. Химическое взаимодействие между молекулами адсорбента и частицами адсорбтива (кинетическая необратимость процесса). 2. Адсорбция - избирательный процесс. 3. Образование ДЭС. 4. Ионная адсорбция – обменная адсорбция. Влияние на И. А. : полярность адсорбента, хим. природа адсорбтива (чем больше кристаллический R иона, тем больше его поляризуемость, тем больше адсорбция - 1), заряд адсорбтива – 2.
Для ионной адсорбции характерны особенности: 1. Химическое взаимодействие между молекулами адсорбента и частицами адсорбтива (кинетическая необратимость процесса). 2. Адсорбция - избирательный процесс. 3. Образование ДЭС. 4. Ионная адсорбция – обменная адсорбция. Влияние на И. А. : полярность адсорбента, хим. природа адсорбтива (чем больше кристаллический R иона, тем больше его поляризуемость, тем больше адсорбция - 1), заряд адсорбтива – 2.
 Cl-
Cl-
 Хроматография – метод разделения, анализа и физико-химического исследования веществ, основанный на распределении вещества между двумя фазами неподвижной и подвижной. Неподвижная фаза – сорбент с развитой поверхностью, а подвижная (элюент) – проток газа или жидкости. Различают газовую, жидкостную; колоночную и плоскослойную (бумажная и тонкослойная). Универсальность метода – разделения практически всех веществ в макро- и микроколичествах.
Хроматография – метод разделения, анализа и физико-химического исследования веществ, основанный на распределении вещества между двумя фазами неподвижной и подвижной. Неподвижная фаза – сорбент с развитой поверхностью, а подвижная (элюент) – проток газа или жидкости. Различают газовую, жидкостную; колоночную и плоскослойную (бумажная и тонкослойная). Универсальность метода – разделения практически всех веществ в макро- и микроколичествах.
 ЭЛЕКТРОФОРЕЗ Электрофорез – это перемещение под действием электрополя неэлектропроводных частиц дисперсной фазы относительно дисперсионной среды.
ЭЛЕКТРОФОРЕЗ Электрофорез – это перемещение под действием электрополя неэлектропроводных частиц дисперсной фазы относительно дисперсионной среды.
 ПРИМЕРЫ Рекламные подвижные щиты, спортивные табло. Под действием электротока заряженные частицы пигмента (белые или цветные) перемещаются в любом из элементов устройства и воспроизводят буквы, цифры и другие изображения в клетках панели. Подобное движение используют для нанесения покрытий, получения, например, прорезиненных тканей. В качестве медицинской процедуры в организме улучшается кровообращение, ликвидируются воспалительные процессы, уменьшаются боли, восстанавливаются поврежденные ткани. Можно выделить необходимый продукт, провести очистку вещества от примесей и ряд других процессов.
ПРИМЕРЫ Рекламные подвижные щиты, спортивные табло. Под действием электротока заряженные частицы пигмента (белые или цветные) перемещаются в любом из элементов устройства и воспроизводят буквы, цифры и другие изображения в клетках панели. Подобное движение используют для нанесения покрытий, получения, например, прорезиненных тканей. В качестве медицинской процедуры в организме улучшается кровообращение, ликвидируются воспалительные процессы, уменьшаются боли, восстанавливаются поврежденные ткани. Можно выделить необходимый продукт, провести очистку вещества от примесей и ряд других процессов.
 ЭЛЕКТРООСМОС Электроосмос – это перемещение дисперсионной среды под действием внешнего электрического поля. Примеры: обезвоживание древесины (сушка), грунта, строительных материалов, продуктов питания.
ЭЛЕКТРООСМОС Электроосмос – это перемещение дисперсионной среды под действием внешнего электрического поля. Примеры: обезвоживание древесины (сушка), грунта, строительных материалов, продуктов питания.
 Вторая группа Э. Я. – потенциал седиментации и потенциал течения. В результате движения дисперсной фазы и дисперсионной среды возникает разность потенциалов. Седиментация – процесс, в котором частицы дисперсной фазы под действием гравитации оседают. Потенциал седиментации обратен электрофорезу.
Вторая группа Э. Я. – потенциал седиментации и потенциал течения. В результате движения дисперсной фазы и дисперсионной среды возникает разность потенциалов. Седиментация – процесс, в котором частицы дисперсной фазы под действием гравитации оседают. Потенциал седиментации обратен электрофорезу.
 Потенциал течения обратен электроосмосу. Примеры – работа насоса, сердца, движение крови по кровеносной системе, давление воздуха и т. д. П. Т. – причина искрового разряда и взрыва при транспортировании нефти по трубопроводам в случае их плохого заземления (примеси в нефти).
Потенциал течения обратен электроосмосу. Примеры – работа насоса, сердца, движение крови по кровеносной системе, давление воздуха и т. д. П. Т. – причина искрового разряда и взрыва при транспортировании нефти по трубопроводам в случае их плохого заземления (примеси в нефти).
 ДЭС и П. Т. возникает на любой границе раздела фаз. По этой причине наливать бензин в полиэтиленовую емкость крайне опасно. При освобождении канистры возникает П. Т. , который может вызвать искру и воспламенить бензин. Работа датчиков, регистрирующих сейсмические колебания и взрывы, основана на принципе П. Т.
ДЭС и П. Т. возникает на любой границе раздела фаз. По этой причине наливать бензин в полиэтиленовую емкость крайне опасно. При освобождении канистры возникает П. Т. , который может вызвать искру и воспламенить бензин. Работа датчиков, регистрирующих сейсмические колебания и взрывы, основана на принципе П. Т.
 Поверхностно – активные вещества 1. 2. 3. Адсорбция на границе жидкий раствор – газ есть концентрирование растворенного в жидкости вещества на поверхности раздела жидкого раствора и газа. Особенности таких систем: Поверхность Ж равноценна для адсорбции, так как однородна. Молекулы растворенного вещества не закреплены на определенных участках поверхности и могут свободно передвигаться. Силы взаимодействия между молекулами газа малы и ими можно пренебречь.
Поверхностно – активные вещества 1. 2. 3. Адсорбция на границе жидкий раствор – газ есть концентрирование растворенного в жидкости вещества на поверхности раздела жидкого раствора и газа. Особенности таких систем: Поверхность Ж равноценна для адсорбции, так как однородна. Молекулы растворенного вещества не закреплены на определенных участках поверхности и могут свободно передвигаться. Силы взаимодействия между молекулами газа малы и ими можно пренебречь.
 Поверхностное натяжение (σ) равно обратимой изотермической работе, которую надо совершить, чтобы увеличить площадь межфазной поверхности на единицу. Величина адсорбции Г = -dσ/dс. Если dσ/dс < 0 (при увеличении концентрации раствора происходит уменьшение поверхностного натяжения), то Г > 0. Растворенные вещества способные снижать поверхностное натяжение растворов, называют поверхностно – активными веществами (ПАВ).
Поверхностное натяжение (σ) равно обратимой изотермической работе, которую надо совершить, чтобы увеличить площадь межфазной поверхности на единицу. Величина адсорбции Г = -dσ/dс. Если dσ/dс < 0 (при увеличении концентрации раствора происходит уменьшение поверхностного натяжения), то Г > 0. Растворенные вещества способные снижать поверхностное натяжение растворов, называют поверхностно – активными веществами (ПАВ).
 ПАВ: спирты, жирные кислоты и их соли, амины – вещества имеющие дифильное строение, т. е. полярную часть (функциональную группу) и неполярную часть (углеводородный радикал). Карбоксильная (-СООН) карбонильная (-С=О) амино (-NH 2) -SH -CNS -CN -SO 3 H
ПАВ: спирты, жирные кислоты и их соли, амины – вещества имеющие дифильное строение, т. е. полярную часть (функциональную группу) и неполярную часть (углеводородный радикал). Карбоксильная (-СООН) карбонильная (-С=О) амино (-NH 2) -SH -CNS -CN -SO 3 H
 ПАВ по отношению к воде менее полярны. µ(Н 2 О) = 1, 84 D; µ(С 2 Н 6 О) = 1, 7 D. Значит, молекулы ПАВ взаимодействуют с молекулами воды слабее, чем молекулы воды между собой. Полярные молекулы воды взаимодействуют с полярными группами ПАВ, а неполярные части ПАВ стараются вытолкнуть на поверхность, что приводит к снижению интенсивности силового поля и снижению σ.
ПАВ по отношению к воде менее полярны. µ(Н 2 О) = 1, 84 D; µ(С 2 Н 6 О) = 1, 7 D. Значит, молекулы ПАВ взаимодействуют с молекулами воды слабее, чем молекулы воды между собой. Полярные молекулы воды взаимодействуют с полярными группами ПАВ, а неполярные части ПАВ стараются вытолкнуть на поверхность, что приводит к снижению интенсивности силового поля и снижению σ.
 Если dσ/dс > 0 (при увеличении концентрации раствора происходит увеличение поверхностного натяжения), то Г < 0. Вещества, повышающие поверхностное натяжение, называют поверхностно – инактивные веществами (ПИВ). Примеры: сильные электролиты. Ионы, образующиеся при диссоциации, взаимодействуют с молекулами воды сильнее, чем молекулы воды между собой. Поэтому значительная часть ионов увлекается молекулами воды в объём раствора. Оставшиеся на поверхности раствора ионы создают силовое поле и повышают σ.
Если dσ/dс > 0 (при увеличении концентрации раствора происходит увеличение поверхностного натяжения), то Г < 0. Вещества, повышающие поверхностное натяжение, называют поверхностно – инактивные веществами (ПИВ). Примеры: сильные электролиты. Ионы, образующиеся при диссоциации, взаимодействуют с молекулами воды сильнее, чем молекулы воды между собой. Поэтому значительная часть ионов увлекается молекулами воды в объём раствора. Оставшиеся на поверхности раствора ионы создают силовое поле и повышают σ.
 Вещества, растворение которых не приводит к изменению σ, называют поверхностно – неактивными веществами (ПНВ). Примеры: органические вещества – сахароза (С 12 Н 22 О 11), глюкоза. Зависимость поверхностного натяжения от концентрации раствора при постоянной температуре называют изотермой поверхностного натяжения.
Вещества, растворение которых не приводит к изменению σ, называют поверхностно – неактивными веществами (ПНВ). Примеры: органические вещества – сахароза (С 12 Н 22 О 11), глюкоза. Зависимость поверхностного натяжения от концентрации раствора при постоянной температуре называют изотермой поверхностного натяжения.
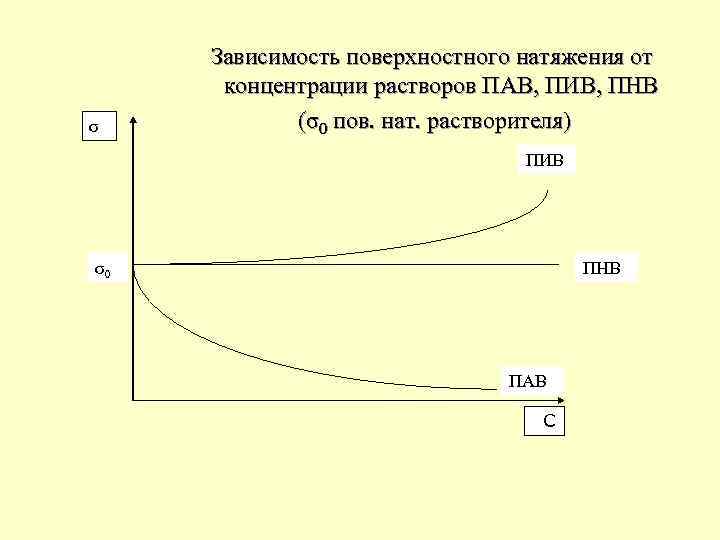 σ Зависимость поверхностного натяжения от концентрации растворов ПАВ, ПИВ, ПНВ (σ0 пов. нат. растворителя) ПИВ σ0 ПНВ ПАВ СС
σ Зависимость поверхностного натяжения от концентрации растворов ПАВ, ПИВ, ПНВ (σ0 пов. нат. растворителя) ПИВ σ0 ПНВ ПАВ СС
 Растворы коллоидных ПАВ Коллоидные ПАВ – это вещества, которые не только снижают σ на границе раздела фаз, но при определённых концентрациях способны к самопроизвольному мицеллобразованию, т. е. образованию новой фазы. Особенность – длина углеводородного радикала. Низкомолекулярные спирты, амины и органические кислоты (до С ~ 8) – истинные растворы (чай с сахаром). При удлинении цепи ПАВ образуют агрегаты из десятков и сотен молекул ПАВ (мицеллы).
Растворы коллоидных ПАВ Коллоидные ПАВ – это вещества, которые не только снижают σ на границе раздела фаз, но при определённых концентрациях способны к самопроизвольному мицеллобразованию, т. е. образованию новой фазы. Особенность – длина углеводородного радикала. Низкомолекулярные спирты, амины и органические кислоты (до С ~ 8) – истинные растворы (чай с сахаром). При удлинении цепи ПАВ образуют агрегаты из десятков и сотен молекул ПАВ (мицеллы).
 Особенности коллоидных ПАВ – дисперсность и гетерогенность – лиофильные коллоидные ПАВ. Концентрация ПАВ в растворе, при которой истинный раствор ПАВ переходит в коллоидный, называют критической концентрацией мицеллобразования (ККМ). Применение: мыла, синтетические моющие средства, танниды, эмульгаторы, стабилизаторы и т. д.
Особенности коллоидных ПАВ – дисперсность и гетерогенность – лиофильные коллоидные ПАВ. Концентрация ПАВ в растворе, при которой истинный раствор ПАВ переходит в коллоидный, называют критической концентрацией мицеллобразования (ККМ). Применение: мыла, синтетические моющие средства, танниды, эмульгаторы, стабилизаторы и т. д.
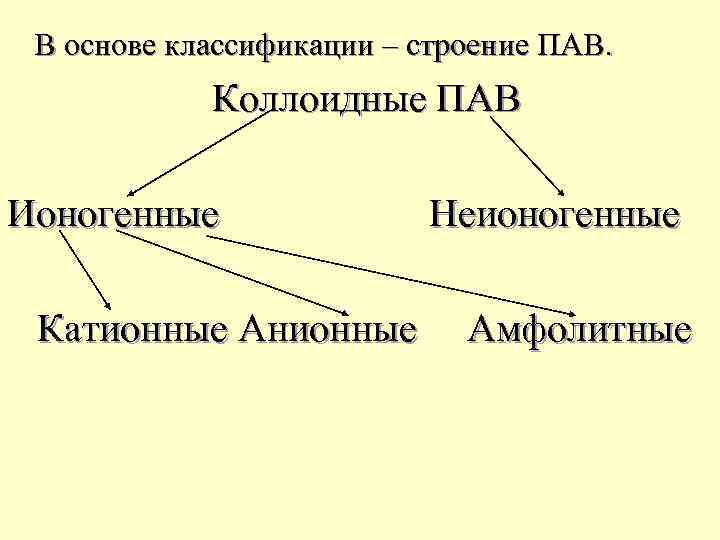 В основе классификации – строение ПАВ. Коллоидные ПАВ Ионогенные Катионные Анионные Неионогенные Амфолитные
В основе классификации – строение ПАВ. Коллоидные ПАВ Ионогенные Катионные Анионные Неионогенные Амфолитные
 Ионогенные ПАВ в растворе диссоциируют на ионы. Анионные ПАВ – поверхностно – активный анион. Na и K – соли высших жирных карбоновых кислот (олеат, стеарат). Синтетические Аn. ПАВ – акилсульфаты, алкилсульфонаты (додецилсульфат натрия – С 12 Н 25 OSO 3 Na). Катионные ПАВ – соли первичных, вторичных, третичных аминов (октадециламмонийхлорид – [C 18 H 37 NH 3]+Cl-).
Ионогенные ПАВ в растворе диссоциируют на ионы. Анионные ПАВ – поверхностно – активный анион. Na и K – соли высших жирных карбоновых кислот (олеат, стеарат). Синтетические Аn. ПАВ – акилсульфаты, алкилсульфонаты (додецилсульфат натрия – С 12 Н 25 OSO 3 Na). Катионные ПАВ – соли первичных, вторичных, третичных аминов (октадециламмонийхлорид – [C 18 H 37 NH 3]+Cl-).
 Амфолитные ПАВ содержат одновременно как кислотные, так и основные функциональные группы, и в зависимости от среды проявляющие свойства как кислотных, так и основных ПАВ (аминокислоты). Неионогенные ПАВ не распадаются на ионы. Результат взаимодействия окиси этилена со спиртами, фенолами, карбоновыми кислотами. R C 6 H 4 O ( CH 2 O )n H
Амфолитные ПАВ содержат одновременно как кислотные, так и основные функциональные группы, и в зависимости от среды проявляющие свойства как кислотных, так и основных ПАВ (аминокислоты). Неионогенные ПАВ не распадаются на ионы. Результат взаимодействия окиси этилена со спиртами, фенолами, карбоновыми кислотами. R C 6 H 4 O ( CH 2 O )n H
 Моющее действие коллоидных ПАВ – это совокупность коллоидно – химических процессов, приводящих к удалению загрязнений с различных поверхностей и удержанию этих загрязнений в растворе.
Моющее действие коллоидных ПАВ – это совокупность коллоидно – химических процессов, приводящих к удалению загрязнений с различных поверхностей и удержанию этих загрязнений в растворе.
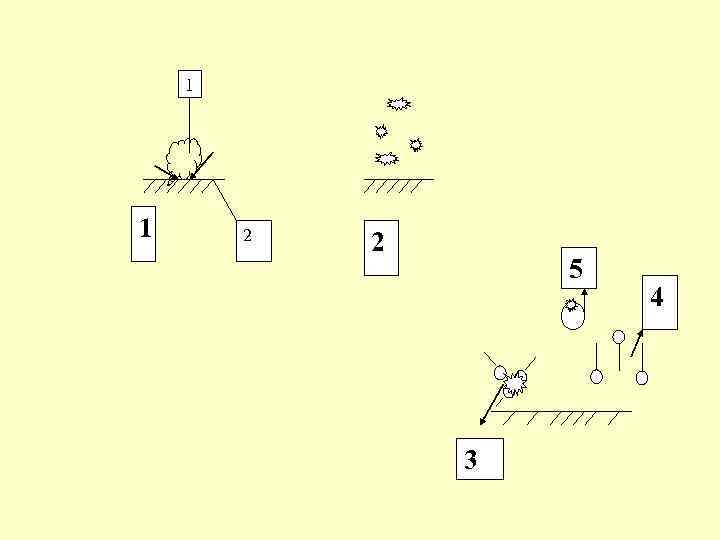
 Стадии: 1. смачивание (1 – обрабатываемая поверхность, 2 – частицы загрязнений) 2. отрыв частиц загрязнений и их дробление (пептизация) 3. удержание загрязнения в растворе за счет суспендирования или эмульгирования 4. солюбилизация 5. пенообразования и флотации
Стадии: 1. смачивание (1 – обрабатываемая поверхность, 2 – частицы загрязнений) 2. отрыв частиц загрязнений и их дробление (пептизация) 3. удержание загрязнения в растворе за счет суспендирования или эмульгирования 4. солюбилизация 5. пенообразования и флотации
 1 1 2 2 5 3 4
1 1 2 2 5 3 4


