lektsia_1_-_1_kurs.pptx
- Количество слайдов: 36

Коллоидная химия лектор Соболева Оксана Анатольевна доцент кафедры коллоидной химии Химического факультета МГУ
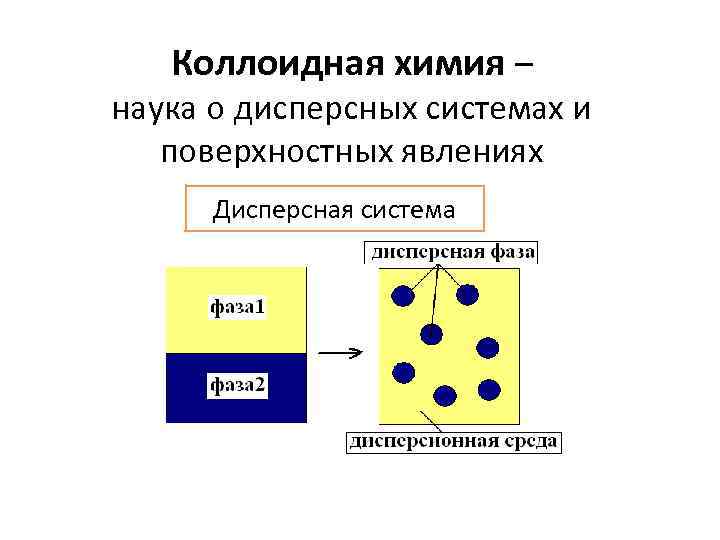
Коллоидная химия – наука о дисперсных системах и поверхностных явлениях Дисперсная система
![Классификация дисперсных систем 1. По дисперсности r – размер частиц дисперсной фазы, [м] высокодисперсные Классификация дисперсных систем 1. По дисперсности r – размер частиц дисперсной фазы, [м] высокодисперсные](https://present5.com/presentation/17579586_72954030/image-3.jpg)
Классификация дисперсных систем 1. По дисперсности r – размер частиц дисперсной фазы, [м] высокодисперсные 1 нм < r < 1 мкм Броуновское движение грубодисперсные 1 мкм < r < 1 мм Оседание частиц
![Sуд – удельная поверхность, [м 2/г] Sуд = S 12/m 2 Sуд – удельная поверхность, [м 2/г] Sуд = S 12/m 2](https://present5.com/presentation/17579586_72954030/image-4.jpg)
Sуд – удельная поверхность, [м 2/г] Sуд = S 12/m 2
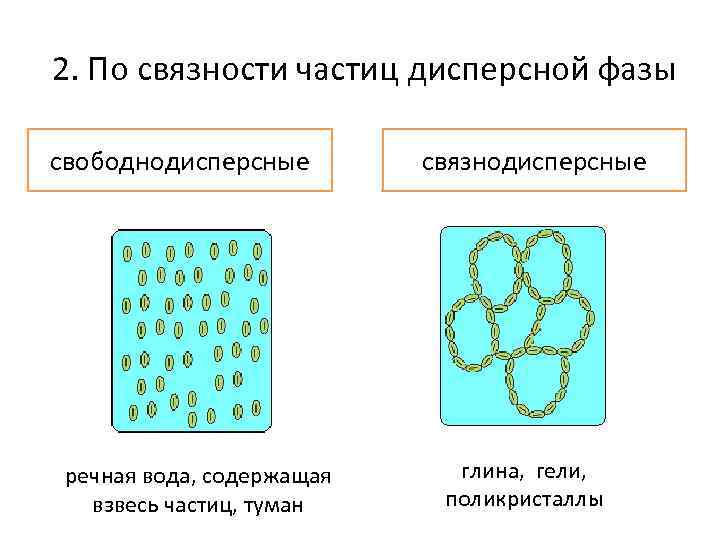
2. По связности частиц дисперсной фазы свободнодисперсные речная вода, содержащая взвесь частиц, туман связнодисперсные глина, гели, поликристаллы
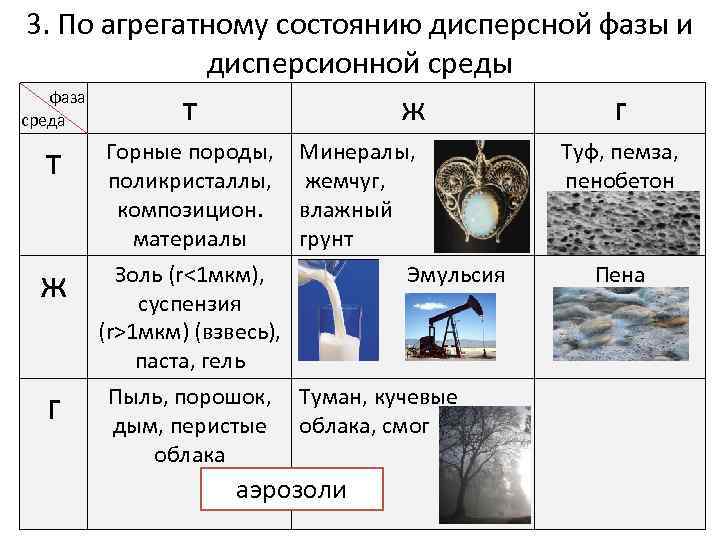
3. По агрегатному состоянию дисперсной фазы и дисперсионной среды фаза среда т т Горные породы, поликристаллы, композицион. материалы Золь (r<1 мкм), суспензия (r>1 мкм) (взвесь), паста, гель Пыль, порошок, дым, перистые облака ж г ж Минералы, жемчуг, влажный грунт Эмульсия Туман, кучевые облака, смог аэрозоли г Туф, пемза, пенобетон Пена
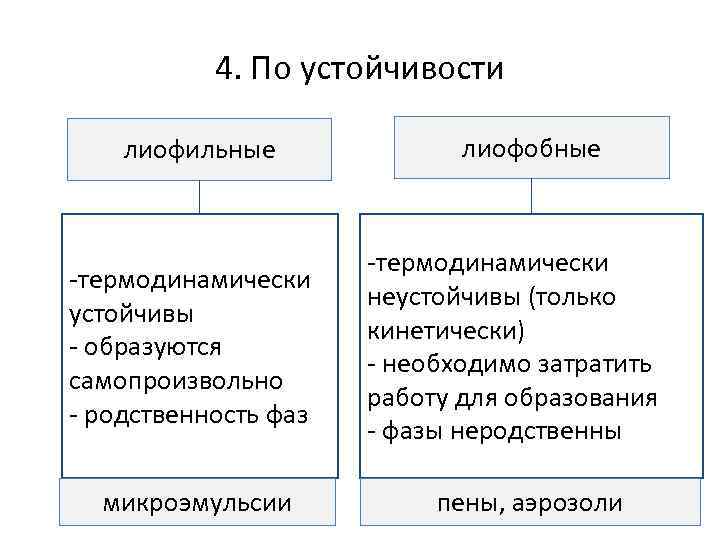
4. По устойчивости лиофильные -термодинамически устойчивы - образуются самопроизвольно - родственность фаз микроэмульсии лиофобные -термодинамически неустойчивы (только кинетически) - необходимо затратить работу для образования - фазы неродственны пены, аэрозоли
![Поверхностные явления ГАЗ (2) ЖИДКОСТЬ (1) σ = Fs/S 12 [Дж/м 2]– поверхностное натяжение Поверхностные явления ГАЗ (2) ЖИДКОСТЬ (1) σ = Fs/S 12 [Дж/м 2]– поверхностное натяжение](https://present5.com/presentation/17579586_72954030/image-8.jpg)
Поверхностные явления ГАЗ (2) ЖИДКОСТЬ (1) σ = Fs/S 12 [Дж/м 2]– поверхностное натяжение удельная свободная поверхностная энергия σ [Дж/м 2] – поверхностное натяжение - работа образования единицы площади поверхности в обратимом изотермическом процессе

![Поверхностное натяжение σ σ = f/2 d [Н/м] поверхностное натяжение - сила, действующая по Поверхностное натяжение σ σ = f/2 d [Н/м] поверхностное натяжение - сила, действующая по](https://present5.com/presentation/17579586_72954030/image-10.jpg)
Поверхностное натяжение σ σ = f/2 d [Н/м] поверхностное натяжение - сила, действующая по касательной к поверхности и стремящаяся сократить поверхность
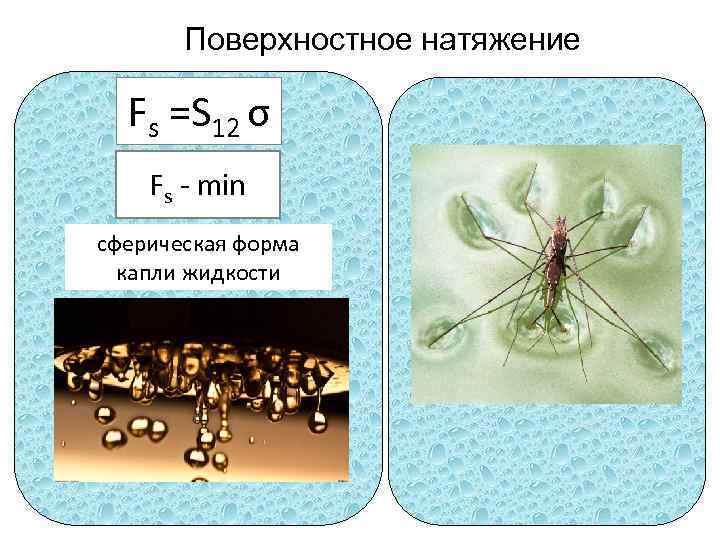
Поверхностное натяжение Fs =S 12 σ Fs - min сферическая форма капли жидкости
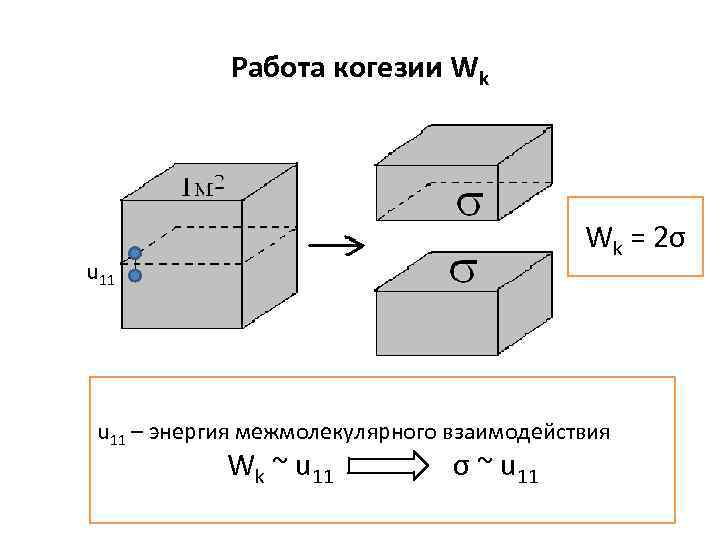
Работа когезии Wk Wk = 2σ u 11 – энергия межмолекулярного взаимодействия Wk ~ u 11 σ ~ u 11
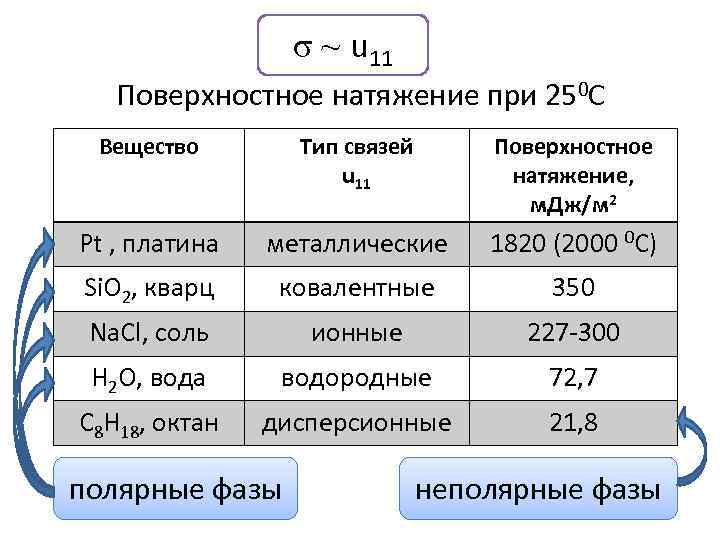
σ ~ u 11 Поверхностное натяжение при 250 С Вещество Тип связей u 11 Поверхностное натяжение, м. Дж/м 2 Pt , платина металлические 1820 (2000 0 C) Si. O 2, кварц ковалентные 350 Na. Cl, соль ионные 227 -300 H 2 O, вода водородные 72, 7 C 8 H 18, октан дисперсионные 21, 8 полярные фазы неполярные фазы
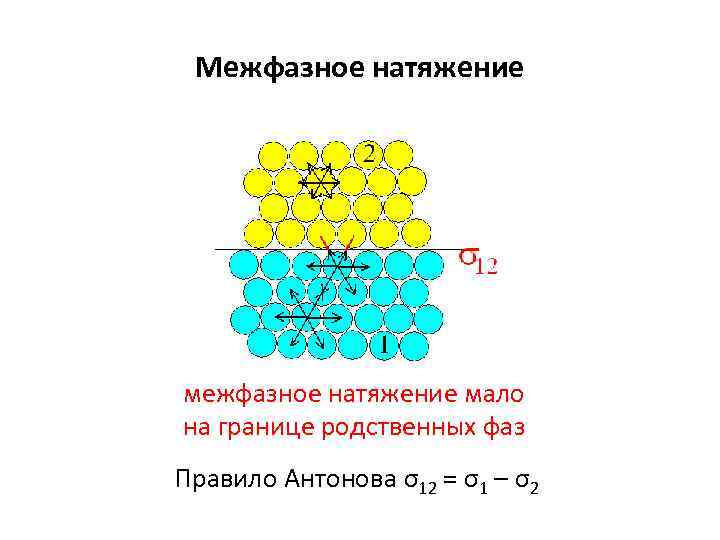
Межфазное натяжение мало на границе родственных фаз Правило Антонова σ12 = σ1 – σ2
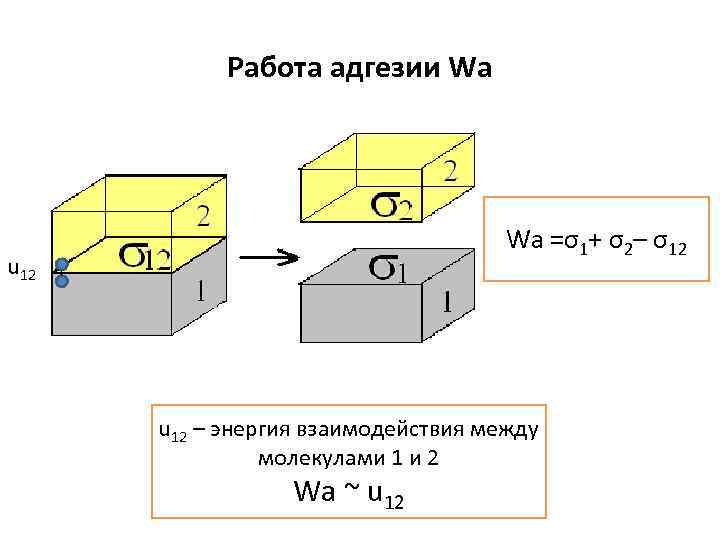
Работа адгезии Wa Wa =σ1+ σ2– σ12 u 12 – энергия взаимодействия между молекулами 1 и 2 Wa ~ u 12
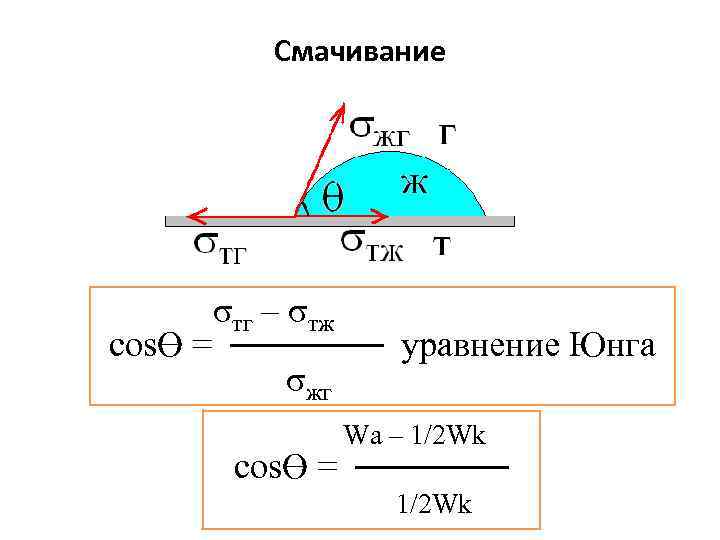
Смачивание σтг – σтж cosϴ = ────── уравнение Юнга σжг Wa – 1/2 Wk cosϴ = ────── 1/2 Wk
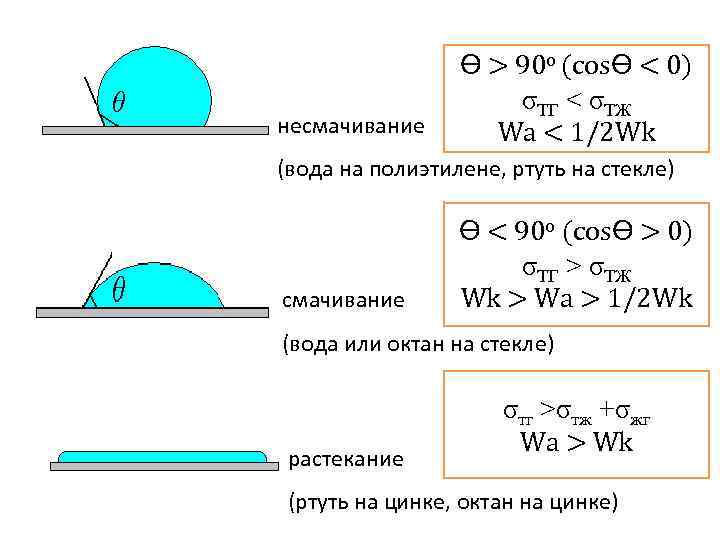
несмачивание ϴ > 90 o (cosϴ < 0) σТГ < σТЖ Wa < 1/2 Wk (вода на полиэтилене, ртуть на стекле) смачивание ϴ < 90 o (cosϴ > 0) σТГ > σТЖ Wk > Wa > 1/2 Wk (вода или октан на стекле) растекание σтг >σтж +σжг Wa > Wk (ртуть на цинке, октан на цинке)
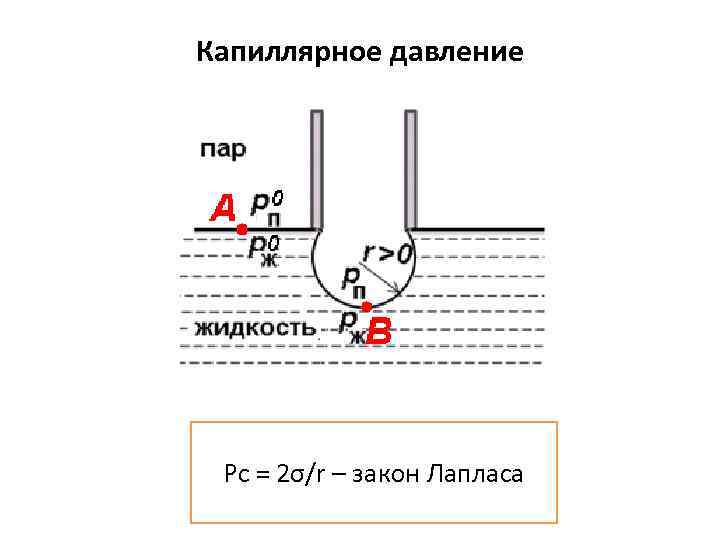
Капиллярное давление Рс = 2σ/r – закон Лапласа
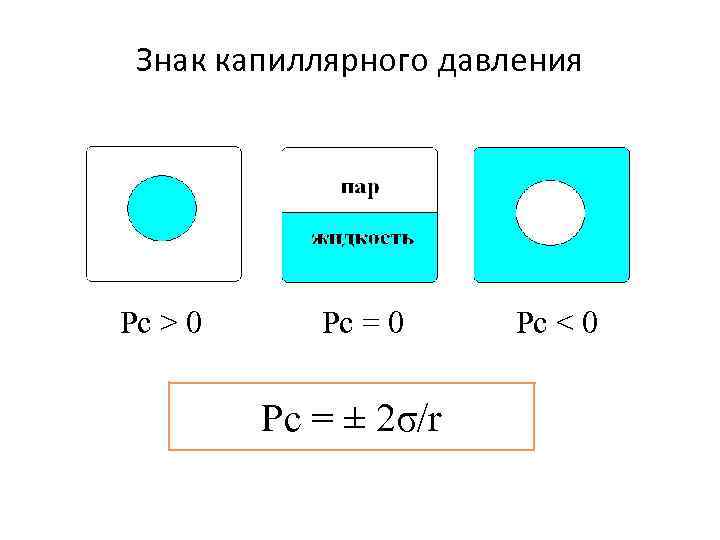
Знак капиллярного давления Pc > 0 Pc = 0 Рс = ± 2σ/r Pc < 0
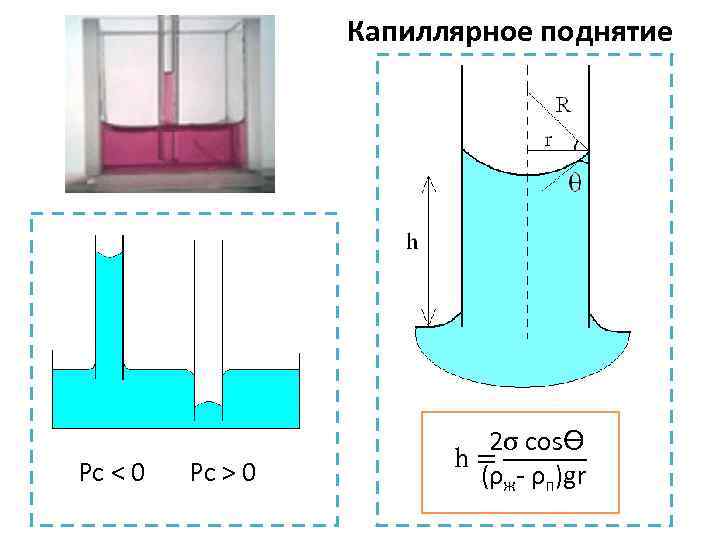
Капиллярное поднятие Pc < 0 Pc > 0 2σ cosϴ h = ────── (ρж- ρп)gr

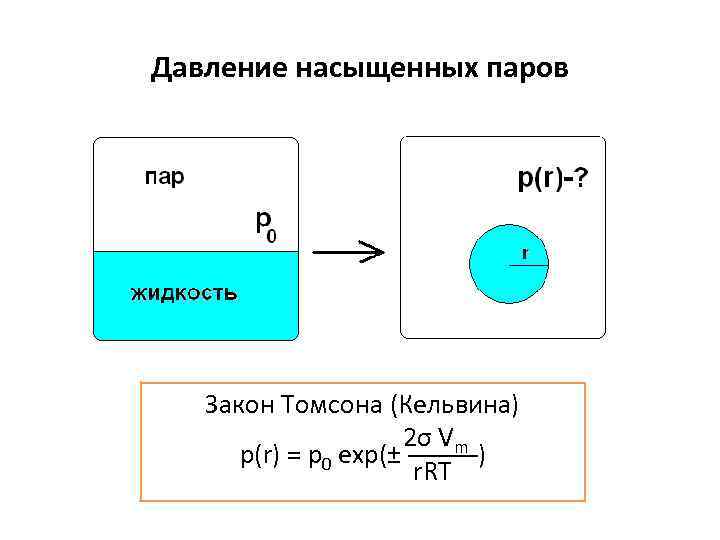
Давление насыщенных паров Закон Томсона (Кельвина) 2σ Vm p(r) = p 0 exp(± ─────) r. RT
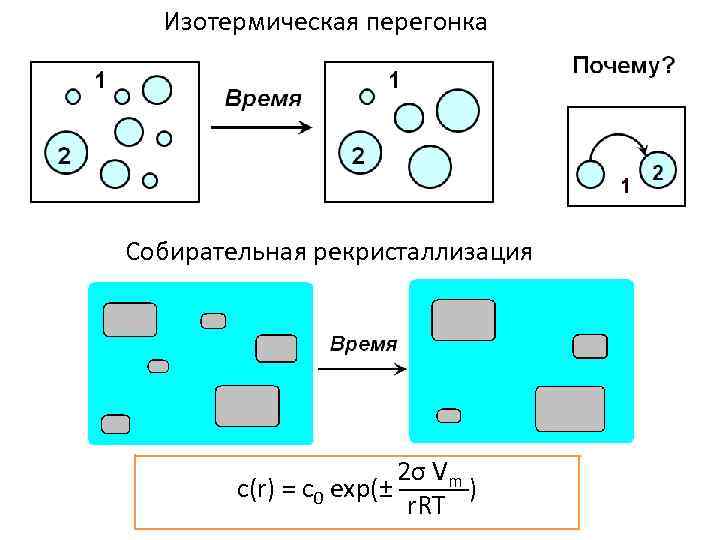
Изотермическая перегонка Собирательная рекристаллизация 2σ Vm с(r) = с0 exp(± ─────) r. RT
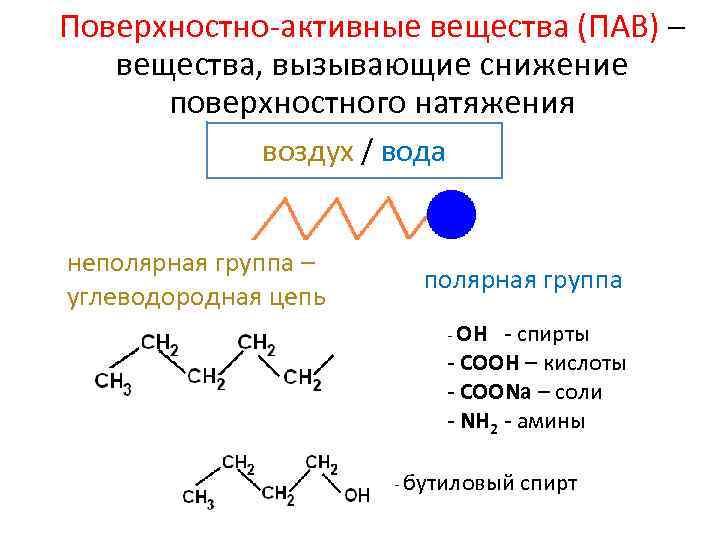
Поверхностно-активные вещества (ПАВ) – вещества, вызывающие снижение поверхностного натяжения воздух / вода неполярная группа – углеводородная цепь полярная группа - ОН - спирты - СООН – кислоты - COONa – соли - NH 2 - амины - бутиловый спирт


Поверхностно-инактивные вещества (ПИн. В) – вещества, вызывающие повышение поверхностного натяжения воздух / вода Na. Cl –соль HCl – кислота Na. OH - основание
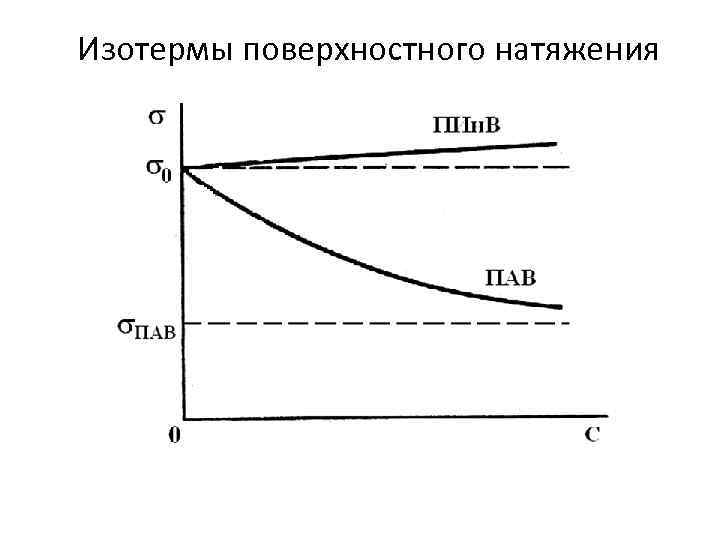
Изотермы поверхностного натяжения
![Адсорбция – самопроизвольное концентрирование вещества на границе раздела фаз 12 [моль/м 2] Ni – Адсорбция – самопроизвольное концентрирование вещества на границе раздела фаз 12 [моль/м 2] Ni –](https://present5.com/presentation/17579586_72954030/image-28.jpg)
Адсорбция – самопроизвольное концентрирование вещества на границе раздела фаз 12 [моль/м 2] Ni – общее число молей данного компонента в двухфазной системе Ni – ׳ число молей компонента в фазе 1 Ni – ״ число молей компонента в фазе 2
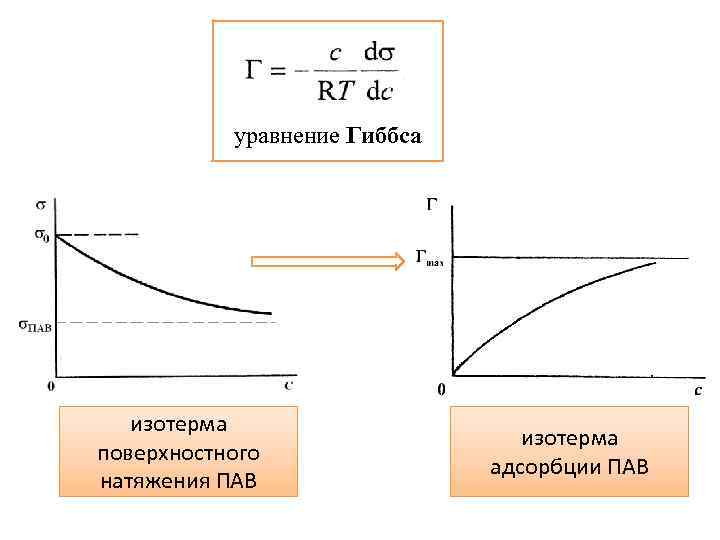
уравнение Гиббса изотерма поверхностного натяжения ПАВ изотерма адсорбции ПАВ
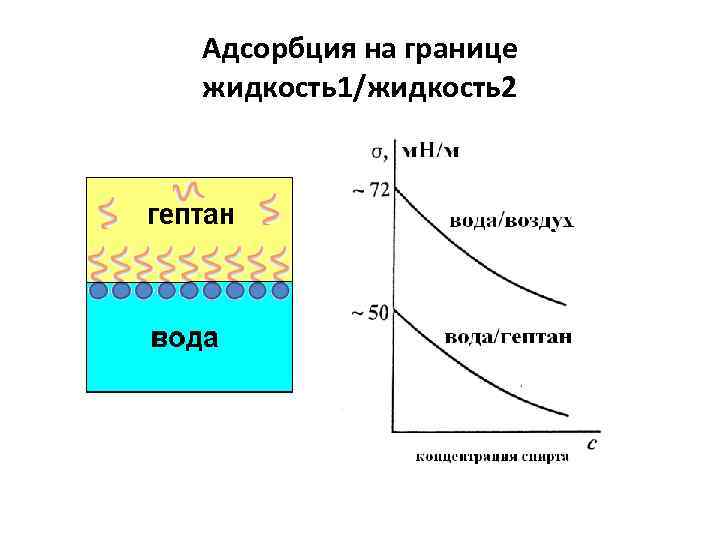
Адсорбция на границе жидкость1/жидкость2
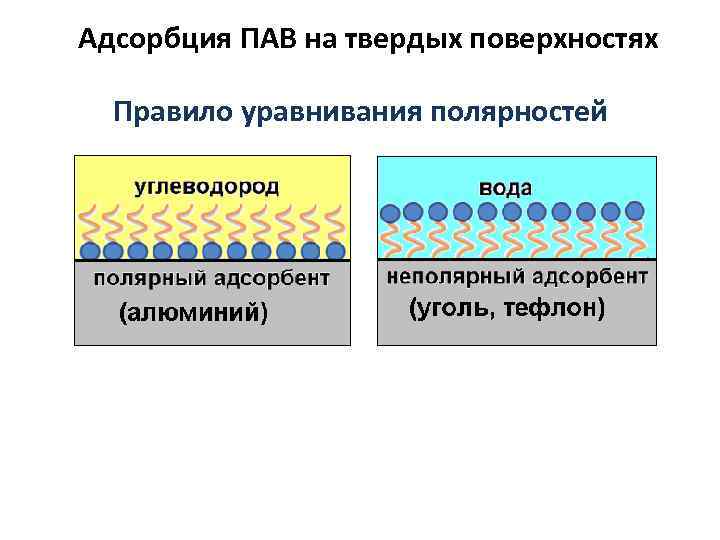
Адсорбция ПАВ на твердых поверхностях Правило уравнивания полярностей
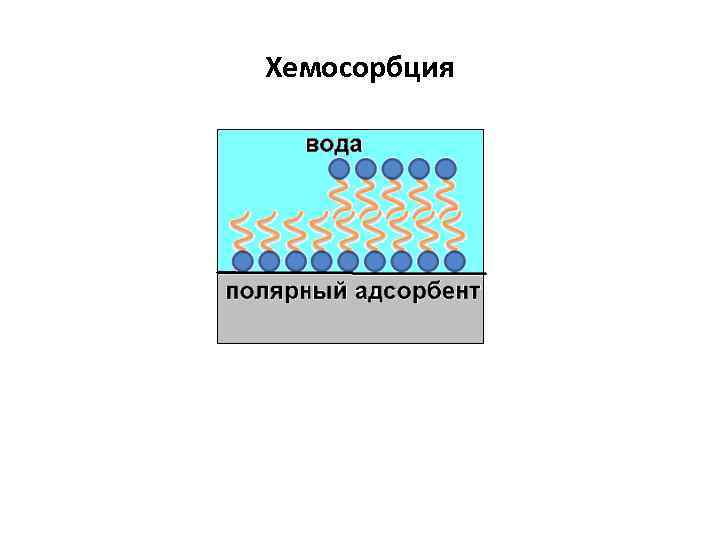
Хемосорбция
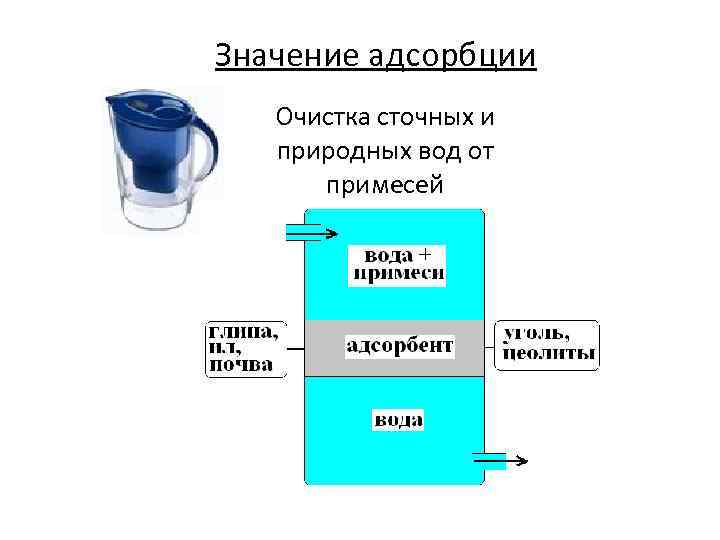
Значение адсорбции Очистка сточных и природных вод от примесей
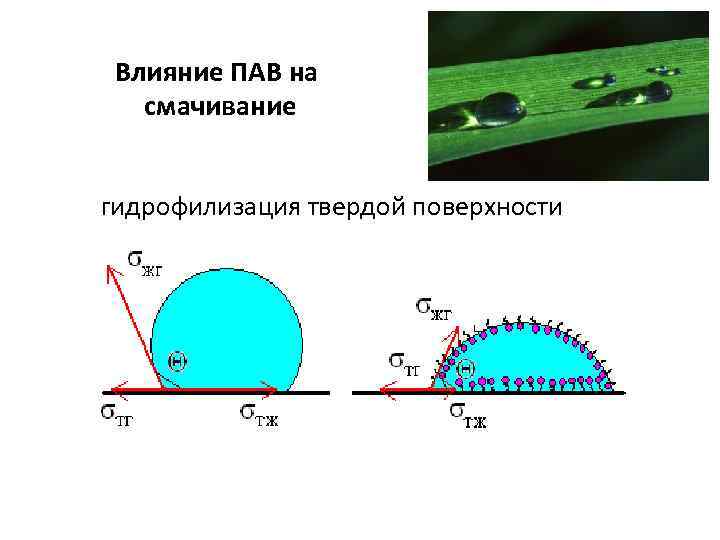
Влияние ПАВ на смачивание гидрофилизация твердой поверхности
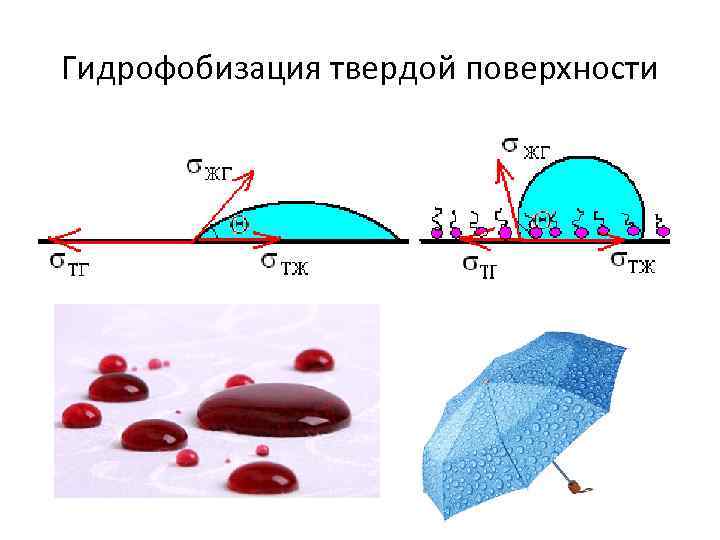
Гидрофобизация твердой поверхности
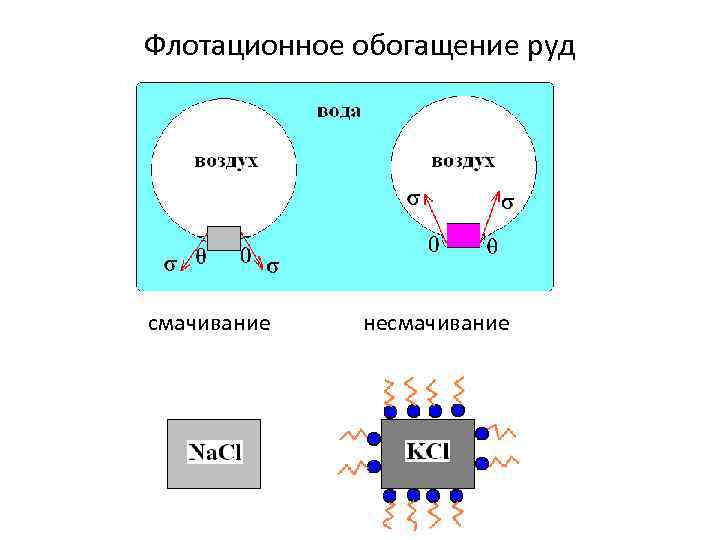
Флотационное обогащение руд смачивание несмачивание
lektsia_1_-_1_kurs.pptx