LECTURE1_fall_16.ppt
- Количество слайдов: 24
 КОЛЛОИДНАЯ ХИМИЯ Лектор: доцент Лариса Ивановна Лопатина ЛИТЕРАТУРА 1. Щукин Е. Д. , Перцов А. В. , Амелина Е. А. Коллоидная химия, 2008. 2. Сумм Б. Д. Основы коллоидной химии, 2006. 3. В. И. Слесарев. Химия. Основы химии живого, 2005. 4. Практикум по коллоидной химии, под ред. В. Г. Куличихина, 2014. 5. Методическое пособие к курсу коллоидной химии под ред. В. Н. Матвеенко, 2011. 6. Измайлова В. Н. , Ямпольская Г. П. , Сумм Б. Д. Поверхностные явления в белковых системах, 1988. 7. Мицеллообразование, солюбилизация и микроэмульсии под ред. Миттела К. , 1980. www. chem. msu. ru Химический факультет Кафедры и лаборатории: Коллоидная химия Учебные материалы по коллоидной химии: Биологический факультет Методическая разработка по курсу коллоидной химии
КОЛЛОИДНАЯ ХИМИЯ Лектор: доцент Лариса Ивановна Лопатина ЛИТЕРАТУРА 1. Щукин Е. Д. , Перцов А. В. , Амелина Е. А. Коллоидная химия, 2008. 2. Сумм Б. Д. Основы коллоидной химии, 2006. 3. В. И. Слесарев. Химия. Основы химии живого, 2005. 4. Практикум по коллоидной химии, под ред. В. Г. Куличихина, 2014. 5. Методическое пособие к курсу коллоидной химии под ред. В. Н. Матвеенко, 2011. 6. Измайлова В. Н. , Ямпольская Г. П. , Сумм Б. Д. Поверхностные явления в белковых системах, 1988. 7. Мицеллообразование, солюбилизация и микроэмульсии под ред. Миттела К. , 1980. www. chem. msu. ru Химический факультет Кафедры и лаборатории: Коллоидная химия Учебные материалы по коллоидной химии: Биологический факультет Методическая разработка по курсу коллоидной химии
 Дисперсные системы: определение, классификация, получение и методы очистки
Дисперсные системы: определение, классификация, получение и методы очистки
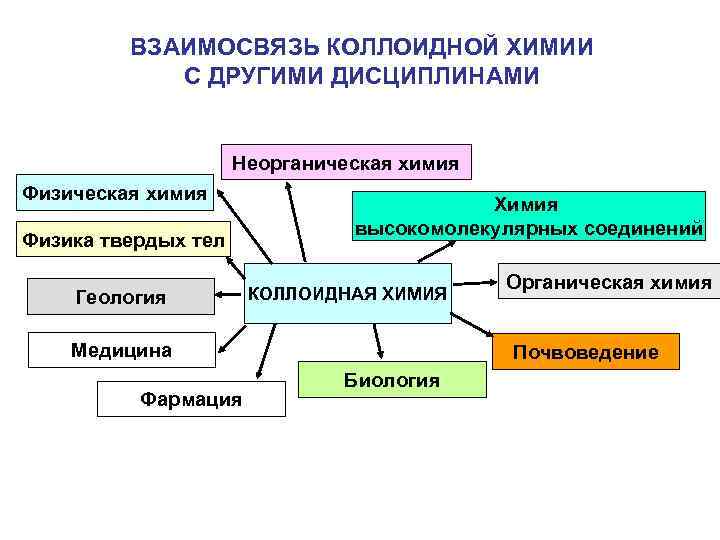 ВЗАИМОСВЯЗЬ КОЛЛОИДНОЙ ХИМИИ С ДРУГИМИ ДИСЦИПЛИНАМИ Неорганическая химия Физика твердых тел Геология Химия высокомолекулярных соединений КОЛЛОИДНАЯ ХИМИЯ Медицина Фармация Органическая химия Почвоведение Биология
ВЗАИМОСВЯЗЬ КОЛЛОИДНОЙ ХИМИИ С ДРУГИМИ ДИСЦИПЛИНАМИ Неорганическая химия Физика твердых тел Геология Химия высокомолекулярных соединений КОЛЛОИДНАЯ ХИМИЯ Медицина Фармация Органическая химия Почвоведение Биология
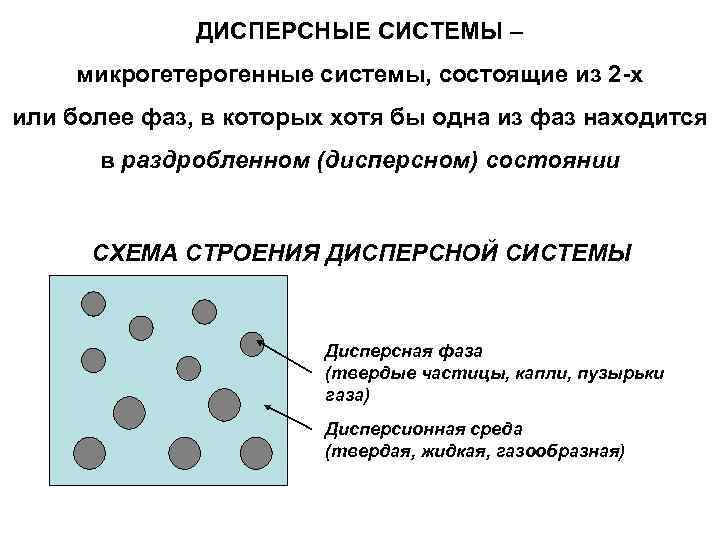 ДИСПЕРСНЫЕ СИСТЕМЫ – микрогетерогенные системы, состоящие из 2 -х или более фаз, в которых хотя бы одна из фаз находится в раздробленном (дисперсном) состоянии СХЕМА СТРОЕНИЯ ДИСПЕРСНОЙ СИСТЕМЫ Дисперсная фаза (твердые частицы, капли, пузырьки газа) Дисперсионная среда (твердая, жидкая, газообразная)
ДИСПЕРСНЫЕ СИСТЕМЫ – микрогетерогенные системы, состоящие из 2 -х или более фаз, в которых хотя бы одна из фаз находится в раздробленном (дисперсном) состоянии СХЕМА СТРОЕНИЯ ДИСПЕРСНОЙ СИСТЕМЫ Дисперсная фаза (твердые частицы, капли, пузырьки газа) Дисперсионная среда (твердая, жидкая, газообразная)
 Примеры объектов изучения коллоидной химии Песок Дым Туман Почва, облака Пыль Косметические средства Горные породы Пищевые продукты Эритроциты Лейкоциты Плазма Лекарства Нервы Легкие Клетка Кровь
Примеры объектов изучения коллоидной химии Песок Дым Туман Почва, облака Пыль Косметические средства Горные породы Пищевые продукты Эритроциты Лейкоциты Плазма Лекарства Нервы Легкие Клетка Кровь
 КЛАССИФИКАЦИЯ ДИСПЕРСНЫХ СИСТЕМ
КЛАССИФИКАЦИЯ ДИСПЕРСНЫХ СИСТЕМ
 КЛАССИФИКАЦИЯ ДИСПЕРСНЫХ СИСТЕМ ПО АГРЕГАТНОМУ СОСТОЯНИЮ ДИСПЕРСНОЙ ФАЗЫ И ДИСПЕРСИОННОЙ СРЕДЫ Дисперсная Т Ж Г Т Т / Т ТВЕРДЫЕ КОЛЛОИДНЫЕ РАСТВОРЫ: Горные породы, минералы, строительные материалы, сплавы (сталь, чугун) Ж / Т Минералы с жидкими включениями (опал, жемчуг), влажные грунты, почвы Г / Т ПОРИСТЫЕ ТЕЛА: пемза, активные угли, пенобетон, пенопласты, хлеб Ж Т / Ж СУСПЕНЗИИ, ЗОЛИ, ГЕЛИ: взвеси песка или ила в природных водах, бактерии в воде Ж / Ж ЭМУЛЬСИИ: молоко, сырая нефть, смазки, майонез, крем Г / Ж ГАЗОВЫЕЭМУЛЬСИИ, ПЕНЫ: мыльная пена, пена пива, шампанского фаза Дисперсионная среда Г А Э Р О З О Л И Т / Г Пыль: угольная пыль, дым: табачный дым, порошки, перистые облака Ж / Г Туман, кучевые облака, тучи Г / Г -----Системы с флуктуацией плотности газов: атмосфера Земли
КЛАССИФИКАЦИЯ ДИСПЕРСНЫХ СИСТЕМ ПО АГРЕГАТНОМУ СОСТОЯНИЮ ДИСПЕРСНОЙ ФАЗЫ И ДИСПЕРСИОННОЙ СРЕДЫ Дисперсная Т Ж Г Т Т / Т ТВЕРДЫЕ КОЛЛОИДНЫЕ РАСТВОРЫ: Горные породы, минералы, строительные материалы, сплавы (сталь, чугун) Ж / Т Минералы с жидкими включениями (опал, жемчуг), влажные грунты, почвы Г / Т ПОРИСТЫЕ ТЕЛА: пемза, активные угли, пенобетон, пенопласты, хлеб Ж Т / Ж СУСПЕНЗИИ, ЗОЛИ, ГЕЛИ: взвеси песка или ила в природных водах, бактерии в воде Ж / Ж ЭМУЛЬСИИ: молоко, сырая нефть, смазки, майонез, крем Г / Ж ГАЗОВЫЕЭМУЛЬСИИ, ПЕНЫ: мыльная пена, пена пива, шампанского фаза Дисперсионная среда Г А Э Р О З О Л И Т / Г Пыль: угольная пыль, дым: табачный дым, порошки, перистые облака Ж / Г Туман, кучевые облака, тучи Г / Г -----Системы с флуктуацией плотности газов: атмосфера Земли
 КЛАССИФИКАЦИЯ ДИСПЕРСНЫХ СИСТЕМ ПО РАЗМЕРУ ЧАСТИЦ ДИСПЕРСНОЙ ФАЗЫ м 10 - 3 Капля крови Пылевой клещ Эритроцит 10 - 9 Нанореактор ДНК Молекула
КЛАССИФИКАЦИЯ ДИСПЕРСНЫХ СИСТЕМ ПО РАЗМЕРУ ЧАСТИЦ ДИСПЕРСНОЙ ФАЗЫ м 10 - 3 Капля крови Пылевой клещ Эритроцит 10 - 9 Нанореактор ДНК Молекула
 КЛАССИФИКАЦИЯ ДИСПЕРСНЫХ СИСТЕМ ПО РАЗМЕРУ ЧАСТИЦ ДИСПЕРСНОЙ ФАЗЫ Грубодисперсные системы 10 -3 – 10 -6 м Высокодисперсные системы 10 -6 – 10 -9 м Количественные характеристики дисперсности Радиус r Дисперсность D Удельная поверхность Sуд - Монодисперсные системы [1/м] - Полидисперсные системы r [м 2/кг] a
КЛАССИФИКАЦИЯ ДИСПЕРСНЫХ СИСТЕМ ПО РАЗМЕРУ ЧАСТИЦ ДИСПЕРСНОЙ ФАЗЫ Грубодисперсные системы 10 -3 – 10 -6 м Высокодисперсные системы 10 -6 – 10 -9 м Количественные характеристики дисперсности Радиус r Дисперсность D Удельная поверхность Sуд - Монодисперсные системы [1/м] - Полидисперсные системы r [м 2/кг] a
 ЗАВИСИМОСТЬ ПЛОЩАДИ ПОВЕРХНОСТИ РАЗДЕЛА ФАЗ S 12 ОТ РАЗМЕРА ЧАСТИЦ … а =1 см Измельчение Ребро кубика длиной а, см Количество кубиков Площадь раздела фаз S 12, см 2 1 1 6 0, 1(1 мм) 103 60 10 -4 (1 мкм) 1012 6. 104 10 -7 (1 нм) 1021 6. 107
ЗАВИСИМОСТЬ ПЛОЩАДИ ПОВЕРХНОСТИ РАЗДЕЛА ФАЗ S 12 ОТ РАЗМЕРА ЧАСТИЦ … а =1 см Измельчение Ребро кубика длиной а, см Количество кубиков Площадь раздела фаз S 12, см 2 1 1 6 0, 1(1 мм) 103 60 10 -4 (1 мкм) 1012 6. 104 10 -7 (1 нм) 1021 6. 107
 КЛАССИФИКАЦИЯ ДИСПЕРСНЫХ СИСТЕМ ПО РАЗМЕРУ ЧАСТИЦ ДИСПЕРСНОЙ ФАЗЫ Вы со ультрадисперсные (наносистемы) ко ди с пе рс ны е Гр уб од и сп ер сн ы е
КЛАССИФИКАЦИЯ ДИСПЕРСНЫХ СИСТЕМ ПО РАЗМЕРУ ЧАСТИЦ ДИСПЕРСНОЙ ФАЗЫ Вы со ультрадисперсные (наносистемы) ко ди с пе рс ны е Гр уб од и сп ер сн ы е
 Всегда ли использование приставки НАНОправомерно? Нанороботы в крови Молекулярный наноавтомобиль ездит по поверхности золотой пластины
Всегда ли использование приставки НАНОправомерно? Нанороботы в крови Молекулярный наноавтомобиль ездит по поверхности золотой пластины
 Флуоресцирующие коллоидные квантовые точки Cd. Se Флуоресценция квантовых точек в клетках Увеличение радиуса частиц УФ-лампа Перспективные направления использования квантовых точек: Биотехнология и медицина: - диагностика опасных заболеваний (метод иммунофлуоресцентного анализа); - при лечении онкологии - метод фотодинамической терапии; - доставка медикаментов в клетки опухоли. Однако влияние наночастиц на человеческий организм не до конца изучено, поэтому медицинские приложения квантовых точек пока ограничены. Оптоэлектроника и светодиоды нового типа. Преимущества: большая в сравнении с тривиальными светильниками яркость, меньший размер; экономия энергии за счет таких преимуществ, как высокая фотостабильность и способность обеспечить любой цвет и любую цветовую температуру.
Флуоресцирующие коллоидные квантовые точки Cd. Se Флуоресценция квантовых точек в клетках Увеличение радиуса частиц УФ-лампа Перспективные направления использования квантовых точек: Биотехнология и медицина: - диагностика опасных заболеваний (метод иммунофлуоресцентного анализа); - при лечении онкологии - метод фотодинамической терапии; - доставка медикаментов в клетки опухоли. Однако влияние наночастиц на человеческий организм не до конца изучено, поэтому медицинские приложения квантовых точек пока ограничены. Оптоэлектроника и светодиоды нового типа. Преимущества: большая в сравнении с тривиальными светильниками яркость, меньший размер; экономия энергии за счет таких преимуществ, как высокая фотостабильность и способность обеспечить любой цвет и любую цветовую температуру.
 Классификация дисперсных систем по размеру частиц дисперсной фазы. Примеры дисперсных систем Дисперсные системы Диаметр частиц максимального размера Эритроциты крови человека 7 мкм Кишечная палочка 3 мкм Частицы на поверхности Венеры 0, 1 – 10 мкм Вирус гриппа 0, 1 мкм – 100 нм Золь золота (синий) 50 нм Муть в природных водах 10 – 100 нм Дым (древесный уголь) 30 – 40 нм Золь золота (красный) 20 нм Вирус ящура 10 нм Молекула гликогена 10 нм Золь золота (зародышевый) 3 нм
Классификация дисперсных систем по размеру частиц дисперсной фазы. Примеры дисперсных систем Дисперсные системы Диаметр частиц максимального размера Эритроциты крови человека 7 мкм Кишечная палочка 3 мкм Частицы на поверхности Венеры 0, 1 – 10 мкм Вирус гриппа 0, 1 мкм – 100 нм Золь золота (синий) 50 нм Муть в природных водах 10 – 100 нм Дым (древесный уголь) 30 – 40 нм Золь золота (красный) 20 нм Вирус ящура 10 нм Молекула гликогена 10 нм Золь золота (зародышевый) 3 нм
 КЛАССИФИКАЦИЯ ПО СТРУКТУРЕ ДИСПЕРСНОЙ ФАЗЫ Свободнодисперсные системы Золь золота с частицами разных размеров Связнодисперсные системы Гель
КЛАССИФИКАЦИЯ ПО СТРУКТУРЕ ДИСПЕРСНОЙ ФАЗЫ Свободнодисперсные системы Золь золота с частицами разных размеров Связнодисперсные системы Гель
 КЛАССИФИКАЦИЯ ПО МЕЖМОЛЕКУЛЯРНЫМ ВЗАИМОДЕЙСТВИЯМ НА ПОВЕРХНОСТИ РАЗДЕЛА ДИСПЕРСНАЯ ФАЗА-ДИСПЕРСИОННАЯ СРЕДА Термодинамически устойчивые Термодинамически неустойчивые (лиофобные) (лиофильные) дисперсные системы 1. Слабое взаимодействие 1. Высокая степень родственности дисперсной фазы с дисперсионной средой и дисперсионной среды 2. Высокие значения межфазной 2. Низкие значения межфазной энергии 3. Характерно самопроизвольное 3. Затрачивается работа на их образование ∆Gобр. > 0. образование ∆Gобр. < 0. Следовательно, склонны к самопроизвольному разрушению. Примеры: мицеллярные Могут быть кинетически растворы мыл, критические устойчивы за счет стабилизации эмульсии, микроэмульсии Примеры: практически все природные системы, почвы, золи, эмульсии, взвесь бактерий в воде
КЛАССИФИКАЦИЯ ПО МЕЖМОЛЕКУЛЯРНЫМ ВЗАИМОДЕЙСТВИЯМ НА ПОВЕРХНОСТИ РАЗДЕЛА ДИСПЕРСНАЯ ФАЗА-ДИСПЕРСИОННАЯ СРЕДА Термодинамически устойчивые Термодинамически неустойчивые (лиофобные) (лиофильные) дисперсные системы 1. Слабое взаимодействие 1. Высокая степень родственности дисперсной фазы с дисперсионной средой и дисперсионной среды 2. Высокие значения межфазной 2. Низкие значения межфазной энергии 3. Характерно самопроизвольное 3. Затрачивается работа на их образование ∆Gобр. > 0. образование ∆Gобр. < 0. Следовательно, склонны к самопроизвольному разрушению. Примеры: мицеллярные Могут быть кинетически растворы мыл, критические устойчивы за счет стабилизации эмульсии, микроэмульсии Примеры: практически все природные системы, почвы, золи, эмульсии, взвесь бактерий в воде
 КЛАССИФИКАЦИЯ ПО ФАЗОВОЙ РАЗЛИЧИМОСТИ МОЛЕКУЛЯРНЫЕ КОЛЛОИДЫ СУСПЕНЗОИДЫ Гомогенные однофазные системы, Высокодисперсные гетерогенные устойчивые, самопроизвольно системы с четко различимой образующиеся, с отдельными физической поверхностью раздела сольватированными макромолекулами дисперсная фаза-дисперсионная в качестве кинетических единиц. среда Растворы высокомолекулярных Золи, эмульсии, суспензии, соединений порошки и. д.
КЛАССИФИКАЦИЯ ПО ФАЗОВОЙ РАЗЛИЧИМОСТИ МОЛЕКУЛЯРНЫЕ КОЛЛОИДЫ СУСПЕНЗОИДЫ Гомогенные однофазные системы, Высокодисперсные гетерогенные устойчивые, самопроизвольно системы с четко различимой образующиеся, с отдельными физической поверхностью раздела сольватированными макромолекулами дисперсная фаза-дисперсионная в качестве кинетических единиц. среда Растворы высокомолекулярных Золи, эмульсии, суспензии, соединений порошки и. д.
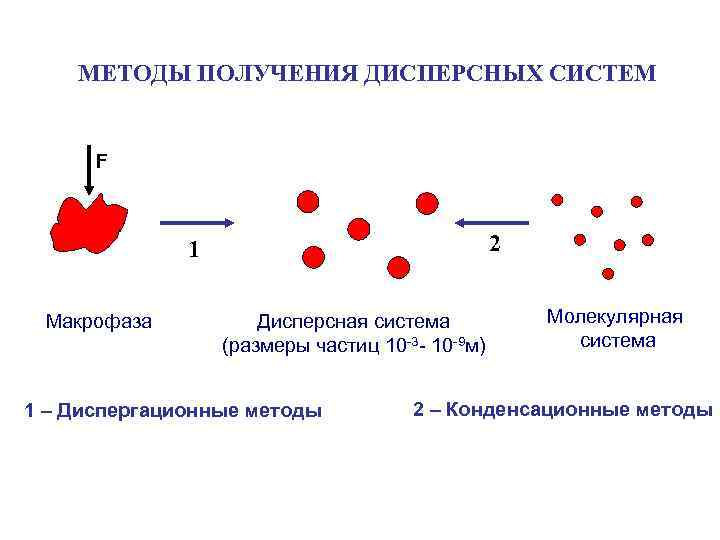 МЕТОДЫ ПОЛУЧЕНИЯ ДИСПЕРСНЫХ СИСТЕМ F 2 1 Макрофаза Дисперсная система (размеры частиц 10 -3 - 10 -9 м) 1 – Диспергационные методы Молекулярная система 2 – Конденсационные методы
МЕТОДЫ ПОЛУЧЕНИЯ ДИСПЕРСНЫХ СИСТЕМ F 2 1 Макрофаза Дисперсная система (размеры частиц 10 -3 - 10 -9 м) 1 – Диспергационные методы Молекулярная система 2 – Конденсационные методы
 ДИСПЕРГИРОВАНИЕ Ультразвуковое Механическое Молот Ступка Мельница Твердое тело
ДИСПЕРГИРОВАНИЕ Ультразвуковое Механическое Молот Ступка Мельница Твердое тело
 ЭФФЕКТ РЕБИНДЕРА – АДСОРБЦИОННОЕ ПОНИЖЕНИЕ ПРОЧНОСТИ ТВЕРДЫХ ТЕЛ ПОД ДЕЙСТВИЕМ АДСОРБЦИОННО-АКТИВНОЙ СРЕДЫ ПРОЧНОСТЬ РЕАЛЬНОГО ТВЕРДОГО ТЕЛА зависит от количества и размеров дефектов. Типы дефектов, существующих в структуре твердых тел Граница зерна Межузельный атом (внедренный между узлами кристаллической решетки атом той же природы) Лишний ряд Растяжение Вакансия Атом включения (атом другой природы) Примесь Константа зависит от природы твердого тела; l – размер дефекта Сжатие
ЭФФЕКТ РЕБИНДЕРА – АДСОРБЦИОННОЕ ПОНИЖЕНИЕ ПРОЧНОСТИ ТВЕРДЫХ ТЕЛ ПОД ДЕЙСТВИЕМ АДСОРБЦИОННО-АКТИВНОЙ СРЕДЫ ПРОЧНОСТЬ РЕАЛЬНОГО ТВЕРДОГО ТЕЛА зависит от количества и размеров дефектов. Типы дефектов, существующих в структуре твердых тел Граница зерна Межузельный атом (внедренный между узлами кристаллической решетки атом той же природы) Лишний ряд Растяжение Вакансия Атом включения (атом другой природы) Примесь Константа зависит от природы твердого тела; l – размер дефекта Сжатие
 ЭФФЕКТ РЕБИНДЕРА – АДСОРБЦИОННОЕ ПОНИЖЕНИЕ ПРОЧНОСТИ ТВЕРДЫХ ТЕЛ ПОД ДЕЙСТВИЕМ АДСОРБЦИОННО-АКТИВНОЙ СРЕДЫ Твердое тело Р (Н/м 2) Адсорбционно-активная среда Пример: резка стекла, разрыв фильтровальной бумаги в присутствии воды
ЭФФЕКТ РЕБИНДЕРА – АДСОРБЦИОННОЕ ПОНИЖЕНИЕ ПРОЧНОСТИ ТВЕРДЫХ ТЕЛ ПОД ДЕЙСТВИЕМ АДСОРБЦИОННО-АКТИВНОЙ СРЕДЫ Твердое тело Р (Н/м 2) Адсорбционно-активная среда Пример: резка стекла, разрыв фильтровальной бумаги в присутствии воды
 КОНДЕНСАЦИОННЫЕ МЕТОДЫ Химические методы: 1. Реакции окисления и восстановления 2 H 2 S+O 2=2 S+2 H 2 O Физические методы: Давление Температура Fe 2 Si. O 4+1/2 O 2+5 H 2 O=2 Fe(OH)3+Si(OH)4 Замена растворителя 2. Реакции гидролиза Fe. Cl 3+3 Na. OH = Fe(OH)3+3 Na. Cl 3. Реакции ионного обмена Ag. NO 3 + KI = Ag. I + KNO 3
КОНДЕНСАЦИОННЫЕ МЕТОДЫ Химические методы: 1. Реакции окисления и восстановления 2 H 2 S+O 2=2 S+2 H 2 O Физические методы: Давление Температура Fe 2 Si. O 4+1/2 O 2+5 H 2 O=2 Fe(OH)3+Si(OH)4 Замена растворителя 2. Реакции гидролиза Fe. Cl 3+3 Na. OH = Fe(OH)3+3 Na. Cl 3. Реакции ионного обмена Ag. NO 3 + KI = Ag. I + KNO 3
 КОНДЕНСАЦИОННЫЕ МЕТОДЫ - Основаны на ассоциации молекул (атомов, ионов) в агрегаты из истинных растворов - Появление новой фазы происходит при пересыщении среды - Используют для получения высокодисперсных систем Обязательное условие появления частиц новой фазы в маточной среде ПЕРЕСЫЩЕНИЕ!!!
КОНДЕНСАЦИОННЫЕ МЕТОДЫ - Основаны на ассоциации молекул (атомов, ионов) в агрегаты из истинных растворов - Появление новой фазы происходит при пересыщении среды - Используют для получения высокодисперсных систем Обязательное условие появления частиц новой фазы в маточной среде ПЕРЕСЫЩЕНИЕ!!!
 МЕТОДЫ ОЧИСТКИ ДИСПЕРСНЫХ СИСТЕМ И РАСТВОРОВ ВЫСОКОМОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙ Диализ Ультрафильтрация Электродиализ Электродекантация
МЕТОДЫ ОЧИСТКИ ДИСПЕРСНЫХ СИСТЕМ И РАСТВОРОВ ВЫСОКОМОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙ Диализ Ультрафильтрация Электродиализ Электродекантация


