лекция 3.pptx
- Количество слайдов: 22

Коллигативные свойства разбавленных растворов неэлектролитов и электролитов. Закон Рауля и следствия из него Лекция № 3 Лектор: канд. хим. наук, доцент Иванова Н. С.

Раствор — фаза 2 состава. переменного «Фаза» указывает однородность на раствора, «переменный состав» на существование различных концентраций одного и того же раствора. 2

3 Профессор Петербургского университета. Основоположник сольватной теории растворения, создатель Периодичесокй системы химических элементов. Дмитрий Иванович Менделеев (1834 1907)

4
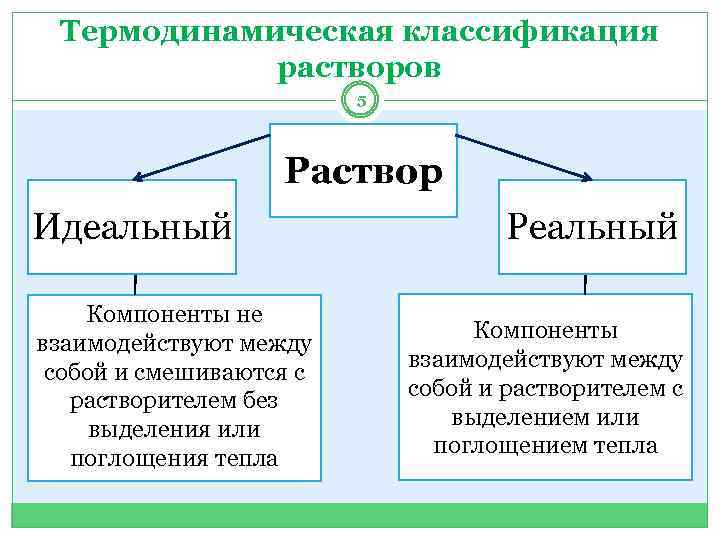
Термодинамическая классификация растворов 5 Раствор Идеальный Компоненты не взаимодействуют между собой и смешиваются с растворителем без выделения или поглощения тепла Реальный Компоненты взаимодействуют между собой и растворителем с выделением или поглощением тепла

Коллигативные свойства … 6 … свойства растворов, которые пропорциональны концентрации растворённого вещества и не зависит от его химической природы. Наличие коллигативных свойств указывает на следующие факты: 1. вещество не реагирует с растворителем, ведёт себя подобно газу; 2. его молекулы не подвергаются ни ассоциации, ни диссоциации, следовательно, тепловых эффектов не наблюдается.
Модель идеального раствора 7 Растворённое вещество
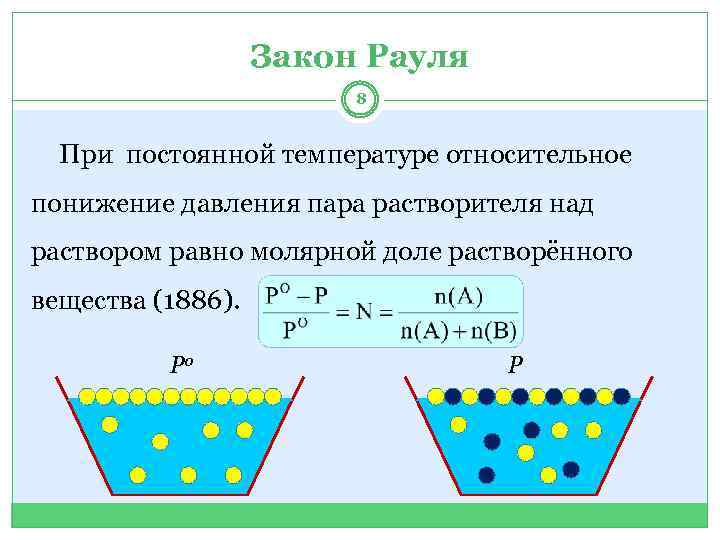
Закон Рауля 8 При постоянной температуре относительное понижение давления пара растворителя над раствором равно молярной доле растворённого вещества (1886). Ро Р

9 Французский физикохимик, профессор университета в Гренобле. Термин «криоскопия» был введён им в 1885 г. в связи с открытием им закона, названного его именем. Сейчас методом криоскопии пользуются для определения молекулярной массы низкомолекулярных веществ. Франсуа Мари Рауль (1830 1901)

Повышение Ткипения и понижение Тзамерзания растворов 10 Повышение Ткип. и понижение Тзам. идеальных растворов прямо пропорционально моляльной концентрации растворов. КК криоскопическая константа. КЭ эбулиоскопическая константа. Физический смысл констант: повышение Ткип или понижение Тзам одномоляльного раствора по сравнению с чистым растворителем. КК(Н 2 О)=1, 86; КЭ(Н 2 О)=0, 52.

Борьба с гололёдом 11

Криоскопия 12 g – масса вещества, растворенного в G граммах растворителя; M – молекулярная масса растворенного вещества; KК – криоскопическая константа растворителя.
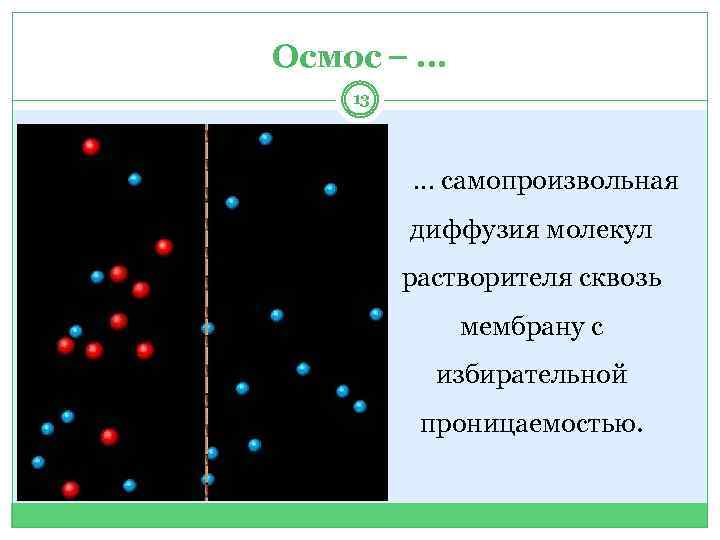
Осмос … 13 … самопроизвольная диффузия молекул растворителя сквозь мембрану с избирательной проницаемостью.

Закон Вант-Гоффа (1887) 14 = с. RТ Осмотическое давление раствора равно тому давлению, которое производило бы растворённое вещество, если бы оно при той же Т находилось в газообразном состоянии и занимало V, равный Vраствора. Якоб Хендрик Вант-Гофф (1852 -1911)
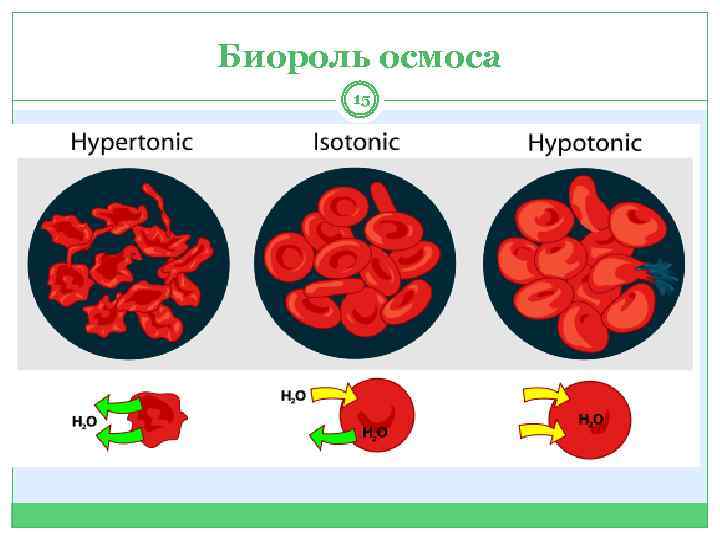
Биороль осмоса 15
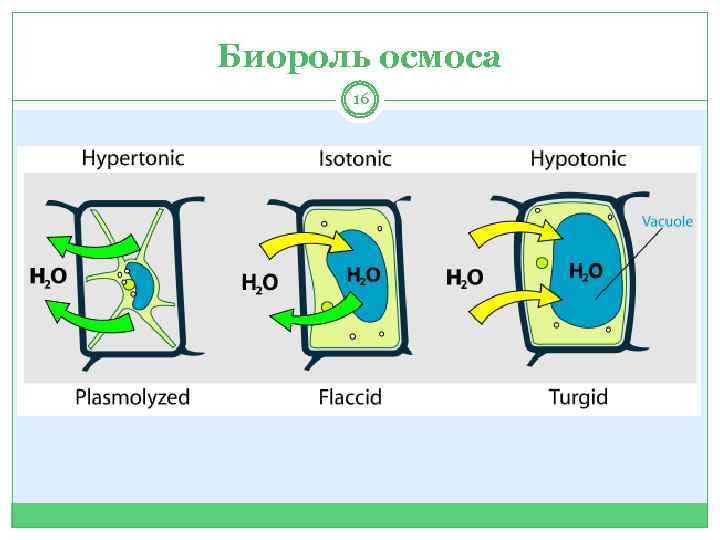
Биороль осмоса 16
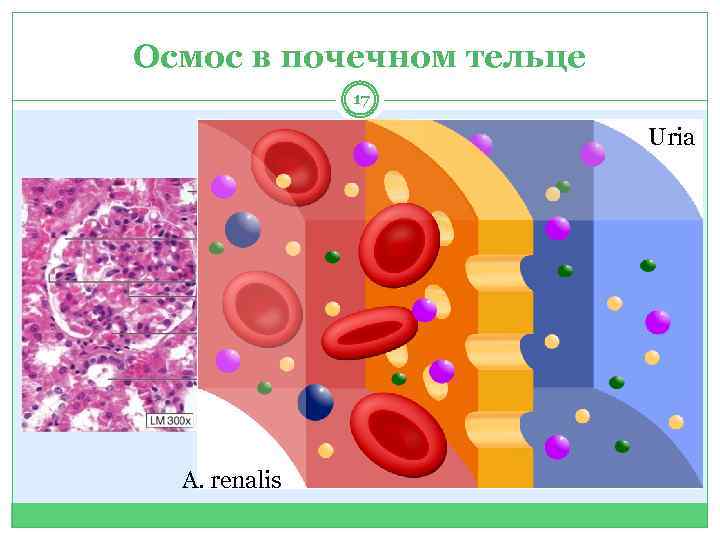
Осмос в почечном тельце 17 Uria A. renalis

Глаукома повышение внутриглазного давления 18 Нормальное зрение Глаукома

Изотонический коэффициент 19 Для реальных растворов математические выражения, характеризующие коллигативные свойства, могут быть использованы с учётом изотонического коэффициента (i). Для неэлектролитов i = 1, для электролитов i > 1, для коллоидов i < 1.

Способы нахождения i 20 1. Экспериментально: 2. По степени диссоциации электролитов ( ): m число ионов, на которое распадается молекула электролита
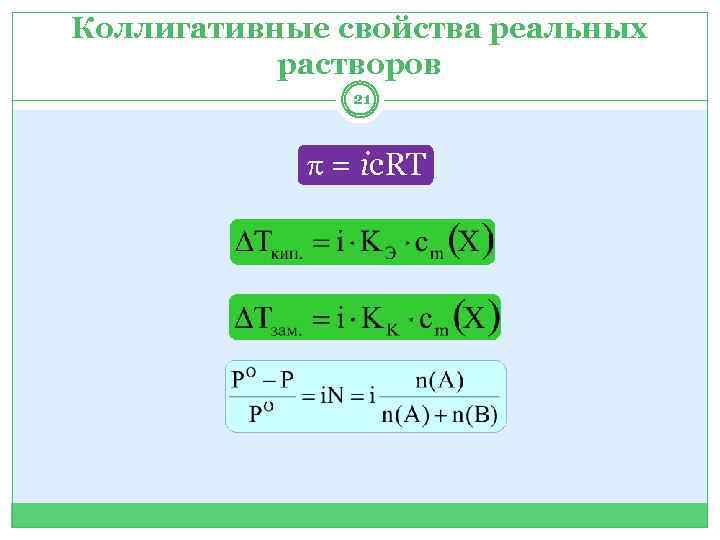
Коллигативные свойства реальных растворов 21 = iс. RТ

22
лекция 3.pptx