 Коллигативные свойства растворов: Неэлектролиты: Вант - Гофф: Р 0 -Р 1/ Р 0 =N Рауль: Δt к р-ра= Kэ∙N= =Kэ∙ m г. р-ра∙ 1000 г. р-ля/ M в-ва∙ m г. р-ля 0 С Kэ =RT 2 / l ; Kэ (H 0 H) = 0, 520 С Δt з р-ра= K к∙N= = Kк∙ m г. в-ва∙ 1000 г. р-ля/M в-ва∙ m 2 р-ля 0 С Kк =RT 2 / r ; K к(H 0 H) = 1, 860 С
Коллигативные свойства растворов: Неэлектролиты: Вант - Гофф: Р 0 -Р 1/ Р 0 =N Рауль: Δt к р-ра= Kэ∙N= =Kэ∙ m г. р-ра∙ 1000 г. р-ля/ M в-ва∙ m г. р-ля 0 С Kэ =RT 2 / l ; Kэ (H 0 H) = 0, 520 С Δt з р-ра= K к∙N= = Kк∙ m г. в-ва∙ 1000 г. р-ля/M в-ва∙ m 2 р-ля 0 С Kк =RT 2 / r ; K к(H 0 H) = 1, 860 С
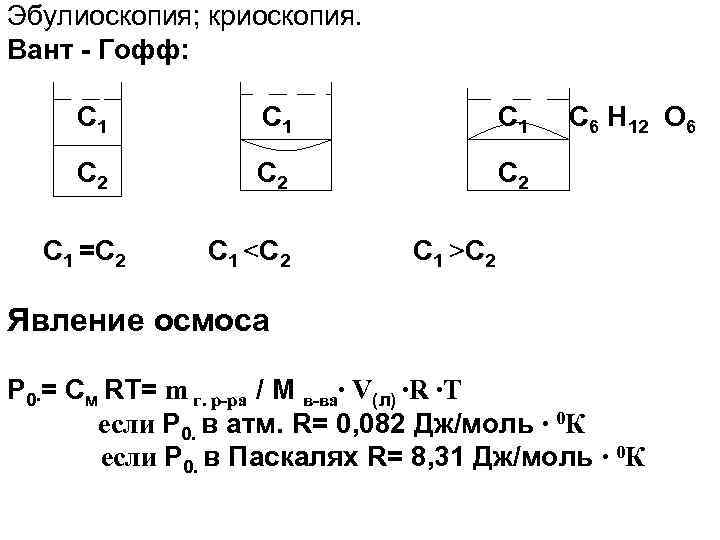 Эбулиоскопия; криоскопия. Вант - Гофф: С 1 С 1 С 2 С 2 С 1 =С 2 С 1 <С 2 С 6 H 12 O 6 С 1 >С 2 Явление осмоса Р 0∙= См RT= m г. р-ра / M в-ва∙ V(л) ∙R ∙Т если Р 0. в атм. R= 0, 082 Дж/моль ∙ 0 К если Р 0. в Паскалях R= 8, 31 Дж/моль ∙ 0 К
Эбулиоскопия; криоскопия. Вант - Гофф: С 1 С 1 С 2 С 2 С 1 =С 2 С 1 <С 2 С 6 H 12 O 6 С 1 >С 2 Явление осмоса Р 0∙= См RT= m г. р-ра / M в-ва∙ V(л) ∙R ∙Т если Р 0. в атм. R= 0, 082 Дж/моль ∙ 0 К если Р 0. в Паскалях R= 8, 31 Дж/моль ∙ 0 К
 Р 0∙ определяется концентрацией в организме всех растворённых веществ: электролитов, неэлектролитов органического и неорганического характера, белков, полисахаридов, нуклеиновых кислот. Электролиты: i = Δt к практ. / Δt к (Рауль) = =Δt з практ. / Δt к (Рауль)= = Р 0. практ / Р 0(Вант. - Гофф)
Р 0∙ определяется концентрацией в организме всех растворённых веществ: электролитов, неэлектролитов органического и неорганического характера, белков, полисахаридов, нуклеиновых кислот. Электролиты: i = Δt к практ. / Δt к (Рауль) = =Δt з практ. / Δt к (Рауль)= = Р 0. практ / Р 0(Вант. - Гофф)
 Вант – Гофф: i= 1 + Lд(S-1) Пример: рассчитать степень диссоциации гидроксида натрия (Na. OH), если в 200 г. воды растворено его 8 г. , и раствор замерзает при tз = -3, 260 С Для растворов электролитов: Δt к = i ∙ Kэ ∙ m г. р-ра∙ 1000 г. р-ля/ M в-ва∙ m г. р-ля 0 С Δt з= i ∙ Kк ∙ m г. р-ра∙ 1000 г. р-ля/ M в-ва∙ m г. р-ля 0 С Р 0. = i ∙ См RT= m г. р-ра / M в-ва∙ V(л) ∙R ∙Т
Вант – Гофф: i= 1 + Lд(S-1) Пример: рассчитать степень диссоциации гидроксида натрия (Na. OH), если в 200 г. воды растворено его 8 г. , и раствор замерзает при tз = -3, 260 С Для растворов электролитов: Δt к = i ∙ Kэ ∙ m г. р-ра∙ 1000 г. р-ля/ M в-ва∙ m г. р-ля 0 С Δt з= i ∙ Kк ∙ m г. р-ра∙ 1000 г. р-ля/ M в-ва∙ m г. р-ля 0 С Р 0. = i ∙ См RT= m г. р-ра / M в-ва∙ V(л) ∙R ∙Т