 Количественный анализ. Классические (химические) методы количественного анализа l Лекция 2
Количественный анализ. Классические (химические) методы количественного анализа l Лекция 2
 План лекции l Количественный химический анализ l Классические (химические) методы анализа l Гравиметрия l Методика гравиметрического анализа l Титриметрия l Разновидности титриметрического анализа l Расчеты в титриметрии
План лекции l Количественный химический анализ l Классические (химические) методы анализа l Гравиметрия l Методика гравиметрического анализа l Титриметрия l Разновидности титриметрического анализа l Расчеты в титриметрии
 Задачей количественного анализа является определение масс, концентраций (содержаний) или количественных соотношений компонентов анализируемого объекта l Компонент, содержащийся в пробе в количестве 5 – 100% обычно называют основным l Компонент, содержащийся в пробе в количестве 0, 01 – 5 % называют легирующим l Компонент, содержание которого ниже 0, 01 % обычно называют следовым или примесью
Задачей количественного анализа является определение масс, концентраций (содержаний) или количественных соотношений компонентов анализируемого объекта l Компонент, содержащийся в пробе в количестве 5 – 100% обычно называют основным l Компонент, содержащийся в пробе в количестве 0, 01 – 5 % называют легирующим l Компонент, содержание которого ниже 0, 01 % обычно называют следовым или примесью
 Химические методы анализа Гравиметрия Титриметрия Химические методы анализа основаны на применении химических реакций
Химические методы анализа Гравиметрия Титриметрия Химические методы анализа основаны на применении химических реакций
 Гравиметрия l Метод основан на точном измерении массы продукта реакции l Определяемый компонент (аналит) обычно осаждают из раствора в виде малорастворимого соединения
Гравиметрия l Метод основан на точном измерении массы продукта реакции l Определяемый компонент (аналит) обычно осаждают из раствора в виде малорастворимого соединения
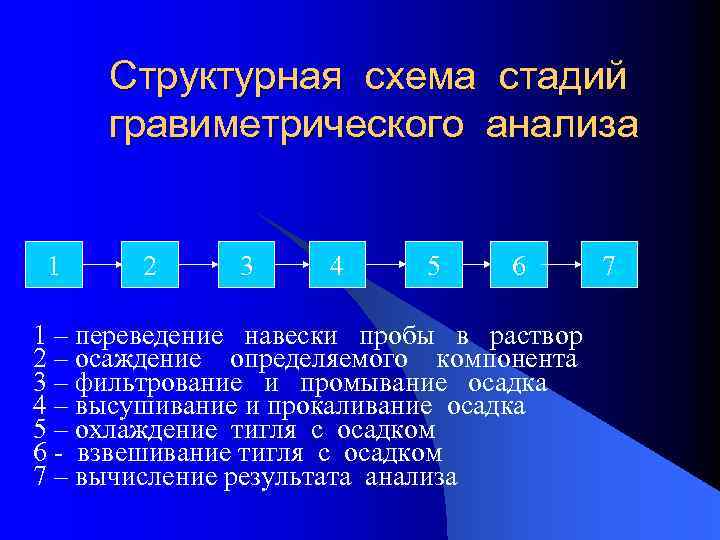 Структурная схема стадий гравиметрического анализа 1 2 3 4 5 6 7 1 – переведение навески пробы в раствор 2 – осаждение определяемого компонента 3 – фильтрование и промывание осадка 4 – высушивание и прокаливание осадка 5 – охлаждение тигля с осадком 6 - взвешивание тигля с осадком 7 – вычисление результата анализа
Структурная схема стадий гравиметрического анализа 1 2 3 4 5 6 7 1 – переведение навески пробы в раствор 2 – осаждение определяемого компонента 3 – фильтрование и промывание осадка 4 – высушивание и прокаливание осадка 5 – охлаждение тигля с осадком 6 - взвешивание тигля с осадком 7 – вычисление результата анализа
 Достоинства гравиметрического метода анализа l Универсальность l Высокая точность l Аппаратурная простота l Отсутствие надобности в стандартных образцах состава --------------------------- Основной недостаток метода – длительность, (малая производительность)
Достоинства гравиметрического метода анализа l Универсальность l Высокая точность l Аппаратурная простота l Отсутствие надобности в стандартных образцах состава --------------------------- Основной недостаток метода – длительность, (малая производительность)
 Титриметрия Метод основан на точном измерении объема раствора реагента (титранта), вступившего в химическую реакцию с определяемым веществом
Титриметрия Метод основан на точном измерении объема раствора реагента (титранта), вступившего в химическую реакцию с определяемым веществом
 В зависимости от характера химической реакции, лежащей в основе определения веществ, титриметрия подразделяется на методы: l кислотно-основное титрование l осадительное титрование l комплексонометрическое титрование l окислительно-восстановительное титрование, включающее в зависимости от используемого титранта – перманганотометрию, иодометрию бихроматометрию, броматометрию и др.
В зависимости от характера химической реакции, лежащей в основе определения веществ, титриметрия подразделяется на методы: l кислотно-основное титрование l осадительное титрование l комплексонометрическое титрование l окислительно-восстановительное титрование, включающее в зависимости от используемого титранта – перманганотометрию, иодометрию бихроматометрию, броматометрию и др.
 Способы выражения концентрации растворов в титриметрии Название Определение Размерность Молярность М – количество молей моль. /литр ( М) вещества в 1 литре раствора Нормальность N – количество грамм- (г-экв)⁄литр (N) эквивалентов вещества в 1 литре раствора Титр (Т) Т – количество граммов г⁄мл вещества в 1 мл раствора
Способы выражения концентрации растворов в титриметрии Название Определение Размерность Молярность М – количество молей моль. /литр ( М) вещества в 1 литре раствора Нормальность N – количество грамм- (г-экв)⁄литр (N) эквивалентов вещества в 1 литре раствора Титр (Т) Т – количество граммов г⁄мл вещества в 1 мл раствора
 Объемы реагирующих растворов обратно-пропорциональны их концентрациям, выраженным через нормальность (V/V)=(N/N). Зная нормальность раствора, можно рассчитать его титр, для чего используется зависимость: Т = (Nε) / 1000, где ε – величина грамм-эквивалента вещества
Объемы реагирующих растворов обратно-пропорциональны их концентрациям, выраженным через нормальность (V/V)=(N/N). Зная нормальность раствора, можно рассчитать его титр, для чего используется зависимость: Т = (Nε) / 1000, где ε – величина грамм-эквивалента вещества
 Области применения титриметрии l Определение основных и легирующих элементов в объектах металлургического производства l Аттестация стандартных образцов состава l Как альтернативный независимый метод при контроле правильности ( «круговой» анализ)
Области применения титриметрии l Определение основных и легирующих элементов в объектах металлургического производства l Аттестация стандартных образцов состава l Как альтернативный независимый метод при контроле правильности ( «круговой» анализ)
 Рекомендуемая литература l Карпов Ю. А. , Савостин А. П. , Сальников В. Д. Аналитический контроль в металлургическом производстве: Учебное пособие. –М. : ИКЦ «Академкнига» , 2006. (Гл. 3) Спасибо за внимание.
Рекомендуемая литература l Карпов Ю. А. , Савостин А. П. , Сальников В. Д. Аналитический контроль в металлургическом производстве: Учебное пособие. –М. : ИКЦ «Академкнига» , 2006. (Гл. 3) Спасибо за внимание.