 Количественные отношения в химии Понятия «моль» и «молярная масса»
Количественные отношения в химии Понятия «моль» и «молярная масса»
 l Коэффициент – число, показывающее количество молекул или одиночных атомов. l Коэффициент – численно равен количеству моль вещества, вступающего в реакцию. 2 моль 3 моль 1 моль
l Коэффициент – число, показывающее количество молекул или одиночных атомов. l Коэффициент – численно равен количеству моль вещества, вступающего в реакцию. 2 моль 3 моль 1 моль
 Определения l Моль – порция вещества, которая содержит 6, 02 молекул или атомов. l Постоянная Авогадро N A- l Молярная масса – масса 1 моль вещества. Молярная масса численно равна относительной атомной или молекулярной массе.
Определения l Моль – порция вещества, которая содержит 6, 02 молекул или атомов. l Постоянная Авогадро N A- l Молярная масса – масса 1 моль вещества. Молярная масса численно равна относительной атомной или молекулярной массе.
 l - молярный объем. Объем одного моля любого газа при нормальных условиях равен 22, 4 л. Нормальные условия: температура- 0º С, давление- 1 атм.
l - молярный объем. Объем одного моля любого газа при нормальных условиях равен 22, 4 л. Нормальные условия: температура- 0º С, давление- 1 атм.
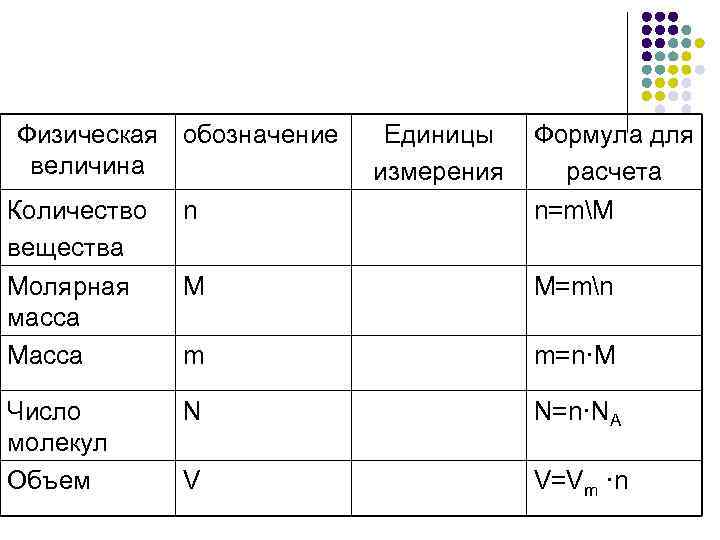 Физическая обозначение Единицы Формула для величина измерения расчета Количество n n=mM вещества Молярная M M=mn масса Масса m m=n·M Число N N=n·NA молекул Объем V V=Vm ·n
Физическая обозначение Единицы Формула для величина измерения расчета Количество n n=mM вещества Молярная M M=mn масса Масса m m=n·M Число N N=n·NA молекул Объем V V=Vm ·n
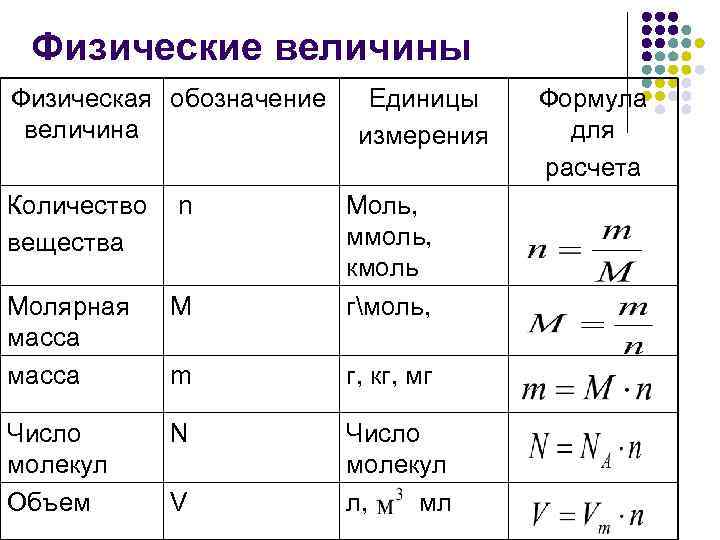 Физические величины Физическая обозначение Единицы Формула величина измерения для расчета Количество n Моль, вещества ммоль, кмоль Молярная М гмоль, масса m г, кг, мг Число N Число молекул Объем V л, мл
Физические величины Физическая обозначение Единицы Формула величина измерения для расчета Количество n Моль, вещества ммоль, кмоль Молярная М гмоль, масса m г, кг, мг Число N Число молекул Объем V л, мл
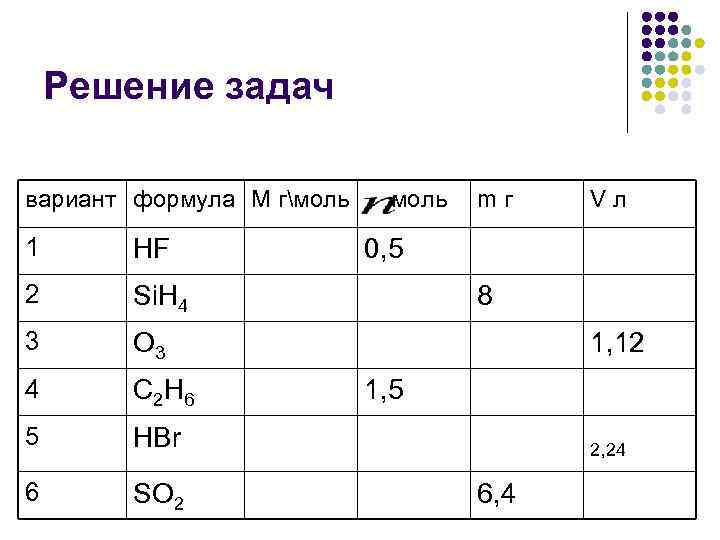 Решение задач вариант формула М гмоль mг Vл 1 HF 0, 5 2 Si. H 4 8 3 O 3 1, 12 4 C 2 H 6 1, 5 5 HBr 2, 24 6 SO 2 6, 4
Решение задач вариант формула М гмоль mг Vл 1 HF 0, 5 2 Si. H 4 8 3 O 3 1, 12 4 C 2 H 6 1, 5 5 HBr 2, 24 6 SO 2 6, 4
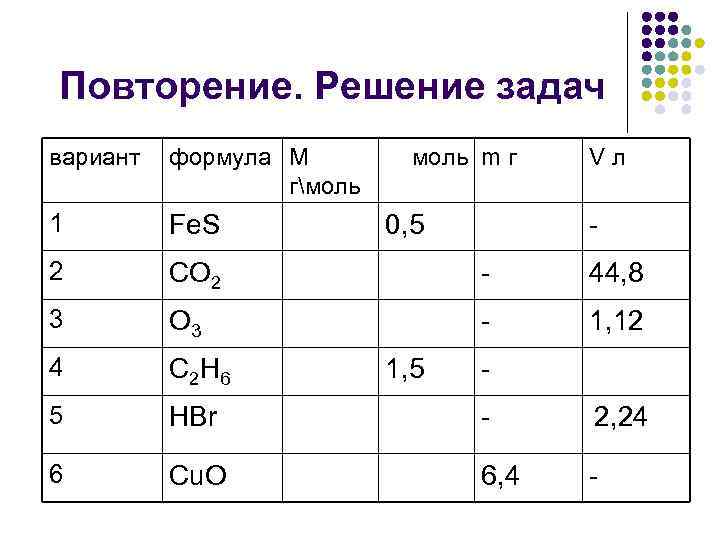 Повторение. Решение задач вариант формула М моль m г Vл гмоль 1 Fe. S 0, 5 - 2 CO 2 - 44, 8 3 O 3 - 1, 12 4 C 2 H 6 1, 5 - 5 HBr - 2, 24 6 Cu. O 6, 4 -
Повторение. Решение задач вариант формула М моль m г Vл гмоль 1 Fe. S 0, 5 - 2 CO 2 - 44, 8 3 O 3 - 1, 12 4 C 2 H 6 1, 5 - 5 HBr - 2, 24 6 Cu. O 6, 4 -
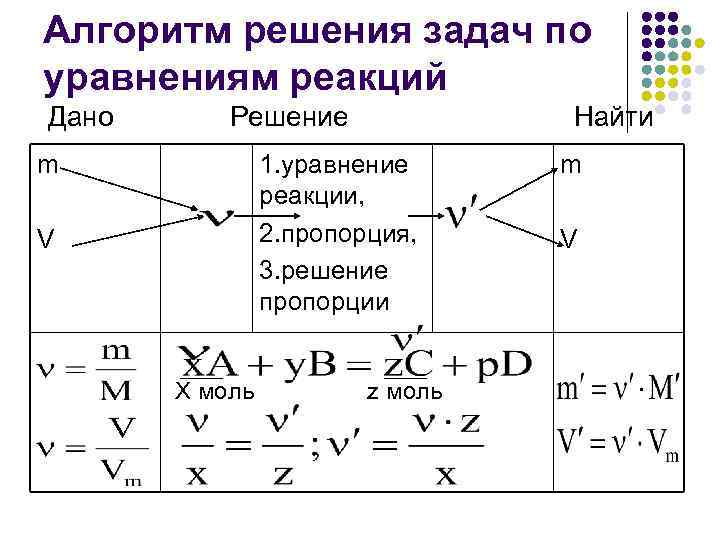 Алгоритм решения задач по уравнениям реакций Дано Решение Найти m 1. уравнение m реакции, V 2. пропорция, V 3. решение пропорции X моль z моль
Алгоритм решения задач по уравнениям реакций Дано Решение Найти m 1. уравнение m реакции, V 2. пропорция, V 3. решение пропорции X моль z моль
 Решение задач Сколько граммов воды потребуется разложить под действием электрического тока, чтобы получить 2, 8 л. кислорода (н. у. ). Дано: V(O 2)=2, 8 л. m( H 2 O)=?
Решение задач Сколько граммов воды потребуется разложить под действием электрического тока, чтобы получить 2, 8 л. кислорода (н. у. ). Дано: V(O 2)=2, 8 л. m( H 2 O)=?
 Решение задач l Сколько граммов оксида фосфора (V) образуется при сжигании 62 г фосфора? l Сколько граммов оксида получится при сжигании в кислороде 5, 4 г. алюминия? l Какая масса хлорида цинка образуется при взаимодействии с соляной кислотой цинка, массой 13 г.
Решение задач l Сколько граммов оксида фосфора (V) образуется при сжигании 62 г фосфора? l Сколько граммов оксида получится при сжигании в кислороде 5, 4 г. алюминия? l Какая масса хлорида цинка образуется при взаимодействии с соляной кислотой цинка, массой 13 г.
 n(Zn)=m/M=13/65=0, 2 моль 0, 2 n' Zn+2 HCl=Zn. Cl 2+H 2 1 1 n ' =0, 2· 11=0, 2 моль (Zn. Cl 2) m(Zn. Cl 2)=0, 2 моль· 136 гмоль=27, 2 г
n(Zn)=m/M=13/65=0, 2 моль 0, 2 n' Zn+2 HCl=Zn. Cl 2+H 2 1 1 n ' =0, 2· 11=0, 2 моль (Zn. Cl 2) m(Zn. Cl 2)=0, 2 моль· 136 гмоль=27, 2 г
 Решение задач с использованием массовой доли l Прочитайте условие задачи 1 на стр. 104. Чем отличается условие этой задачи от решаемых ранее задач? Дано: m (Al)=540· 60%: 100%=324 мг. ν(Al)=324/27=12 ммоль m (Al)=540 мг. ω (прим. )=40% V(H 2)=? Al + HCl→ Al. Cl 3 + H 2↑ ( )=?
Решение задач с использованием массовой доли l Прочитайте условие задачи 1 на стр. 104. Чем отличается условие этой задачи от решаемых ранее задач? Дано: m (Al)=540· 60%: 100%=324 мг. ν(Al)=324/27=12 ммоль m (Al)=540 мг. ω (прим. )=40% V(H 2)=? Al + HCl→ Al. Cl 3 + H 2↑ ( )=?
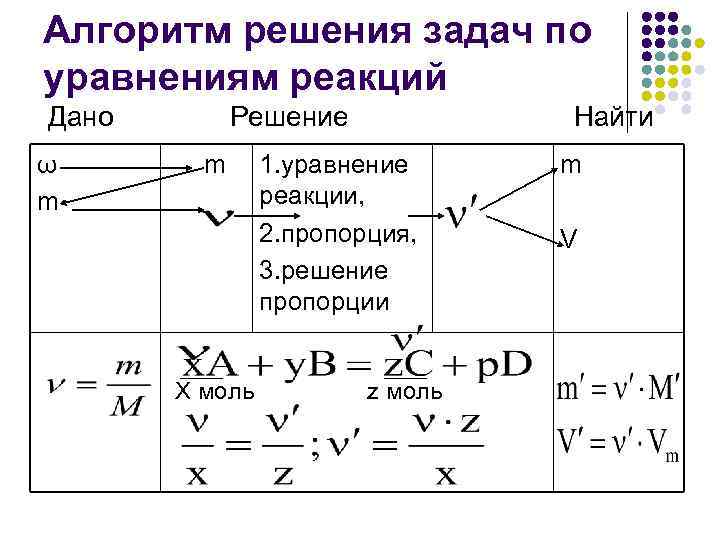 Алгоритм решения задач по уравнениям реакций Дано Решение Найти ω m 1. уравнение m m реакции, 2. пропорция, V 3. решение пропорции X моль z моль
Алгоритм решения задач по уравнениям реакций Дано Решение Найти ω m 1. уравнение m m реакции, 2. пропорция, V 3. решение пропорции X моль z моль
 Решение задач l Определите массу соли, которая образуется при взаимодействии гидроксида калия и раствора серной кислоты, массой 460 г с массовой долей вещества 10%.
Решение задач l Определите массу соли, которая образуется при взаимодействии гидроксида калия и раствора серной кислоты, массой 460 г с массовой долей вещества 10%.