 Коферменты
Коферменты
 Коферменты и кофакторы l l l Для проявления активности многих ферментов необходимы небелковые факторы. Если они представлены органическими соединениями, то их называют коферментами. Если они представлены неорганическими веществами, то их именуют кофакторами. Это низкомолекулярные термостабильные соединения. Коферменты располагаются в активном центре фермента.
Коферменты и кофакторы l l l Для проявления активности многих ферментов необходимы небелковые факторы. Если они представлены органическими соединениями, то их называют коферментами. Если они представлены неорганическими веществами, то их именуют кофакторами. Это низкомолекулярные термостабильные соединения. Коферменты располагаются в активном центре фермента.
 Функции коферментов участие в каталитическом превращении субстрата, l промежуточные переносчики групп от субстрата к ферменту, l присоединение кофермента или кофактора стабилизирует структуру белка фермента. l
Функции коферментов участие в каталитическом превращении субстрата, l промежуточные переносчики групп от субстрата к ферменту, l присоединение кофермента или кофактора стабилизирует структуру белка фермента. l
 Химическое строение коферментов производные водорастворимых витаминов, l производные полипептидов, l производные нуклеотидов и других соединений. l
Химическое строение коферментов производные водорастворимых витаминов, l производные полипептидов, l производные нуклеотидов и других соединений. l
 Водорастворимые витамины как предшественники коферментов l должны присутствовать в пище и всасываться в тонком кишечнике в оптимальных количествах.
Водорастворимые витамины как предшественники коферментов l должны присутствовать в пище и всасываться в тонком кишечнике в оптимальных количествах.
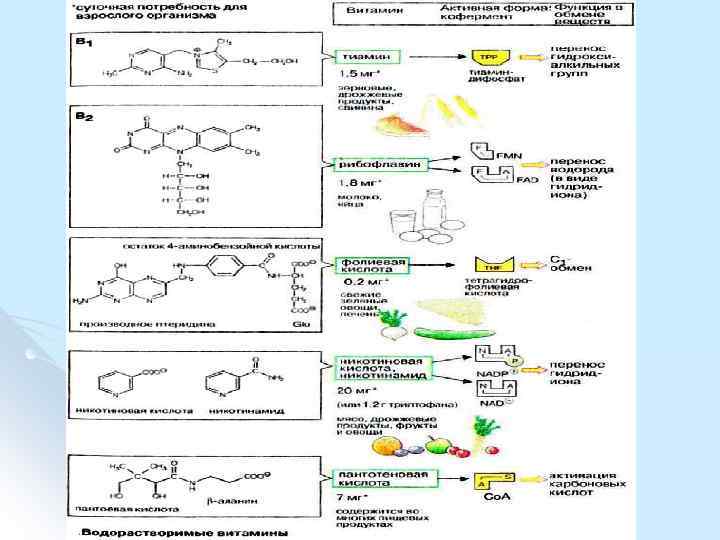
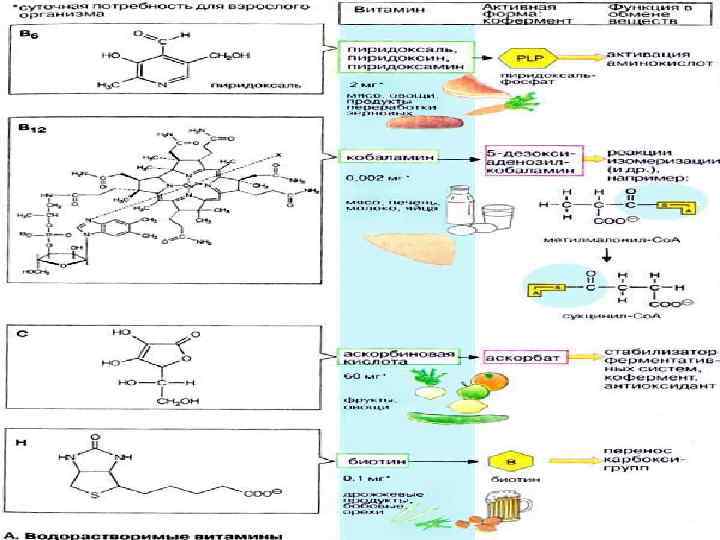
 Витамины l Витамины пищевые незаменимые факторы, которые, присутствуя в небольших количествах в пище обеспечивают нормальное развитие организма животных и человека и адекватную скорость протекания биохимических и физиологических процессов.
Витамины l Витамины пищевые незаменимые факторы, которые, присутствуя в небольших количествах в пище обеспечивают нормальное развитие организма животных и человека и адекватную скорость протекания биохимических и физиологических процессов.
 Болезни при недостатке витаминов – следствие нарушения обмена веществ из за снижения концентрации коферментов. Авитаминозы – болезни, возникающие при полном отсутствии в пище или полном нарушении усвоения какого либо витамина. l Гиповитаминозы болезни, возникающие из за недостаточного поступления или неполного усвоения какого либо витамина. l
Болезни при недостатке витаминов – следствие нарушения обмена веществ из за снижения концентрации коферментов. Авитаминозы – болезни, возникающие при полном отсутствии в пище или полном нарушении усвоения какого либо витамина. l Гиповитаминозы болезни, возникающие из за недостаточного поступления или неполного усвоения какого либо витамина. l
 Причины авитаминозов и гиповитаминозов Экзогенные: отсутствие витамина в пище, недостаточное, неполноценное питание, l Эндогенные: повышенная потребность при некоторых физиологических и патологических состояниях (беременность, лактация, токсикоз, кахексия), усиленный распад витаминов в кишечнике из за развития в нём микрофлоры, нарушение всасывания витаминов при заболеваниях кишечника, болезни печени и поджелудочной железы, религиозные обряды, глистные инвазии, алкоголизм, врождённые нарушения обмена и функций витаминов. l
Причины авитаминозов и гиповитаминозов Экзогенные: отсутствие витамина в пище, недостаточное, неполноценное питание, l Эндогенные: повышенная потребность при некоторых физиологических и патологических состояниях (беременность, лактация, токсикоз, кахексия), усиленный распад витаминов в кишечнике из за развития в нём микрофлоры, нарушение всасывания витаминов при заболеваниях кишечника, болезни печени и поджелудочной железы, религиозные обряды, глистные инвазии, алкоголизм, врождённые нарушения обмена и функций витаминов. l
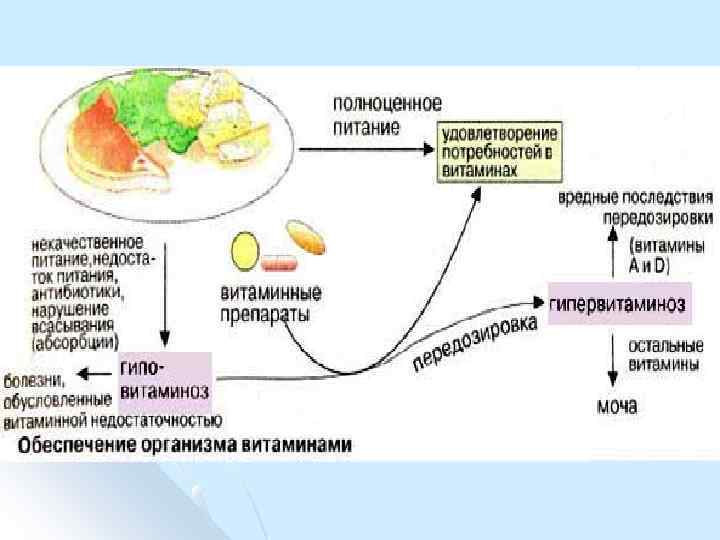
 Гипервитаминозы l патологические состояния, связанные с поступлением больших количеств витаминов в организм (А, D, Е, К).
Гипервитаминозы l патологические состояния, связанные с поступлением больших количеств витаминов в организм (А, D, Е, К).
 Антивитамины структурные аналоги витаминов, l после введения их в организм вызывают авитаминозы или гиповитаминозы. l
Антивитамины структурные аналоги витаминов, l после введения их в организм вызывают авитаминозы или гиповитаминозы. l
 Классификация коферментов по функции l l l коферменты оксидоредуктаз, коферменты трансфераз, коферменты лиаз. коферменты изомераз, коферменты лигаз.
Классификация коферментов по функции l l l коферменты оксидоредуктаз, коферменты трансфераз, коферменты лиаз. коферменты изомераз, коферменты лигаз.
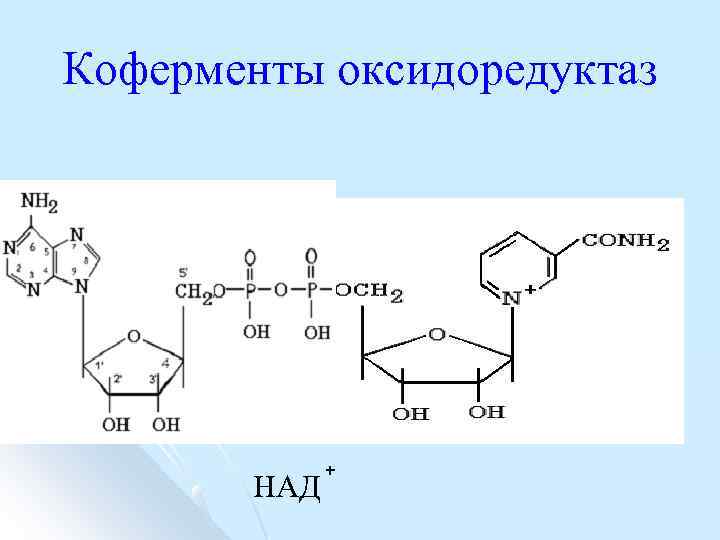 Коферменты оксидоредуктаз НАД +
Коферменты оксидоредуктаз НАД +
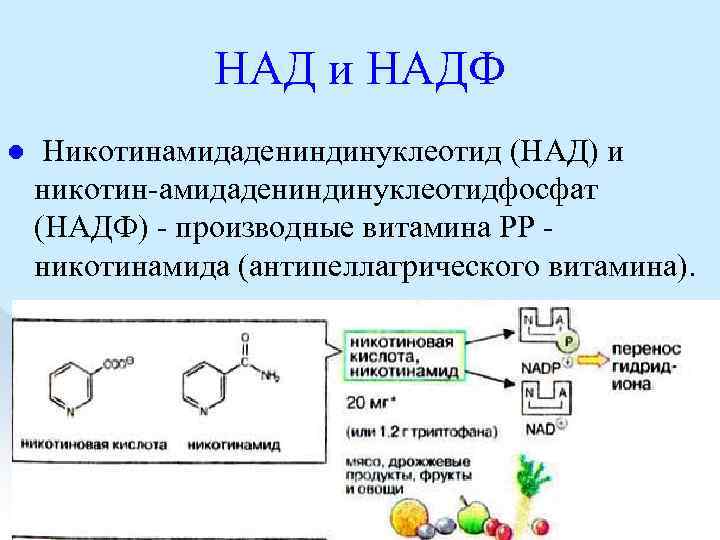 НАД и НАДФ l Никотинамидадениндинуклеотид (НАД) и никотин амидадениндинуклеотидфосфат (НАДФ) производные витамина РР никотинамида (антипеллагрического витамина).
НАД и НАДФ l Никотинамидадениндинуклеотид (НАД) и никотин амидадениндинуклеотидфосфат (НАДФ) производные витамина РР никотинамида (антипеллагрического витамина).
 Пеллагра авитаминоз РР. дерматит, l деменция, l диарея. Симптомы пеллагры наиболее резко выражены у больных с недостаточным белковым питанием. Это объясняется недостатком триптофана, который является предшественником никотинамида. l
Пеллагра авитаминоз РР. дерматит, l деменция, l диарея. Симптомы пеллагры наиболее резко выражены у больных с недостаточным белковым питанием. Это объясняется недостатком триптофана, который является предшественником никотинамида. l
 Пищевые источники витамина РР дрожжи, l продукты животного происхождения, l гречиха, l грибы. l
Пищевые источники витамина РР дрожжи, l продукты животного происхождения, l гречиха, l грибы. l
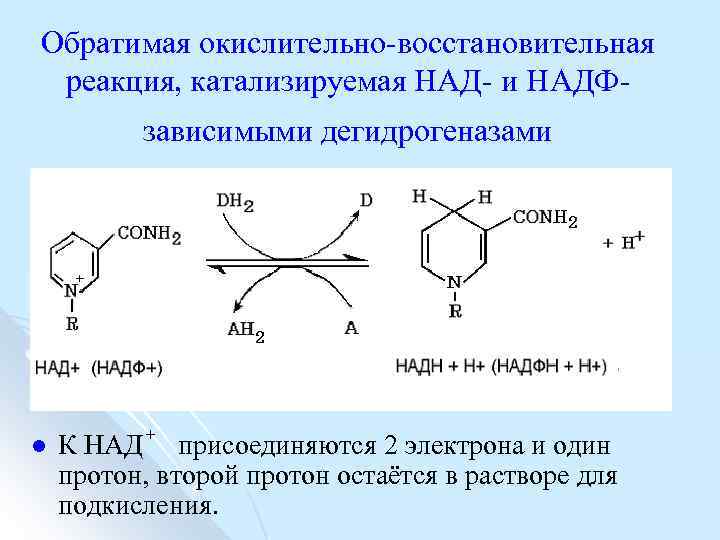 Обратимая окислительно восстановительная реакция, катализируемая НАД и НАДФ зависимыми дегидрогеназами l К НАД + присоединяются 2 электрона и один протон, второй протон остаётся в растворе для подкисления.
Обратимая окислительно восстановительная реакция, катализируемая НАД и НАДФ зависимыми дегидрогеназами l К НАД + присоединяются 2 электрона и один протон, второй протон остаётся в растворе для подкисления.
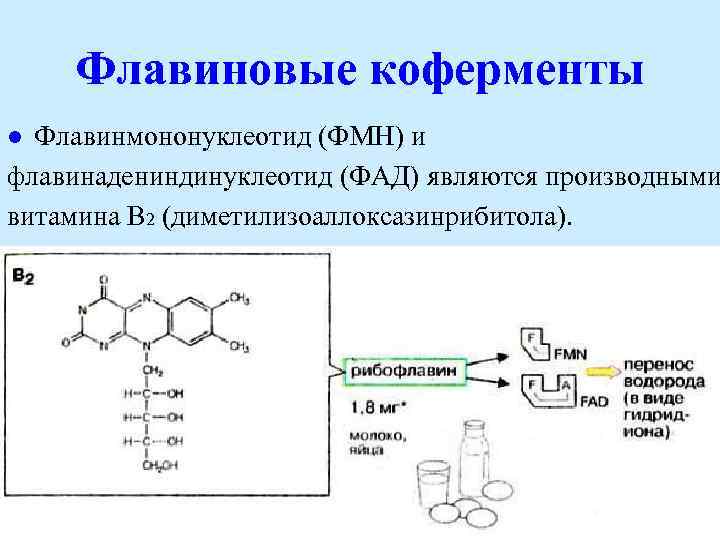 Флавиновые коферменты Флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД) являются производными витамина В 2 (диметилизоаллоксазинрибитола). l
Флавиновые коферменты Флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД) являются производными витамина В 2 (диметилизоаллоксазинрибитола). l
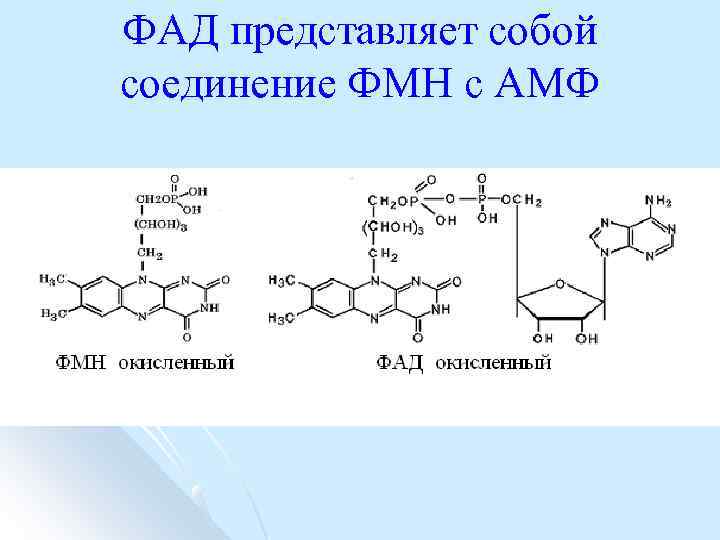 ФАД представляет собой соединение ФМН с АМФ
ФАД представляет собой соединение ФМН с АМФ
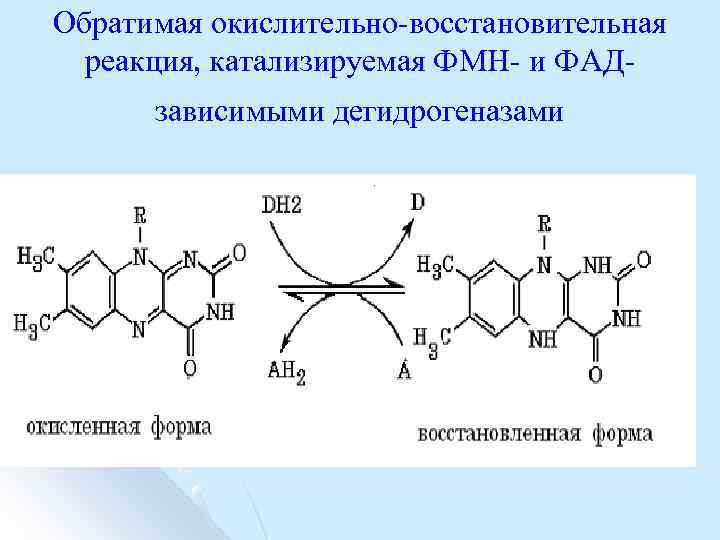 Обратимая окислительно восстановительная реакция, катализируемая ФМН и ФАД зависимыми дегидрогеназами
Обратимая окислительно восстановительная реакция, катализируемая ФМН и ФАД зависимыми дегидрогеназами
 Дефицит витамина В 2 расстройство пищеварения и нервной системы, l хронические гастриты и колиты, l общая слабость, l кожные заболевания, l снижает сопротивляемость болезням. l
Дефицит витамина В 2 расстройство пищеварения и нервной системы, l хронические гастриты и колиты, l общая слабость, l кожные заболевания, l снижает сопротивляемость болезням. l
 Пищевые источники витамина В 2 l l l капуста, горох, яблоки, зеленая фасоль, помидоры, репа, дрожжи, яйца, печень, мясо, молоко.
Пищевые источники витамина В 2 l l l капуста, горох, яблоки, зеленая фасоль, помидоры, репа, дрожжи, яйца, печень, мясо, молоко.
 Коэнзим Q (убихинон) l представляет собой 2, 3 диметоксихинон 5 метил, замещенный в 6 м положении полиизопреновой цепью. l В дыхательной цепи окисленная форма убихинона в результате внутримолекулярного перемещения двойных связей переходит в восстановленную форму.
Коэнзим Q (убихинон) l представляет собой 2, 3 диметоксихинон 5 метил, замещенный в 6 м положении полиизопреновой цепью. l В дыхательной цепи окисленная форма убихинона в результате внутримолекулярного перемещения двойных связей переходит в восстановленную форму.
 Глутатион l трипептид глутамилцистеинилглицин (GSН),
Глутатион l трипептид глутамилцистеинилглицин (GSН),
 В окисленной форме глутатион гексапептид (GSSG)
В окисленной форме глутатион гексапептид (GSSG)
 Восстановление пероксида водорода или органических пероксидов RООН с участием антиоксидантного фермента глутатионпероксидазы:
Восстановление пероксида водорода или органических пероксидов RООН с участием антиоксидантного фермента глутатионпероксидазы:
 Как кофермент GSН участвует в реакции транспорта ами нокислот через мембраны клеток. l Процесс катализируется трансферазным ферментом γ глутамилтранспептидазой. l
Как кофермент GSН участвует в реакции транспорта ами нокислот через мембраны клеток. l Процесс катализируется трансферазным ферментом γ глутамилтранспептидазой. l
 Липоевая кислота l l Как кофермент, амид липоевой кислоты участвует в окислительном декарбоксилировании пировиноградной кислоты в пируватдегидрогеназном комплексе и α кетоглутаратдегидрогеназной реакции в цикле трикарбоновых кислот (ЦТК). Окисленная форма содержит дисульфидную связь, которая разрывается при восстановлении с образованием сульфгидрильных групп SН.
Липоевая кислота l l Как кофермент, амид липоевой кислоты участвует в окислительном декарбоксилировании пировиноградной кислоты в пируватдегидрогеназном комплексе и α кетоглутаратдегидрогеназной реакции в цикле трикарбоновых кислот (ЦТК). Окисленная форма содержит дисульфидную связь, которая разрывается при восстановлении с образованием сульфгидрильных групп SН.
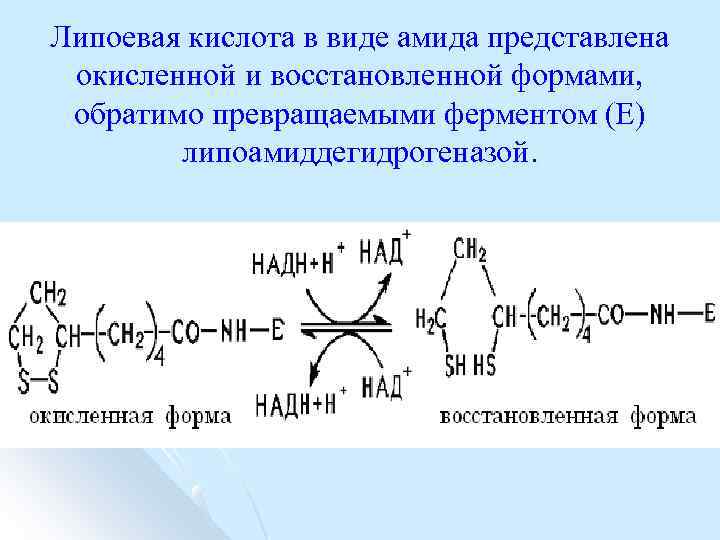 Липоевая кислота в виде амида представлена окисленной и восстановленной формами, обратимо превращаемыми ферментом (Е) липоамиддегидрогеназой.
Липоевая кислота в виде амида представлена окисленной и восстановленной формами, обратимо превращаемыми ферментом (Е) липоамиддегидрогеназой.
 Порфириновые коферменты l В цитохромах и каталазе изменения валентности Fе порфириновых коферментов (гема и его производных) связаны с обратимой окислительно восстановительной реакцией, которую они катализируют. 3+ l Электрон от донора присоединяется к Fе гема.
Порфириновые коферменты l В цитохромах и каталазе изменения валентности Fе порфириновых коферментов (гема и его производных) связаны с обратимой окислительно восстановительной реакцией, которую они катализируют. 3+ l Электрон от донора присоединяется к Fе гема.
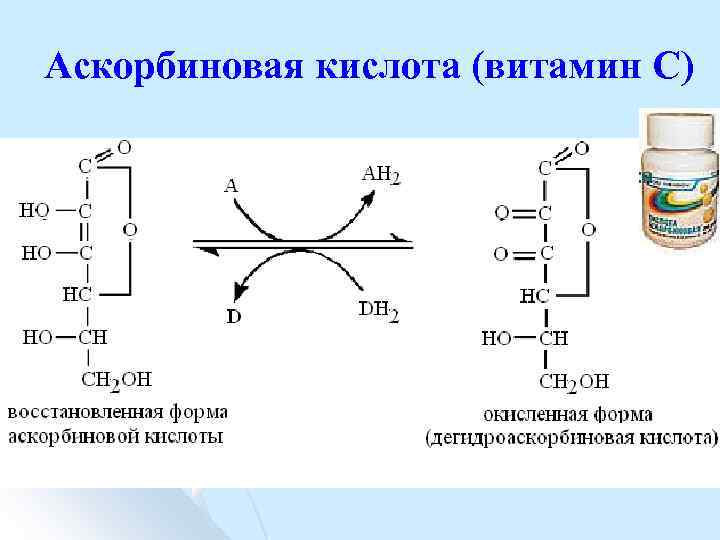 Аскорбиновая кислота (витамин С)
Аскорбиновая кислота (витамин С)
 Пищевые источники витамина С цитрусовые, l шиповник, l капуста, l черная смородина, l редька, l картофель, l помидоры. l
Пищевые источники витамина С цитрусовые, l шиповник, l капуста, l черная смородина, l редька, l картофель, l помидоры. l
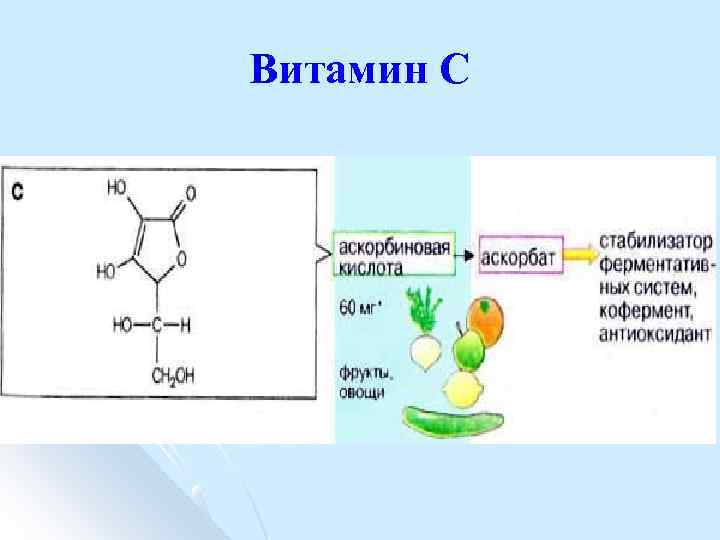 Витамин С
Витамин С
 Функции витамина С l l l l стимулирует работу ЦНС, улучшает общее самочувствие, настроение, повышает сопротивляемость организма, участвует в окислительно восстановительных реакциях, нормализует обмен холестерина, способствует усвоению железа и нормальному кроветворению, укрепляет кровеносные сосуды, кости, заживляет раны, участвуя в синтезе коллагена, антиоксидант.
Функции витамина С l l l l стимулирует работу ЦНС, улучшает общее самочувствие, настроение, повышает сопротивляемость организма, участвует в окислительно восстановительных реакциях, нормализует обмен холестерина, способствует усвоению железа и нормальному кроветворению, укрепляет кровеносные сосуды, кости, заживляет раны, участвуя в синтезе коллагена, антиоксидант.
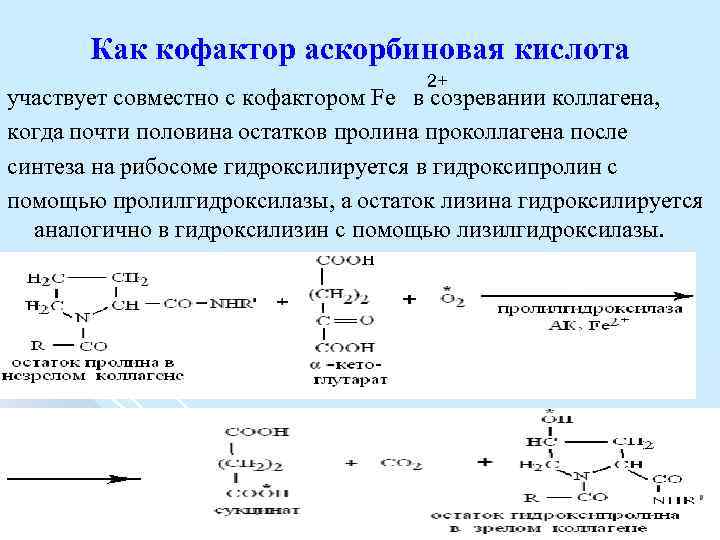 Как кофактор аскорбиновая кислота 2+ участвует совместно с кофактором Fе в созревании коллагена, когда почти половина остатков пролина проколлагена после синтеза на рибосоме гидроксилируется в гидроксипролин с помощью пролилгидроксилазы, а остаток лизина гидроксилируется аналогично в гидроксилизин с помощью лизилгидроксилазы.
Как кофактор аскорбиновая кислота 2+ участвует совместно с кофактором Fе в созревании коллагена, когда почти половина остатков пролина проколлагена после синтеза на рибосоме гидроксилируется в гидроксипролин с помощью пролилгидроксилазы, а остаток лизина гидроксилируется аналогично в гидроксилизин с помощью лизилгидроксилазы.
 Враги витамина С За 1 час стресса уничтожается дневная норма витамина С. l Каждая сигарета «крадёт» у организма 10 мг витамина С. l
Враги витамина С За 1 час стресса уничтожается дневная норма витамина С. l Каждая сигарета «крадёт» у организма 10 мг витамина С. l
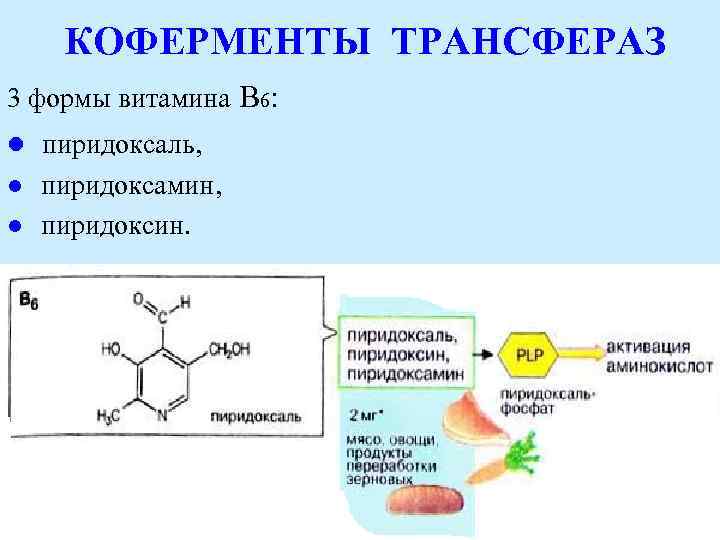 КОФЕРМЕНТЫ ТРАНСФЕРАЗ 3 формы витамина В 6: l пиридоксаль, l l пиридоксамин, пиридоксин.
КОФЕРМЕНТЫ ТРАНСФЕРАЗ 3 формы витамина В 6: l пиридоксаль, l l пиридоксамин, пиридоксин.
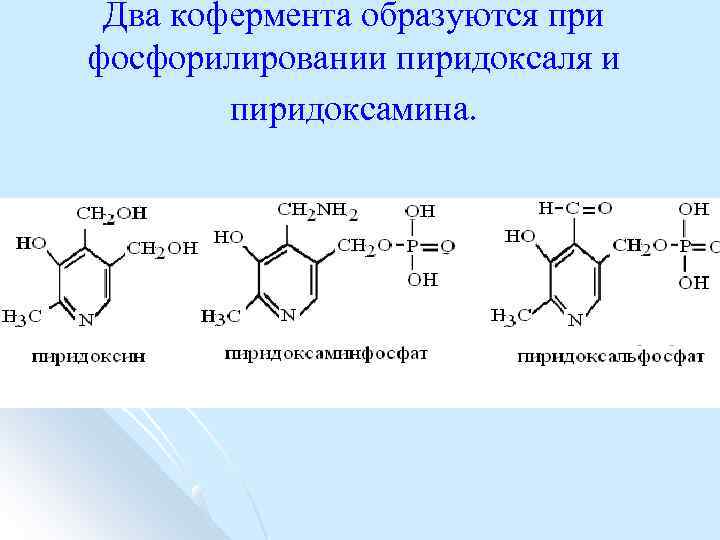 Два кофермента образуются при фосфорилировании пиридоксаля и пиридоксамина.
Два кофермента образуются при фосфорилировании пиридоксаля и пиридоксамина.
 Основные пищевые источники витамина В 6 каши из недробленых круп, l хлеб из муки грубого помола, l мясо, l рыба, l печень, l большинство растительных продуктов, l дрожжи. l
Основные пищевые источники витамина В 6 каши из недробленых круп, l хлеб из муки грубого помола, l мясо, l рыба, l печень, l большинство растительных продуктов, l дрожжи. l
 Дефицит пиридоксина может вызвать l l отит, дерматит.
Дефицит пиридоксина может вызвать l l отит, дерматит.
 Пиридоксальфосфат –кофермент трансаминаз
Пиридоксальфосфат –кофермент трансаминаз
 Пиридоксальфосфат –кофермент аминотрансфераз, l декарбоксилаз. l при неокислительном дезаминировании серина и треонина, l при окислении триптофана, l при превращении серосодержащих АМК, l при взаимопревращении серина и глицина, l в синтезе γ аминолевулиновой кислоты. l
Пиридоксальфосфат –кофермент аминотрансфераз, l декарбоксилаз. l при неокислительном дезаминировании серина и треонина, l при окислении триптофана, l при превращении серосодержащих АМК, l при взаимопревращении серина и глицина, l в синтезе γ аминолевулиновой кислоты. l
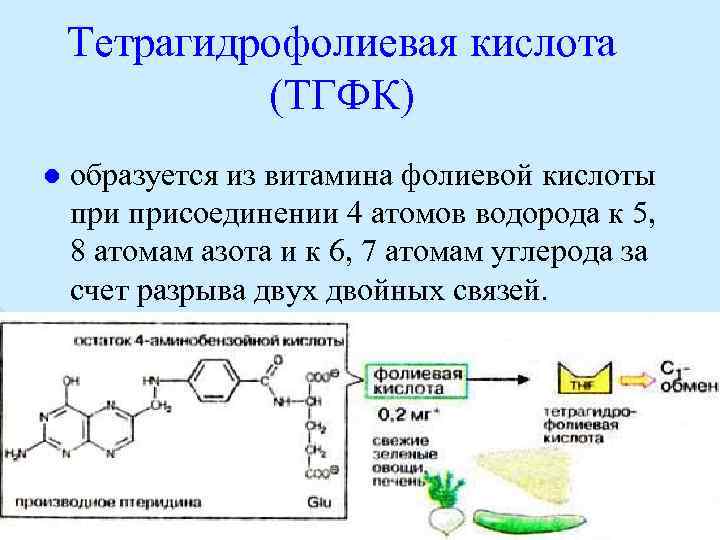 Тетрагидрофолиевая кислота (ТГФК) l образуется из витамина фолиевой кислоты присоединении 4 атомов водорода к 5, 8 атомам азота и к 6, 7 атомам углерода за счет разрыва двух двойных связей.
Тетрагидрофолиевая кислота (ТГФК) l образуется из витамина фолиевой кислоты присоединении 4 атомов водорода к 5, 8 атомам азота и к 6, 7 атомам углерода за счет разрыва двух двойных связей.
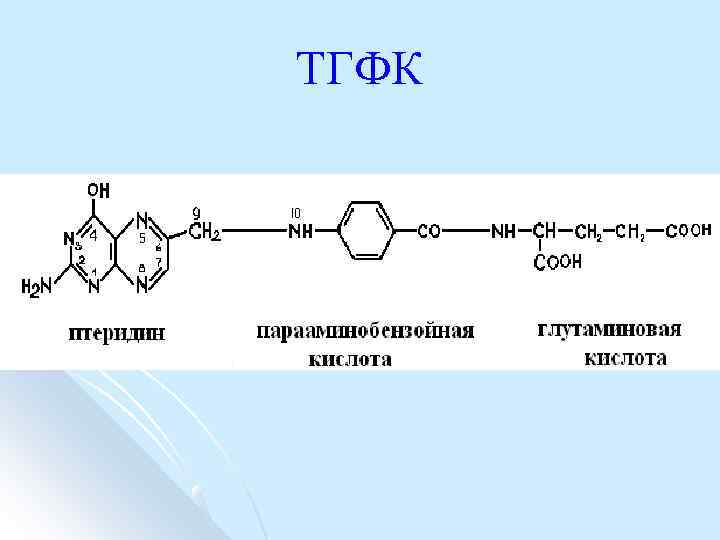 ТГФК
ТГФК
 Фолиевая кислота содержится в салате, l капусте, l шпинате, l петрушке, l томате, l злаках, l печени, l говядине, l яичном желтке. l
Фолиевая кислота содержится в салате, l капусте, l шпинате, l петрушке, l томате, l злаках, l печени, l говядине, l яичном желтке. l
 При дефиците фолиевой кислоты l у человека развивается макроцитарная анемия.
При дефиците фолиевой кислоты l у человека развивается макроцитарная анемия.
 ТГФК участвует в синтезе пуринов и пиримидинов, l обмене АМК (взаимопревращении серина и глицина), l биосинтезе метионина. l
ТГФК участвует в синтезе пуринов и пиримидинов, l обмене АМК (взаимопревращении серина и глицина), l биосинтезе метионина. l
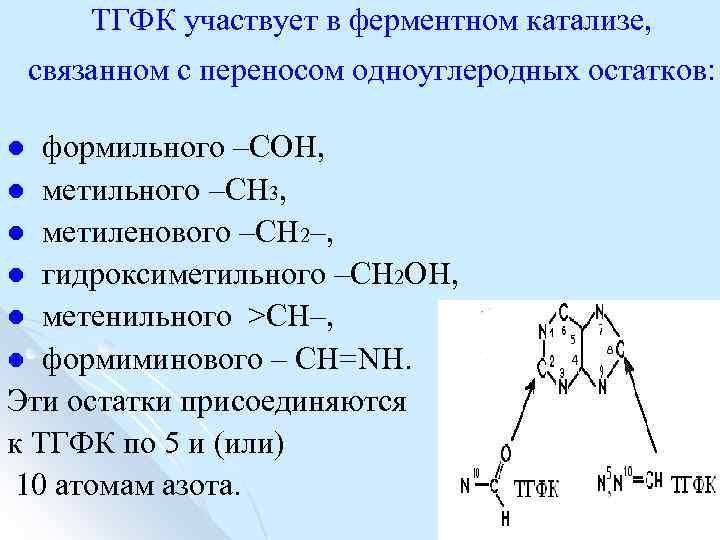 ТГФК участвует в ферментном катализе, связанном с переносом одноуглеродных остатков: формильного –СОН, l метильного –СН 3, l метиленового –СН 2–, l гидроксиметильного –СН 2 ОН, l метенильного >СН–, l формиминового – CH=NH. Эти остатки присоединяются к ТГФК по 5 и (или) 10 атомам азота. l
ТГФК участвует в ферментном катализе, связанном с переносом одноуглеродных остатков: формильного –СОН, l метильного –СН 3, l метиленового –СН 2–, l гидроксиметильного –СН 2 ОН, l метенильного >СН–, l формиминового – CH=NH. Эти остатки присоединяются к ТГФК по 5 и (или) 10 атомам азота. l
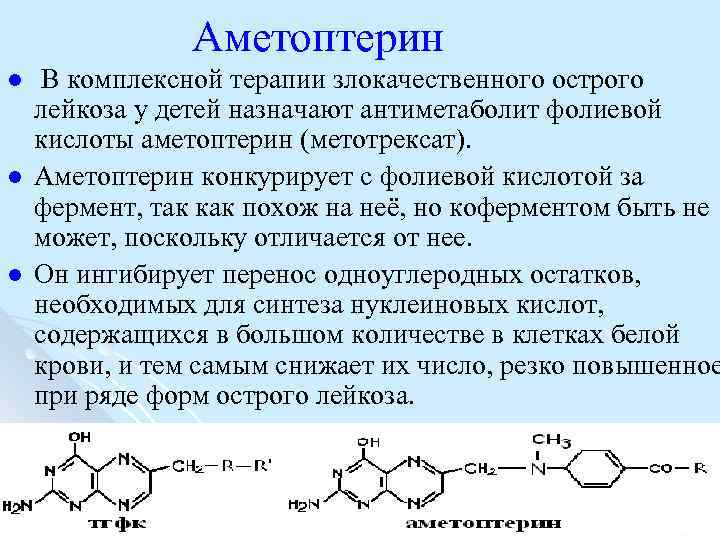 Аметоптерин l l l В комплексной терапии злокачественного острого лейкоза у детей назначают антиметаболит фолиевой кислоты аметоптерин (метотрексат). Аметоптерин конкурирует с фолиевой кислотой за фермент, так как похож на неё, но коферментом быть не может, поскольку отличается от нее. Он ингибирует перенос одноуглеродных остатков, необходимых для синтеза нуклеиновых кислот, содержащихся в большом количестве в клетках белой крови, и тем самым снижает их число, резко повышенное при ряде форм острого лейкоза.
Аметоптерин l l l В комплексной терапии злокачественного острого лейкоза у детей назначают антиметаболит фолиевой кислоты аметоптерин (метотрексат). Аметоптерин конкурирует с фолиевой кислотой за фермент, так как похож на неё, но коферментом быть не может, поскольку отличается от нее. Он ингибирует перенос одноуглеродных остатков, необходимых для синтеза нуклеиновых кислот, содержащихся в большом количестве в клетках белой крови, и тем самым снижает их число, резко повышенное при ряде форм острого лейкоза.
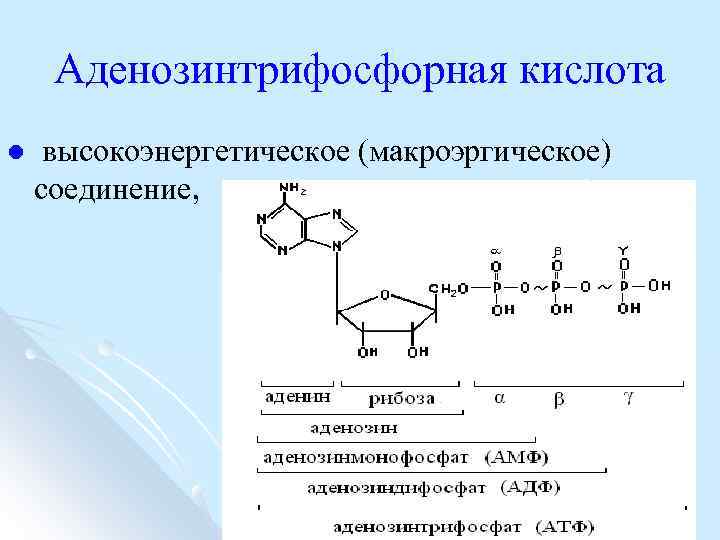 Аденозинтрифосфорная кислота l высокоэнергетическое (макроэргическое) соединение,
Аденозинтрифосфорная кислота l высокоэнергетическое (макроэргическое) соединение,
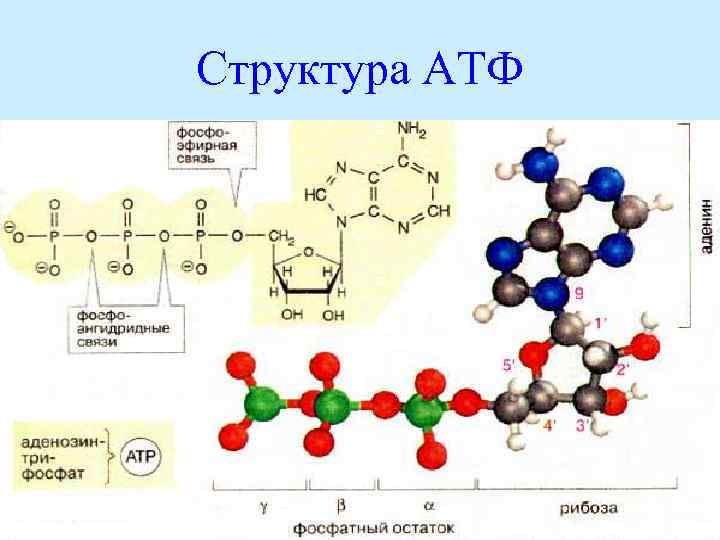 Структура АТФ
Структура АТФ
 При химических реакциях энергия макроэргических связей АТФ может переноситься на другие соединения, превращая их в макроэргические, l использоваться при синтезах, l использоваться при сокращении мышц, l использоваться при активном транспорте, l использоваться при нервном возбуждении. l
При химических реакциях энергия макроэргических связей АТФ может переноситься на другие соединения, превращая их в макроэргические, l использоваться при синтезах, l использоваться при сокращении мышц, l использоваться при активном транспорте, l использоваться при нервном возбуждении. l
 Как кофермент, АТФ участвует в реакциях 4 типов 1. Перенос ортофосфата (в гликолизе, катализируемый гексокиназой с участием кофактора Mg 2+ ):
Как кофермент, АТФ участвует в реакциях 4 типов 1. Перенос ортофосфата (в гликолизе, катализируемый гексокиназой с участием кофактора Mg 2+ ):
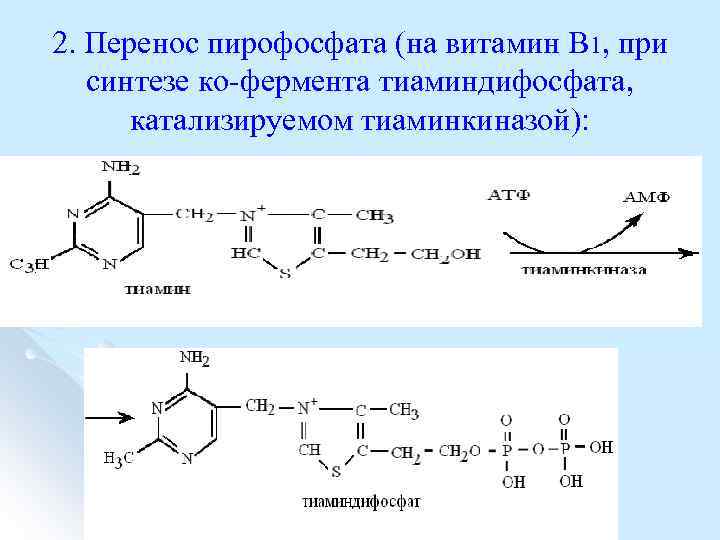 2. Перенос пирофосфата (на витамин В 1, при синтезе ко фермента тиаминдифосфата, катализируемом тиаминкиназой):
2. Перенос пирофосфата (на витамин В 1, при синтезе ко фермента тиаминдифосфата, катализируемом тиаминкиназой):
 3. Перенос аденилата (при активировании α аминокислот, катализируемом аминоацил т. РНК синтетазами в биосинтезе белка):
3. Перенос аденилата (при активировании α аминокислот, катализируемом аминоацил т. РНК синтетазами в биосинтезе белка):
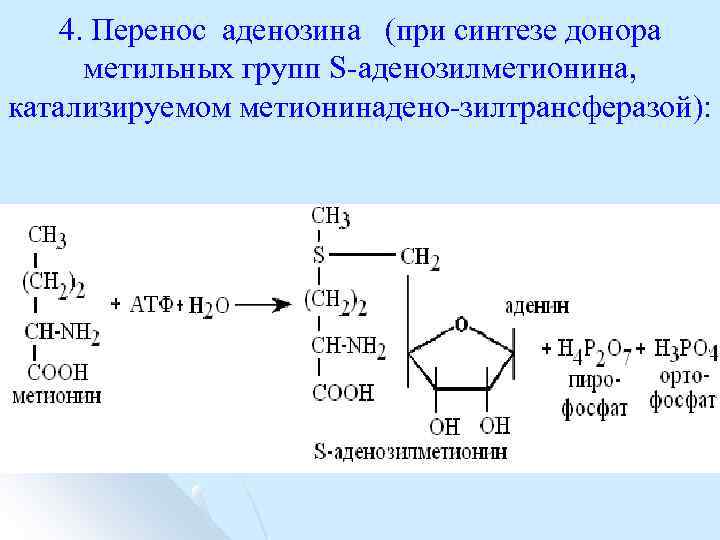 4. Перенос аденозина (при синтезе донора метильных групп S аденозилметионина, катализируемом метионинадено зилтрансферазой):
4. Перенос аденозина (при синтезе донора метильных групп S аденозилметионина, катализируемом метионинадено зилтрансферазой):
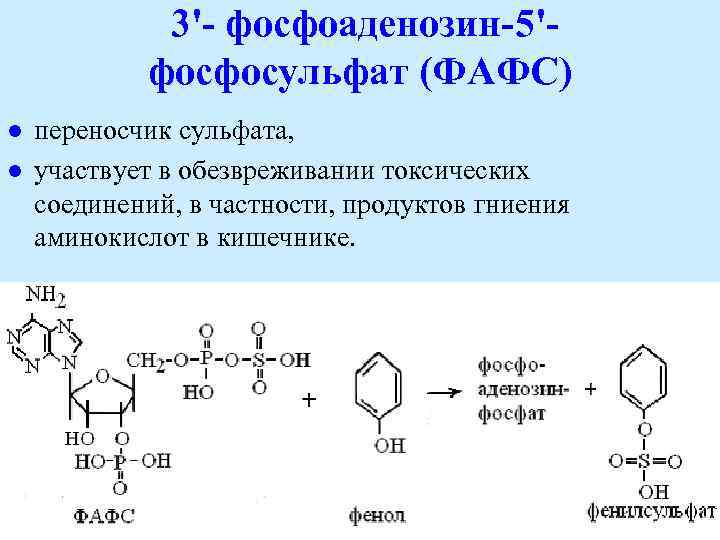 3'- фосфоаденозин-5'фосфосульфат (ФАФС) l l переносчик сульфата, участвует в обезвреживании токсических соединений, в частности, продуктов гниения аминокислот в кишечнике.
3'- фосфоаденозин-5'фосфосульфат (ФАФС) l l переносчик сульфата, участвует в обезвреживании токсических соединений, в частности, продуктов гниения аминокислот в кишечнике.
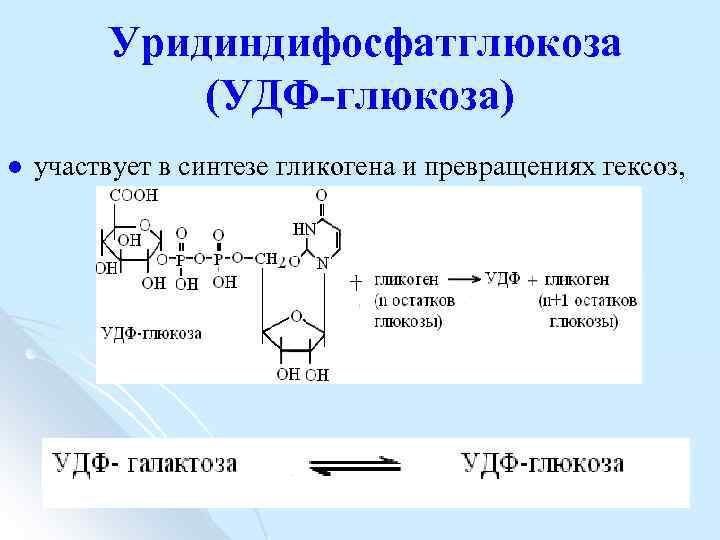 Уридиндифосфатглюкоза (УДФ-глюкоза) l участвует в синтезе гликогена и превращениях гексоз,
Уридиндифосфатглюкоза (УДФ-глюкоза) l участвует в синтезе гликогена и превращениях гексоз,
 Уридиндифосфатглюкуронид (УДФ-глюкуронид) l участвует в обезвреживании токсических продуктов, обезвреживании билирубина.
Уридиндифосфатглюкуронид (УДФ-глюкуронид) l участвует в обезвреживании токсических продуктов, обезвреживании билирубина.
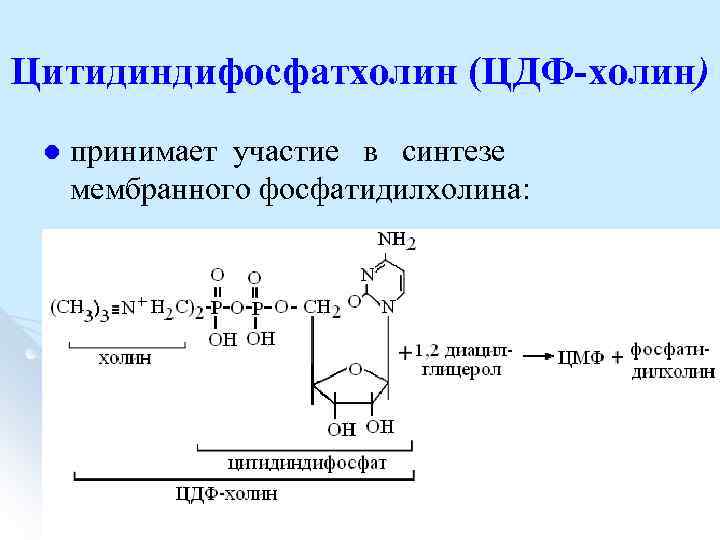 Цитидиндифосфатхолин (ЦДФ-холин) l принимает участие в синтезе мембранного фосфатидилхолина:
Цитидиндифосфатхолин (ЦДФ-холин) l принимает участие в синтезе мембранного фосфатидилхолина:
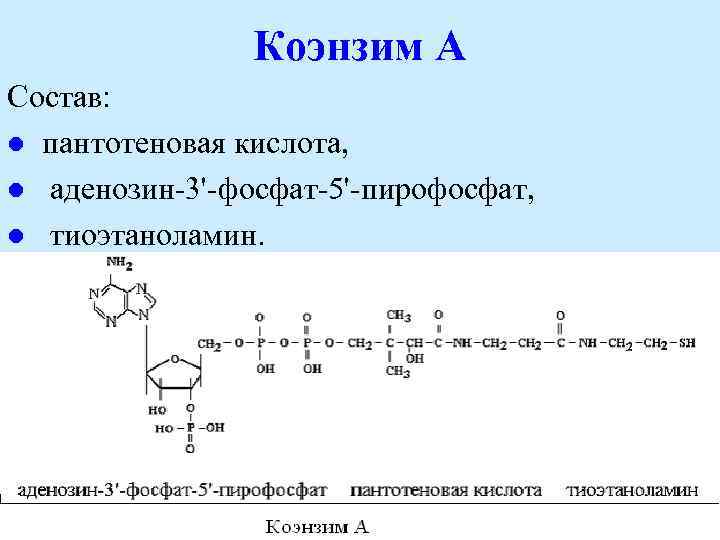 Коэнзим А Состав: l пантотеновая кислота, l аденозин 3' фосфат 5' пирофосфат, l тиоэтаноламин.
Коэнзим А Состав: l пантотеновая кислота, l аденозин 3' фосфат 5' пирофосфат, l тиоэтаноламин.
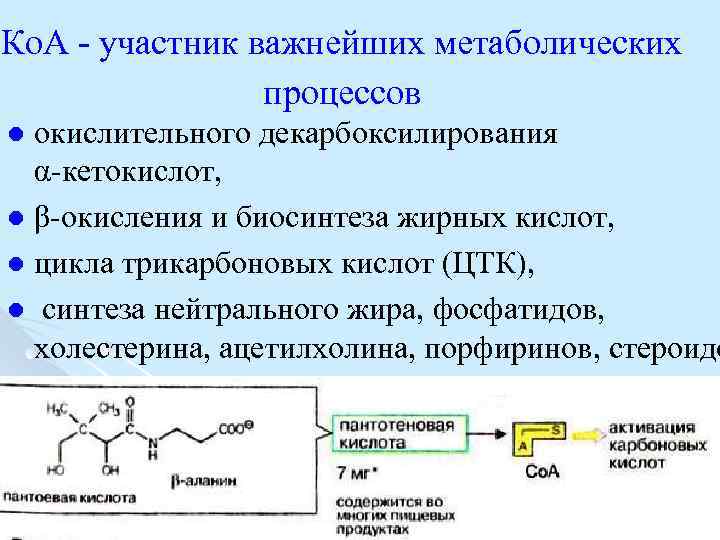 Ко. А участник важнейших метаболических процессов окислительного декарбоксилирования α кетокислот, l β окисления и биосинтеза жирных кислот, l цикла трикарбоновых кислот (ЦТК), l синтеза нейтрального жира, фосфатидов, холестерина, ацетилхолина, порфиринов, стероидо l
Ко. А участник важнейших метаболических процессов окислительного декарбоксилирования α кетокислот, l β окисления и биосинтеза жирных кислот, l цикла трикарбоновых кислот (ЦТК), l синтеза нейтрального жира, фосфатидов, холестерина, ацетилхолина, порфиринов, стероидо l
 Синтез ацетилхолина, катализируемый ацетил Ко. А ацетилтрансферазой:
Синтез ацетилхолина, катализируемый ацетил Ко. А ацетилтрансферазой:
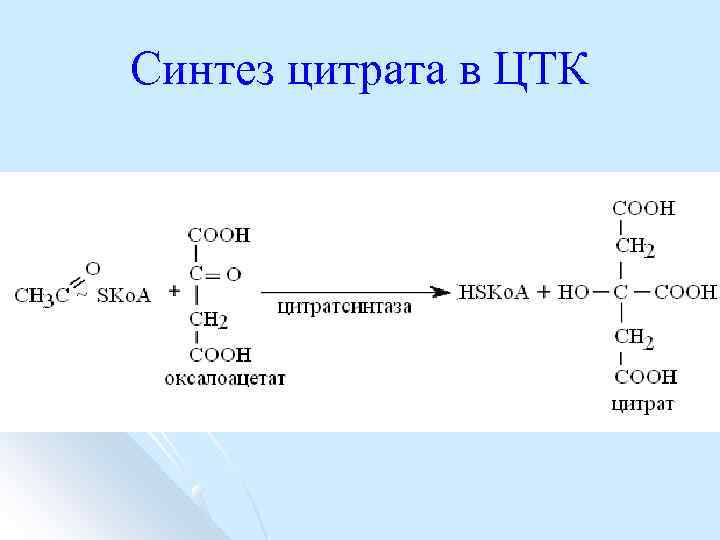 Синтез цитрата в ЦТК
Синтез цитрата в ЦТК
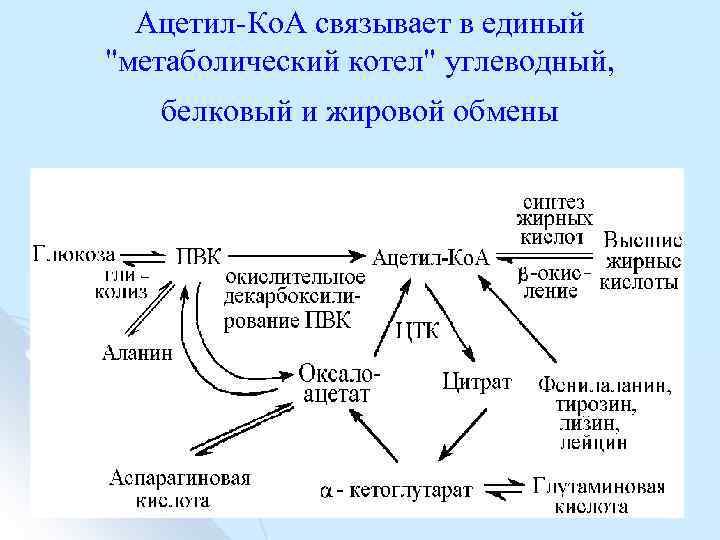 Ацетил Ко. А связывает в единый "метаболический котел" углеводный, белковый и жировой обмены
Ацетил Ко. А связывает в единый "метаболический котел" углеводный, белковый и жировой обмены
 КОФЕРМЕНТЫ ЛИАЗ l l ТПФ, Ко. А, ФП, витамин К,
КОФЕРМЕНТЫ ЛИАЗ l l ТПФ, Ко. А, ФП, витамин К,
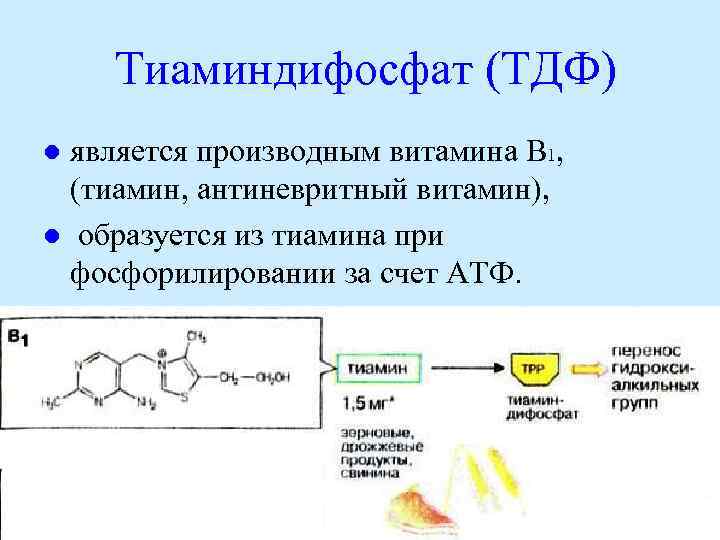 Тиаминдифосфат (ТДФ) является производным витамина В 1, (тиамин, антиневритный витамин), l образуется из тиамина при фосфорилировании за счет АТФ. l
Тиаминдифосфат (ТДФ) является производным витамина В 1, (тиамин, антиневритный витамин), l образуется из тиамина при фосфорилировании за счет АТФ. l
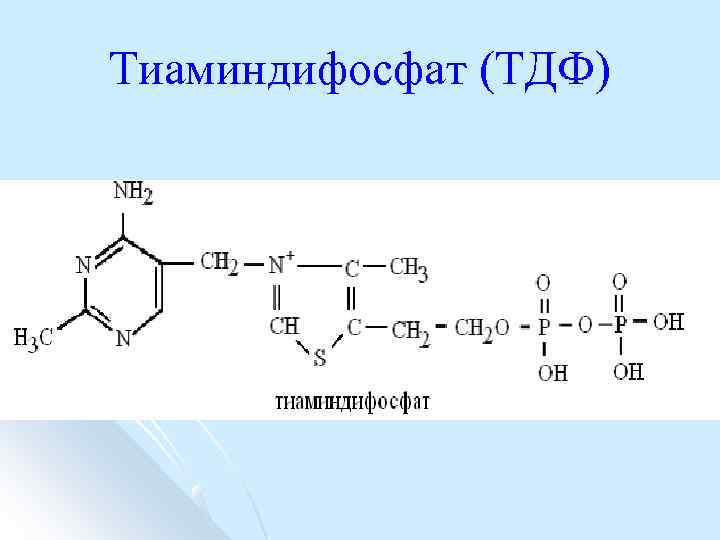 Тиаминдифосфат (ТДФ)
Тиаминдифосфат (ТДФ)
 Содержится тиамин в отрубях злаков, l картофеле, l дрожжах, l печени. l
Содержится тиамин в отрубях злаков, l картофеле, l дрожжах, l печени. l
 Авитаминоз В 1 l бери (полиневрит).
Авитаминоз В 1 l бери (полиневрит).
 Биологическая роль ТДФ окислительное декарбоксилирование ПВК, l окислительное декарбоксилирование α кетоглутарата, l кофермент транскетолазы, l кофермент пируватдекабоксилазы, l кофермент ДГ γ оксиглутаровой кислоты. l
Биологическая роль ТДФ окислительное декарбоксилирование ПВК, l окислительное декарбоксилирование α кетоглутарата, l кофермент транскетолазы, l кофермент пируватдекабоксилазы, l кофермент ДГ γ оксиглутаровой кислоты. l
 Витамин К К классу лиаз относится γ глутаматкарбоксилаза, кофактором которой служит жирорастворимый витамин К (антигеморрагический).
Витамин К К классу лиаз относится γ глутаматкарбоксилаза, кофактором которой служит жирорастворимый витамин К (антигеморрагический).
 Пищевые источники витамина К крапива. l Человек получает достаточное количество витамина К с пищей, а также за счет синтеза кишечной микрофлорой. l Недостаточность витамина К может наступить из за нарушения всасывания жиров в кишечнике, вместе с кото рыми всасывается витамин К. l
Пищевые источники витамина К крапива. l Человек получает достаточное количество витамина К с пищей, а также за счет синтеза кишечной микрофлорой. l Недостаточность витамина К может наступить из за нарушения всасывания жиров в кишечнике, вместе с кото рыми всасывается витамин К. l
 Недостаточность витамина К нарушается свертывание крови, l возникает кровотечение. Для предупреждения и лечения геморрагии назначают витамин К. l
Недостаточность витамина К нарушается свертывание крови, l возникает кровотечение. Для предупреждения и лечения геморрагии назначают витамин К. l
 Различают витамин К 1 (филлохинон) в растениях, l витамин К 2 (метахинон) в тканях животных, l витамин К 3 – искусственно синтезированный водорастворимый витамин. l
Различают витамин К 1 (филлохинон) в растениях, l витамин К 2 (метахинон) в тканях животных, l витамин К 3 – искусственно синтезированный водорастворимый витамин. l
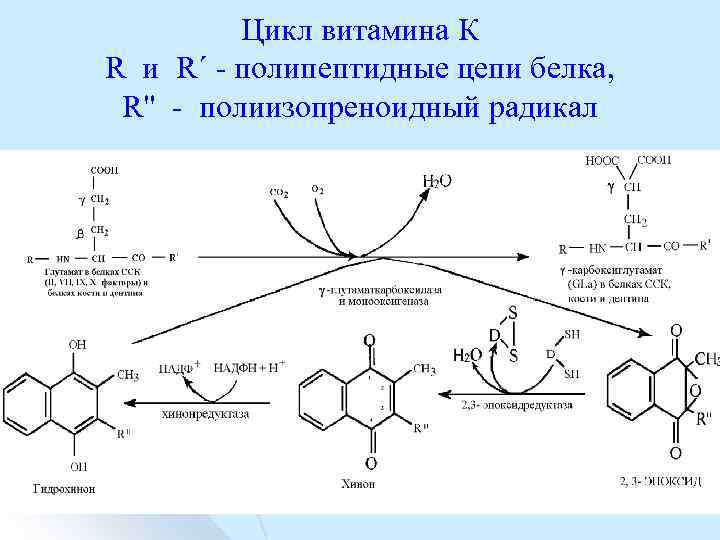 Цикл витамина К R и R΄ полипептидные цепи белка, R" полиизопреноидный радикал
Цикл витамина К R и R΄ полипептидные цепи белка, R" полиизопреноидный радикал
 Цикл витамина К l l l l начинается с превращения гидрохинона в 2, 3 эпоксид гаммаглутаматкарбоксилазой и монооксигеназой, затем 2, 3 эпоксиддредуктаэа преобразует 2, 3 эпоксид в хинон, хинонредуктаза воссоздает исходную форму гидрохинона. В результате цикла витамина К глутамат в белках трансформируется в γ карбоксиглутамат (Gla). Протромбин приобретает 10 остатков Gla. Карбоксилы присоединяют катион кальция, который связывается с анионной группой фосфолипидов. Это способствует образованию кровяного сгустка.
Цикл витамина К l l l l начинается с превращения гидрохинона в 2, 3 эпоксид гаммаглутаматкарбоксилазой и монооксигеназой, затем 2, 3 эпоксиддредуктаэа преобразует 2, 3 эпоксид в хинон, хинонредуктаза воссоздает исходную форму гидрохинона. В результате цикла витамина К глутамат в белках трансформируется в γ карбоксиглутамат (Gla). Протромбин приобретает 10 остатков Gla. Карбоксилы присоединяют катион кальция, который связывается с анионной группой фосфолипидов. Это способствует образованию кровяного сгустка.
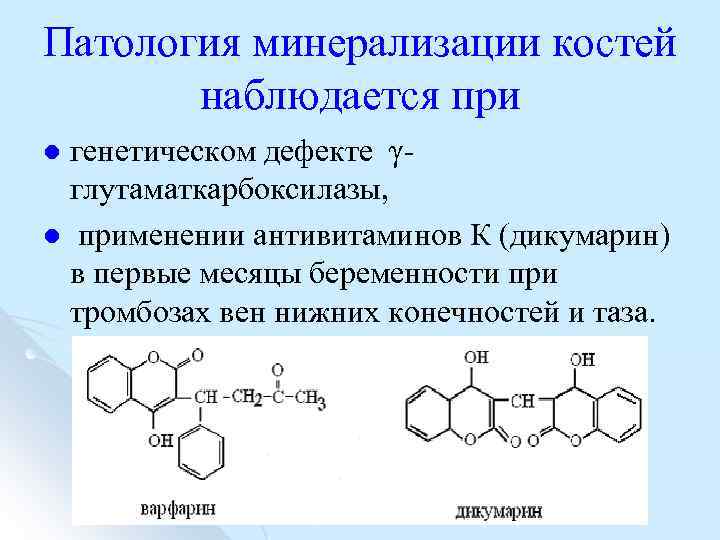 Патология минерализации костей наблюдается при генетическом дефекте γ глутаматкарбоксилазы, l применении антивитаминов К (дикумарин) в первые месяцы беременности при тромбозах вен нижних конечностей и таза. l
Патология минерализации костей наблюдается при генетическом дефекте γ глутаматкарбоксилазы, l применении антивитаминов К (дикумарин) в первые месяцы беременности при тромбозах вен нижних конечностей и таза. l
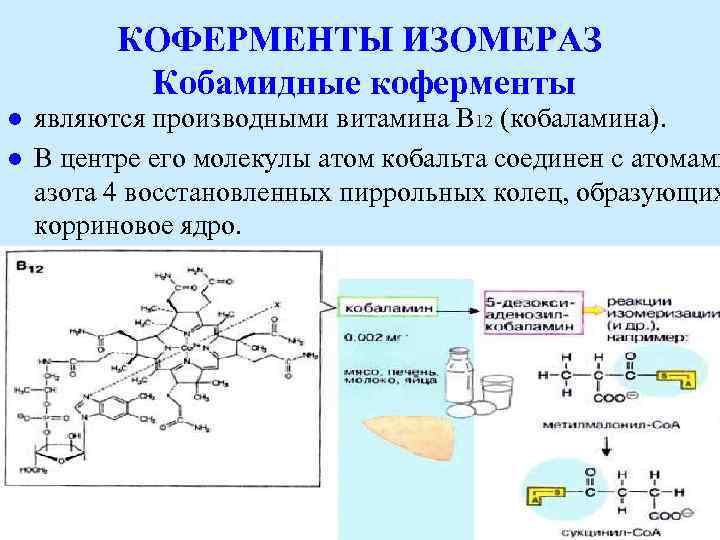 КОФЕРМЕНТЫ ИЗОМЕРАЗ Кобамидные коферменты l l являются производными витамина В 12 (кобаламина). В центре его молекулы атом кобальта соединен с атомами азота 4 восстановленных пиррольных колец, образующих корриновое ядро.
КОФЕРМЕНТЫ ИЗОМЕРАЗ Кобамидные коферменты l l являются производными витамина В 12 (кобаламина). В центре его молекулы атом кобальта соединен с атомами азота 4 восстановленных пиррольных колец, образующих корриновое ядро.
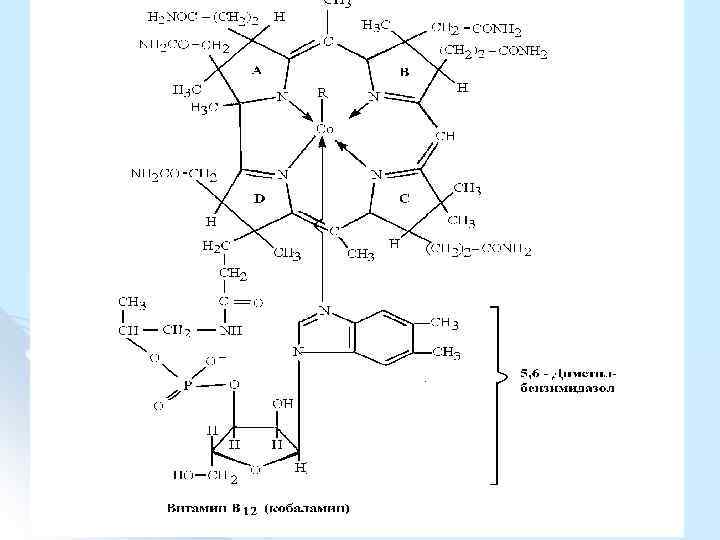
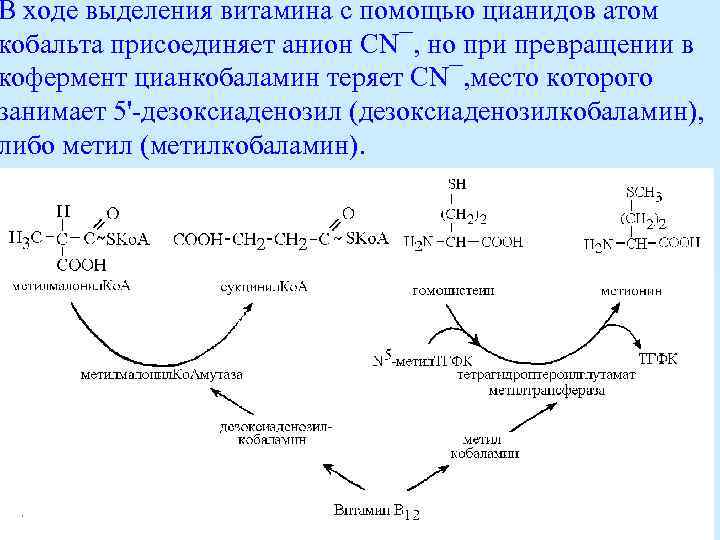 В ходе выделения витамина с помощью цианидов атом кобальта присоединяет анион СN¯, но при превращении в кофермент цианкобаламин теряет СN¯, место которого занимает 5' дезоксиаденозил (дезоксиаденозилкобаламин), либо метил (метилкобаламин).
В ходе выделения витамина с помощью цианидов атом кобальта присоединяет анион СN¯, но при превращении в кофермент цианкобаламин теряет СN¯, место которого занимает 5' дезоксиаденозил (дезоксиаденозилкобаламин), либо метил (метилкобаламин).
 Кобамидные коферменты отщепляют от субстратов одноуглеродные остатки и передают ТГФК, а затем другому субстрату, l работают ТГФК и цианкобаламин совместно. l
Кобамидные коферменты отщепляют от субстратов одноуглеродные остатки и передают ТГФК, а затем другому субстрату, l работают ТГФК и цианкобаламин совместно. l
 Биологическая роль как кофермент в реакциях метилирования (реакции синтеза метионина), l кофермент изомераз в обмене липидов, l образование из рибозы дезоксирибозы, l для превращения фолиевой кислоты в фолиновую, l влияет на созревание эритроцитов. l
Биологическая роль как кофермент в реакциях метилирования (реакции синтеза метионина), l кофермент изомераз в обмене липидов, l образование из рибозы дезоксирибозы, l для превращения фолиевой кислоты в фолиновую, l влияет на созревание эритроцитов. l
 Витамин В 12 содержится в печени, l мясе, l рыбе. Витамин В 12 синтезируют микроорганизмы. l
Витамин В 12 содержится в печени, l мясе, l рыбе. Витамин В 12 синтезируют микроорганизмы. l
 В печень Витамин В 12 поступает с животной пищей или синтезируется микрофлорой кишечника при условии доставки с пищей кобальта. l Всасывание витамина В 12 в кишечнике требует выработки в желудке внутреннего фактора Касла (гастромукопротеина) и связывания с ним витамина В 12. l
В печень Витамин В 12 поступает с животной пищей или синтезируется микрофлорой кишечника при условии доставки с пищей кобальта. l Всасывание витамина В 12 в кишечнике требует выработки в желудке внутреннего фактора Касла (гастромукопротеина) и связывания с ним витамина В 12. l
 Недостаток витамина В 12 вызывает злокачественную макроцитарную мегалобластическую анемию, l нарушения нервной системы, l снижение кислотности желудочного сока. l
Недостаток витамина В 12 вызывает злокачественную макроцитарную мегалобластическую анемию, l нарушения нервной системы, l снижение кислотности желудочного сока. l
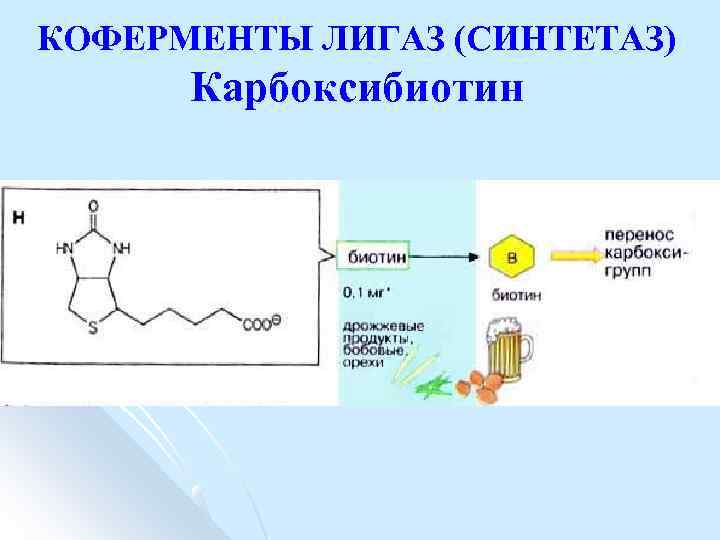 КОФЕРМЕНТЫ ЛИГАЗ (СИНТЕТАЗ) Карбоксибиотин
КОФЕРМЕНТЫ ЛИГАЗ (СИНТЕТАЗ) Карбоксибиотин
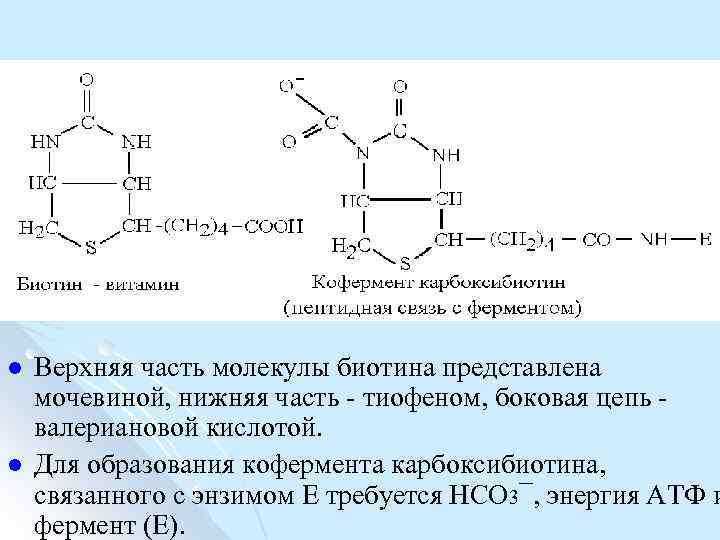 l l Верхняя часть молекулы биотина представлена мочевиной, нижняя часть тиофеном, боковая цепь валериановой кислотой. Для образования кофермента карбоксибиотина, связанного с энзимом E требуется НСО 3¯, энергия АТФ и фермент (Е).
l l Верхняя часть молекулы биотина представлена мочевиной, нижняя часть тиофеном, боковая цепь валериановой кислотой. Для образования кофермента карбоксибиотина, связанного с энзимом E требуется НСО 3¯, энергия АТФ и фермент (Е).
 Карбоксибиотин участвует l во многих реакциях карбоксилирования, например, при синтезе оксалоацетата из пирувата, l при синтезе жирных кислот.
Карбоксибиотин участвует l во многих реакциях карбоксилирования, например, при синтезе оксалоацетата из пирувата, l при синтезе жирных кислот.
 Биотин содержится в горохе, l сое, l луке, l цельной пшеничной муке, l печени, l яичном желтке. l
Биотин содержится в горохе, l сое, l луке, l цельной пшеничной муке, l печени, l яичном желтке. l
 Авитаминоз Н проявляется в виде дерматита, но наблюдают его редко, l можно вызвать избыточным потреблением белка куриного яйца, содержащего белок авидин, необратимо связывающий биотин. l
Авитаминоз Н проявляется в виде дерматита, но наблюдают его редко, l можно вызвать избыточным потреблением белка куриного яйца, содержащего белок авидин, необратимо связывающий биотин. l
 НЕОРГАНИЧЕСКИЕ АНИОНЫ Хлор l Сl¯ необходим для каталитической активности α амилазы, катализирующей гидролиз α-1, 4 – гликозидных связей, между остатками глюкозы в крахмале и гликогене в пищеварительном тракте.
НЕОРГАНИЧЕСКИЕ АНИОНЫ Хлор l Сl¯ необходим для каталитической активности α амилазы, катализирующей гидролиз α-1, 4 – гликозидных связей, между остатками глюкозы в крахмале и гликогене в пищеварительном тракте.
 Фтор l l l F¯ активирует аденилатциклазу, превращающую АТФ в циклический 3', 5' АМФ (ц. АМФ). F¯ активирует фосфодиэстеразу циклического 3', 5' ГМФ (ц. ГМФ), превращающую, его в ГМФ. F¯ ингибирует енолазу зубного налета и слюны, что приводит к падению образования молочной кислоты, являющейся конечным продуктом гликолиза.
Фтор l l l F¯ активирует аденилатциклазу, превращающую АТФ в циклический 3', 5' АМФ (ц. АМФ). F¯ активирует фосфодиэстеразу циклического 3', 5' ГМФ (ц. ГМФ), превращающую, его в ГМФ. F¯ ингибирует енолазу зубного налета и слюны, что приводит к падению образования молочной кислоты, являющейся конечным продуктом гликолиза.
 Селен Se, введенный в составе селенита Sе. О 3¯, необходим для антиоксидантного действия фермента глутатионпероксидазы по отношению к органическим пероксидам и пероксиду водорода. l Se, введенный в составе селенита, является кофактором формиатдегидрогеназы, катализирующей окисление формальдегида в формиат в реакции, сопряженной с восстановлением НАД+ в НАДН+Н. + l Se, введенный в составе селенита, является кофактором глицинредуктазы, которая в реакции восстановительного дезаминирования, катализирует перенос электронов от восстановителей на глицин с образованием аммиака и ацетата l
Селен Se, введенный в составе селенита Sе. О 3¯, необходим для антиоксидантного действия фермента глутатионпероксидазы по отношению к органическим пероксидам и пероксиду водорода. l Se, введенный в составе селенита, является кофактором формиатдегидрогеназы, катализирующей окисление формальдегида в формиат в реакции, сопряженной с восстановлением НАД+ в НАДН+Н. + l Se, введенный в составе селенита, является кофактором глицинредуктазы, которая в реакции восстановительного дезаминирования, катализирует перенос электронов от восстановителей на глицин с образованием аммиака и ацетата l


