Коагуляция воды.pptx
- Количество слайдов: 13
 Коагуляция
Коагуляция
 Коагуляцией воды называют процесс укрупнения коллоидных и диспергированных частиц, происходящий вследствие их слипания под действием сил молекулярного притяжения. Коагуляция завершается образованием видимых невооруженным глазом агрегатов - хлопьев и отделением их от жидкой среды.
Коагуляцией воды называют процесс укрупнения коллоидных и диспергированных частиц, происходящий вследствие их слипания под действием сил молекулярного притяжения. Коагуляция завершается образованием видимых невооруженным глазом агрегатов - хлопьев и отделением их от жидкой среды.
 Различают два типа коагуляции: коагуляцию в свободном объеме (происходит в камерах реакции или хлопьеобразования) и контактную (в толще зернистой загрузки контактных осветлителей и контактных фильтров или же в массе взвешенного осадка отстойников-осветлителей). Вследствие процесса коагуляции не только повышается скорость и эффективность осаждения взвеси, но и значительно уменьшается природная цветность воды, обусловленная наличием в ней гуминовых соединений. Обесцвечивание, которого невозможно добиться другими способами очистки, происходит вследствие адсорбции гуминовых веществ на поверхности хлопьев коагулянта и дальнейшего выпадения в осадок. Уменьшение количества взвеси способствует также значительному уменьшению количества бактерий и вирусов, содержащихся в воде
Различают два типа коагуляции: коагуляцию в свободном объеме (происходит в камерах реакции или хлопьеобразования) и контактную (в толще зернистой загрузки контактных осветлителей и контактных фильтров или же в массе взвешенного осадка отстойников-осветлителей). Вследствие процесса коагуляции не только повышается скорость и эффективность осаждения взвеси, но и значительно уменьшается природная цветность воды, обусловленная наличием в ней гуминовых соединений. Обесцвечивание, которого невозможно добиться другими способами очистки, происходит вследствие адсорбции гуминовых веществ на поверхности хлопьев коагулянта и дальнейшего выпадения в осадок. Уменьшение количества взвеси способствует также значительному уменьшению количества бактерий и вирусов, содержащихся в воде
 Коагуляция происходит с участием химических реагентов - коагулянтов (солей алюминия и железа): алюминия сульфата - A 12(S 04)3 х 18 Н 20; алюминия оксихлорида - [А 12(ОН)5]С 1 х 6 Н 20; натрия алюмината - Na. A 102; железа сульфата - Fe. S 04 х 7 Н 20; железа хлорида - Fe. Cl 3 х 6 Н 20 и др. Кроме алюмо-и железосодержащих, используют комбинированные коагулянты, которые содержат соли (сульфаты или хлориды) одновременно обоих металлов.
Коагуляция происходит с участием химических реагентов - коагулянтов (солей алюминия и железа): алюминия сульфата - A 12(S 04)3 х 18 Н 20; алюминия оксихлорида - [А 12(ОН)5]С 1 х 6 Н 20; натрия алюмината - Na. A 102; железа сульфата - Fe. S 04 х 7 Н 20; железа хлорида - Fe. Cl 3 х 6 Н 20 и др. Кроме алюмо-и железосодержащих, используют комбинированные коагулянты, которые содержат соли (сульфаты или хлориды) одновременно обоих металлов.
 Наиболее часто на хозяйственно-питьевых водопроводах в качестве коагулянта применяют неочищенный алюминия сульфат, который содержит 33% безводного алюминия сульфата и до 23% нерастворимых примесей. В настоящее время промышленность выпускает также и очищенный алюминия сульфат, который содержит не более 1% нерастворимых примесей.
Наиболее часто на хозяйственно-питьевых водопроводах в качестве коагулянта применяют неочищенный алюминия сульфат, который содержит 33% безводного алюминия сульфата и до 23% нерастворимых примесей. В настоящее время промышленность выпускает также и очищенный алюминия сульфат, который содержит не более 1% нерастворимых примесей.
 Теоретические основы коагулирования воды Примеси природной воды позволяют рассматривать ее как гетерофазную систему, в которой вода является дисперсионной средой, а масса распределенных в воде коллоидных частиц — дисперсной фазой. Эти частицы представляют собой мелкие агрегаты кристаллического или аморфного строения с огромной удельной поверхностью, обладающей весьма значительной поверхностной энергией, а следовательно, и высокой адсорбционной емкостью. На границе раздела фаз возникает двойной электрический слой, представляющий собой тонкий поверхностный слой из пространственно разделенных электрических зарядов противоположного знака.
Теоретические основы коагулирования воды Примеси природной воды позволяют рассматривать ее как гетерофазную систему, в которой вода является дисперсионной средой, а масса распределенных в воде коллоидных частиц — дисперсной фазой. Эти частицы представляют собой мелкие агрегаты кристаллического или аморфного строения с огромной удельной поверхностью, обладающей весьма значительной поверхностной энергией, а следовательно, и высокой адсорбционной емкостью. На границе раздела фаз возникает двойной электрический слой, представляющий собой тонкий поверхностный слой из пространственно разделенных электрических зарядов противоположного знака.
 В дисперсных системах двойной электрический слой образуют ионы и дипольные молекулы. Ионный двойной электрический слой возникает либо в результате диссоциации ионогенных групп вещества твердой фазы, либо вследствие избирательной адсорбции ионов, идентичных ионам, образующим кристаллическую решетку твердой фазы, либо сходных с ними. При этом сильнее адсорбируются ионы, которые значительнее понижают свободную энергию поверхности твердой фазы. В результате на границе между твердой фазой и раствором возникает подобие конденсатора, внутренняя обкладка которого образована потенциалопределяющими ионами, а наружная — противоионами — присутствующими в воде ионами противоположного знака. Противоионы группируются у поверхности ядра вследствие электрического притяжения между разноименными электрическими зарядами, образуя коллоидную частицу.
В дисперсных системах двойной электрический слой образуют ионы и дипольные молекулы. Ионный двойной электрический слой возникает либо в результате диссоциации ионогенных групп вещества твердой фазы, либо вследствие избирательной адсорбции ионов, идентичных ионам, образующим кристаллическую решетку твердой фазы, либо сходных с ними. При этом сильнее адсорбируются ионы, которые значительнее понижают свободную энергию поверхности твердой фазы. В результате на границе между твердой фазой и раствором возникает подобие конденсатора, внутренняя обкладка которого образована потенциалопределяющими ионами, а наружная — противоионами — присутствующими в воде ионами противоположного знака. Противоионы группируются у поверхности ядра вследствие электрического притяжения между разноименными электрическими зарядами, образуя коллоидную частицу.
 Из-за теплового движения ионов в воде и их отрыва слой окружающих частиц противоионов приобретает диффузионный характер. Коллоидная частица вместе с окружающим ее диффузионным слоем называется мицеллой Необходимым условием слипания частиц дисперсной фазы является их сближение, достаточное для проявления сил межмолекулярного притяжения.
Из-за теплового движения ионов в воде и их отрыва слой окружающих частиц противоионов приобретает диффузионный характер. Коллоидная частица вместе с окружающим ее диффузионным слоем называется мицеллой Необходимым условием слипания частиц дисперсной фазы является их сближение, достаточное для проявления сил межмолекулярного притяжения.
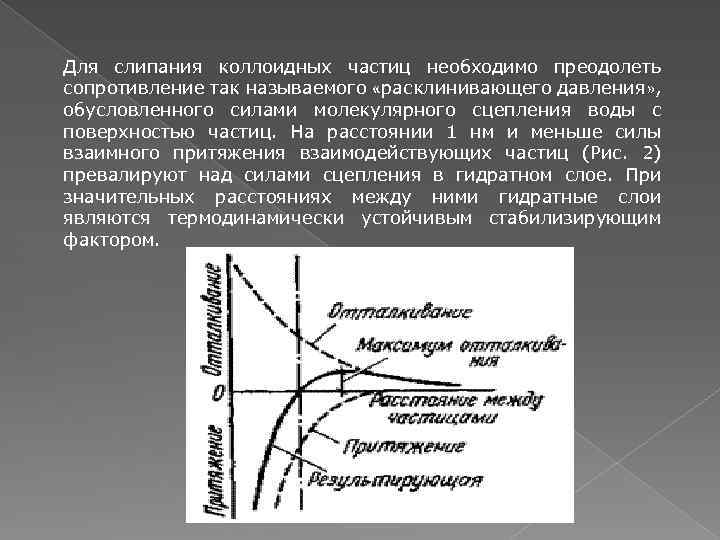 Для слипания коллоидных частиц необходимо преодолеть сопротивление так называемого «расклинивающего давления» , обусловленного силами молекулярного сцепления воды с поверхностью частиц. На расстоянии 1 нм и меньше силы взаимного притяжения взаимодействующих частиц (Рис. 2) превалируют над силами сцепления в гидратном слое. При значительных расстояниях между ними гидратные слои являются термодинамически устойчивым стабилизирующим фактором.
Для слипания коллоидных частиц необходимо преодолеть сопротивление так называемого «расклинивающего давления» , обусловленного силами молекулярного сцепления воды с поверхностью частиц. На расстоянии 1 нм и меньше силы взаимного притяжения взаимодействующих частиц (Рис. 2) превалируют над силами сцепления в гидратном слое. При значительных расстояниях между ними гидратные слои являются термодинамически устойчивым стабилизирующим фактором.
 При добавлении в очищаемую воду коагулянтов – противоположно заряженных коллоидов – происходит взаимная коагуляция двух систем. На рисунке представлена схема строения мицеллы золя гидроксида алюминия. Золь – система, состоящая из коллоидных частиц, распределенных в жидкой или газообразной среде. Если такой средой является вода, система называется гидрозолем.
При добавлении в очищаемую воду коагулянтов – противоположно заряженных коллоидов – происходит взаимная коагуляция двух систем. На рисунке представлена схема строения мицеллы золя гидроксида алюминия. Золь – система, состоящая из коллоидных частиц, распределенных в жидкой или газообразной среде. Если такой средой является вода, система называется гидрозолем.
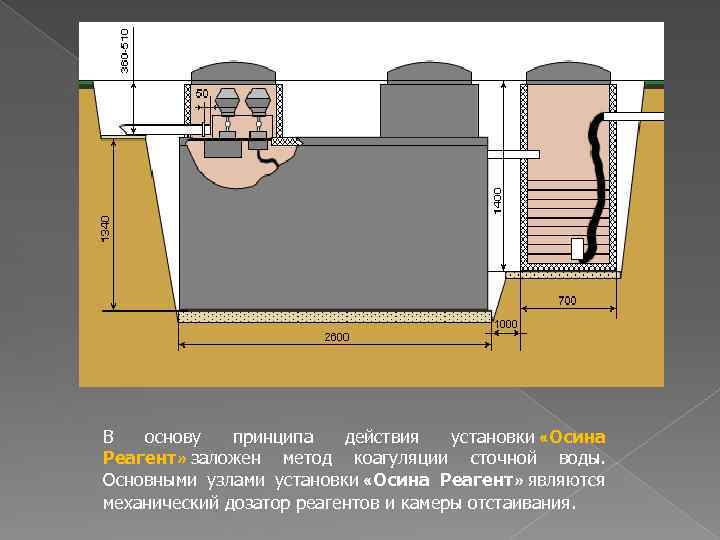 В основу принципа действия установки «Осина Реагент» заложен метод коагуляции сточной воды. Основными узлами установки «Осина Реагент» являются механический дозатор реагентов и камеры отстаивания.
В основу принципа действия установки «Осина Реагент» заложен метод коагуляции сточной воды. Основными узлами установки «Осина Реагент» являются механический дозатор реагентов и камеры отстаивания.



