Клинические испытания.pptx
- Количество слайдов: 27
 Клинические испытания: от Таскиги до наших дней
Клинические испытания: от Таскиги до наших дней
 Клиническое исследование — научное исследование с участием людей, которое проводится с целью оценки эффективности и безопасности нового ЛП или расширения показаний к применению уже известного.
Клиническое исследование — научное исследование с участием людей, которое проводится с целью оценки эффективности и безопасности нового ЛП или расширения показаний к применению уже известного.
 Краткая схема
Краткая схема
 Фаза III
Фаза III
 Лекарствакандидаты 10. 000 Доклинические испытания 250 Клинические испытания 5 Рынок 1
Лекарствакандидаты 10. 000 Доклинические испытания 250 Клинические испытания 5 Рынок 1
 Статистика 158 160 140 120 100 96 75 % 80 59 % 60 69 % 680 48 % 460 40 1999 2009 20 0 количество процедур уровень набора пациентов число пациентов, завершивших испытания длительность
Статистика 158 160 140 120 100 96 75 % 80 59 % 60 69 % 680 48 % 460 40 1999 2009 20 0 количество процедур уровень набора пациентов число пациентов, завершивших испытания длительность
 Цель Протокол Персонал Испытуемые Данные Средства Что должно быть?
Цель Протокол Персонал Испытуемые Данные Средства Что должно быть?
 Цель Оценка безопасности и эффективности нового препарата у пациентов с определённым заболеванием (например, у пациентов с болезнью Альцгеймера), Оценка безопасности и эффективности различных дозировок препарата, который уже используется в широкой медицинской практике (например, 10 мг в сравнении с 5 мг),
Цель Оценка безопасности и эффективности нового препарата у пациентов с определённым заболеванием (например, у пациентов с болезнью Альцгеймера), Оценка безопасности и эффективности различных дозировок препарата, который уже используется в широкой медицинской практике (например, 10 мг в сравнении с 5 мг),
 Протокол одобряется комитетом по этике и утверждается Министерством здравоохранения Республики Беларусь. Решение о назначении клинических испытаний лекарственного средства принимается Министерством здравоохранения Республики Беларусь
Протокол одобряется комитетом по этике и утверждается Министерством здравоохранения Республики Беларусь. Решение о назначении клинических испытаний лекарственного средства принимается Министерством здравоохранения Республики Беларусь
 Важный пункт – информированное согласие Запрещается участие беременных женщин несовершеннолетних детей-сирот и детей, оставшихся без попечения родителей; военнослужащих и лиц, на которых распространяется статус военнослужащих; осужденных и лиц, содержащихся под стражей; лиц, признанных в установленном порядке недееспособными Испытуемые
Важный пункт – информированное согласие Запрещается участие беременных женщин несовершеннолетних детей-сирот и детей, оставшихся без попечения родителей; военнослужащих и лиц, на которых распространяется статус военнослужащих; осужденных и лиц, содержащихся под стражей; лиц, признанных в установленном порядке недееспособными Испытуемые
 Tuskegee syphilis experiment 1932 -1972
Tuskegee syphilis experiment 1932 -1972
 1947 - Нюрнбергский кодекс 1964 – Хельсинская декларация Всемирной медицинской ассоциации (ВМА) 1938 - закон «О пищевых продуктах, лекарствах и косметических средствах» (Federal Food, Drug, and Cosmetic Act) 1962 - поправка об эффективности препарата (Drug Efficacy Amendment) 1996 - "Международные гармонизированные трехсторонние правила Good Clinical Practice (ICH Harmonized Tripartite Guideline for Good Clinical Practice, сокращенно — ICH GCP) Правовое регулирование
1947 - Нюрнбергский кодекс 1964 – Хельсинская декларация Всемирной медицинской ассоциации (ВМА) 1938 - закон «О пищевых продуктах, лекарствах и косметических средствах» (Federal Food, Drug, and Cosmetic Act) 1962 - поправка об эффективности препарата (Drug Efficacy Amendment) 1996 - "Международные гармонизированные трехсторонние правила Good Clinical Practice (ICH Harmonized Tripartite Guideline for Good Clinical Practice, сокращенно — ICH GCP) Правовое регулирование
 Финансовая сторона Производство изучаемого препарата, Зарплаты сотрудникам, ; Выплаты лечебным учреждениям и исследовательской команде ; Оплату работы контрактной исследовательской организации и других внешних консультантов; Логистические затраты; Оценку возможности проведения исследования в исследовательских центрах до начала клинического исследования, а также мониторинг и аудит в ходе его проведения; Тренинги исследователей; Какие-либо выплаты пациентам, принимающим участие в исследовании (3 и 4 фазы);
Финансовая сторона Производство изучаемого препарата, Зарплаты сотрудникам, ; Выплаты лечебным учреждениям и исследовательской команде ; Оплату работы контрактной исследовательской организации и других внешних консультантов; Логистические затраты; Оценку возможности проведения исследования в исследовательских центрах до начала клинического исследования, а также мониторинг и аудит в ходе его проведения; Тренинги исследователей; Какие-либо выплаты пациентам, принимающим участие в исследовании (3 и 4 фазы);
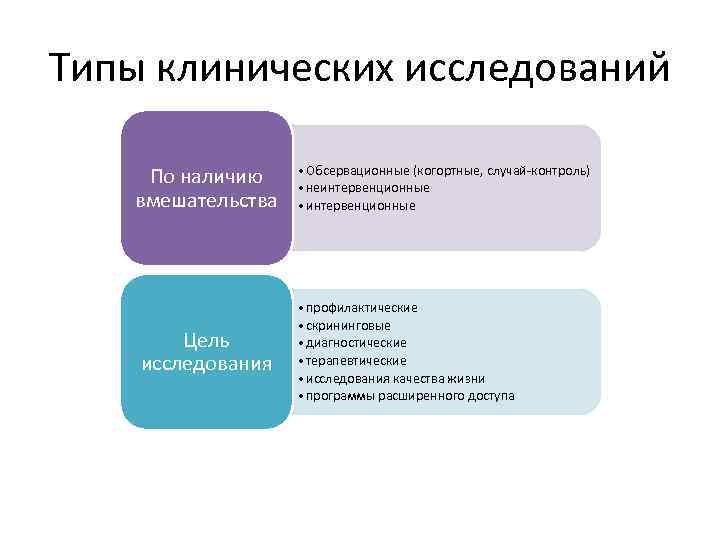 Типы клинических исследований По наличию вмешательства Цель исследования • Обсервационные (когортные, случай-контроль) • неинтервенционные • интервенционные • профилактические • скрининговые • диагностические • терапевтические • исследования качества жизни • программы расширенного доступа
Типы клинических исследований По наличию вмешательства Цель исследования • Обсервационные (когортные, случай-контроль) • неинтервенционные • интервенционные • профилактические • скрининговые • диагностические • терапевтические • исследования качества жизни • программы расширенного доступа
 Классификация исследований в зависимости от целей фармакологические • Оценить переносимость, установить/ описать фармакокинетику и фармакодинамику, исследовать метаболизм и взаимодействие с другими препаратами, оценить активность Терапевтические поисковые • Исследовать применение по определённым показаниям, установить дозировку для последующих исследований, собрать данные для определения дизайна, конечных точек и методологии терапевтического подтверждающего исследования Терапевтические подтверждающие • Доказать/ подтвердить эффективность, установить профиль безопасности, предоставить данные для оценки соотношения риска и пользы для регистрации препарата, установить зависимость эффекта от дозы Терапевтические исследования применения • Уточнить соотношение риска к пользе вообще и в отдельных популяциях и/ или условиях, выявить редкие нежелательные реакции, уточнить рекомендации по дозировке
Классификация исследований в зависимости от целей фармакологические • Оценить переносимость, установить/ описать фармакокинетику и фармакодинамику, исследовать метаболизм и взаимодействие с другими препаратами, оценить активность Терапевтические поисковые • Исследовать применение по определённым показаниям, установить дозировку для последующих исследований, собрать данные для определения дизайна, конечных точек и методологии терапевтического подтверждающего исследования Терапевтические подтверждающие • Доказать/ подтвердить эффективность, установить профиль безопасности, предоставить данные для оценки соотношения риска и пользы для регистрации препарата, установить зависимость эффекта от дозы Терапевтические исследования применения • Уточнить соотношение риска к пользе вообще и в отдельных популяциях и/ или условиях, выявить редкие нежелательные реакции, уточнить рекомендации по дозировке
 Дизайн исследований Эталонным дизайном клинических исследований являются рандомизированные контролируемые двойные слепые исследования; ни пациент, ни исследователь не знают, что получает больной: плацебо или действующее вещество.
Дизайн исследований Эталонным дизайном клинических исследований являются рандомизированные контролируемые двойные слепые исследования; ни пациент, ни исследователь не знают, что получает больной: плацебо или действующее вещество.

 Фаза I Число добровольцев – от 20 до 100; Продолжительность – от нескольких недель до 1 года; Цель - установить переносимость, фармакокинетические и фармакодинамические параметры; исследуется такие показатели, как абсорбция, распределение, метаболизм, экскреция, а также предпочтительная форма применения и безопасный уровень дозирования; Вознаграждение – есть; Варианты: SAD, MAD.
Фаза I Число добровольцев – от 20 до 100; Продолжительность – от нескольких недель до 1 года; Цель - установить переносимость, фармакокинетические и фармакодинамические параметры; исследуется такие показатели, как абсорбция, распределение, метаболизм, экскреция, а также предпочтительная форма применения и безопасный уровень дозирования; Вознаграждение – есть; Варианты: SAD, MAD.
 Фаза II Число участников – от 100 до 500, небольшая гомогенная популяция пациентов, отобранная по жёстким критериям; Цель - определить уровень дозирования и схему приёма препарата для исследований фазы III; Наличие контрольной группы; Дополнительная задача - оценка возможных конечных точек, терапевтической схемы приёма (включая сопутствующие препараты) и определение таргетной группы; Деление на две стадии: A и B;
Фаза II Число участников – от 100 до 500, небольшая гомогенная популяция пациентов, отобранная по жёстким критериям; Цель - определить уровень дозирования и схему приёма препарата для исследований фазы III; Наличие контрольной группы; Дополнительная задача - оценка возможных конечных точек, терапевтической схемы приёма (включая сопутствующие препараты) и определение таргетной группы; Деление на две стадии: A и B;
 Фаза III Рандомизированные контролируемые мультицентровые исследования; Число участников – от 300 до 3000; По окончании формируется регистрационное досье препарата: методология и результаты доклинических исследований препарата, особенности производства, его состав, срок годности
Фаза III Рандомизированные контролируемые мультицентровые исследования; Число участников – от 300 до 3000; По окончании формируется регистрационное досье препарата: методология и результаты доклинических исследований препарата, особенности производства, его состав, срок годности
 Рекомендации к применению препарат более эффективен, чем известные препараты аналогичного действия; обладает лучшей переносимостью при сравнимой с уже известными препаратами; эффективен в тех случаях, когда лечение уже известными препаратам безуспешно; экономически более выгоден; прост в применении; имеет более удобную ЛФ; обладает синергичным действием при комбинированной терапии, не повышая токсичности.
Рекомендации к применению препарат более эффективен, чем известные препараты аналогичного действия; обладает лучшей переносимостью при сравнимой с уже известными препаратами; эффективен в тех случаях, когда лечение уже известными препаратам безуспешно; экономически более выгоден; прост в применении; имеет более удобную ЛФ; обладает синергичным действием при комбинированной терапии, не повышая токсичности.
 Фаза IV пострегистрационные исследования сбор дополнительной информации по безопасности препарата на достаточно большой популяции в течение длительного времени.
Фаза IV пострегистрационные исследования сбор дополнительной информации по безопасности препарата на достаточно большой популяции в течение длительного времени.
 Корреляция между фазами и типами исследований Терапевтическое исследование применения Терапевтическое подтверждающее Терапевтическое поисковое Фармакологическое Фаза III Фаза IV
Корреляция между фазами и типами исследований Терапевтическое исследование применения Терапевтическое подтверждающее Терапевтическое поисковое Фармакологическое Фаза III Фаза IV
 Обязанности сторон Органы здоравоохранения Спонсор Исследователь
Обязанности сторон Органы здоравоохранения Спонсор Исследователь
 спонсор • Привлечение квалифицированных лиц; • Подача всех необходимых документов в уполномоч. органы; • Подготовка протокола и брошюры исследователя; • Мониторинг; • Аудит; • Оценка безопасности; • Здоровье пациента; • Строгое исполнение протокола; • исследователь Контроль за сотрудниками; • Уведомления спонсора и уполномоч. органов о ходе проведения исследований; Органы • Проверка материалов здравоохране исследования; ния • Инспекция;
спонсор • Привлечение квалифицированных лиц; • Подача всех необходимых документов в уполномоч. органы; • Подготовка протокола и брошюры исследователя; • Мониторинг; • Аудит; • Оценка безопасности; • Здоровье пациента; • Строгое исполнение протокола; • исследователь Контроль за сотрудниками; • Уведомления спонсора и уполномоч. органов о ходе проведения исследований; Органы • Проверка материалов здравоохране исследования; ния • Инспекция;
 Международный день клинических исследований 20 мая в честь меня, Джеймса Линда
Международный день клинических исследований 20 мая в честь меня, Джеймса Линда
 Ну было очень интересно!
Ну было очень интересно!


