архангельск.pptx
- Количество слайдов: 29
 «Клинические аспекты терапии хронических вирусных гепатитов у больных ВИЧ-инфекцией. Современные рекомендации» С. Н. Кижло, СПб ГБУЗ Центр СПИД г. Архангельск 01. 10. 2015 г.
«Клинические аспекты терапии хронических вирусных гепатитов у больных ВИЧ-инфекцией. Современные рекомендации» С. Н. Кижло, СПб ГБУЗ Центр СПИД г. Архангельск 01. 10. 2015 г.
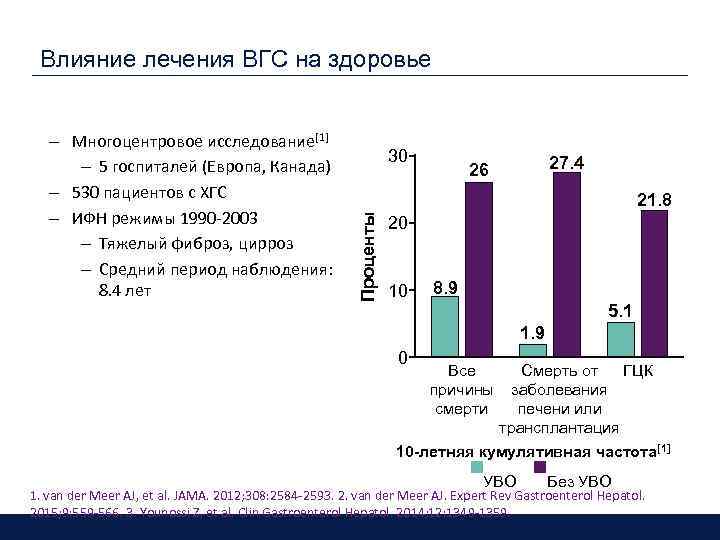 Влияние лечения ВГС на здоровье 30 27. 4 26 21. 8 Проценты §Advanced fibrosis – Многоцентровое исследование[1] – 5 госпиталей (Европа, Канада) – 530 пациентов с ХГС – ИФН режимы 1990 -2003 – Тяжелый фиброз, цирроз – Средний период наблюдения: 8. 4 лет 20 10 8. 9 5. 1 §Early-stage disease 1. 9 0 Все причины смерти Смерть от ГЦК заболевания печени или трансплантация 10 -летняя кумулятивная частота[1] УВО Без УВО 1. van der Meer AJ, et al. JAMA. 2012; 308: 2584 -2593. 2. van der Meer AJ. Expert Rev Gastroenterol Hepatol. 2015; 9: 559 -566. 3. Younossi Z, et al. Clin Gastroenterol Hepatol. 2014; 12: 1349 -1359.
Влияние лечения ВГС на здоровье 30 27. 4 26 21. 8 Проценты §Advanced fibrosis – Многоцентровое исследование[1] – 5 госпиталей (Европа, Канада) – 530 пациентов с ХГС – ИФН режимы 1990 -2003 – Тяжелый фиброз, цирроз – Средний период наблюдения: 8. 4 лет 20 10 8. 9 5. 1 §Early-stage disease 1. 9 0 Все причины смерти Смерть от ГЦК заболевания печени или трансплантация 10 -летняя кумулятивная частота[1] УВО Без УВО 1. van der Meer AJ, et al. JAMA. 2012; 308: 2584 -2593. 2. van der Meer AJ. Expert Rev Gastroenterol Hepatol. 2015; 9: 559 -566. 3. Younossi Z, et al. Clin Gastroenterol Hepatol. 2014; 12: 1349 -1359.
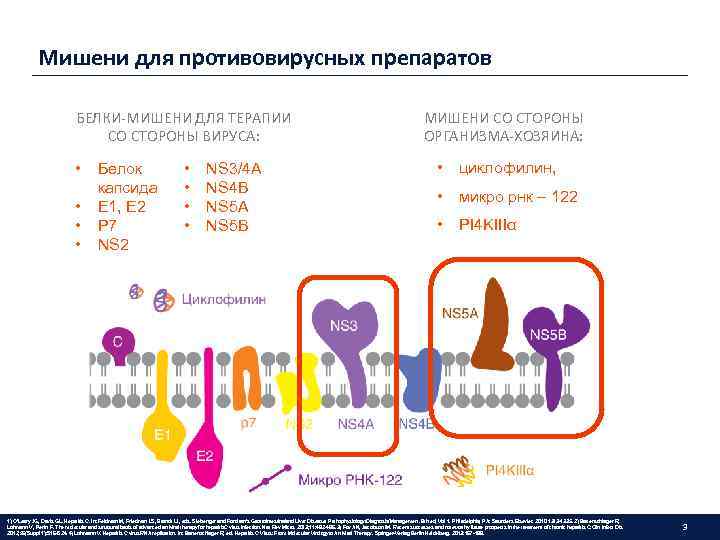 Мишени для противовирусных препаратов БЕЛКИ-МИШЕНИ ДЛЯ ТЕРАПИИ СО СТОРОНЫ ВИРУСА: • • Белок капсида E 1, E 2 P 7 NS 2 • • NS 3/4 A NS 4 B NS 5 A NS 5 B МИШЕНИ СО СТОРОНЫ ОРГАНИЗМА-ХОЗЯИНА: • циклофилин, • микро рнк – 122 • PI 4 KIIIα 1) O’Leary JG, Davis GL. Hepatitis C. In: Feldman M, Friedman LS, Brandt LJ, eds. Sleisenger and Fordtran’s Gastrointestinaland Liver Disease: Pathophysiology/Diagnosis/Management. 9 th ed, Vol 1. Philadelphia, PA: Saunders Elsevier. 2010: 1313 -1335. 2) Bartenschlager R, Lohmann V, Penin F. The molecular and structural basis of advanced antiviral therapy for hepatitis. C virus infection. Nat Rev Micro. 2013; 11: 482 -496. 3) Fox AN, Jacobson IM. Recent successes and noteworthy future prospects in the treatment of chronic hepatitis C. Clin Infect Dis. 2012; 55(Suppl 1): S 16 -S 24. 4) Lohmann V. Hepatitis C virus RNA replication. In: Bartenschlager R, ed. Hepatitis C Virus: From Molecular Virologyto Antiviral Therapy. Springer-Verlag Berlin Heidelberg. 2013: 167 -198. 3
Мишени для противовирусных препаратов БЕЛКИ-МИШЕНИ ДЛЯ ТЕРАПИИ СО СТОРОНЫ ВИРУСА: • • Белок капсида E 1, E 2 P 7 NS 2 • • NS 3/4 A NS 4 B NS 5 A NS 5 B МИШЕНИ СО СТОРОНЫ ОРГАНИЗМА-ХОЗЯИНА: • циклофилин, • микро рнк – 122 • PI 4 KIIIα 1) O’Leary JG, Davis GL. Hepatitis C. In: Feldman M, Friedman LS, Brandt LJ, eds. Sleisenger and Fordtran’s Gastrointestinaland Liver Disease: Pathophysiology/Diagnosis/Management. 9 th ed, Vol 1. Philadelphia, PA: Saunders Elsevier. 2010: 1313 -1335. 2) Bartenschlager R, Lohmann V, Penin F. The molecular and structural basis of advanced antiviral therapy for hepatitis. C virus infection. Nat Rev Micro. 2013; 11: 482 -496. 3) Fox AN, Jacobson IM. Recent successes and noteworthy future prospects in the treatment of chronic hepatitis C. Clin Infect Dis. 2012; 55(Suppl 1): S 16 -S 24. 4) Lohmann V. Hepatitis C virus RNA replication. In: Bartenschlager R, ed. Hepatitis C Virus: From Molecular Virologyto Antiviral Therapy. Springer-Verlag Berlin Heidelberg. 2013: 167 -198. 3
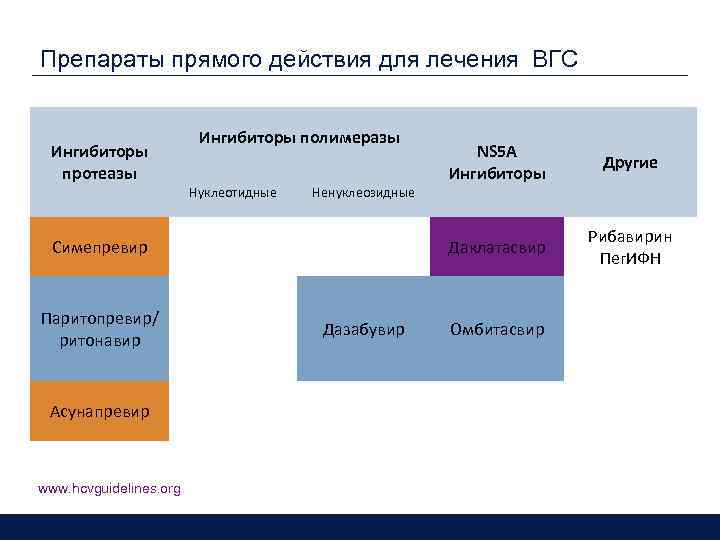 Препараты прямого действия для лечения ВГС Ингибиторы протеазы Ингибиторы полимеразы Нуклеотидные Симепревир Паритопревир/ ритонавир Асунапревир www. hcvguidelines. org Дазабувир Другие Даклатасвир Ненуклеозидные NS 5 A Ингибиторы Рибавирин Пег. ИФН Омбитасвир
Препараты прямого действия для лечения ВГС Ингибиторы протеазы Ингибиторы полимеразы Нуклеотидные Симепревир Паритопревир/ ритонавир Асунапревир www. hcvguidelines. org Дазабувир Другие Даклатасвир Ненуклеозидные NS 5 A Ингибиторы Рибавирин Пег. ИФН Омбитасвир
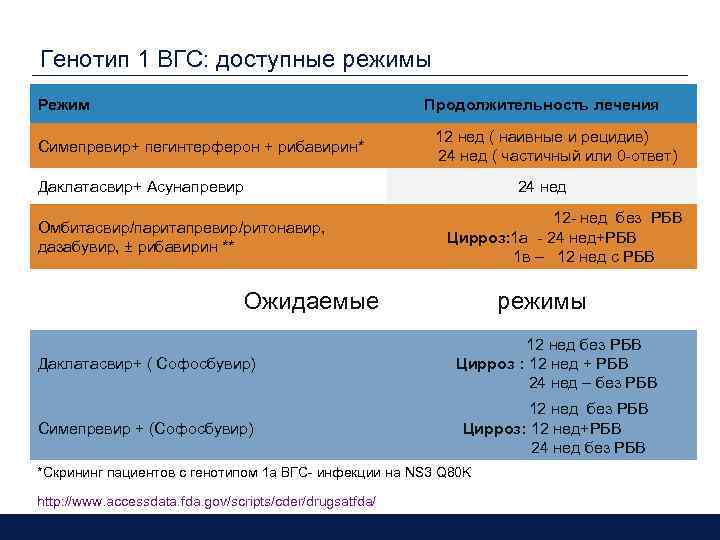 Генотип 1 ВГС: доступные режимы Режим Продолжительность лечения Симепревир+ пегинтерферон + рибавирин* 12 нед ( наивные и рецидив) 24 нед ( частичный или 0 -ответ) Даклатасвир+ Асунапревир Омбитасвир/паритапревир/ритонавир, дазабувир, ± рибавирин ** 24 нед 12 - нед без РБВ Цирроз: 1 а - 24 нед+РБВ 1 в – 12 нед с РБВ Ожидаемые режимы Даклатасвир+ ( Софосбувир) 12 нед без РБВ Цирроз : 12 нед + РБВ 24 нед – без РБВ Симепревир + (Софосбувир) 12 нед без РБВ Цирроз: 12 нед+РБВ 24 нед без РБВ *Скрининг пациентов с генотипом 1 a ВГС- инфекции на NS 3 Q 80 K http: //www. accessdata. fda. gov/scripts/cder/drugsatfda/
Генотип 1 ВГС: доступные режимы Режим Продолжительность лечения Симепревир+ пегинтерферон + рибавирин* 12 нед ( наивные и рецидив) 24 нед ( частичный или 0 -ответ) Даклатасвир+ Асунапревир Омбитасвир/паритапревир/ритонавир, дазабувир, ± рибавирин ** 24 нед 12 - нед без РБВ Цирроз: 1 а - 24 нед+РБВ 1 в – 12 нед с РБВ Ожидаемые режимы Даклатасвир+ ( Софосбувир) 12 нед без РБВ Цирроз : 12 нед + РБВ 24 нед – без РБВ Симепревир + (Софосбувир) 12 нед без РБВ Цирроз: 12 нед+РБВ 24 нед без РБВ *Скрининг пациентов с генотипом 1 a ВГС- инфекции на NS 3 Q 80 K http: //www. accessdata. fda. gov/scripts/cder/drugsatfda/
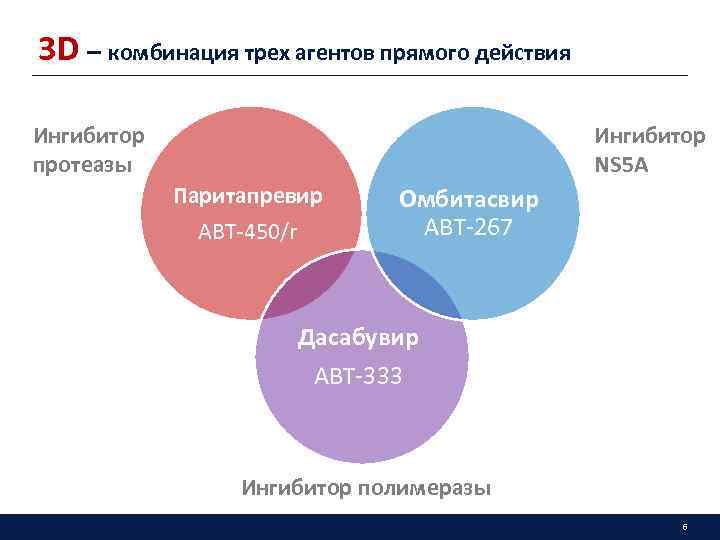 3 D – комбинация трех агентов прямого действия Ингибитор NS 5 A Ингибитор протеазы Паритапревир ABT-450/r Омбитасвир ABT-267 Дасабувир ABT-333 Ингибитор полимеразы 6
3 D – комбинация трех агентов прямого действия Ингибитор NS 5 A Ингибитор протеазы Паритапревир ABT-450/r Омбитасвир ABT-267 Дасабувир ABT-333 Ингибитор полимеразы 6
 Суточный режим приема препаратов в схеме Утро Вечер Дасабувир 1 таблетка х 2 раза в сутки Паритапревир/r + + Омбитасвир 2 таблетки х 1 раз в сутки Paritaprevir/ritonavir/ombitasvir, 150 мг/100 мг/25 мг; dasabuvir, 250 mg BID 7
Суточный режим приема препаратов в схеме Утро Вечер Дасабувир 1 таблетка х 2 раза в сутки Паритапревир/r + + Омбитасвир 2 таблетки х 1 раз в сутки Paritaprevir/ritonavir/ombitasvir, 150 мг/100 мг/25 мг; dasabuvir, 250 mg BID 7
 TURQUOISE-I «Turquoise» – бирюза (англ. ) ● Цель исследования – определить вирусологический ответ и и безопасность схемы 3 DAA (далее « 3 D» ) (паритапревир/ритонавир/омбитасвир + дасабувир) + РБВ у пациентов с коинфекцией ХГС (генотип 1) и ВИЧ, как с циррозом печени, так и без него ● В данном анализе представлены результаты, полученные на момент 12 недели после окончания терапии – Анализ «intent-to-treat» включил данные по всем рандомизированным пациентам, получившим одну или более доз(у) исследуемого препарата Wyles D et al. Presented at the 65 th Annual Meeting of the American Association for the Study of Liver Diseases, November 7 -11, 2014, Boston, Massachusetts. Poster 1939. Confidential information 8
TURQUOISE-I «Turquoise» – бирюза (англ. ) ● Цель исследования – определить вирусологический ответ и и безопасность схемы 3 DAA (далее « 3 D» ) (паритапревир/ритонавир/омбитасвир + дасабувир) + РБВ у пациентов с коинфекцией ХГС (генотип 1) и ВИЧ, как с циррозом печени, так и без него ● В данном анализе представлены результаты, полученные на момент 12 недели после окончания терапии – Анализ «intent-to-treat» включил данные по всем рандомизированным пациентам, получившим одну или более доз(у) исследуемого препарата Wyles D et al. Presented at the 65 th Annual Meeting of the American Association for the Study of Liver Diseases, November 7 -11, 2014, Boston, Massachusetts. Poster 1939. Confidential information 8
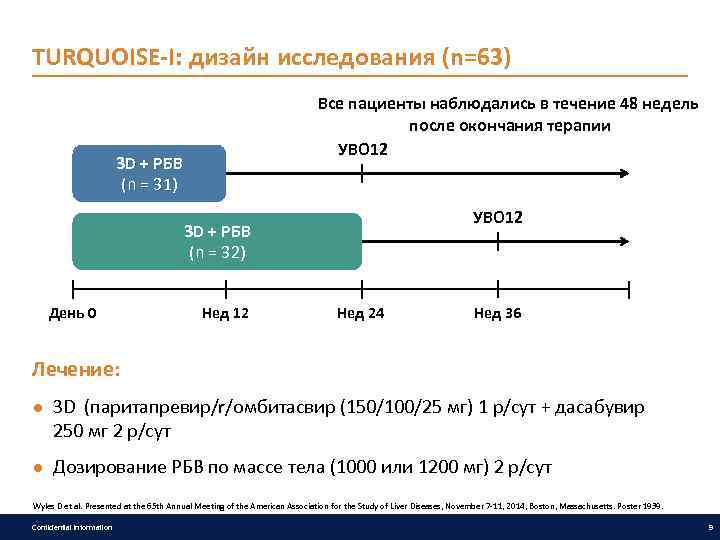 TURQUOISE-I: дизайн исследования (n=63) Все пациенты наблюдались в течение 48 недель после окончания терапии УВО 12 3 D + РБВ (n = 31) УВО 12 3 D + РБВ (n = 32) День 0 Нед 12 Нед 24 Нед 36 Лечение: ● 3 D (паритапревир/r/омбитасвир (150/100/25 мг) 1 р/сут + дасабувир 250 мг 2 р/сут ● Дозирование РБВ по массе тела (1000 или 1200 мг) 2 р/сут Wyles D et al. Presented at the 65 th Annual Meeting of the American Association for the Study of Liver Diseases, November 7 -11, 2014, Boston, Massachusetts. Poster 1939. Confidential information 9
TURQUOISE-I: дизайн исследования (n=63) Все пациенты наблюдались в течение 48 недель после окончания терапии УВО 12 3 D + РБВ (n = 31) УВО 12 3 D + РБВ (n = 32) День 0 Нед 12 Нед 24 Нед 36 Лечение: ● 3 D (паритапревир/r/омбитасвир (150/100/25 мг) 1 р/сут + дасабувир 250 мг 2 р/сут ● Дозирование РБВ по массе тела (1000 или 1200 мг) 2 р/сут Wyles D et al. Presented at the 65 th Annual Meeting of the American Association for the Study of Liver Diseases, November 7 -11, 2014, Boston, Massachusetts. Poster 1939. Confidential information 9
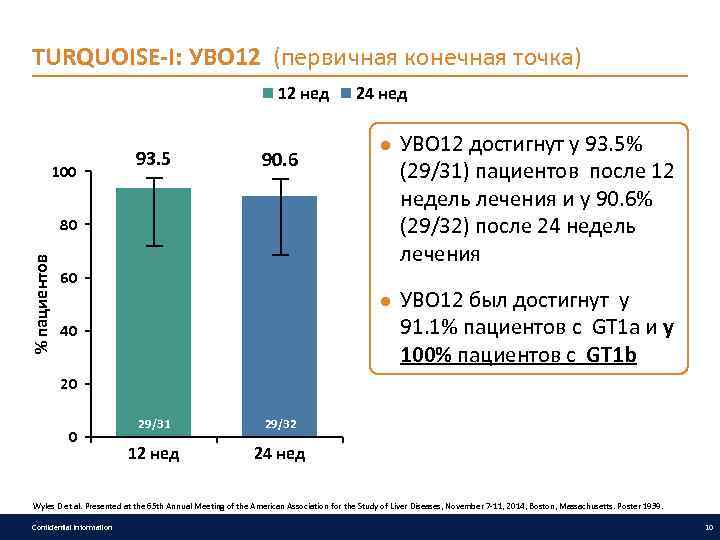 TURQUOISE-I: УВО 12 (первичная конечная точка) 12 нед 100 93. 5 90. 6 % пациентов 80 60 24 нед ● УВО 12 достигнут у 93. 5% (29/31) пациентов после 12 недель лечения и у 90. 6% (29/32) после 24 недель лечения ● УВО 12 был достигнут у 91. 1% пациентов с GT 1 a и у 100% пациентов с GT 1 b 40 20 0 29/31 29/32 12 нед 24 нед Wyles D et al. Presented at the 65 th Annual Meeting of the American Association for the Study of Liver Diseases, November 7 -11, 2014, Boston, Massachusetts. Poster 1939. Confidential information 10
TURQUOISE-I: УВО 12 (первичная конечная точка) 12 нед 100 93. 5 90. 6 % пациентов 80 60 24 нед ● УВО 12 достигнут у 93. 5% (29/31) пациентов после 12 недель лечения и у 90. 6% (29/32) после 24 недель лечения ● УВО 12 был достигнут у 91. 1% пациентов с GT 1 a и у 100% пациентов с GT 1 b 40 20 0 29/31 29/32 12 нед 24 нед Wyles D et al. Presented at the 65 th Annual Meeting of the American Association for the Study of Liver Diseases, November 7 -11, 2014, Boston, Massachusetts. Poster 1939. Confidential information 10
 TURQUOISE-I: вирусологические неудачи У 3. 1% (4/63) пациентов УВО не был достигнут (1 пациент из 12 -недельной группы и 3 пациента из 24 -недельной группы 12 недельная группа: ● У 1 пациента развился рецидив на 4 неделе после окончания лечения с появлениv RAV в трех вирусных мишенях, отсутствовавших исходно 24 недельная группа: ● У 1 пациента подствержден вирусологический прорыв с выявлением трех RAV, отсутствовавших исходно ● 2 пациента были реинфицированы новым изолятом вируса генотипа GT 1; RAV не обнаружены ни для одной из мишеней Wyles D et al. Presented at the 65 th Annual Meeting of the American Association for the Study of Liver Diseases, November 7 -11, 2014, Boston, Massachusetts. Poster 1939. Confidential information 11
TURQUOISE-I: вирусологические неудачи У 3. 1% (4/63) пациентов УВО не был достигнут (1 пациент из 12 -недельной группы и 3 пациента из 24 -недельной группы 12 недельная группа: ● У 1 пациента развился рецидив на 4 неделе после окончания лечения с появлениv RAV в трех вирусных мишенях, отсутствовавших исходно 24 недельная группа: ● У 1 пациента подствержден вирусологический прорыв с выявлением трех RAV, отсутствовавших исходно ● 2 пациента были реинфицированы новым изолятом вируса генотипа GT 1; RAV не обнаружены ни для одной из мишеней Wyles D et al. Presented at the 65 th Annual Meeting of the American Association for the Study of Liver Diseases, November 7 -11, 2014, Boston, Massachusetts. Poster 1939. Confidential information 11
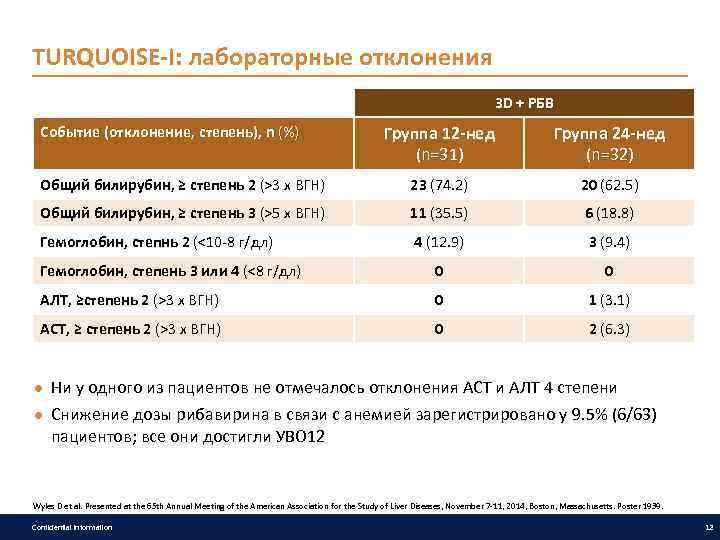 TURQUOISE-I: лабораторные отклонения 3 D + РБВ Группа 12 -нед (n=31) Группа 24 -нед (n=32) Общий билирубин, ≥ степень 2 (>3 x ВГН) 23 (74. 2) 20 (62. 5) Общий билирубин, ≥ степень 3 (>5 x ВГН) 11 (35. 5) 6 (18. 8) Гемоглобин, степнь 2 (<10 -8 г/дл) 4 (12. 9) 3 (9. 4) Гемоглобин, степень 3 или 4 (<8 г/дл) 0 0 АЛТ, ≥степень 2 (>3 x ВГН) 0 1 (3. 1) АСТ, ≥ степень 2 (>3 x ВГН) 0 2 (6. 3) Событие (отклонение, степень), n (%) ● Ни у одного из пациентов не отмечалось отклонения АСТ и АЛТ 4 степени ● Снижение дозы рибавирина в связи с анемией зарегистрировано у 9. 5% (6/63) пациентов; все они достигли УВО 12 Wyles D et al. Presented at the 65 th Annual Meeting of the American Association for the Study of Liver Diseases, November 7 -11, 2014, Boston, Massachusetts. Poster 1939. Confidential information 12
TURQUOISE-I: лабораторные отклонения 3 D + РБВ Группа 12 -нед (n=31) Группа 24 -нед (n=32) Общий билирубин, ≥ степень 2 (>3 x ВГН) 23 (74. 2) 20 (62. 5) Общий билирубин, ≥ степень 3 (>5 x ВГН) 11 (35. 5) 6 (18. 8) Гемоглобин, степнь 2 (<10 -8 г/дл) 4 (12. 9) 3 (9. 4) Гемоглобин, степень 3 или 4 (<8 г/дл) 0 0 АЛТ, ≥степень 2 (>3 x ВГН) 0 1 (3. 1) АСТ, ≥ степень 2 (>3 x ВГН) 0 2 (6. 3) Событие (отклонение, степень), n (%) ● Ни у одного из пациентов не отмечалось отклонения АСТ и АЛТ 4 степени ● Снижение дозы рибавирина в связи с анемией зарегистрировано у 9. 5% (6/63) пациентов; все они достигли УВО 12 Wyles D et al. Presented at the 65 th Annual Meeting of the American Association for the Study of Liver Diseases, November 7 -11, 2014, Boston, Massachusetts. Poster 1939. Confidential information 12
 Даклатасвир (DCV, BMS-790052) • Ингибитор комплекса репликации NS 5 A ВГС 1 • Мощная (пикомолярные EC 50) пангенотипическая активность in vitro 1 • Дозирование один раз в день без необходимости изменения дозировки у пациентов с нарушением функции печени или финальной стадии заболевания почек 1, 2 • Отсутствие значимых межлекарственных взаимодействий 3 -7 • Не активен против прочих РНК и ДНК содержащих вирусов, включая вирус иммунодефицита человека (ВИЧ) 1. Gao et al. Nature. 2010; 465: 96. 2. Bifano et al. AASLD 2011. Poster 1362. 3. Bifano et al. AASLD 2010. Poster 827. 4. Eley et al. 8 th Internationall Workshop on Clinical Pharmacology of Hepatitis Therapy. 2013. Oral presentation 014 PK. 6. Bifano et al. AASLD 2013. Poster 1081. 5. Bifano et al. Antivir Ther. 2013. Epub ahead of print. 7. Bifano et al. EASL 2013. Poster 794.
Даклатасвир (DCV, BMS-790052) • Ингибитор комплекса репликации NS 5 A ВГС 1 • Мощная (пикомолярные EC 50) пангенотипическая активность in vitro 1 • Дозирование один раз в день без необходимости изменения дозировки у пациентов с нарушением функции печени или финальной стадии заболевания почек 1, 2 • Отсутствие значимых межлекарственных взаимодействий 3 -7 • Не активен против прочих РНК и ДНК содержащих вирусов, включая вирус иммунодефицита человека (ВИЧ) 1. Gao et al. Nature. 2010; 465: 96. 2. Bifano et al. AASLD 2011. Poster 1362. 3. Bifano et al. AASLD 2010. Poster 827. 4. Eley et al. 8 th Internationall Workshop on Clinical Pharmacology of Hepatitis Therapy. 2013. Oral presentation 014 PK. 6. Bifano et al. AASLD 2013. Poster 1081. 5. Bifano et al. Antivir Ther. 2013. Epub ahead of print. 7. Bifano et al. EASL 2013. Poster 794.
 Асунапревир (ASV, BMS-650032) ■ Высоко селективный ингибитор протеазы NS 3 ВГС 1 ■ Противовирусная активность в отношении 1, 4, 5, 6 генотипов ВГС in vitro*1, 2 ■ Мощное действие (наномолярные EC 50)1 ■ Дозирование 2 раза в сутки без необходимости бустирования или изменения дозировки у пациентов финальной стадии заболевания почек 3, 4, 6 ■ Изучен в комбинации с другими препаратами прямого действия и/или Peg. IFN alfa + RBV у более чем 2000 пациентов 3 -5 ■ Не активен против прочих РНК и ДНК содержащих вирусов, включая вирус иммунодефицита человека (ВИЧ) *В РФ ожидается регистрация только для лечения ХГС 1 генотипа DAAs = direct-acting antivirals; RBV = ribavirin; Peg. IFN alfa = pegylated interferon alfa. 1. Mc. Phee et al. Antimicrob Agents Chemother. 2012; 56: 5387; 2. Pelosi et al. Antimicrob Agents Chemother. 2012; 56: 5230; 3. Everson et al. AASLD 2012. Oral presentation LB-3; 4. Pasquinelli et al. AASLD 2009. Oral presentation 225; 5. Garimella et al. AASLD 2013. Poster 463. 6. Garimella et al. AASLD 2013. Oral presentation 463
Асунапревир (ASV, BMS-650032) ■ Высоко селективный ингибитор протеазы NS 3 ВГС 1 ■ Противовирусная активность в отношении 1, 4, 5, 6 генотипов ВГС in vitro*1, 2 ■ Мощное действие (наномолярные EC 50)1 ■ Дозирование 2 раза в сутки без необходимости бустирования или изменения дозировки у пациентов финальной стадии заболевания почек 3, 4, 6 ■ Изучен в комбинации с другими препаратами прямого действия и/или Peg. IFN alfa + RBV у более чем 2000 пациентов 3 -5 ■ Не активен против прочих РНК и ДНК содержащих вирусов, включая вирус иммунодефицита человека (ВИЧ) *В РФ ожидается регистрация только для лечения ХГС 1 генотипа DAAs = direct-acting antivirals; RBV = ribavirin; Peg. IFN alfa = pegylated interferon alfa. 1. Mc. Phee et al. Antimicrob Agents Chemother. 2012; 56: 5387; 2. Pelosi et al. Antimicrob Agents Chemother. 2012; 56: 5230; 3. Everson et al. AASLD 2012. Oral presentation LB-3; 4. Pasquinelli et al. AASLD 2009. Oral presentation 225; 5. Garimella et al. AASLD 2013. Poster 463. 6. Garimella et al. AASLD 2013. Oral presentation 463
 КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ КОМБИНАЦИИ DCV+ASV В ТЕРАПИИ ХРОНИЧЕСКОГО ГЕПАТИТА С
КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ КОМБИНАЦИИ DCV+ASV В ТЕРАПИИ ХРОНИЧЕСКОГО ГЕПАТИТА С
 Дизайн исследования HALLMARK-DUAL (AI 447 -028) Рандомизация 2: 1 День1 Ранее не получавшие терапию Не ответившие на терапию Противопоказания/ непереносимость peg. IFNα/RBV 12 нед 24 нед DCV 60 мг 1 р/д + ASV 100 мг 2 р/д 24 нед (N = 203)a DCV-PBO + ASVСТОП PBO 12 нед (N = 102) 48 нед Наблюдение 24 недели Включенны в другое исследование: DCV + ASV 24 weeks DCV + ASV 24 недели (N = 205) Наблюдение 24 недели DCV + ASV 24 недели (N = 235) Наблюдение 24 недели a Исключая 2 пациентов, которым был назначены DCV + ASV, несмотря на ■ ■ УВО 12 Первичная конечная точка: доля пациентов, достигших УВО 12, получавших DCV + ASV Пациенты, инфицированные ВГС, генотип 1 b рандомизацию; пациенты были исключены из анализа эффективности, но оба достигли УВО 12. – Не получавшие ранее терапии – Не ответившие: нулевой или частичный ответ на терапию peg. IFNα/RBV – Пациенты, имеющие противопоказания/непереносимость(получавшие и не получавшие ранее терапию peg. IFNα/RBV) ввиду: ■ ■ ■ Депрессии Анемии/нейтропении Компенсированного фиброза/цирроза (F 3/F 4) с тромбоцитопенией Manns M. , Pol S. , Jacobson I. et al. Lancet, 2014
Дизайн исследования HALLMARK-DUAL (AI 447 -028) Рандомизация 2: 1 День1 Ранее не получавшие терапию Не ответившие на терапию Противопоказания/ непереносимость peg. IFNα/RBV 12 нед 24 нед DCV 60 мг 1 р/д + ASV 100 мг 2 р/д 24 нед (N = 203)a DCV-PBO + ASVСТОП PBO 12 нед (N = 102) 48 нед Наблюдение 24 недели Включенны в другое исследование: DCV + ASV 24 weeks DCV + ASV 24 недели (N = 205) Наблюдение 24 недели DCV + ASV 24 недели (N = 235) Наблюдение 24 недели a Исключая 2 пациентов, которым был назначены DCV + ASV, несмотря на ■ ■ УВО 12 Первичная конечная точка: доля пациентов, достигших УВО 12, получавших DCV + ASV Пациенты, инфицированные ВГС, генотип 1 b рандомизацию; пациенты были исключены из анализа эффективности, но оба достигли УВО 12. – Не получавшие ранее терапии – Не ответившие: нулевой или частичный ответ на терапию peg. IFNα/RBV – Пациенты, имеющие противопоказания/непереносимость(получавшие и не получавшие ранее терапию peg. IFNα/RBV) ввиду: ■ ■ ■ Депрессии Анемии/нейтропении Компенсированного фиброза/цирроза (F 3/F 4) с тромбоцитопенией Manns M. , Pol S. , Jacobson I. et al. Lancet, 2014
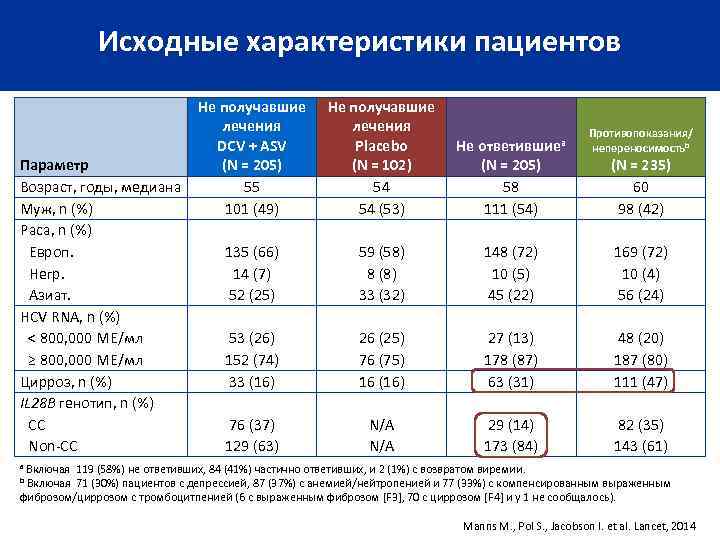 Исходные характеристики пациентов Параметр Возраст, годы, медиана Муж, n (%) Раса, n (%) Европ. Негр. Азиат. HCV RNA, n (%) < 800, 000 МЕ/мл ≥ 800, 000 МЕ/мл Цирроз, n (%) IL 28 B генотип, n (%) CC Non-CC Не получавшие лечения DCV + ASV (N = 205) 55 101 (49) Не получавшие лечения Placebo (N = 102) 54 54 (53) Не ответившиеa (N = 205) 58 111 (54) 135 (66) 14 (7) 52 (25) 59 (58) 8 (8) 33 (32) 148 (72) 10 (5) 45 (22) 169 (72) 10 (4) 56 (24) 53 (26) 152 (74) 33 (16) 26 (25) 76 (75) 16 (16) 27 (13) 178 (87) 63 (31) 48 (20) 187 (80) 111 (47) 76 (37) 129 (63) N/A 29 (14) 173 (84) 82 (35) 143 (61) Противопоказания/ непереносимостьb (N = 235) 60 98 (42) a Включая 119 (58%) не ответивших, 84 (41%) частично ответивших, и 2 (1%) с возвратом виремии. b Включая 71 (30%) пациентов с депрессией, 87 (37%) с анемией/нейтропенией и 77 (33%) с компенсированным выраженным фиброзом/циррозом с тромбоцитпенией (6 с выраженным фиброзом [F 3], 70 с циррозом [F 4] и у 1 не сообщалось). Manns M. , Pol S. , Jacobson I. et al. Lancet, 2014
Исходные характеристики пациентов Параметр Возраст, годы, медиана Муж, n (%) Раса, n (%) Европ. Негр. Азиат. HCV RNA, n (%) < 800, 000 МЕ/мл ≥ 800, 000 МЕ/мл Цирроз, n (%) IL 28 B генотип, n (%) CC Non-CC Не получавшие лечения DCV + ASV (N = 205) 55 101 (49) Не получавшие лечения Placebo (N = 102) 54 54 (53) Не ответившиеa (N = 205) 58 111 (54) 135 (66) 14 (7) 52 (25) 59 (58) 8 (8) 33 (32) 148 (72) 10 (5) 45 (22) 169 (72) 10 (4) 56 (24) 53 (26) 152 (74) 33 (16) 26 (25) 76 (75) 16 (16) 27 (13) 178 (87) 63 (31) 48 (20) 187 (80) 111 (47) 76 (37) 129 (63) N/A 29 (14) 173 (84) 82 (35) 143 (61) Противопоказания/ непереносимостьb (N = 235) 60 98 (42) a Включая 119 (58%) не ответивших, 84 (41%) частично ответивших, и 2 (1%) с возвратом виремии. b Включая 71 (30%) пациентов с депрессией, 87 (37%) с анемией/нейтропенией и 77 (33%) с компенсированным выраженным фиброзом/циррозом с тромбоцитпенией (6 с выраженным фиброзом [F 3], 70 с циррозом [F 4] и у 1 не сообщалось). Manns M. , Pol S. , Jacobson I. et al. Lancet, 2014
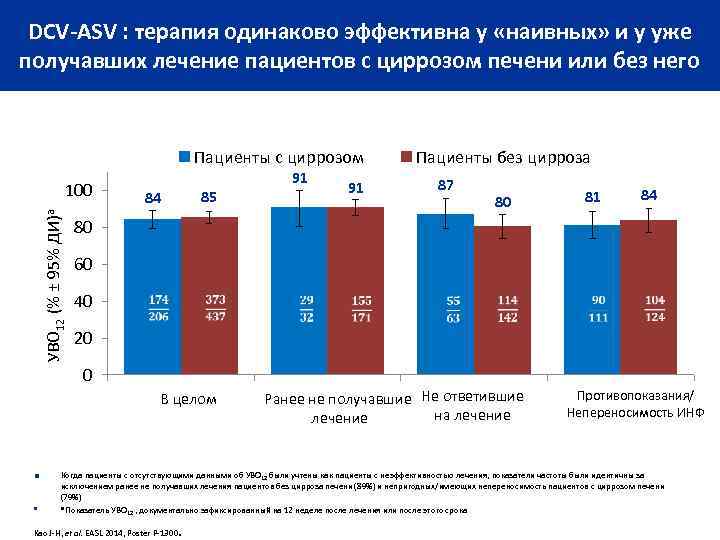 DCV-ASV : терапия одинаково эффективна у «наивных» и у уже получавших лечение пациентов с циррозом печени или без него Пациенты с циррозом УВО 12 (% ± 95% ДИ)a 100 84 85 ■ 91 87 80 81 84 80 60 40 20 0 В целом ■ 91 Пациенты без цирроза Ранее не получавшие Не ответившие на лечение Противопоказания/ Непереносимость ИНФ Когда пациенты с отсутствующими данными об УВО 12 были учтены как пациенты с неэффективностью лечения, показатели частоты были идентичны за исключением ранее не получавших лечения пациентов без цирроза печени (89%) и непригодных/имеющих непереносимость пациентов с циррозом печени (79%) a Показатель УВО , документально зафиксированный на 12 неделе после лечения или после этого срока 12 . Kao J-H, et al. EASL 2014, Poster P-1300
DCV-ASV : терапия одинаково эффективна у «наивных» и у уже получавших лечение пациентов с циррозом печени или без него Пациенты с циррозом УВО 12 (% ± 95% ДИ)a 100 84 85 ■ 91 87 80 81 84 80 60 40 20 0 В целом ■ 91 Пациенты без цирроза Ранее не получавшие Не ответившие на лечение Противопоказания/ Непереносимость ИНФ Когда пациенты с отсутствующими данными об УВО 12 были учтены как пациенты с неэффективностью лечения, показатели частоты были идентичны за исключением ранее не получавших лечения пациентов без цирроза печени (89%) и непригодных/имеющих непереносимость пациентов с циррозом печени (79%) a Показатель УВО , документально зафиксированный на 12 неделе после лечения или после этого срока 12 . Kao J-H, et al. EASL 2014, Poster P-1300
 AI 447 -011 ASV +DCV SVR 4 GT 1 Null Responders Заключение по исследованию HALLMARK DUAL ■ На терапии DCV + ASV у пациентов с ХГС генотипа 1 b частота достижения УВО 12 была 91% в группе не получавших ранее лечения, 82% -у ранее не ответивших на терапию, и 83% у имевших противопоказания/непереносимость терапии ИНФ/РБВ – Частота УВО 12 одинакова у группе пациентов без цирроза (85%) и с циррозом (84%) – Ответ на терапию не зависел от пола, возраста, расы, генотипа IL 28 B, опыта терапии IFN/RBV ■ Комбинация DCV + ASV показала хороший профиль безопасности и переносимости – Всего 1, 6% пациентов прервали терапию в связи с развитием НЯ
AI 447 -011 ASV +DCV SVR 4 GT 1 Null Responders Заключение по исследованию HALLMARK DUAL ■ На терапии DCV + ASV у пациентов с ХГС генотипа 1 b частота достижения УВО 12 была 91% в группе не получавших ранее лечения, 82% -у ранее не ответивших на терапию, и 83% у имевших противопоказания/непереносимость терапии ИНФ/РБВ – Частота УВО 12 одинакова у группе пациентов без цирроза (85%) и с циррозом (84%) – Ответ на терапию не зависел от пола, возраста, расы, генотипа IL 28 B, опыта терапии IFN/RBV ■ Комбинация DCV + ASV показала хороший профиль безопасности и переносимости – Всего 1, 6% пациентов прервали терапию в связи с развитием НЯ
 ALLY-2 ( Даклатасвир + Софосбувир): Дизайн исследования( N-203) Ранее не получавшие лечения N 101 Рандомизация 2: 1 50 DCV 30/60/90 мг + SOF 400 мг QD Ранее получавшие лечение 52 УВО 12* DCV 30/60/90 мг + SOF 400 мг QD Неделя 0 8 12 24 ■ Первичная конечная точка: УВО 12 у ранее не леченных пациентов с GT 1, полчавших терапию 12 недель ■ Даклатасвир в стандартной дозировке 60 мг – Доза корректировалась в зависимости от сопутсвующей ВААРТ: 30 мг если ИП бустирован ритонавиром, 90 мг с ННИОТ и кроме RPV * HCV RNA
ALLY-2 ( Даклатасвир + Софосбувир): Дизайн исследования( N-203) Ранее не получавшие лечения N 101 Рандомизация 2: 1 50 DCV 30/60/90 мг + SOF 400 мг QD Ранее получавшие лечение 52 УВО 12* DCV 30/60/90 мг + SOF 400 мг QD Неделя 0 8 12 24 ■ Первичная конечная точка: УВО 12 у ранее не леченных пациентов с GT 1, полчавших терапию 12 недель ■ Даклатасвир в стандартной дозировке 60 мг – Доза корректировалась в зависимости от сопутсвующей ВААРТ: 30 мг если ИП бустирован ритонавиром, 90 мг с ННИОТ и кроме RPV * HCV RNA
 ALLY-2: Популяция пациентов ■ Две когорты – Ранее не получавшие лечение – Ранее получавшие лечение: ИНФ – альфа содержащее лечение, включая комбинацию с ингибиторами NS 3 протеазы, NS 5 B полимеразы (т. е. софосбувир), micro. RNA или циклофилин ■ Любой генотип HCV (GT) – Не-GT 1 до 20% в каждой когорте ■ Компенсированный цирроз до 50% ■ ВИЧ-1 инфекция – На АРВТ: РНК ВИЧ < 50 копий/мл и CD 4 ≥ 100 клеток/мл – Без АРВТ: CD 4 ≥ 350 клеток/мл ■ Разрешенный АРВ препараты: ИП бустированные ритонавиром, НИОТ, ННИОТ, ИИ, антагонисты CCR 5, ИС – Исключение: режим на основе ННИОТ (кроме RPV) с бустированным ритонавиром ИП 21
ALLY-2: Популяция пациентов ■ Две когорты – Ранее не получавшие лечение – Ранее получавшие лечение: ИНФ – альфа содержащее лечение, включая комбинацию с ингибиторами NS 3 протеазы, NS 5 B полимеразы (т. е. софосбувир), micro. RNA или циклофилин ■ Любой генотип HCV (GT) – Не-GT 1 до 20% в каждой когорте ■ Компенсированный цирроз до 50% ■ ВИЧ-1 инфекция – На АРВТ: РНК ВИЧ < 50 копий/мл и CD 4 ≥ 100 клеток/мл – Без АРВТ: CD 4 ≥ 350 клеток/мл ■ Разрешенный АРВ препараты: ИП бустированные ритонавиром, НИОТ, ННИОТ, ИИ, антагонисты CCR 5, ИС – Исключение: режим на основе ННИОТ (кроме RPV) с бустированным ритонавиром ИП 21
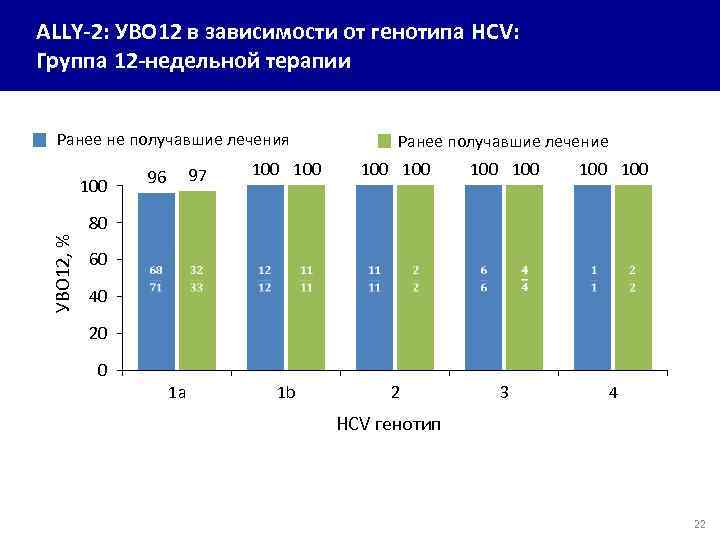 ALLY-2: УВО 12 в зависимости от генотипа HCV: Группа 12 -недельной терапии Ранее не получавшие лечения 97 96 100 Ранее получавшие лечение 100 100 УВО 12, % 80 60 40 20 0 1 a 1 b 2 3 4 HCV генотип 22
ALLY-2: УВО 12 в зависимости от генотипа HCV: Группа 12 -недельной терапии Ранее не получавшие лечения 97 96 100 Ранее получавшие лечение 100 100 УВО 12, % 80 60 40 20 0 1 a 1 b 2 3 4 HCV генотип 22
 ALLY-2: Заключение ■ Было достигнуто 97% УВО 12 после 12 недель терапии DCV + SOF 1 р/д у пациентов с ко-инфекцией ВИЧ/HCV – 97% в GT 1; 100% в GT 2, 3, и 4 – 97% у ранее не получавших лечения и 98% у пациентов, ранее получавших терапию – Не было выявлено значимых различий по расе, исходному уровню РНК HСV, наличию цирроза или АРВ-режиму ■ УВО 12 был получен у 76% пациентов в группе 8 недельной терапии ■ Не было отмечено влияния на подавление РНК ВИЧ у пациентов получающих ВААРТ совместно с DCV + SOF ■ Режим DCV + SOF был безопасным и в целом хорошо переносился 23
ALLY-2: Заключение ■ Было достигнуто 97% УВО 12 после 12 недель терапии DCV + SOF 1 р/д у пациентов с ко-инфекцией ВИЧ/HCV – 97% в GT 1; 100% в GT 2, 3, и 4 – 97% у ранее не получавших лечения и 98% у пациентов, ранее получавших терапию – Не было выявлено значимых различий по расе, исходному уровню РНК HСV, наличию цирроза или АРВ-режиму ■ УВО 12 был получен у 76% пациентов в группе 8 недельной терапии ■ Не было отмечено влияния на подавление РНК ВИЧ у пациентов получающих ВААРТ совместно с DCV + SOF ■ Режим DCV + SOF был безопасным и в целом хорошо переносился 23
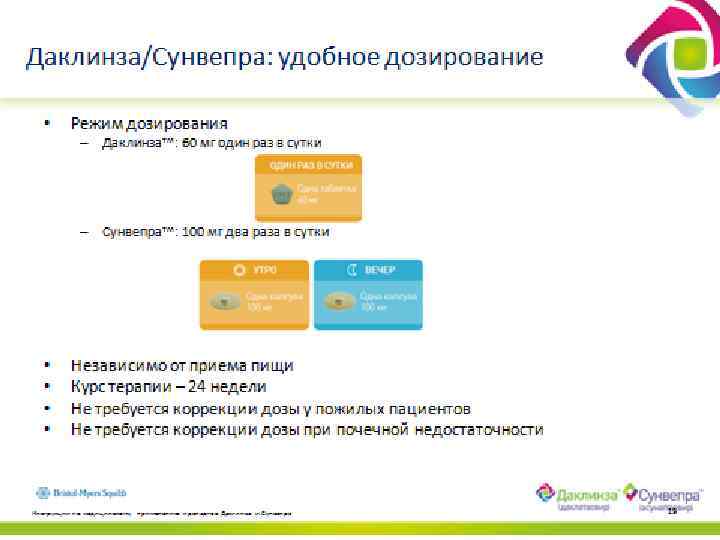 24
24
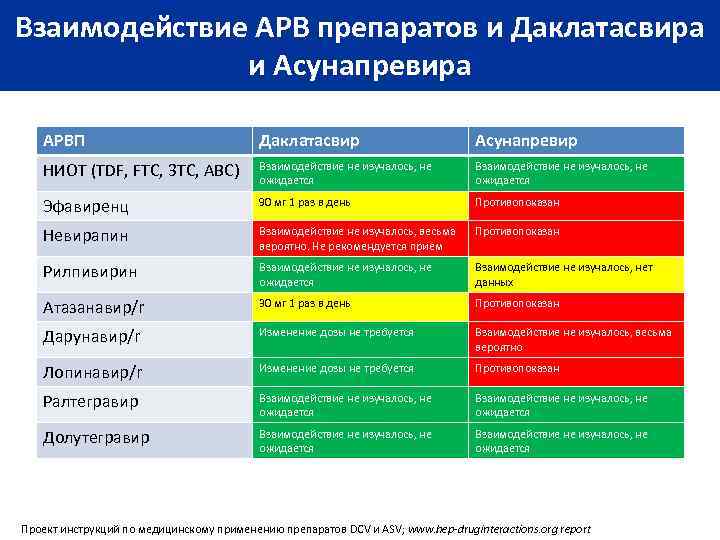 Взаимодействие АРВ препаратов и Даклатасвира и Асунапревира АРВП Даклатасвир Асунапревир НИОТ (TDF, FTC, 3 TC, ABC) Взаимодействие не изучалось, не ожидается Эфавиренц 90 мг 1 раз в день Противопоказан Невирапин Взаимодействие не изучалось, весьма вероятно. Не рекомендуется прием Противопоказан Рилпивирин Взаимодействие не изучалось, не ожидается Взаимодействие не изучалось, нет данных Атазанавир/r 30 мг 1 раз в день Противопоказан Дарунавир/r Изменение дозы не требуется Взаимодействие не изучалось, весьма вероятно Лопинавир/r Изменение дозы не требуется Противопоказан Ралтегравир Взаимодействие не изучалось, не ожидается Долутегравир Взаимодействие не изучалось, не ожидается Проект инструкций по медицинскому применению препаратов DCV и ASV; www. hep-druginteractions. org report
Взаимодействие АРВ препаратов и Даклатасвира и Асунапревира АРВП Даклатасвир Асунапревир НИОТ (TDF, FTC, 3 TC, ABC) Взаимодействие не изучалось, не ожидается Эфавиренц 90 мг 1 раз в день Противопоказан Невирапин Взаимодействие не изучалось, весьма вероятно. Не рекомендуется прием Противопоказан Рилпивирин Взаимодействие не изучалось, не ожидается Взаимодействие не изучалось, нет данных Атазанавир/r 30 мг 1 раз в день Противопоказан Дарунавир/r Изменение дозы не требуется Взаимодействие не изучалось, весьма вероятно Лопинавир/r Изменение дозы не требуется Противопоказан Ралтегравир Взаимодействие не изучалось, не ожидается Долутегравир Взаимодействие не изучалось, не ожидается Проект инструкций по медицинскому применению препаратов DCV и ASV; www. hep-druginteractions. org report
 Резюме • Получены многообещающие данные о применении ПППД у пациентов с коинфекцией ВИЧ/ВГС – Установлена высокая эффективность и безопасность ПППД у пациентов с коинфекцией ; – У пациентов, получающих ВААРТ, сохраняется супрессия ВИЧ – Доказана равная эффективность схем с ПППД у пациентов с моно ВГС и коинфекцией ВИЧ • Продолжаются исследования по изучению эффективности и безопасности, укорочению длительности лечения ПППД следующего поколения
Резюме • Получены многообещающие данные о применении ПППД у пациентов с коинфекцией ВИЧ/ВГС – Установлена высокая эффективность и безопасность ПППД у пациентов с коинфекцией ; – У пациентов, получающих ВААРТ, сохраняется супрессия ВИЧ – Доказана равная эффективность схем с ПППД у пациентов с моно ВГС и коинфекцией ВИЧ • Продолжаются исследования по изучению эффективности и безопасности, укорочению длительности лечения ПППД следующего поколения
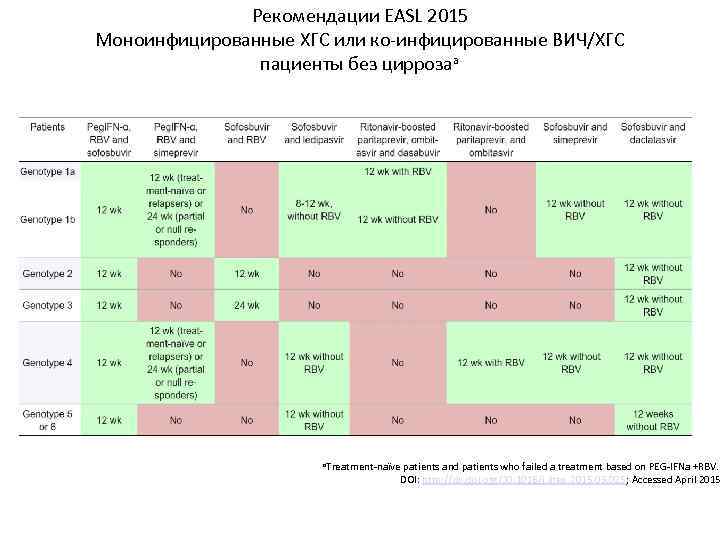 Рекомендации EASL 2015 Моноинфицированные ХГС или ко-инфицированные ВИЧ/ХГС пациенты без циррозаa a. Treatment-naïve patients and patients who failed a treatment based on PEG-IFNa +RBV. DOI: http: //dx. doi. org/10. 1016/j. jhep. 2015. 03. 025; Accessed April 2015
Рекомендации EASL 2015 Моноинфицированные ХГС или ко-инфицированные ВИЧ/ХГС пациенты без циррозаa a. Treatment-naïve patients and patients who failed a treatment based on PEG-IFNa +RBV. DOI: http: //dx. doi. org/10. 1016/j. jhep. 2015. 03. 025; Accessed April 2015
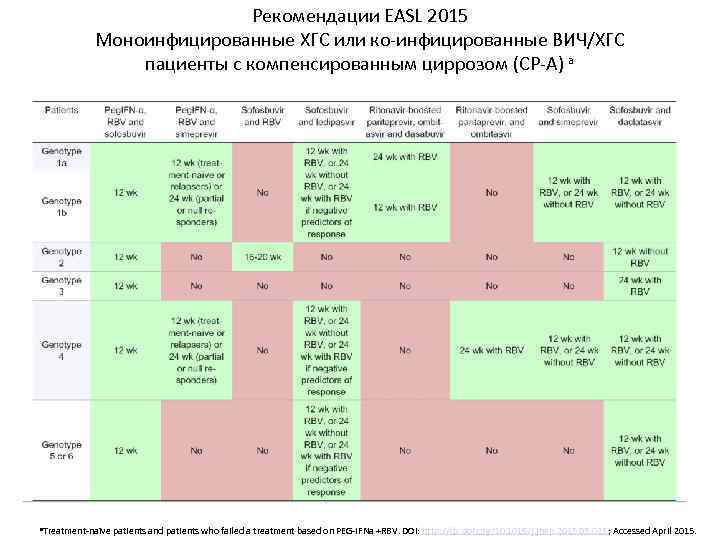 Рекомендации EASL 2015 Моноинфицированные ХГС или ко-инфицированные ВИЧ/ХГС пациенты с компенсированным циррозом (CP-A) a a. Treatment-naïve patients and patients who failed a treatment based on PEG-IFNa +RBV. DOI: http: //dx. doi. org/10. 1016/j. jhep. 2015. 03. 025; Accessed April 2015.
Рекомендации EASL 2015 Моноинфицированные ХГС или ко-инфицированные ВИЧ/ХГС пациенты с компенсированным циррозом (CP-A) a a. Treatment-naïve patients and patients who failed a treatment based on PEG-IFNa +RBV. DOI: http: //dx. doi. org/10. 1016/j. jhep. 2015. 03. 025; Accessed April 2015.
 СПАСИБО ЗА ВНИМАНИЕ! Paritaprevir/ ritonavir + dasabuvir + Sofosbuvir + GSombitasvir 5816 Asunaprevir + Grazoprevir + daclatasvir elbasvir Daclatasvir + Sofosbuvir + asunaprevir + daclatasvir beclabuvir Sofosbuvir + GS 5816 Sofosbuvir + ribavirin daclatasvir Sofosbuvir + Simeprevir + ledipasvir sofosbuvir Grazoprevir + elbasvir Daclatasvir + asunaprevir + beclabuvir Sofosbuvir + GS 5816
СПАСИБО ЗА ВНИМАНИЕ! Paritaprevir/ ritonavir + dasabuvir + Sofosbuvir + GSombitasvir 5816 Asunaprevir + Grazoprevir + daclatasvir elbasvir Daclatasvir + Sofosbuvir + asunaprevir + daclatasvir beclabuvir Sofosbuvir + GS 5816 Sofosbuvir + ribavirin daclatasvir Sofosbuvir + Simeprevir + ledipasvir sofosbuvir Grazoprevir + elbasvir Daclatasvir + asunaprevir + beclabuvir Sofosbuvir + GS 5816


