Иммунология опухолевого роста 2013.ppt
- Количество слайдов: 41
 Клиническая иммунология опухолевого роста
Клиническая иммунология опухолевого роста
 • Злокачественные новообразования форма патологии, которая сопровождается принципиальными искажениями механизмов контроля пролиферации и дифференцировки клеток: неконтролируемая пролиферация клона клеток без полноценной дифференцировки.
• Злокачественные новообразования форма патологии, которая сопровождается принципиальными искажениями механизмов контроля пролиферации и дифференцировки клеток: неконтролируемая пролиферация клона клеток без полноценной дифференцировки.
 Современная концепция онкогенеза • Протоонкогены - гены пролиферации и дифференцировки клеток. В нормальных клетках белки, кодируемые онкогенами, необходимы для регуляции роста клеток (гены синтеза ростовых факторов, рецепторов к ним, гены сигнальных и транскрибирующих факторов). • Онкогены - избыточно или аномально экспрессированные протоонкогены. • Опухолесупресорные гены – гены, контролирующие клеточный цикл или индукцию апоптоза.
Современная концепция онкогенеза • Протоонкогены - гены пролиферации и дифференцировки клеток. В нормальных клетках белки, кодируемые онкогенами, необходимы для регуляции роста клеток (гены синтеза ростовых факторов, рецепторов к ним, гены сигнальных и транскрибирующих факторов). • Онкогены - избыточно или аномально экспрессированные протоонкогены. • Опухолесупресорные гены – гены, контролирующие клеточный цикл или индукцию апоптоза.
 Механизмы онкогенеза - Нарушение контроля над пролиферативной активностью клеток - Нарушение механизмов апоптоза
Механизмы онкогенеза - Нарушение контроля над пролиферативной активностью клеток - Нарушение механизмов апоптоза
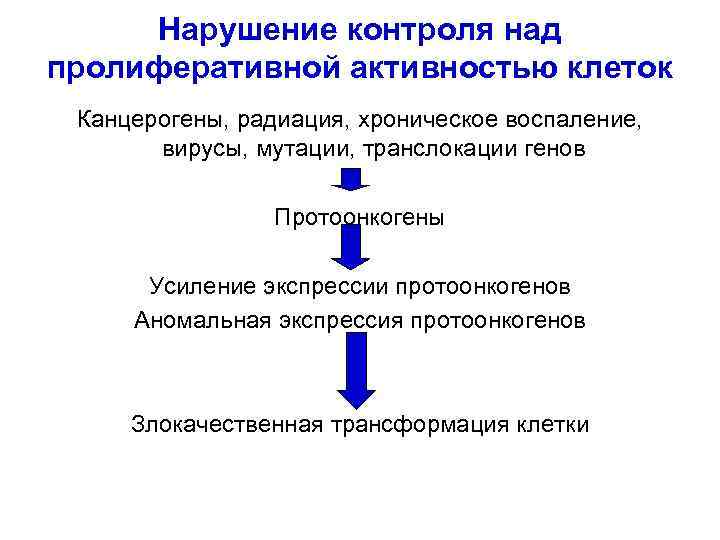 Нарушение контроля над пролиферативной активностью клеток Канцерогены, радиация, хроническое воспаление, вирусы, мутации, транслокации генов Протоонкогены Усиление экспрессии протоонкогенов Аномальная экспрессия протоонкогенов Злокачественная трансформация клетки
Нарушение контроля над пролиферативной активностью клеток Канцерогены, радиация, хроническое воспаление, вирусы, мутации, транслокации генов Протоонкогены Усиление экспрессии протоонкогенов Аномальная экспрессия протоонкогенов Злокачественная трансформация клетки
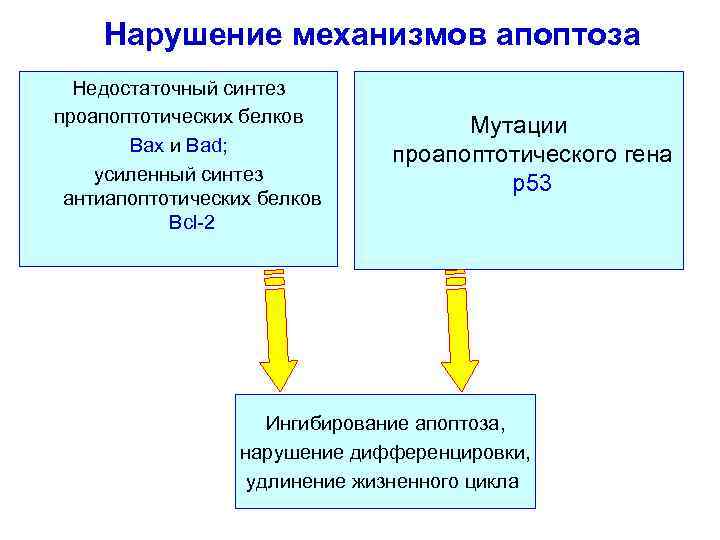 Нарушение механизмов апоптоза Недостаточный синтез проапоптотических белков Bax и Bad; усиленный синтез антиапоптотических белков Bcl-2 Мутации проапоптотического гена p 53 Ингибирование апоптоза, нарушение дифференцировки, удлинение жизненного цикла
Нарушение механизмов апоптоза Недостаточный синтез проапоптотических белков Bax и Bad; усиленный синтез антиапоптотических белков Bcl-2 Мутации проапоптотического гена p 53 Ингибирование апоптоза, нарушение дифференцировки, удлинение жизненного цикла
 Результат активации онкогенов и нарушения контроля над дифференцировкой - возникновение клона опухолевых клеток с новыми свойствами
Результат активации онкогенов и нарушения контроля над дифференцировкой - возникновение клона опухолевых клеток с новыми свойствами
 Свойства опухолевых клеток - Функциональные особенности опухолевых клеток - Антигенные свойства опухолевых клеток
Свойства опухолевых клеток - Функциональные особенности опухолевых клеток - Антигенные свойства опухолевых клеток
 Функциональные особенности опухолевых клеток • • Активация онкогенов, мутации в опухолесупрессорных генах Способность к безудержному росту Опухолевая трансформация - изменение антигенных свойств опухолей Резистентность к апоптозу (экспрессия антиапоптозных белков) Индукция ангиогенеза Склонность к метастазированию Иммунная система не способна элиминировать сформировавшуюся опухоль (ускользание из-под иммунобиологического надзора)
Функциональные особенности опухолевых клеток • • Активация онкогенов, мутации в опухолесупрессорных генах Способность к безудержному росту Опухолевая трансформация - изменение антигенных свойств опухолей Резистентность к апоптозу (экспрессия антиапоптозных белков) Индукция ангиогенеза Склонность к метастазированию Иммунная система не способна элиминировать сформировавшуюся опухоль (ускользание из-под иммунобиологического надзора)
 Антигенные свойства опухолевых клеток • Опухолеспецифичные антигены (TSTA) • Эмбриоспецифичные или онкофетальные антигены • Опухолеассоциированные антигены • Вирусные антигены • Низкая экспрессия МНС при сохранной экспрессии неполиморфных молекул CD 1
Антигенные свойства опухолевых клеток • Опухолеспецифичные антигены (TSTA) • Эмбриоспецифичные или онкофетальные антигены • Опухолеассоциированные антигены • Вирусные антигены • Низкая экспрессия МНС при сохранной экспрессии неполиморфных молекул CD 1
 Опухолеспецифичные антигены – новые или модифицированные АГ, распознаваемые Т-лф • Антигены опухолей разных гистологических типов – MAGE, BAGE, GAGE, RAGE • Антигены, специфичные для меланомы – тирозиназа, gp 100, gp 75 • Антигены, возникающие в результате уникальных точечных мутаций – MUM-1, CDK 4 • Немеланомные антигены – HER-2/neu, MUC-1 и др.
Опухолеспецифичные антигены – новые или модифицированные АГ, распознаваемые Т-лф • Антигены опухолей разных гистологических типов – MAGE, BAGE, GAGE, RAGE • Антигены, специфичные для меланомы – тирозиназа, gp 100, gp 75 • Антигены, возникающие в результате уникальных точечных мутаций – MUM-1, CDK 4 • Немеланомные антигены – HER-2/neu, MUC-1 и др.
 Эмбриоспецифичные антигены – выявляются на определенных этапах эмбрионального развития • α-фетопротеин (AFP) • Раково-эмбриональный антиген (CEA) • Хорионический гонадотропин человека (HCG) и др.
Эмбриоспецифичные антигены – выявляются на определенных этапах эмбрионального развития • α-фетопротеин (AFP) • Раково-эмбриональный антиген (CEA) • Хорионический гонадотропин человека (HCG) и др.
 Опухолеассоциированные антигены (опухолевые маркеры) – могут присутствовать в нормальных клетках, при опухолях выявляются в больших количествах • СА 15 -3 – при раке молочной железы • СА 125 – при опухолях яичников • SCC – при раке легкого
Опухолеассоциированные антигены (опухолевые маркеры) – могут присутствовать в нормальных клетках, при опухолях выявляются в больших количествах • СА 15 -3 – при раке молочной железы • СА 125 – при опухолях яичников • SCC – при раке легкого
 Вирусные антигены • HPV-16 (вирус папилломы человека) – при раке шейки матки
Вирусные антигены • HPV-16 (вирус папилломы человека) – при раке шейки матки
 Теории противоопухолевого иммунитета • Опухоль развивается в условиях иммунодефицита ( «мало хорошего» дефицит NK, Т-киллеров, интерферонов и т. д. ) • Опухоль развивается в условиях иммуносупрессии ( «очень много плохого» - ИЛ-10, ТФР-β и др. супрессорные механизмы)
Теории противоопухолевого иммунитета • Опухоль развивается в условиях иммунодефицита ( «мало хорошего» дефицит NK, Т-киллеров, интерферонов и т. д. ) • Опухоль развивается в условиях иммуносупрессии ( «очень много плохого» - ИЛ-10, ТФР-β и др. супрессорные механизмы)
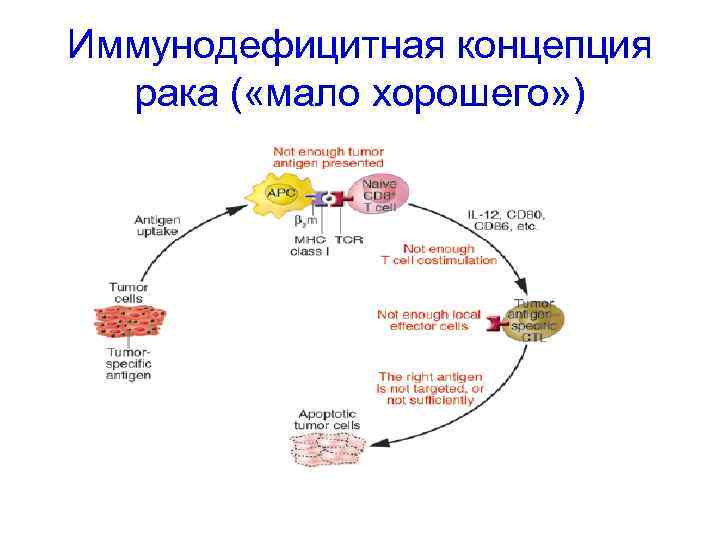 Иммунодефицитная концепция рака ( «мало хорошего» )
Иммунодефицитная концепция рака ( «мало хорошего» )
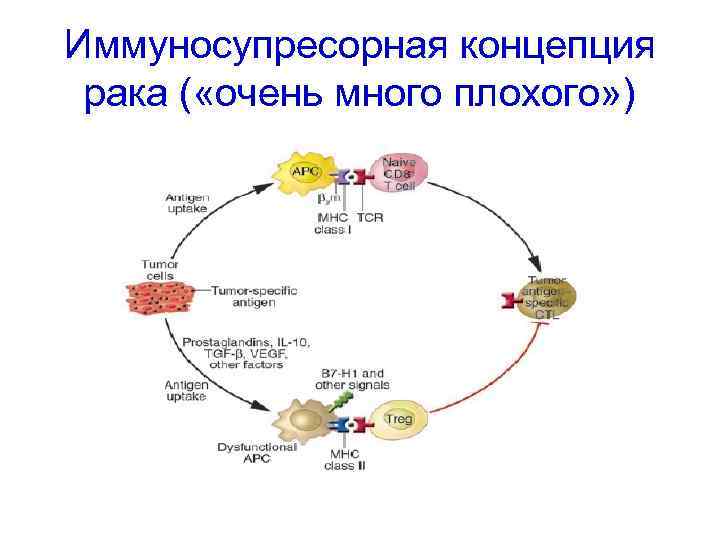 Иммуносупресорная концепция рака ( «очень много плохого» )
Иммуносупресорная концепция рака ( «очень много плохого» )
 Доказательства роли иммунной системы в противоопухолевых реакциях • Дефицит перфорина, лиганда апоптоза, цитокинов, способствует риску развития спонтанных опухолей у животных • Канцероген-индуцированные опухоли легко развиваются в организме иммунодефицитных животных • Дефекты онкосупрессорных генов (р53) способствуют развитию опухолей у иммунодефицитных животных • Клинические наблюдения: -3 -х -100 -кратный риск развития опухолей у пациентов с ПИД и ВИД; - дремлющие опухоли хорошо растут после иммуносупресорных влияний; - наличие опухольинфильтрирующих лимфоцитов продлевает жизнь опухоленосителей.
Доказательства роли иммунной системы в противоопухолевых реакциях • Дефицит перфорина, лиганда апоптоза, цитокинов, способствует риску развития спонтанных опухолей у животных • Канцероген-индуцированные опухоли легко развиваются в организме иммунодефицитных животных • Дефекты онкосупрессорных генов (р53) способствуют развитию опухолей у иммунодефицитных животных • Клинические наблюдения: -3 -х -100 -кратный риск развития опухолей у пациентов с ПИД и ВИД; - дремлющие опухоли хорошо растут после иммуносупресорных влияний; - наличие опухольинфильтрирующих лимфоцитов продлевает жизнь опухоленосителей.
 Возможная роль иммунной системы в предотвращении опухолевого роста • Защита против вирус-индуцированных опухолей путем элиминации или супрессии вирусов • Элиминация патогена и предотвращение формирования воспалительного микроокружения, необходимого для опухолевого роста • Идентификация и элиминация опухолевых клеток за счет экспрессии опухолеспецифичных или стрессиндуцированных молекул
Возможная роль иммунной системы в предотвращении опухолевого роста • Защита против вирус-индуцированных опухолей путем элиминации или супрессии вирусов • Элиминация патогена и предотвращение формирования воспалительного микроокружения, необходимого для опухолевого роста • Идентификация и элиминация опухолевых клеток за счет экспрессии опухолеспецифичных или стрессиндуцированных молекул
 • Способность опухоли развиваться в присутствии функционирующей иммунной системы послужила основой для создания концепции опухолевого иммуноредактирования, согласно которой иммунная система последовательно меняет стратегию от противоопухолевой к проопухолевой по мере развития опухолевого процесса
• Способность опухоли развиваться в присутствии функционирующей иммунной системы послужила основой для создания концепции опухолевого иммуноредактирования, согласно которой иммунная система последовательно меняет стратегию от противоопухолевой к проопухолевой по мере развития опухолевого процесса
 Опухолевое иммуноредактирование – последовательная смена трех фаз: 1. Контроль иммунной системы над опухолевым ростом и элиминация опухоли 2. Равновесие между активностью опухоли и иммунной системой (балансирование) 3. Избегание опухолью иммунных механизмов защиты (ускользание из-под иммунобиологического надзора)
Опухолевое иммуноредактирование – последовательная смена трех фаз: 1. Контроль иммунной системы над опухолевым ростом и элиминация опухоли 2. Равновесие между активностью опухоли и иммунной системой (балансирование) 3. Избегание опухолью иммунных механизмов защиты (ускользание из-под иммунобиологического надзора)
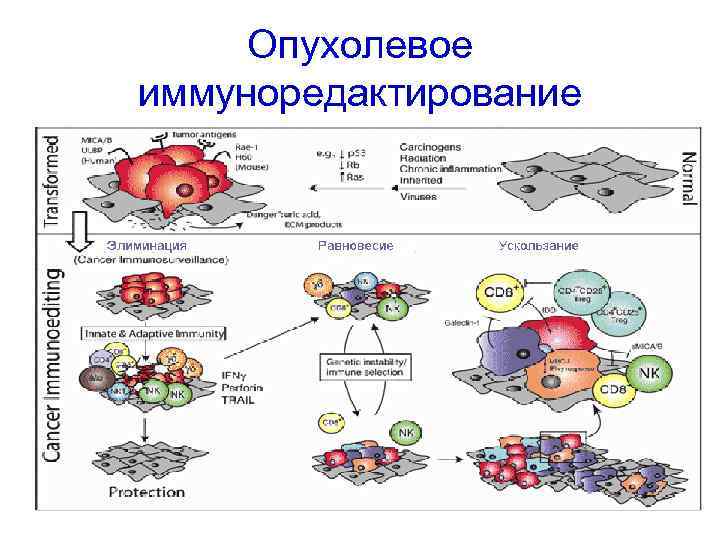 Опухолевое иммуноредактирование
Опухолевое иммуноредактирование
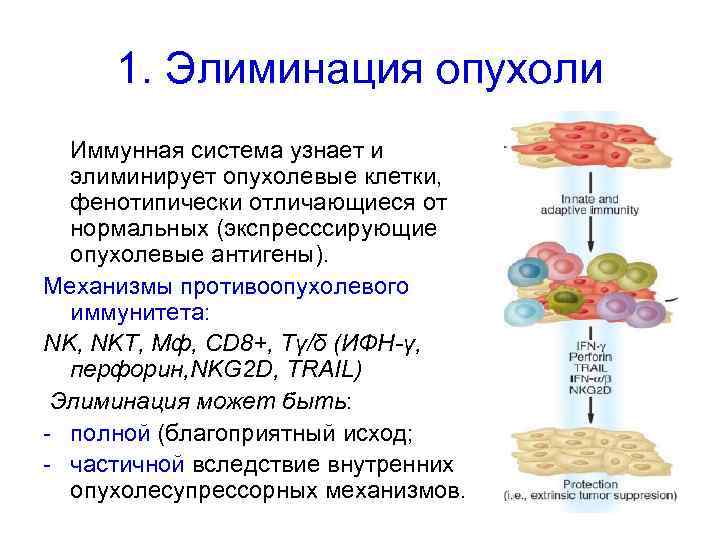 1. Элиминация опухоли Иммунная система узнает и элиминирует опухолевые клетки, фенотипически отличающиеся от нормальных (экспресссирующие опухолевые антигены). Механизмы противоопухолевого иммунитета: NK, NKT, Мф, CD 8+, Tγ/δ (ИФН-γ, перфорин, NKG 2 D, TRAIL) Элиминация может быть: - полной (благоприятный исход; - частичной вследствие внутренних опухолесупрессорных механизмов.
1. Элиминация опухоли Иммунная система узнает и элиминирует опухолевые клетки, фенотипически отличающиеся от нормальных (экспресссирующие опухолевые антигены). Механизмы противоопухолевого иммунитета: NK, NKT, Мф, CD 8+, Tγ/δ (ИФН-γ, перфорин, NKG 2 D, TRAIL) Элиминация может быть: - полной (благоприятный исход; - частичной вследствие внутренних опухолесупрессорных механизмов.
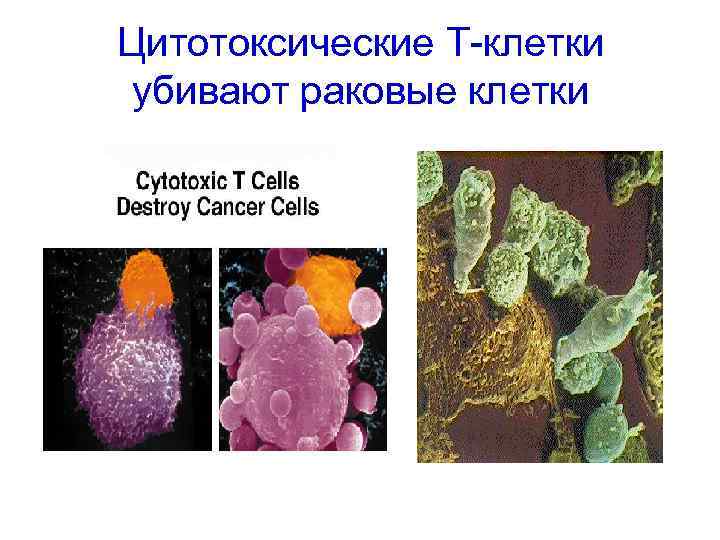 Цитотоксические Т-клетки убивают раковые клетки
Цитотоксические Т-клетки убивают раковые клетки
 2. «Балансирование» При частичной элиминации опухолевые клетки могут находиться в «дремлющем» состоянии либо продолжать «эволюционировать» (ДНК-мутации, изменение экспрессии генов). Результаты «балансирования» : - контроль за опухолевой прогрессией - селекция опухолевых клонов, устойчивых к иммунным механизмам, или супрессирующих иммунный ответ
2. «Балансирование» При частичной элиминации опухолевые клетки могут находиться в «дремлющем» состоянии либо продолжать «эволюционировать» (ДНК-мутации, изменение экспрессии генов). Результаты «балансирования» : - контроль за опухолевой прогрессией - селекция опухолевых клонов, устойчивых к иммунным механизмам, или супрессирующих иммунный ответ
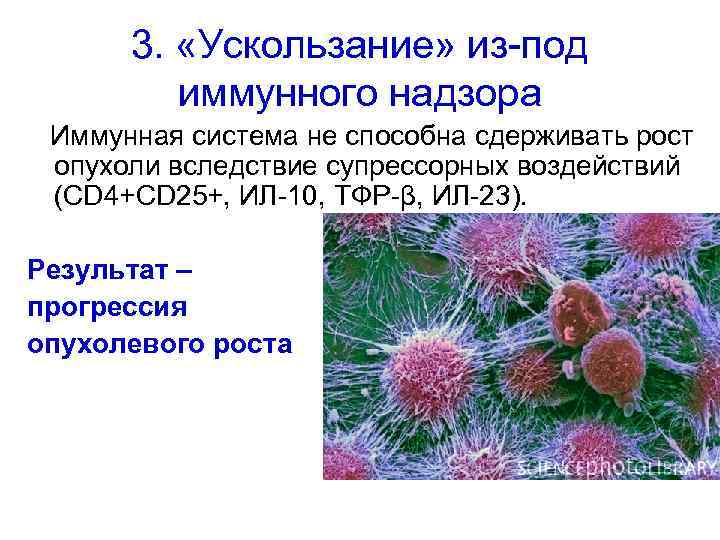 3. «Ускользание» из-под иммунного надзора Иммунная система не способна сдерживать рост опухоли вследствие супрессорных воздействий (CD 4+CD 25+, ИЛ-10, ТФР-β, ИЛ-23). Результат – прогрессия опухолевого роста
3. «Ускользание» из-под иммунного надзора Иммунная система не способна сдерживать рост опухоли вследствие супрессорных воздействий (CD 4+CD 25+, ИЛ-10, ТФР-β, ИЛ-23). Результат – прогрессия опухолевого роста
 Механизмы “ускользания” опухолей из -под контроля иммунной системы • • низкая экспрессия опухолевых антигенов низкая степень экспрессии дифференцировочных антигенов (HLA) модуляция мембранных антигенов опухолевых клеток растворимые формы мембранных антигенов отсутствие экспрессии костимулирующих молекул CD 80 и CD 86 экспрессия ингибиторных молекул (TGF- , IL-10, IL 4, PGЕ 2) и снижение экспрессии рецепторов к ингибирующим факторам роста оверэкспрессия антиапоптотических молекул • • • увеличение численности. Трег (CD 4+CD 25+) экспансия иммуносупрессорных миелоидных клеток (i. MC) нарушение ответа иммунокомпетентных клеток на цитокины
Механизмы “ускользания” опухолей из -под контроля иммунной системы • • низкая экспрессия опухолевых антигенов низкая степень экспрессии дифференцировочных антигенов (HLA) модуляция мембранных антигенов опухолевых клеток растворимые формы мембранных антигенов отсутствие экспрессии костимулирующих молекул CD 80 и CD 86 экспрессия ингибиторных молекул (TGF- , IL-10, IL 4, PGЕ 2) и снижение экспрессии рецепторов к ингибирующим факторам роста оверэкспрессия антиапоптотических молекул • • • увеличение численности. Трег (CD 4+CD 25+) экспансия иммуносупрессорных миелоидных клеток (i. MC) нарушение ответа иммунокомпетентных клеток на цитокины
 Иммунодиагностика опухолей • выявление изменений в иммунном статусе с целью назначения адекватной иммунокоррекции • выявление маркеров опухолевых клеток
Иммунодиагностика опухолей • выявление изменений в иммунном статусе с целью назначения адекватной иммунокоррекции • выявление маркеров опухолевых клеток
 Особенности иммунного статуса при онкопатологии • Снижение общего количества и функциональной активности CD 3+-клеток • Снижение количества и функциональной активности. Th 1 • Нарушение функций NK • Нарушение функций DC и макрофагов • Снижение чувствительности иммунных клеток к цитокинам • Нарушение баланса цитокинов • Увеличение количества CD 4+CD 25+-Трег до 12 -21%
Особенности иммунного статуса при онкопатологии • Снижение общего количества и функциональной активности CD 3+-клеток • Снижение количества и функциональной активности. Th 1 • Нарушение функций NK • Нарушение функций DC и макрофагов • Снижение чувствительности иммунных клеток к цитокинам • Нарушение баланса цитокинов • Увеличение количества CD 4+CD 25+-Трег до 12 -21%
 Серологические опухолеассоциированные маркеры - белки, которые синтезируются и секретируются в значительно больших количествах опухолевыми клетками по сравнению с нормальными. Серологические опухолевые маркеры (ОМ) могут использоваться при динамическом наблюдении для раннего выявления субклинических рецидивов и для контроля за эффективностью терапии. Для солидных опухолей большинства локализаций подобраны 2 -5 ОМ.
Серологические опухолеассоциированные маркеры - белки, которые синтезируются и секретируются в значительно больших количествах опухолевыми клетками по сравнению с нормальными. Серологические опухолевые маркеры (ОМ) могут использоваться при динамическом наблюдении для раннего выявления субклинических рецидивов и для контроля за эффективностью терапии. Для солидных опухолей большинства локализаций подобраны 2 -5 ОМ.
 Наиболее информативные опухолевые маркеры злокачественных новообразований основных локализаци Карциномы Опухолевые маркеры 1. Рак молочной железы СА 15 -3, CEA, СА 19 -9, ТПА, МРА, НСЕ, ТРS, гормоны (пролактин, эстрадиол) 2. Опухоли яичников СА 125, СА 72 -4, СА 19 -9, САSA, ТПА, TPS, -ХЧГ, AFP, эстрадиол 3. Рак шейки матки SCC, CEA, ТПА, TPS 4. Рак желудка СА 72 -4, CEA, СА 19 -9 5. Рак почки СА 125, СА 15 -3, ТАTI, М 2 -РК 6. Рак предстательной железы ПСА общ. , ПСАсвоб/ПСАобщ 7. Рак легкого - мелкоклеточный - плоскоклеточный - аденокарцинома - крупноклеточный НСЕ, CEA SCC, CEA, СА 72 -4, СА 19 -9, СА 125 SCC, CEA 8. Рак печени AFP, ферритин, CEA, СА 19 -9
Наиболее информативные опухолевые маркеры злокачественных новообразований основных локализаци Карциномы Опухолевые маркеры 1. Рак молочной железы СА 15 -3, CEA, СА 19 -9, ТПА, МРА, НСЕ, ТРS, гормоны (пролактин, эстрадиол) 2. Опухоли яичников СА 125, СА 72 -4, СА 19 -9, САSA, ТПА, TPS, -ХЧГ, AFP, эстрадиол 3. Рак шейки матки SCC, CEA, ТПА, TPS 4. Рак желудка СА 72 -4, CEA, СА 19 -9 5. Рак почки СА 125, СА 15 -3, ТАTI, М 2 -РК 6. Рак предстательной железы ПСА общ. , ПСАсвоб/ПСАобщ 7. Рак легкого - мелкоклеточный - плоскоклеточный - аденокарцинома - крупноклеточный НСЕ, CEA SCC, CEA, СА 72 -4, СА 19 -9, СА 125 SCC, CEA 8. Рак печени AFP, ферритин, CEA, СА 19 -9
 Современные подходы к иммунотерапии опухолей - цитокинотерапия (препараты интерферонов, IL-2) - препараты на основе использования моноклональных антител (м. АТ) к опухолевым антигенам (таргетная терапия) - противораковые вакцины
Современные подходы к иммунотерапии опухолей - цитокинотерапия (препараты интерферонов, IL-2) - препараты на основе использования моноклональных антител (м. АТ) к опухолевым антигенам (таргетная терапия) - противораковые вакцины
 Цитокинотерапия опухолей • Препараты интерферонов (роферон, реаферон, интрон А, берофор, веллферон). Эффективны при метастатическом раке почки, миеломе, гемобластозах. • Интерлейкины (беталейкин, пролейкин, альдеслейкин, ронколейкин). Эффективны при сохранности функций иммунной системы в составе комплексной терапии.
Цитокинотерапия опухолей • Препараты интерферонов (роферон, реаферон, интрон А, берофор, веллферон). Эффективны при метастатическом раке почки, миеломе, гемобластозах. • Интерлейкины (беталейкин, пролейкин, альдеслейкин, ронколейкин). Эффективны при сохранности функций иммунной системы в составе комплексной терапии.
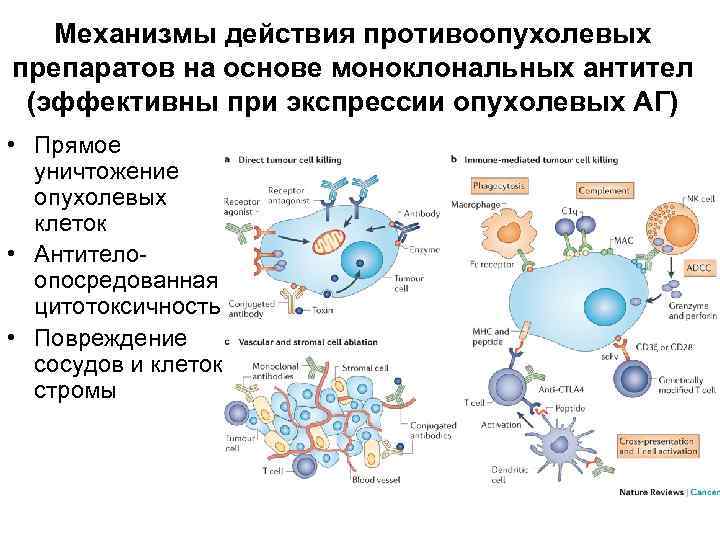 Механизмы действия противоопухолевых препаратов на основе моноклональных антител (эффективны при экспрессии опухолевых АГ) • Прямое уничтожение опухолевых клеток • Антителоопосредованная цитотоксичность • Повреждение сосудов и клеток стромы
Механизмы действия противоопухолевых препаратов на основе моноклональных антител (эффективны при экспрессии опухолевых АГ) • Прямое уничтожение опухолевых клеток • Антителоопосредованная цитотоксичность • Повреждение сосудов и клеток стромы
 Моноклональные антитела (м. АТ) в терапии опухолей • Герцептин (trastusumab) – блокирует рецептор эпидермального фактора роста (HER 2) • Ритуксимаб – анти-CD 20 -м. АТ • Цетуксимаб – м. АТ против ECAM • Имутеран – м. АТ против MUC 1
Моноклональные антитела (м. АТ) в терапии опухолей • Герцептин (trastusumab) – блокирует рецептор эпидермального фактора роста (HER 2) • Ритуксимаб – анти-CD 20 -м. АТ • Цетуксимаб – м. АТ против ECAM • Имутеран – м. АТ против MUC 1
 • Герцептин - препарат, созданный на основе моноклонального антитела, которое способно избирательно воздействовать на раковые опухоли, вырабатывающие протеин HER 2 (примерно четверть всех случаев заболевания раком груди).
• Герцептин - препарат, созданный на основе моноклонального антитела, которое способно избирательно воздействовать на раковые опухоли, вырабатывающие протеин HER 2 (примерно четверть всех случаев заболевания раком груди).
 ЭРБИТУКС (ERBITUX) cetuximab • Противоопухолевый препарат. Химерное моноклональное антитело Ig. G 1, направленное против рецептора эпидермального фактора роста • Показания Рак головы и шеи (языка, губ, неба, миндалин, синусов, глотки, гортани) Рак колоректальный (карцинома толстой и прямой кишки)
ЭРБИТУКС (ERBITUX) cetuximab • Противоопухолевый препарат. Химерное моноклональное антитело Ig. G 1, направленное против рецептора эпидермального фактора роста • Показания Рак головы и шеи (языка, губ, неба, миндалин, синусов, глотки, гортани) Рак колоректальный (карцинома толстой и прямой кишки)
 Создание противораковых вакцин • На основе дендритных клеток • Получение гибридных белков, состоящих из конъюгатов опухолеассоциированных антигенов с цитокинами • Коньюгаты опухолеассоциированных белков с низкомолекулярными белками теплового шока противоопухолевая вакцина HSPPC-96(Oncophage) • Введение в опухолевую клетку генов (цитокинов и их рецепторов, опухолеассоциированных антигенов, “суицидных” генов, чужеродных генов“ксеногенизация опухолей)
Создание противораковых вакцин • На основе дендритных клеток • Получение гибридных белков, состоящих из конъюгатов опухолеассоциированных антигенов с цитокинами • Коньюгаты опухолеассоциированных белков с низкомолекулярными белками теплового шока противоопухолевая вакцина HSPPC-96(Oncophage) • Введение в опухолевую клетку генов (цитокинов и их рецепторов, опухолеассоциированных антигенов, “суицидных” генов, чужеродных генов“ксеногенизация опухолей)
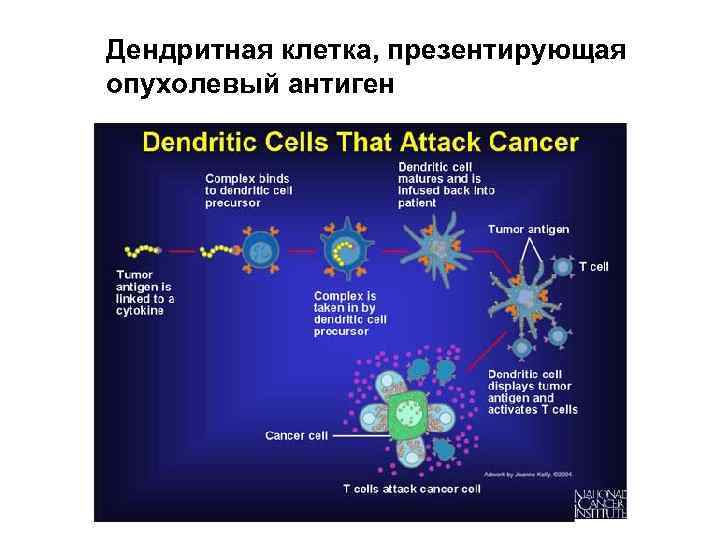 Дендритная клетка, презентирующая опухолевый антиген
Дендритная клетка, презентирующая опухолевый антиген
 Перспективы онкоиммунологии • Использование генетических подходов и накопление данных о полиморфизме генов и мутациях при различных опухолях. • Выяснение роли иммунокомпетентных клеток в прогнозе развития различных типов опухолей. • Более эффективное использование иммунотерапии ( триггеры апоптоза опухолевых клеток, стимуляция иммунных ответов, ингибирование толерогенных механизмов) в комплексе с другими противоопухолевыми способами лечения
Перспективы онкоиммунологии • Использование генетических подходов и накопление данных о полиморфизме генов и мутациях при различных опухолях. • Выяснение роли иммунокомпетентных клеток в прогнозе развития различных типов опухолей. • Более эффективное использование иммунотерапии ( триггеры апоптоза опухолевых клеток, стимуляция иммунных ответов, ингибирование толерогенных механизмов) в комплексе с другими противоопухолевыми способами лечения
 Благодарю за внимание!
Благодарю за внимание!


