Клиническая фармакология противомикробных средств.pptx
- Количество слайдов: 45

Клиническая фармакология противомикробных средств Бойко Татьяна Владимировна, доктор ветеринарных наук, доцент

План: Принципы современной химиотерапии. Проблемы резистентности микроорганизмов к антимикробным препаратам. Лекарственные взаимодействия противомикробных средств. Критерии эффективности химиотерапии. Нежелательные эффекты противомикробных препаратов.

Принципы рациональной антибиотикотерапии I принцип – антибиотики – это этиотропные препараты специфического действия, которые надо назначать в соответствии с чувствительностью к ним возбудителей заболеваний. Антибиотики – влияют на бактерии, спирохеты, микоплазмы, хламидии, рикетсии и грибы: Не влияют – на вирусы и прионы !!! Ошибочное назначение антибиотиков при заболеваниях неинфекционной природы приводит к: Возникновению нежелательных эффектов; Задержке принятия необходимых мер ; Неправильным выводам о неэффективности препарата с привлечением других альтернативных и резервных антибиотиков

При инфекционном заболевании необходимо произвести идентификацию инфекционного агента! Микробиологическая служба должна определить возбудителя (при микстовой инфекции- лидирующего возбудителя), уровень обсемененности и в чистой культуре – его чувствительность к антибиотику! (-) Ответ – через 12 час (4 -5 суток)! Невозможно идентифицировать
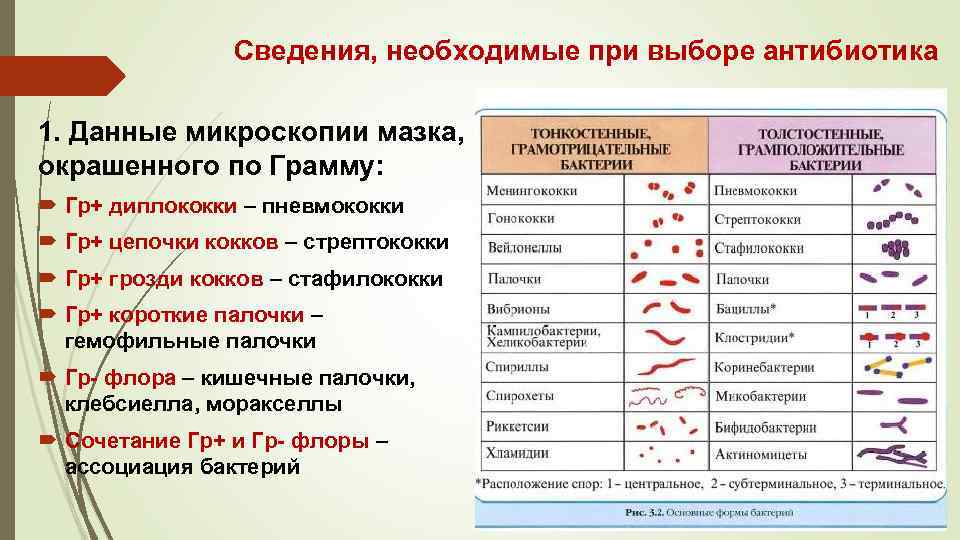
Сведения, необходимые при выборе антибиотика 1. Данные микроскопии мазка, окрашенного по Грамму: Гр+ диплококки – пневмококки Гр+ цепочки кокков – стрептококки Гр+ грозди кокков – стафилококки Гр+ короткие палочки – гемофильные палочки Гр- флора – кишечные палочки, клебсиелла, моракселлы Сочетание Гр+ и Гр- флоры – ассоциация бактерий

Сведения, необходимые при выборе антибиотика 2. Клиническая картина Микроорганизмы имеют тропность к тканям, обусловленную их адгезивной способностью! Известно: Рожистое воспаление, лимфаденит, артрозы чаще вызывают стрептококки; Гнойный мастит, фурункулы, карбункулы, флегмону – стафилококки; Пневмонию – пневмококки, гемофильные палочки, моракселлы катарралис, микоплазмы (золотистый стафилококк, клебсиеллы, синегнойные палочки); Пиелонефрит – кишечные палочки и др. ; Заболевания ЖКТ – энтеробактерии, Гранаэробы (бактероиды) и др.

Сведения, необходимые при выборе антибиотика 3. Возраст больного животного Многие инфекционные болезни вызываются условно-патогенной флорой, т. е. возбудителями, которые вегетируют в организме здоровых животных. В соответствии с тканевой специфичностью у новорожденных причиной инфекционных болезней чаще бывают кишечная палочка и др. Гр- палочки; стафилококки, синегнойные палочки, сальмонеллы и др.

Сведения, необходимые при выборе антибиотика 4. Эпидемическая обстановка 5. Предшествующее лечение, которое меняет микрофлору. Врач, определив предполагаемого возбудителя выбирает антибиотик, к которому данный микроорганизм имеет первичную (конститутивную) высокую чувствительность. Это означает, что минимальные подавляющие концентрации (МПК) должны находиться в пределах от 0, 0 Х до 0, 00 Х мкг/мл и ниже. МПК – это та концентрация антибиотика, которая in vitro подавляет рост выделенного штамма возбудителя Если зона задержки роста на питательной среде, выявленная методом дисков, более 25 мм, у микроба высокая чувствительность к антибиотику; если 15 -25 – умеренная чувствительность; менее 15 мм – низкая.

Классификация антибиотиков по механизму действия и противомикробному эффекту I группа – антибиотики, нарушающие синтез микробной стенки во время митоза: пенициллины, цефалоспорины, карбапенемы (тиенам, меропенем и др. ), монобактамы (азтреонам), ристомицин, фосфомицин, гликопептиды (ванкомицин и др. ) По фармакологическому эффекту – это бактерицидные антибиотики

Классификация антибиотиков по механизму действия и противомикробному эффекту I группа – антибиотики, нарушающие синтез микробной стенки во время митоза: пенициллины, цефалоспорины, карбапенемы (тиенам, меропенем и др. ), монобактамы (азтреонам), ристомицин, фосфомицин, гликопептиды (ванкомицин и др. ) По фармакологическому эффекту – это бактерицидные антибиотики

Классификация антибиотиков по механизму действия и противомикробному эффекту II группа – антибиотики, нарушающие функцию цитоплазматической мембраны: Полимиксины, полиены ( нистатин, леворин, амфотерицин В и др. ), аминогликозиды (канамицин, гентамицин, амикацин и др. ), гликопептидные препараты. По фармакологическому эффекту – это бактерицидные антибиотики

Классификация антибиотиков по механизму действия и противомикробному эффекту III группа – антибиотики, нарушающие синтез белков и нуклеиновых кислот: Левомицетин, тетрациклины, линкозамиды, макролиды, рифамицины, фузидин, гризеофульвин, аминогликозидные и гликопептидные средства. По фармакологическому эффекту – это бактериостатические антибиотики


Бактерицидным антибиотикам отдают предпочтение: Бактериостатические средства: Тяжело больным пациентам со сниженным иммунитетом; Назначают пациентам с «нормальным» иммунным статусом; Пациенты, получающие иммунодепрессивные препараты. Терапевтический эффект наступает через 3 -4 дня. Лечебный эффект – через 1 -2 дня, продолжительность до 7 суток. Продолжительность лечения – 10 -14 суток.

При совместном назначении разных антибиотиков из I группы возникает синергизм по типу суммации (1 + 1 = 2). Препараты I группы можно комбинировать с препаратами II группы, при этом происходит потенцирование их эффектов (1 + 1 = 3), но нельзя с препаратами III группы, которые нарушают деление микробных клеток. Лекарственные средства I группы действуют только во время митоза. Некоторые антибиотики из III группы оказывают бактерицидное действие на ряд микроорганизмов (например, эритромицин влияет на коринебактерии, бордетеллы, а левомицетин — на гемофильную палочку типа «в» ). В этом случае антибиотики из I группы целесообразно комбинировать с антибиотиками из III группы. Антибиотики II группы можно комбинировать друг с другом, с препаратами I и III групп. Однако все они высокотоксичны, поэтому часто происходит суммация не только желаемого эффекта, но и побочного. Антибиотики III группы можно комбинировать друг с другом, если они влияют на разные субъединицы рибосом, при этом происходит суммация эффектов (1 + 1 = 2). В противном случае возникав! индифференция (1 + 1 = 1) или антагонизм (1 + 1 = 0, 75).
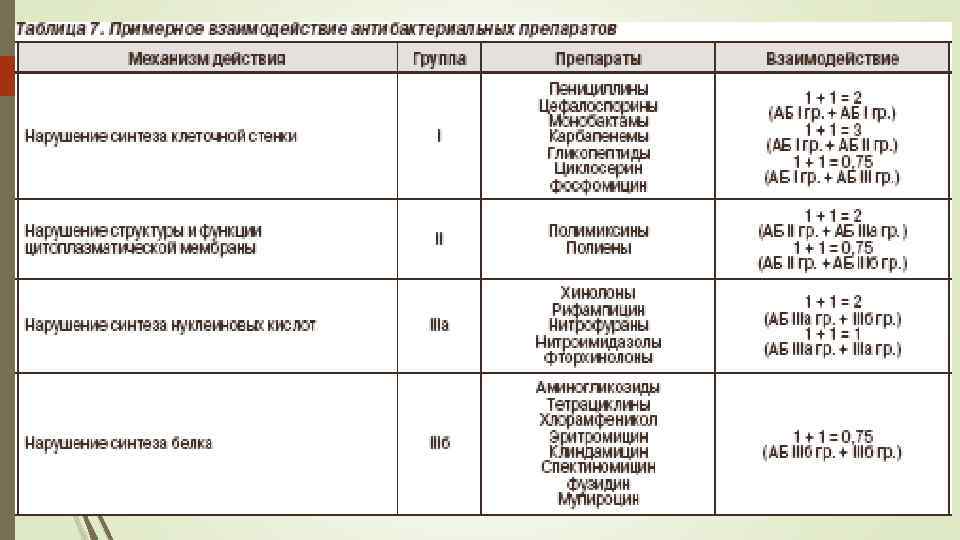

Комбинирование антибиотиков помогает решать следующие задачи: расширять спектр действия, что имеет особое значение, если возбудитель неидентифицирован; усиливать эффект, что особенно важно для борьбы с резистентной флорой (синегнойные палочки, энтерококки, стафилококки), а также при тяжелой клинической картине (сепсис, эндокардит, менингит, остеомиелит) и у ослабленных пациентов с подавленным иммунитетом. Однако следует подчеркнуть, что при одновременном назначении более двух антибиотиков легче проявляется антагонизм между ними и значительно возрастает опасность возникновения нежелательных эффектов, кроме того, увеличивается стоимость лечения. При возможности выбора антибиотика предпочтение следует отдать узкоспектральному препарату для снижения опасности появления нежелательных эффектов:

1. Антибиотики узкого спектра, влияющие на Гр+бактерии и кокки: естественные пенициллины, изоксазолпенициллины, линкозамиды, ристомицин, гликопептиды, фузидин. 2. Антибиотики узкого спектра, влияющие на Гр- бактерии: амидинопенициллины, монобактамы, полимиксины. 3. Антибиотики узкого спектра, влияющие на патогенные грибы: полиеновые, гризеофульвин. 4. Антибиотики широкого спектра чаще используют при сочетанной инфекции: аминопенициллины, карбоксипенициллины, уреидопенициллины, цефалоспорины, аминогликозидные препараты, левомицетин, тетрациклины, фосфомицин, рифамицины, макролиды, карбапенемы. Для новорожденных и молодняка антибиотиками первоочередного выбора должны быть: пенициллины (бензилпенициллин, оксациллин, ампициллин, амоксициллин), цефазолин (цефалоспорин I поколения), цефотаксин и цефтриаксон (цефалоспорины III поколения), эритромицин, линкомицин, нистатин, леворин.

Второй принцип применения антибиотиков — препарат нужно назначать в такой дозе (разовой и суточной) и так вводить, чтобы обеспечить его среднюю терапевтическую концентрацию (СТК) в тканях и жидкостях макроорганизма на протяжении всего курса терапии. Средняя терапевтическая концентрация в несколько раз (чаще в 4 -5 раз) должна быть больше минимальной подавляющей концентрации. Средняя терапевтическая концентрация зависит от вида возбудителя, его локализации и тяжести заболевания. Так при лечении менингита последняя для антибиотика в ликворе должна быть в 10 -20 раз выше его МПК. Обеспечить среднюю терапевтическую концентрацию антибиотика в организме пациента можно только при знании его фармакокинетики. Выбор оптимального пути введения препарата зависит от его биоусвояемости.

Антибиотики с биоусвояемостью более 60%: левомицетин, тетрациклины (миноциклин и доксициклин), энтеральные формы цефалоспоринов, аминопенициллины (амоксициллин), рифамицины, фузидин и другие. При возможности (нет рвоты и других нарушений со стороны желудочнокишечного тракта и т. д. ) надо как можно раньше переходить на энтеральный путь введения этих препаратов. Высокая биоусвояемость обеспечивает близость доз перорального и парентерального введения антибиотика; минимальную опасность появления нежелательных эффектов со стороны кишечника (диспепсические расстройства, дисбактериоз); положительный экономический эффект.

Антибиотики с биоусвояемостью более 30%: феноксиметилпенициллин, изоксазолпенициллины, амидинопенициллины, аминопенициллины (ампициллин), карбоксипенициллины (карфециллин), макролиды, тетрациклины (тетрациклин, окситетрациклин, метациклин), линкозамиды и другие. Эти препараты не создают высоких концентраций в тканях и жидкостях макроорганизма, поэтому их лучше использовать при: очень высокой чувствительности к ним инфекционного агента; при нетяжелой форме заболевания (низкая степень инфицирования); при локализации очагов инфекции не в труднодоступных местах, плохо защищенных гистогематическими барьерами. В противном случае эти препараты нужно комбинировать с другими антибиотиками.

3. Антибиотики с биоусвояемостью меньше 30%: аминогликозидные и гликопептидные препараты, полимиксины, полиены (нистатин, леворин), уреидопенициллины, карбапенемы, монобактамы, инъекционные формы цефалоспоринов и многие другие. При приеме этих препаратов внутрь можно рассчитывать только на их местный эффект. Для получения резорбтивного эффекта большинство из них применяют только парентерально. Биоусвояемость антибиотиков может существенно изменяться. Она зависит от: — соблюдения режима приема антибиотика относительно кормления, так как многие препараты разрушаются соляной кислотой; — характера корма и одновременно принимаемых препаратов, так как некоторые антибиотики образуют комплексы с компонентами пищи, с антацидами, адсорбентами и это снижает их всасывание; — характера патологии желудочно-кишечного тракта (например, всасывание многих препаратов уменьшается при диареи, селективной ваготомии и, наоборот, увеличивается при ахлоргидрии (для кислотолабильных антибиотиков); язвенной болезни желудка и двенадцатиперстной кишки без стеноза); — лекарственной формы и технологии приготовления лекарства, т. е. от его биоэквивалентности.

Окончательный выбор пути введения лекарства осуществляется с учетом тяжести заболевания и локализации инфекционного процесса. Поэтому важно знать процент связывания антибиотика с белками плазмы крови и его способность проникать в те или иные ткани и органы. Кроме того, величины этих показателей определяют время наступления эффекта. Режим дозирования антибиотиков во многом зависит от скорости их элиминации, которая складывается из процессов биотрансформации и экскреции. Биотрансформация большинства антибиотиков, назначенных внутрь, осуществляется в желудочно-кишечном тракте; в печени происходит превращение левомицетина и макролидов (эритромицина и др. ); а в почках — карбапенемов (имипенема). Главный путь экскреции антибиотиков — почки. Поэтому при почечной недостаточности для этих препаратов требуется коррекция режима дозирования. При этом врач ориентируется на показатель эндогенного креатинина.

Если клиренс эндогенного креатинина меньше 80 мл/мин (почечная недостаточность I-II степени), необходимо уменьшить разовую дозу и/или кратность назначения следующих антибиотиков: иминогликозидных, полимиксинов В и Е, карбоксипенициллинов и уреидопенициллинов, цефалоспоринов I поколения (цефалоридина, цефалотина и др. ), тетрациклинов (кроме доксициклина и миноциклина), ристомицина, гликопептидных препаратов, карбапенемов (при внутривенном введении) и монобактамов. Если клиренс эндогенного креатинина меньше 30 мл/мин (почечная недостаточность III степени), существует опасность применения следующих антибиотиков: аминопенициллинов, цефалоспоринов II и IV поколения, амединопенициллинов, естественных пенициллинов и карбапенемов (при внутримышечном введении). Скорость почечной экскреции антибиотиков может уменьшаться при дегидратации, хронической недостаточности кровообращения, гипотонии, задержке мочи и др. состояниях.

При необходимости санации мочи необходимо знать, что эффективность некоторых антибиотиков зависит от p. H мочи Препараты, эффективные в кислой среде (p. H 5, 0 -6, 5) – тетрациклины, пенициллины, рифамицины, полимиксины; в щелочной среде (p. H 7, 5 -8, 5) — макролиды, линкозамиды, аминогликозиды. В первом случае, одновременно с антибиотиками нужно назначать средства, понижающие p. H мочи — аскорбиновую кислоту, кальция хлорид; во втором — повышать p. H мочи с помощью бикарбоната натрия. Эффективность цефалоспоринов, левомицетина не зависит от реакции мочи. Антибиотики, не требующие коррекции дозы при почечной недостаточности любой степени, но их опасно использовать при заболеваниях печени: левомицетин, макролиды, линкозамиды, тетрациклины (доксициклин и миноциклин), фузидин, рифамицины, изоксазолпенициллины, цефалоспорины III поколения.

Нужно помнить, что для обеспечения средней терапевтической концентрации антибиотиков важно учитывать их взаимодействие с препаратами из других групп на: 1) фармакодинамическом уровне (например, комбинирование с синтетическими противоинфекционными препаратами — нитрофуранами, хинолонами, сульфаниламидами и т. п. ); 2) фармакокинетическом уровне (например, антациды уменьшают всасывание тетрациклинов и других антибиотиков; нестероидные противовоспалительные средства вытесняют их из связи с белками плазмы крови; мочегонные препараты влияют на скорость экскреции некоторых антибиотиков и т. п. ); 3) на физико-химическом уровне (например, несовместимы в одном шприце пенициллины и витамины группы В, аскорбиновая кислота; ампициллин и гидрокортизон; любой антибиотик и гепарин и т. п. ).

Только знание фармакокинетики антибиотиков и их особенностей взаимодействия с другими препаратами позволяет врачу удержать концентрацию их в терапевтическом диапазоне на протяжении всего лечения у данного пациента, что особенно важно при лечении препаратами с очень малой широтой терапевтического диапазона (с малым токсикотерапевтическим отношением). К таким антибиотикам в первую очередь относят аминогликозиды, левомицетин, ванкомицин. Например, для гентамицина и тобрамицина терапевтическая концентрация в сыворотке крови составляет от 4 до 8 мкг/мл, при 12 мкг/мл возникают тяжелые лекарственные осложнения; для канамицина и амикацина — от 15 до 35 мкг/мл, нежелательные эффекты — при концентрации 36 (!) мкг/мл; для левомицетина — от 5 до 25 мкг/мл, при концентрации более 25 мкг/мл — опасность обратимого угнетения костного мозга, больше 50 мкг/мл — «серый синдром» , часто приводящий к летальному исходу; для ванкомицина — от 25 до 40 мкг/мл, при концентрации больше 40 мкг/мл — нефро-, ототоксичность и другие осложнения.

При оценке эффективности антибиотикотерапии используют следующие критерии: Динамика симптомов заболевания (лихорадка, интоксикация, физикальная выраженность признаков органного поражения и др. ). Динамика лабораторно-инструментальных показателей активности воспалительного процесса (клинический анализ крови, анализ мочи, протеинограмма, С-реактивный белок, сиаловые кислоты, копрограмма, данные рентгеновского обследования др. ). Динамика бактериологических и иммунологических показателей (посевы патологического материала с определением чувствительности флоры к антибиотикам, определение титров специфических антител).

Проблема вторичной (индуцированной, приобретенной) резистентности антибиотиков - одна из важнейших проблем современной антибактериальной терапии Возникновение вторичной резистентности может быть результатом: ошибочного выбора антибиотика; неправильного дозирования препарата, без учета особенностей фармакокинетики, взаимодействия антибиотиков между собой с другими группами лекарственных средств; несоблюдения курса назначения антибиотиков. Лекарственная резистентность следует за лекарством как преданная тень…. Пауль Эрлих Последнее зависит не только от выбранного препарата (бактерицидный или бактериостатический), но и от штамма возбудителя, локализации инфекционного очага, состояния защитных сил организма, клинического течения заболевания.
ГЛОБАЛЬНАЯ СТРАТЕГИЯ ВОЗ ПО СДЕРЖИВАНИЮ УСТОЙЧИВОСТИ К ПРОТИВОМИКРОБНЫМ ПРЕПАРАТАМ, 2001

Наиболее часто встречаются следующие молекулярные механизмы вторичной резистентности микроорганизмов: 1. Синтез ферментов, разрушающих антибиотик. 2. Изменение структуры клеточной мембраны, что делает ее непроницаемой для антибиотиков. 3. Нарушение контакта (взаимодействия) клеточных «мишеней» с антибиотиком. (Например, микробная мембрана теряет способность сорбировать препарат на своей поверхности или конформация субъединиц рибосом делает их недоступными для антибиотиков). Вторичная устойчивость микроорганизмов может развиваться быстро — «стрептомициновый» вид резистентности и медленно — «пенициллиновый» вид резистентности Первый вид резистентности присущ аминогликозидам, рифамицинам, макролидам, фузидину. Поэтому названные препараты нужно назначать коротким курсом или обязательно комбинировать с другими противоинфекционными препаратами. Второй вид — характерен для пенициллинов, тетрациклинов, левомицетина, ристомицина, линкозамидов, цефалоспоринов, карбапенемов, монобактамов, гликопептидов, фосфометина.

Применение антибиотиков с профилактической целью – одна из причин вторичной резистентности к антибиотикам. Иногда считают, что если препарат может излечить больного, то он может и предупредить заболевание, но это не всегда так. Поэтому профилактическое применение антибиотиков необходимо максимально ограничить!!! В качестве профилактических средств антибиотики могут быть использованы только для: 1. Истинного предупреждения развития инфекций (защита пациентов с иммунодефицитом, профилактика повторных атак ревматизма, рецидивов инфекций мочевых путей и т. д. ). 2. Предотвращения оппортунистических инфекций, вызванных существующими эндогенными микроорганизмам, попадающими в места, благоприятные для их размножения (перитониты после операции на кишечнике, хирургические манипуляции…). Особенно это важно делать у ослабленных животных, но до операции антибиотик можно начать вводить не ранее чем за 1 сут, иначе могут появиться и устойчивые к препарату микроорганизмы, что приведет к опасной ситуации. Проблемы возникновения вторичной резистентности — это использование антибиотиков в ветеринарии и пищевой промышленности, а также свободная продажа антибиотиков в аптечной сети!



Перед убоем животных и птиц применение антибиотиков в лечебных и профилактических дозах должно быть прекращено в следующие сроки:

Молоко, полученное от животных, подвергавшихся лечению антибиотиками, запрещается использовать для пищевых целей (последнего введения препаратов) в течение: при внутримышечном введении непролонгированных форм пенициллина, тетрациклина, окситетрациклина, неомицина - 12 ч; стрептомицина - 48 ч; экмоновоциллина-24 ч; бициллана-3 - 36 ч. При внутривымянном введении пенициллина - двое суток; окситетрациклина, стрептомицина - пять суток; эритромицина - сутки; мономицина - семь суток. Молоко, в котором обнаружены антибиотики, используют для кормления животных. Яйца, полученные от птиц, которым вводили антибиотики в лечебных или профилактических целях, а также в виде кормовых добавок, используют без ограничений. Мед, в котором обнаружены антибиотики, применяют только для подкормки пчел.

Третий принцип применения антибиотиков — выбор антибиотика, его дозы и способа введения должны исключить или существенно уменьшить повреждающее действие препарата на макроорганизм. При использовании антибиотиков могут появиться нежелательные эффекты: 1. Нефизиологические отклонения от нормы. 2. Аллергические реакции, чаще возникают применении пенициллинов (в 80% случаев) и цефалоспоринов (в 18% случаев). 3. Прямое токсическое действие антибиотиков характеризуется рядом четких признаков: а) избирательностью (у каждого антибиотика свои «мишени» ), введение препарата сопровождается индивидуальными клиническими проявлениями; б) наибольшей вероятностью повреждения уже патологически измененного организма (или ткани); в) дозо- и времязависимостью.

При приеме внутрь все антибиотики могут вызвать поражение желудочно- кишечного тракта. При этом возникают гастрит, энтерит, эрозии и язвы. Прием тетрациклинов может привести к стоматиту и колиту, линкомицина — к псевдомембранозному колиту. Нейротоксичность в виде полиневритов, нервно-мышечного блока характерна для аминогликозидных антибиотиков, полимиксинов, линкозамидов, ристомицина, амфотерицина В; а в виде галлюцинаций, судорог, эпилепсии — для пенициллинов, стрептомицина, полимиксинов, амфотерицина В. Нефротоксичностъ (гломерулонефриты интракапиллярные, п. периартерииты, канальцево-интерстициальный нефрит, почечная недостаточность) возникает при использовании аминогликозидов, гликопептидов, полимиксинов, некоторых цефалоспоринов I поколения, амфотерицина В, ристомицина, просроченных тетрациклинов.

Гепатотоксичность: появление токсического гепатита характерно для приема амфотерицина В; холестаза — для макролидов и линкозамидов; конъюгационной желтухи — для левомицетина, тетрациклинов; жировой инфильтрации печени — для тетрациклинов, гризеофульвина. Гематотоксичность (угнетение лейкопоэза, тромбоцитопоэза, эритропоэза, тотальная аплазия, гемолитические реакции, метгемоглобинемия, гемокоагуляционные расстройства) чаще встречается применении левомицетина, тетрациклинов, ристомицина, карбоксипенициллинов и уреидопенициллинов. Поражение костной ткани (замедление роста, поражение зубов) вызывают тетрациклины.

Учитывая опасность прямого токсического действия антибиотиков на ткани и органы, все препараты делят на 3 группы: I — антибиотики широкого дозирования — пенициллины (кроме карбокси- и уреидопенициллинов). II — антибиотики ограниченного дозирования — цефалоспорины, фосфомицин, макролиды, карбапенемы, монобактамы. III — антибиотики строгого дозирования — аминогликозиды, полимиксины, левомицетин, тетрациклины, ристомицин, поли-еновые антибиотики, гликопептиды, линкозамиды, гризиофуль-вин. При наличии клинических показаний средняя терапевтическая концентрация препаратов первой группы может быть увеличена в 5 -10 (и даже 20) раз, второй — в 3 -4 раза и третьей — максимально в 1, 5 раза.

4. Биологические реакции — чаще возникают при использовании антибиотиков широкого спектра действия; плохо всасывающихся приеме внутрь; попадающих в активной форме в толстую кишечнику; при длительной терапии. 5. Нежелательные эффекты комплексной природы (аллергической, токсической и биологической). Например, линкозамиды, тетрациклины вызывают псевдомембранозный энтероколит, холероподобный синдром; тетрациклины, левомицетин — колоаноректальный синдром (колит, проктит, болезненные дефекации, тенезмы, слизисто-кровянистые испражнения).

Основываясь на 3 принципах Эрлиха-Флеминга, лежащих в основе применения антибиотиков, выбор препарата I ряда по предполагаемой микрофлоре сделан. Через 2— 4 дня от начала лечения врач, руководствуясь критериями оценки эффективности назначенного препарата (см. раньше), сделает окончательный вывод об его эффективности. В случае, если антибиотик «сработал» , лечение этим лекарством продолжают и заканчивают. Если же его эффективность недостаточна (отсутствует) или при появлении нежелательных эффектов врач (с учетом данных из бактериологической лаборатории, полученных к этому времени) проводит коррекцию антибиотикотерапии, пользуясь предложенным выше алгоритмом.

Возможные ошибки проведении антибиотикотерапии 1. Необоснованное назначение антибиотика (вирусная инфекция; выделенный микроб не служит причиной болезни; лекарственная устойчивость (первичная или вторичная) микроорганизма; изменение микробного спектра заболевания в процессе лечения; назначение антибиотика «на всякий случай» ; стремление врача сделать для владельца, что-нибудь «позитивное» ). 2. Применение бактериостатических антибиотиков при тяжелых инфекциях, у ослабленных пациентов. 3. Увлечение антибиотиками широкого спектра действия (чаше возникают нежелательные эффекты, выше опасность оппортунистических инфекций и возникновения вторичной резистентности, большая стоимость лечения). 4. Поздно начатое лечение, использование низких доз, несоблюдение кратности введения (интервалы между дозами слишком велики), преждевременное прерывание курса.

Возможные ошибки проведении антибиотикотерапии 5. Неправильно выбранный путь введения, незнание других фармакокинетических параметров (опасность кумуляции и реализация нежелательных эффектов). 6. Неправильная комбинация нескольких антибиотиков. 7. Несовместимость (фармакодинамическая, фармакокинетическая и физикохимическая) антибиотика с другими лекарственными средствами, одновременно с ним назначаемыми. 8. Снижение защитных сил макроорганизма (применение иммунодепрессантов — глюкокортикоидов, цитостатиков; сопутствующие заболевания — лейкоз, сахарный диабет, гипогаммаглобулинемия и др). 9. Присутствие в организме животного субстанции, препятствующей действию антибиотика (гной, очаг некроза) или наличие анатомических нарушений (ателектаз, абсцесс, изгибы, аневризмы, опухоли, камни) и инородных тел (катетеры, клапаны, протезы).

Правильный выбор препарата – залог успешной терапии!
Клиническая фармакология противомикробных средств.pptx