Клиническая фармакология и ИРК.ppt
- Количество слайдов: 61
 Клиническая фармакология для анестезиологареаниматолога. Программно-управляемая инфузия средств для общей анестезии 1
Клиническая фармакология для анестезиологареаниматолога. Программно-управляемая инфузия средств для общей анестезии 1
 Основные этапы развития внутривенной анестезии n n n n III век до н. э. – опиум используют для обезболивания и развлечения XYI век - в качестве яда для стрел применяют кураре XYII век – выполнены первые вв инъекции лекарственных веществ 1803 г - из опия выделен морфий 1845 г – изобретена полая игла 1846 г – проведена публичная демонстрация эфирной анестезии 1853 г – изобретен шприц 2
Основные этапы развития внутривенной анестезии n n n n III век до н. э. – опиум используют для обезболивания и развлечения XYI век - в качестве яда для стрел применяют кураре XYII век – выполнены первые вв инъекции лекарственных веществ 1803 г - из опия выделен морфий 1845 г – изобретена полая игла 1846 г – проведена публичная демонстрация эфирной анестезии 1853 г – изобретен шприц 2
 Основные этапы развития внутривенной анестезии n n n 1872 г – хлоралгидрат вв 1909 г – для вв анестезии применено производное уретана – гедонал 1910 г - разработана концепция сбалансированной анестезии 1921 г - в клинике начал применяться первый барбитуровый анестетик - сомнифен 1934 г – в клинике начал применяться тиопентал 1939 г – синтезирован петидин (первый синтетический опиоид) 3
Основные этапы развития внутривенной анестезии n n n 1872 г – хлоралгидрат вв 1909 г – для вв анестезии применено производное уретана – гедонал 1910 г - разработана концепция сбалансированной анестезии 1921 г - в клинике начал применяться первый барбитуровый анестетик - сомнифен 1934 г – в клинике начал применяться тиопентал 1939 г – синтезирован петидин (первый синтетический опиоид) 3
 Основные этапы развития внутривенной анестезии n n n n n 1941 г – трагические события в Перл-Харборе, внутривенная анестезия названа «идеальным методом эвтаназии» . Открыты анестетические свойства стероидов. 1942 г – в клинике начали применяться препараты кураре 1950 г – в анестезиологии начали применяться принципы фармакокинетики 1954 г – искусственная гибернация 1955 г – синтезирован первый бензодиазепин, первый стероидный анестетик - гидроксидион 1957 г – в клинике стал применяться метогекситал 1959 г – описана методика НЛА 1960 г – в клинике начал применяться диазепам 1965 г – в клинике начал применяться кетамин и пропанидид 4
Основные этапы развития внутривенной анестезии n n n n n 1941 г – трагические события в Перл-Харборе, внутривенная анестезия названа «идеальным методом эвтаназии» . Открыты анестетические свойства стероидов. 1942 г – в клинике начали применяться препараты кураре 1950 г – в анестезиологии начали применяться принципы фармакокинетики 1954 г – искусственная гибернация 1955 г – синтезирован первый бензодиазепин, первый стероидный анестетик - гидроксидион 1957 г – в клинике стал применяться метогекситал 1959 г – описана методика НЛА 1960 г – в клинике начал применяться диазепам 1965 г – в клинике начал применяться кетамин и пропанидид 4
 Основные этапы развития внутривенной анестезии n n n n 1967 г – в клинике начал применяться фентанил 1969 г – предложена методика высокодозной опиоидной анестезии 1972 г – в клинике начал применяться альтезин 1974 г – в клинике начал применяться этомидат, синтезирован суфентанил 1976 г – синтезирован альфентанил 1979 г – в клинике начал применяться мидазолам, синтезирован флумазенил 1984 г – в клинике начал применяться пропофол, запрещено применение альтезина и пропанидида 1996 г – в клинике начал применяться ремифентанил, внедрение методики инфузии пропофола, управляемой по 5 целевой концентрации
Основные этапы развития внутривенной анестезии n n n n 1967 г – в клинике начал применяться фентанил 1969 г – предложена методика высокодозной опиоидной анестезии 1972 г – в клинике начал применяться альтезин 1974 г – в клинике начал применяться этомидат, синтезирован суфентанил 1976 г – синтезирован альфентанил 1979 г – в клинике начал применяться мидазолам, синтезирован флумазенил 1984 г – в клинике начал применяться пропофол, запрещено применение альтезина и пропанидида 1996 г – в клинике начал применяться ремифентанил, внедрение методики инфузии пропофола, управляемой по 5 целевой концентрации
 Фармакокинетика n n Учение о взаимоотношениях между дозой, концентрацией и продолжительностью действия лекарственного средства. Фармакокинетика отвечает на ? : Что организм делает с препаратом 6
Фармакокинетика n n Учение о взаимоотношениях между дозой, концентрацией и продолжительностью действия лекарственного средства. Фармакокинетика отвечает на ? : Что организм делает с препаратом 6
 Фармакокинетика определяется 4 параметрами Абсорбция n Распределение n Биотрансформация n Экскреция n Элиминация 7
Фармакокинетика определяется 4 параметрами Абсорбция n Распределение n Биотрансформация n Экскреция n Элиминация 7
 Абсорбция n Процесс, в ходе которого лекарственное средство из места введения попадает в системный кровоток 8
Абсорбция n Процесс, в ходе которого лекарственное средство из места введения попадает в системный кровоток 8
 ПУТИ АБСОРБЦИИ PER OS, СУБЛИНГВАЛЬНЫЙ, РЕКТАЛЬНЫЙ ИНГАЛЯЦИОННЫЙ ЧРЕСКОЖНЫЙ ПОДКОЖНЫЙ ВНУТРИМЫШЕЧНЫЙ ВНУТРИВЕННЫЙ 9
ПУТИ АБСОРБЦИИ PER OS, СУБЛИНГВАЛЬНЫЙ, РЕКТАЛЬНЫЙ ИНГАЛЯЦИОННЫЙ ЧРЕСКОЖНЫЙ ПОДКОЖНЫЙ ВНУТРИМЫШЕЧНЫЙ ВНУТРИВЕННЫЙ 9
 Абсорбция Физические свойства препарата Характеристика места абсорбции Растворимость концентрация Перфузия р. Н Площадь 10
Абсорбция Физические свойства препарата Характеристика места абсорбции Растворимость концентрация Перфузия р. Н Площадь 10
 Биодоступность – фракция неизмененного вещества в плазме относительно исходной дозы. n Хорошая абсорбция → ↑ биодоступность. n Исключение – НГЛ: хорошо абсорбируется через ЖКТ, но имеет низкую биодоступность, т. к. подвергается интенсивному метаболизму в печени – т. н. «эффект первого прохождения» . n 11
Биодоступность – фракция неизмененного вещества в плазме относительно исходной дозы. n Хорошая абсорбция → ↑ биодоступность. n Исключение – НГЛ: хорошо абсорбируется через ЖКТ, но имеет низкую биодоступность, т. к. подвергается интенсивному метаболизму в печени – т. н. «эффект первого прохождения» . n 11
 Распределение n Ключевой параметр фармакокинетики, определяющий концентрацию препарата в органе – мишени. 12
Распределение n Ключевой параметр фармакокинетики, определяющий концентрацию препарата в органе – мишени. 12
 Распределение зависит от: Перфузии органа n Связывания препарата с белками n Жирорастворимости n 13
Распределение зависит от: Перфузии органа n Связывания препарата с белками n Жирорастворимости n 13
 По уровню перфузии выделяют Хорошо васкуляризованные ткани Мозг Сердце Печень Почки Эндокр. железы 10% от МТ 75% от СВ Органы с низкой перфузией Мышцы, кожа 50 % от МТ и 19% от СВ Слабо васкуляризованные органы Кости, связки, Хрящ 20%от МТ и 0% от СВ Жир 20 % от МТ и 6% от СВ 14
По уровню перфузии выделяют Хорошо васкуляризованные ткани Мозг Сердце Печень Почки Эндокр. железы 10% от МТ 75% от СВ Органы с низкой перфузией Мышцы, кожа 50 % от МТ и 19% от СВ Слабо васкуляризованные органы Кости, связки, Хрящ 20%от МТ и 0% от СВ Жир 20 % от МТ и 6% от СВ 14
 Связывание с белком Пока лекарственное средство связано с белками, оно недоступно для поглощения органом, вне зависимости от интенсивности кровотока. n Альбумин – связывает препараты – кислоты n n α -1 - гликопротеин – препараты основания (МА) 15
Связывание с белком Пока лекарственное средство связано с белками, оно недоступно для поглощения органом, вне зависимости от интенсивности кровотока. n Альбумин – связывает препараты – кислоты n n α -1 - гликопротеин – препараты основания (МА) 15
 Жирорастворимость Обеспечивает проникновение через липидные мембраны. n Высокоионизированные (липофобные) соединения не проникают через ГЭБ n Неионизированные (липофильные) – хорошо проникают через ГЭБ n 16
Жирорастворимость Обеспечивает проникновение через липидные мембраны. n Высокоионизированные (липофобные) соединения не проникают через ГЭБ n Неионизированные (липофильные) – хорошо проникают через ГЭБ n 16
 Перераспределение n n После того, как в ходе начального распределения насыщаются хорошо васкуляризованные ткани, большая масса слабо васкуляризованных тканей продолжает поглощать препарат из кровотока. Когда концентрация препарата в плазме значительно снижается, некоторое количество его покидает хорошо васкуляризованные ткани и поступает в кровоток, чтобы поддержать равновесие. 17
Перераспределение n n После того, как в ходе начального распределения насыщаются хорошо васкуляризованные ткани, большая масса слабо васкуляризованных тканей продолжает поглощать препарат из кровотока. Когда концентрация препарата в плазме значительно снижается, некоторое количество его покидает хорошо васкуляризованные ткани и поступает в кровоток, чтобы поддержать равновесие. 17
 n Феномен перераспределения из хорошо васкуляризованных тканей (ЦНС) приводит к прекращению действия многих анестетиков. n n Пробуждение после анестезии барбитуратами связано с перераспределением препарата из головного мозга в мышцы и жировую ткань. Из феномена перераспределения следует еще один вывод: если насытить препаратом слабо васкуляризованные ткани (с помощью повторных инъекций), то перераспределения не будет и окончание эффекта препарата станет определяться элиминацией. Поэтому препараты короткого действия (фентанил, тиопентал) после повторных введений или после введения большой однократной дозы действуют значительно дольше. 18
n Феномен перераспределения из хорошо васкуляризованных тканей (ЦНС) приводит к прекращению действия многих анестетиков. n n Пробуждение после анестезии барбитуратами связано с перераспределением препарата из головного мозга в мышцы и жировую ткань. Из феномена перераспределения следует еще один вывод: если насытить препаратом слабо васкуляризованные ткани (с помощью повторных инъекций), то перераспределения не будет и окончание эффекта препарата станет определяться элиминацией. Поэтому препараты короткого действия (фентанил, тиопентал) после повторных введений или после введения большой однократной дозы действуют значительно дольше. 18
 Объем распределения n Vd = доза/концентрация n Отражает тот объем плазмы, который был бы необходим для распределения дозы препарата в измеренной концентрации 19
Объем распределения n Vd = доза/концентрация n Отражает тот объем плазмы, который был бы необходим для распределения дозы препарата в измеренной концентрации 19
 n Низкий объем распределения (у панкурониума Vd=10 л) указывает на то, что препарат распределяется в кровь, основные причины: Высокая степень ионизации n Высокое связывание с белками n 20
n Низкий объем распределения (у панкурониума Vd=10 л) указывает на то, что препарат распределяется в кровь, основные причины: Высокая степень ионизации n Высокое связывание с белками n 20
 Высокий объем распределения (фентанил Vd=350 л): n Высокая растворимость n Лучшее связывание препарата в тканях, по сравнению с плазмой n 21
Высокий объем распределения (фентанил Vd=350 л): n Высокая растворимость n Лучшее связывание препарата в тканях, по сравнению с плазмой n 21
 Элиминация n n n Выведение препарата из организма путем его биотрансформации и экскреции k - константа элиминации – характеризует крутизну снижения концентрации вещества на кривой концентрация-время и измеряется в единицах, обратных времени. Показатель отражает фракцию препарата, элиминируемого в единицу времени: k = Cl/Vd 22
Элиминация n n n Выведение препарата из организма путем его биотрансформации и экскреции k - константа элиминации – характеризует крутизну снижения концентрации вещества на кривой концентрация-время и измеряется в единицах, обратных времени. Показатель отражает фракцию препарата, элиминируемого в единицу времени: k = Cl/Vd 22
 Период полуэлиминации (T 1/2) Указывает на время, в течении которого концентрация препарата в субстрате уменьшается на 50%. n T 1/2 cоотносится с k: T 1/2= 0, 693*k n 23
Период полуэлиминации (T 1/2) Указывает на время, в течении которого концентрация препарата в субстрате уменьшается на 50%. n T 1/2 cоотносится с k: T 1/2= 0, 693*k n 23
 Период полуэлиминации n n n на является точным показателем, характеризующим выведение лекарственного средства, он варьирует в широких пределах при различных заболеваниях, зависит от возраста пациента и длительности инфузии. Поэтому предлагается вводить такой параметр, как контекстно-зависимый T 1/2. В зависимости от продолжительности введения препарата может изменяться T 1/2 - с увеличением продолжительности инфузии T 1/2 большинства препаратов существенно возрастает. Эта особенность учитывается при разработке систем с программно-контролируемой инфузией. 24
Период полуэлиминации n n n на является точным показателем, характеризующим выведение лекарственного средства, он варьирует в широких пределах при различных заболеваниях, зависит от возраста пациента и длительности инфузии. Поэтому предлагается вводить такой параметр, как контекстно-зависимый T 1/2. В зависимости от продолжительности введения препарата может изменяться T 1/2 - с увеличением продолжительности инфузии T 1/2 большинства препаратов существенно возрастает. Эта особенность учитывается при разработке систем с программно-контролируемой инфузией. 24
 Биотрансформация Химическое превращение лекарственного вещества в ходе метаболизма. n Конченые продукты метаболизма обычно неактивные и водорастворимые. n Печень – главный орган биотрансформации. n 25
Биотрансформация Химическое превращение лекарственного вещества в ходе метаболизма. n Конченые продукты метаболизма обычно неактивные и водорастворимые. n Печень – главный орган биотрансформации. n 25
 Реакции биотрансформации n Реакции I фазы: Окисление n Восстановление n Гидролиз Молекула лекарственного средства становится более полярной n Реакции II фазы: n Реакции коньюгации (глюкуроновая кислота) В результате образуется еще более полярный метаболит n n n 26
Реакции биотрансформации n Реакции I фазы: Окисление n Восстановление n Гидролиз Молекула лекарственного средства становится более полярной n Реакции II фазы: n Реакции коньюгации (глюкуроновая кислота) В результате образуется еще более полярный метаболит n n n 26
 Клиренс n Cl=скорость удаления препарата/концентрация препарата в плазме n n n Объем плазмы, очищенный от препарата за единицу времени, мл/мин Печеночный клиренс - это скорость элиминации лекарственного вещества в результате биотрансформации в печени. Почечный клиренс – скорость элиминации путем почечной экскреции 27
Клиренс n Cl=скорость удаления препарата/концентрация препарата в плазме n n n Объем плазмы, очищенный от препарата за единицу времени, мл/мин Печеночный клиренс - это скорость элиминации лекарственного вещества в результате биотрансформации в печени. Почечный клиренс – скорость элиминации путем почечной экскреции 27
 Печеночный клиренс зависит: n n Печеночный кровоток Фракция препарата, поглощаемого печенью (отношение печеночной экстракции). n n Препараты, которые поглощаются печенью в значительной степени, имеют высокое отношение печеночной экстракции и их клиренс пропорционален печеночному кровотоку. Препараты с низким отношением печеночной экстракции поглощаются печенью незначительно и их клиренс ограничен емкостью ферментных систем печени. 28
Печеночный клиренс зависит: n n Печеночный кровоток Фракция препарата, поглощаемого печенью (отношение печеночной экстракции). n n Препараты, которые поглощаются печенью в значительной степени, имеют высокое отношение печеночной экстракции и их клиренс пропорционален печеночному кровотоку. Препараты с низким отношением печеночной экстракции поглощаются печенью незначительно и их клиренс ограничен емкостью ферментных систем печени. 28
 Экскреция n n Главный орган – почки Лекарственные вещества, не связанные с белками, свободно проходят через клубочковый фильтр. Неионизированная фракция препарата реабсорбируется в почечных канальцах Ионизированная – выделяется с мочой 29
Экскреция n n Главный орган – почки Лекарственные вещества, не связанные с белками, свободно проходят через клубочковый фильтр. Неионизированная фракция препарата реабсорбируется в почечных канальцах Ионизированная – выделяется с мочой 29
 n Почечная недостаточность влияет на фармакокинетику многих лекарственных препаратов, при этом изменяется: Степень связывания с белками n Объем распределения n Почечный клиренс n 30
n Почечная недостаточность влияет на фармакокинетику многих лекарственных препаратов, при этом изменяется: Степень связывания с белками n Объем распределения n Почечный клиренс n 30
 Модели камер Упрощенная схема, позволяющая охарактеризовать распределение и элиминацию лекарственных веществ. n Камерой называют группу тканей, обладающих сходными фармакокинетическими характеристиками. n 31
Модели камер Упрощенная схема, позволяющая охарактеризовать распределение и элиминацию лекарственных веществ. n Камерой называют группу тканей, обладающих сходными фармакокинетическими характеристиками. n 31
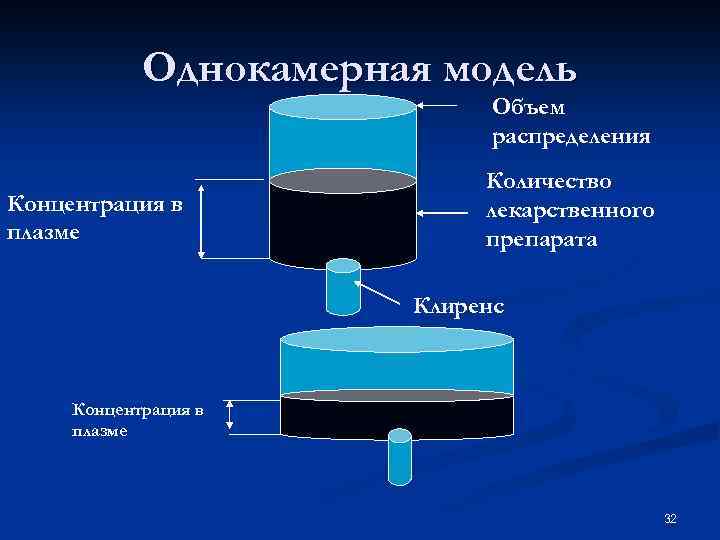 Однокамерная модель Объем распределения Концентрация в плазме Количество лекарственного препарата Клиренс Концентрация в плазме 32
Однокамерная модель Объем распределения Концентрация в плазме Количество лекарственного препарата Клиренс Концентрация в плазме 32
 Периферическая камера: Мышцы Кожа Жир Двухкамерная модель V 1 V 2 K 1 -2 K 2 -1 Центральная камера: Плазма Группа хорошо васкуляризованных тканей K 0 -1 Кинетика распределения характеризуется 3 константами: 1. Скорость элиминации К 0 -1 2. Скорость перехода из центральной камеры в периферическую К 1 -2 3. Скорость перехода из периферической камеры в центральную К 2 -1 33
Периферическая камера: Мышцы Кожа Жир Двухкамерная модель V 1 V 2 K 1 -2 K 2 -1 Центральная камера: Плазма Группа хорошо васкуляризованных тканей K 0 -1 Кинетика распределения характеризуется 3 константами: 1. Скорость элиминации К 0 -1 2. Скорость перехода из центральной камеры в периферическую К 1 -2 3. Скорость перехода из периферической камеры в центральную К 2 -1 33
 Двухкамерная модель Фаза распределения Фаза элиминации 34
Двухкамерная модель Фаза распределения Фаза элиминации 34
 n n Период полусуществования препарата в фазе элиминации прямо пропорционален объему распределения и обратно пропорционален клиренсу. Если распределение, а не элиминация играет основную роль в снижении концентрации препарата, то даже при длительных периодах полусуществования концентрация препарата в сыворотке будет быстро уменьшаться. 35
n n Период полусуществования препарата в фазе элиминации прямо пропорционален объему распределения и обратно пропорционален клиренсу. Если распределение, а не элиминация играет основную роль в снижении концентрации препарата, то даже при длительных периодах полусуществования концентрация препарата в сыворотке будет быстро уменьшаться. 35
 Медленная периферическая камера: Трехкамерная модель Быстрая периферическая камера V 3 V 1 K 1 -3 V 2 K 1 -2 K 3 -1 К 2 -1 K 0 -1 Клиренс элиминации Межкамерные клиренсы 36
Медленная периферическая камера: Трехкамерная модель Быстрая периферическая камера V 3 V 1 K 1 -3 V 2 K 1 -2 K 3 -1 К 2 -1 K 0 -1 Клиренс элиминации Межкамерные клиренсы 36
 n Кривые концентрации многих лекарственных веществ описывают с помощью трехкамерной модели, где оперируют одной центральной камерой и двумя периферическими n Продолжительность действия препарата нельзя рассчитать, зная только периоды полусуществования. 37
n Кривые концентрации многих лекарственных веществ описывают с помощью трехкамерной модели, где оперируют одной центральной камерой и двумя периферическими n Продолжительность действия препарата нельзя рассчитать, зная только периоды полусуществования. 37
 Трехкамерная модель n 1. 2. 3. Изменение плазменной концентрации препарата во времени имеет 3 фазы: Фаза быстрого распределения – начинается сразу после введения нагрузочной дозы (обусловлена перемещением препарата из плазмы в быструю периферическую камеру) Фаза медленного распределения – обусловлена перемещением препарата в медленную периферическую камеру, а также возвратом препарата из быстрой периферической камеры в плазму. Терминальная фаза - отражает элиминацию препарата из организма, а также возвращение препарата из обеих периферических камер в плазму. Возвращение препарата уменьшает скорость снижения его концентрации в плазме. 38
Трехкамерная модель n 1. 2. 3. Изменение плазменной концентрации препарата во времени имеет 3 фазы: Фаза быстрого распределения – начинается сразу после введения нагрузочной дозы (обусловлена перемещением препарата из плазмы в быструю периферическую камеру) Фаза медленного распределения – обусловлена перемещением препарата в медленную периферическую камеру, а также возвратом препарата из быстрой периферической камеры в плазму. Терминальная фаза - отражает элиминацию препарата из организма, а также возвращение препарата из обеих периферических камер в плазму. Возвращение препарата уменьшает скорость снижения его концентрации в плазме. 38
 Трехкамерная модель Ve – эффекторная камера ke 0 – константа микроскорости К е-0 V 3 K 1 -e V 1 V 2 K 1 -3 K 3 -1 К 2 -1 K 0 -1 39
Трехкамерная модель Ve – эффекторная камера ke 0 – константа микроскорости К е-0 V 3 K 1 -e V 1 V 2 K 1 -3 K 3 -1 К 2 -1 K 0 -1 39
 Фармакодинамика n Наука о действии препарата на организм. Отвечает на ? : Что препарат делает с организмом. n Изучает механизмы действия лекарств, соотношение между структурой и активностью, а также межлекарственные взаимодействия. n 40
Фармакодинамика n Наука о действии препарата на организм. Отвечает на ? : Что препарат делает с организмом. n Изучает механизмы действия лекарств, соотношение между структурой и активностью, а также межлекарственные взаимодействия. n 40
 Действие препарата на организм характеризуется Эффективностью n Мощностью n Терапевтической широтой n 41
Действие препарата на организм характеризуется Эффективностью n Мощностью n Терапевтической широтой n 41
 n Фармакодинамика рассматривает зависимость между концентрацией препарата и эффектом. 42
n Фармакодинамика рассматривает зависимость между концентрацией препарата и эффектом. 42
 Кривая «доза-эффект» 43
Кривая «доза-эффект» 43
 n n Концентрацию, соответствующую 50% от максимального эффекта, обозначают как EC 50. ЕС 50 используют для сравнения мощности препаратов сходного действия. Для достижения одного и того же эффекта, концентрация менее МОЩНОГО препарата должна быть выше. Именно мощность отражает зависимость между концентрацией и эффектом, в то время как на взаимозависимость «доза –эффект» влияют фармакокинетические параметры. Терапевтическая широта – разница между концентрацией, вызывающей максимальный эффект, и концентрацией, не вызывающей никакого эффекта. 44
n n Концентрацию, соответствующую 50% от максимального эффекта, обозначают как EC 50. ЕС 50 используют для сравнения мощности препаратов сходного действия. Для достижения одного и того же эффекта, концентрация менее МОЩНОГО препарата должна быть выше. Именно мощность отражает зависимость между концентрацией и эффектом, в то время как на взаимозависимость «доза –эффект» влияют фармакокинетические параметры. Терапевтическая широта – разница между концентрацией, вызывающей максимальный эффект, и концентрацией, не вызывающей никакого эффекта. 44
 45
45
 Программно-управляемая инфузия Автоматическое введение препаратов в соответствии с их фармакокинетической моделью. n Начало 80 -х годов - первые системы для программно-контролируемой инфузии, основанные на применении вычислительной техники. n 46
Программно-управляемая инфузия Автоматическое введение препаратов в соответствии с их фармакокинетической моделью. n Начало 80 -х годов - первые системы для программно-контролируемой инфузии, основанные на применении вычислительной техники. n 46
 Терминология CATIA – computer-assiated total intravenous anaesthesia system (1981) n TIAC – titration on intravenous agents by computer (1985) n CACI – computer-assisted continuous infusion (1990) n CCIP – computer-controlled infusion pump (1990) n TCI – target-controlled infusion (1997). n 47
Терминология CATIA – computer-assiated total intravenous anaesthesia system (1981) n TIAC – titration on intravenous agents by computer (1985) n CACI – computer-assisted continuous infusion (1990) n CCIP – computer-controlled infusion pump (1990) n TCI – target-controlled infusion (1997). n 47
 Терминология n ИЦК – инфузия по целевой концентрации (TCI – целевая контролируемая инфузия) n n ИУЦК – инфузия, управляемая по целевой концентрации ИКЦК – инфузия, контролируемая по целевой концентации ИРЦК - инфузия, регулируемая по целевой концентрации Однако современная анестезия не может не подразумевать контроль и управление. Поэтому термин ИЦК – с одной стороны, отражает суть методики, а с другой, прост в обращении. 48
Терминология n ИЦК – инфузия по целевой концентрации (TCI – целевая контролируемая инфузия) n n ИУЦК – инфузия, управляемая по целевой концентрации ИКЦК – инфузия, контролируемая по целевой концентации ИРЦК - инфузия, регулируемая по целевой концентрации Однако современная анестезия не может не подразумевать контроль и управление. Поэтому термин ИЦК – с одной стороны, отражает суть методики, а с другой, прост в обращении. 48
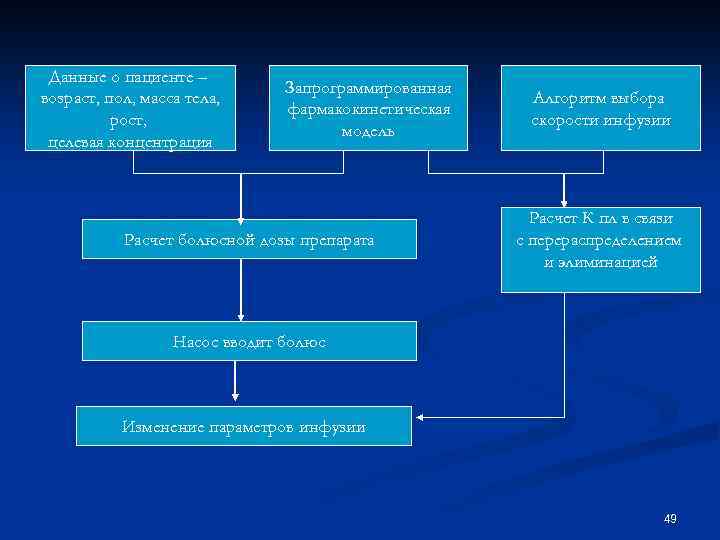 Данные о пациенте – возраст, пол, масса тела, рост, целевая концентрация Запрограммированная фармакокинетическая модель Расчет болюсной дозы препарата Алгоритм выбора скорости инфузии Расчет К пл в связи с перераспределением и элиминацией Насос вводит болюс Изменение параметров инфузии 49
Данные о пациенте – возраст, пол, масса тела, рост, целевая концентрация Запрограммированная фармакокинетическая модель Расчет болюсной дозы препарата Алгоритм выбора скорости инфузии Расчет К пл в связи с перераспределением и элиминацией Насос вводит болюс Изменение параметров инфузии 49
 Терминология ИЦК n n Ккр – концентрация препарата в крови или плазме Кэф – концентрация препарата в точке приложения эффекта n n n На начальном этапе инфузии создается значительное различие между Ккр и Кэф (Ккр>Кэф) Через некоторое время - зависит от градиента (Ккр-Кэф) – концентрации выравниваются. Выраженность побочных эффектов препаратов (вазодилатация, гипотензия, миокардиальная депрессия) зависит от Ккр. До момента эквилибрации между Ккр и Кэф могут преобладать побочные эффекты. Существует прием минимизации градиента Ккр-Кэф введение препарата с невысокой скоростью. Но это замедляет достижение Кэф. На определенном этапе Ккр и Кэф становятся равными, достигается эквилибрация между центральной камерой фармакокинетической модели и точкой приложения эффекта. 50
Терминология ИЦК n n Ккр – концентрация препарата в крови или плазме Кэф – концентрация препарата в точке приложения эффекта n n n На начальном этапе инфузии создается значительное различие между Ккр и Кэф (Ккр>Кэф) Через некоторое время - зависит от градиента (Ккр-Кэф) – концентрации выравниваются. Выраженность побочных эффектов препаратов (вазодилатация, гипотензия, миокардиальная депрессия) зависит от Ккр. До момента эквилибрации между Ккр и Кэф могут преобладать побочные эффекты. Существует прием минимизации градиента Ккр-Кэф введение препарата с невысокой скоростью. Но это замедляет достижение Кэф. На определенном этапе Ккр и Кэф становятся равными, достигается эквилибрация между центральной камерой фармакокинетической модели и точкой приложения эффекта. 50
 Первой коммерческой системой ИЦК стал “Diprifusor” (1996), предназначенный для введения пропофола. n В настоящее время созданы фармакокинетические модели для большинства вв анестетиков и опиоидов (фентанил, альфентанил, суфентанил) n 51
Первой коммерческой системой ИЦК стал “Diprifusor” (1996), предназначенный для введения пропофола. n В настоящее время созданы фармакокинетические модели для большинства вв анестетиков и опиоидов (фентанил, альфентанил, суфентанил) n 51
 Использование ИЦК альфентанила по сравнению с болюсным введением Снижает количество периодов неадекватной анестезии, n Обеспечивает гемодинамическую стабильность, n Полностью исключает использование антагонистов опиатных рецепторов с целью коррекции послеоперационной депрессии дыхания n Снижает частоту побочных эффектов. n 52
Использование ИЦК альфентанила по сравнению с болюсным введением Снижает количество периодов неадекватной анестезии, n Обеспечивает гемодинамическую стабильность, n Полностью исключает использование антагонистов опиатных рецепторов с целью коррекции послеоперационной депрессии дыхания n Снижает частоту побочных эффектов. n 52
 Пропофол как анестетик для программноуправляемого введения n n n n Обладает уникальными фармакокинетическими и фармакодинамическими параметрами. Начальный полупериод распределения 2 -8 мин Метаболический клиренс 1, 5 -2 л/мин Период полувыведения 30 -60 мин Обладает высоким сродством к белкам плазмы – 98% от введенной дозы связывается с белками Гипнотический эффект проявляется через 30 с от начала введения и достигает максимума ко 2 -3 минуте. Динамика снижения концентрации профпофола после прекращения инфузии мало зависит от длительности введения. 53
Пропофол как анестетик для программноуправляемого введения n n n n Обладает уникальными фармакокинетическими и фармакодинамическими параметрами. Начальный полупериод распределения 2 -8 мин Метаболический клиренс 1, 5 -2 л/мин Период полувыведения 30 -60 мин Обладает высоким сродством к белкам плазмы – 98% от введенной дозы связывается с белками Гипнотический эффект проявляется через 30 с от начала введения и достигает максимума ко 2 -3 минуте. Динамика снижения концентрации профпофола после прекращения инфузии мало зависит от длительности введения. 53
 Целевая концентрация пропофола в плазме (мкг/мл) Целевая концентрация пропофола в плазме в зависимости от методики, сопутствующего анестетика и травматичности операции 10 8 6 ТВВА: только пропофол 4 2 0 Седация ТВВА: Пропофол/ опиоид Пропофол/ N 2 O при малотравматичных операциях Пропофол/ N 2 O при высокотравматичных операциях 54
Целевая концентрация пропофола в плазме (мкг/мл) Целевая концентрация пропофола в плазме в зависимости от методики, сопутствующего анестетика и травматичности операции 10 8 6 ТВВА: только пропофол 4 2 0 Седация ТВВА: Пропофол/ опиоид Пропофол/ N 2 O при малотравматичных операциях Пропофол/ N 2 O при высокотравматичных операциях 54
 Показатели различных фармакокинетических моделей пропофола Авторы Показатели V 1 K 1 - 0 K 1 -2 K 2 -1 K 1 -3 Gepts (1987) 0, 241 0, 119 0, 114 0, 055 0, 0419 0, 0033 Shafer (1988) 0, 35 0, 086 0, 059 0, 01 В двухкамерной модели отсутствуют Kirpatrick (1988) 0, 376 0, 077 0, 246 0, 0597 0, 0391 0, 0019 Cockshoott (1988) 0, 25 0, 1058 0, 144 0, 064 0, 0282 0, 0034 Tackley (1989) 0, 32 0, 0827 0, 105 0, 064 0, 022 Marsh (1991) 0, 228 0, 119 0, 055 0, 0419 0, 0033 55 0, 114 K 3 -1 0, 0034
Показатели различных фармакокинетических моделей пропофола Авторы Показатели V 1 K 1 - 0 K 1 -2 K 2 -1 K 1 -3 Gepts (1987) 0, 241 0, 119 0, 114 0, 055 0, 0419 0, 0033 Shafer (1988) 0, 35 0, 086 0, 059 0, 01 В двухкамерной модели отсутствуют Kirpatrick (1988) 0, 376 0, 077 0, 246 0, 0597 0, 0391 0, 0019 Cockshoott (1988) 0, 25 0, 1058 0, 144 0, 064 0, 0282 0, 0034 Tackley (1989) 0, 32 0, 0827 0, 105 0, 064 0, 022 Marsh (1991) 0, 228 0, 119 0, 055 0, 0419 0, 0033 55 0, 114 K 3 -1 0, 0034
 Дозы пропофола Для поддержания сбалансированной анестезии – 75 – 200 мкг/кг в мин, что соответствует целевой концентрации в плазме 3 -7 мкг/мл n При изолированном применении – 100 – 300 мкг/кг в мин (целевая концентрация 6 – 10 мкг/мл) n Для обеспечения седации – 25 – 75 мкг/кг в мин (целевая концентрация 0, 5 – 1, 0 мкг/мл) n 56
Дозы пропофола Для поддержания сбалансированной анестезии – 75 – 200 мкг/кг в мин, что соответствует целевой концентрации в плазме 3 -7 мкг/мл n При изолированном применении – 100 – 300 мкг/кг в мин (целевая концентрация 6 – 10 мкг/мл) n Для обеспечения седации – 25 – 75 мкг/кг в мин (целевая концентрация 0, 5 – 1, 0 мкг/мл) n 56
 Показания для использования ИЦК пропофола n n n n Малые хирургические процедуры и вмешательства Препарат выбора в хирургии «одного дня» Абдоминальная хирургия (грыжесечение, холецистэкстомия, аппендэктомия, резекция желудка, реконструктивные вмешательства на желчных путях) Эндоскопические процедуры (артроскопия, колоноскопия) Ортопедические операции Торакальные операции Нейрохирургические вмешательства 57
Показания для использования ИЦК пропофола n n n n Малые хирургические процедуры и вмешательства Препарат выбора в хирургии «одного дня» Абдоминальная хирургия (грыжесечение, холецистэкстомия, аппендэктомия, резекция желудка, реконструктивные вмешательства на желчных путях) Эндоскопические процедуры (артроскопия, колоноскопия) Ортопедические операции Торакальные операции Нейрохирургические вмешательства 57
 Методы оценки адекватности анестезии Метод Преимущества Недостатки Интраоперационное восстановление сознания «Золотой стандарт» Оценивается только ретроспективно. Воспоминаний об интраоперационных событиях может не быть Целенаправленные движения Очевидный и относительно достоверный симптом Симптом достоверен не всегда, нельзя судить при использовании миорелаксантов Частота и характер дыхания Относительно достоверный Достоверен не всегда, показатель нельзя судить при использовании миорелаксантов 58
Методы оценки адекватности анестезии Метод Преимущества Недостатки Интраоперационное восстановление сознания «Золотой стандарт» Оценивается только ретроспективно. Воспоминаний об интраоперационных событиях может не быть Целенаправленные движения Очевидный и относительно достоверный симптом Симптом достоверен не всегда, нельзя судить при использовании миорелаксантов Частота и характер дыхания Относительно достоверный Достоверен не всегда, показатель нельзя судить при использовании миорелаксантов 58
 Методы оценки адекватности анестезии Метод Преимущества Недостатки Вегетативные проявления (ЧСС, АД, размер и реакция зрачков, потоотделение) Показатели легко оценить клинически и с помощью стандартных мониторов, используют для оценки адекватности анестезии очень давно. Показатели и симптомы недостоверны и неспецифичны ЭЭГ – стандартная методика (необработанный сигнал) Относительно просто получить данные Трудно интерпретировать результаты, на них влияет не только глубина, но и методика анестезии Обработанные сигнал Относительно легко ЭЭГ – сжатый интерпретировать спектральный ряд, результаты частота спектрального края Необходимо специальное оборудование, на результаты влияет не только глубина, но и методика анестезии. Достоверность спорная 59
Методы оценки адекватности анестезии Метод Преимущества Недостатки Вегетативные проявления (ЧСС, АД, размер и реакция зрачков, потоотделение) Показатели легко оценить клинически и с помощью стандартных мониторов, используют для оценки адекватности анестезии очень давно. Показатели и симптомы недостоверны и неспецифичны ЭЭГ – стандартная методика (необработанный сигнал) Относительно просто получить данные Трудно интерпретировать результаты, на них влияет не только глубина, но и методика анестезии Обработанные сигнал Относительно легко ЭЭГ – сжатый интерпретировать спектральный ряд, результаты частота спектрального края Необходимо специальное оборудование, на результаты влияет не только глубина, но и методика анестезии. Достоверность спорная 59
 Методы оценки адекватности анестезии Метод Преимущества Недостатки ЭЭГ – обработанный сигнал, биспектральный индекс Относительно легко интерпретировать результаты, метод перспективен Необходимо специальное оборудование, независимость о тметодики анестезии не доказа, необходимы далнейшие исследования Активность мимических мышц Мимические мышцы не подвержены действию релаксантов, метод перспективен Необходимо специальное оборудование, дальнейшие исследования Сократимость нижнего отдела пищевода Метод очень сильно Необходимо специальное отличается от клинических оборудование и электрофизиологических подходов Вызванные потенциалы Возможно, будет использоваться в будущем Необходимо специальное оборудование, дальнейшие исследования 60
Методы оценки адекватности анестезии Метод Преимущества Недостатки ЭЭГ – обработанный сигнал, биспектральный индекс Относительно легко интерпретировать результаты, метод перспективен Необходимо специальное оборудование, независимость о тметодики анестезии не доказа, необходимы далнейшие исследования Активность мимических мышц Мимические мышцы не подвержены действию релаксантов, метод перспективен Необходимо специальное оборудование, дальнейшие исследования Сократимость нижнего отдела пищевода Метод очень сильно Необходимо специальное отличается от клинических оборудование и электрофизиологических подходов Вызванные потенциалы Возможно, будет использоваться в будущем Необходимо специальное оборудование, дальнейшие исследования 60
 Что почитать по теме: n n n n Т. Н. Калви, Н. Е. Уильямс. Фармакология для анестезиолога/ Пер с англ. – М. : Бином, 2007. Йен Смит, Пол Уайт Тотальная внутривенная анестезия (клиническое руководство), Москва-СПб, 2002. Рациональная фармакоанестезиология. Руководство для практикующих врачей. Под общей редакцией А. А. Бунятяна, В. М. Мизикова, Москва, 2006. Руководство по кардиоанестезиологии, под ред. А. А. Бунятяна, Н. А. Трековой, Москва, 2005. Белоусов Ю. Б. , Моисеев В. С. , Лепахин В. К. Клиническая фармакология и фармакотерапия: Руководство для врачей, Москва, 1993. Воронин С. В. , Козлов И. А. Программно-управляемая инфузия средств для общей анестезии, А и Р, 2003, № 3. Стамов И. В. , Мизиков В. М. , Дешко Ю. В. Теоретические и практические аспекты применения различных вариантов инфузии пропофола с управлением по целевой концентрации, А и Р, 2006, № 5. 61
Что почитать по теме: n n n n Т. Н. Калви, Н. Е. Уильямс. Фармакология для анестезиолога/ Пер с англ. – М. : Бином, 2007. Йен Смит, Пол Уайт Тотальная внутривенная анестезия (клиническое руководство), Москва-СПб, 2002. Рациональная фармакоанестезиология. Руководство для практикующих врачей. Под общей редакцией А. А. Бунятяна, В. М. Мизикова, Москва, 2006. Руководство по кардиоанестезиологии, под ред. А. А. Бунятяна, Н. А. Трековой, Москва, 2005. Белоусов Ю. Б. , Моисеев В. С. , Лепахин В. К. Клиническая фармакология и фармакотерапия: Руководство для врачей, Москва, 1993. Воронин С. В. , Козлов И. А. Программно-управляемая инфузия средств для общей анестезии, А и Р, 2003, № 3. Стамов И. В. , Мизиков В. М. , Дешко Ю. В. Теоретические и практические аспекты применения различных вариантов инфузии пропофола с управлением по целевой концентрации, А и Р, 2006, № 5. 61


