лекция АБ.ppt
- Количество слайдов: 123

Клиническая фармакология антимикробных препаратов


Нобелевская Премия по физиологии и медицине за 1945 г. Сэр Александр Фле минг в 1920 г. впервые выделил исторически первый антибиотик из плесневых грибов Penicillium notatum – пенициллин

Антимикробные препараты в России В настоящее время в России зарегистрировано более 200 антимикробных препаратов Антибактериальные – 20 классов Противогрибковые – 8 классов Противовирусные – 8 классов Противопротозойные – 12 классов


История современной антимикробной химиотерапии – это непрерывный процесс развития и распространения различных форм устойчивости микробов к антибиотикам и создание новых антибактериальных препаратов для преодоления этой резистентности.

Антибиотики и смертность от инфекционных болезней Эр Ван Амп Гент Амк Цфт Феп Цип Ими Ази Мокс Лин

Главная причина резистентности: широкое и неадекватное применение АБ Финляндия с 1991 до 1996 г. на национальном уровне ограничения макролидов – уменьшение устойчивости пневмококков с 19 до 9% Россия: гентамицин – до 60% устойчивых штаммов.

АНТИБИОТИКИ В АМБУЛАТОРНОЙ ПРАКТИКЕ Антибиотики, назначаемые внутрь (162 млн. назначений): инфекции мочевыводящих путей инфекции дыхательных путей 17% 58% 9% 9% 7% инфекции кожи / мягких тканей инфекции ЖКТ прочие IMS, 2002

КЛЮЧЕВЫЕ ВОПРОСЫ ПРИ ЛЕЧЕНИИ ИНФЕКЦИЙ ВОПРОСЫ: ПОДХОДЫ: Ø Нужны ли антибиотики? Ø Этиология, вероятность спонтанного разрешения/риск осложнений Ø Какой антибиотик выбрать? Ø Структура и резистентность возбудителей, ФД, ФК, профиль безопасности АБ и т. д. Ø Цели и длительность Ø Клиническое улучшение vs терапии? эрадикация возбудителя

ЭМПИРИЧЕСКАЯ АБ-ТЕРАПИЯ Ø Сведения о наиболее вероятных возбудителях Ø Локальные данных об их чувствительности к антибиотикам Ø Способности создавать адекватные для подавления возбудителей концентрации в очаге инфекции Ø Доказанная эффективность в контролируемых клинических исследованиях
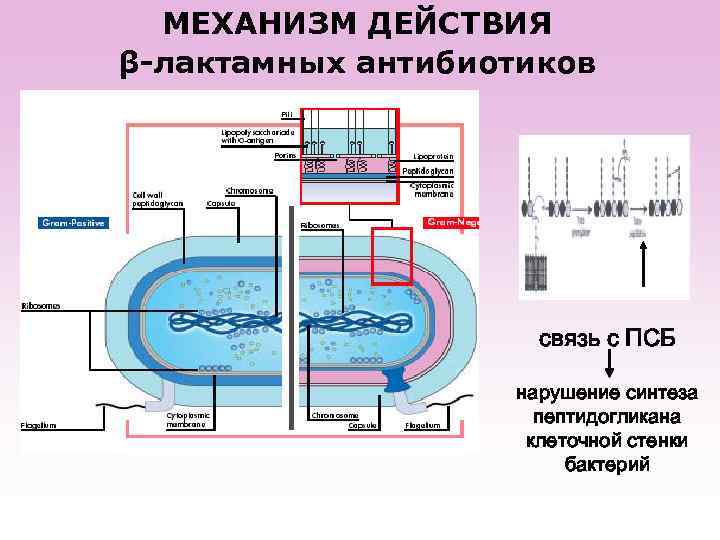
МЕХАНИЗМ ДЕЙСТВИЯ β-лактамных антибиотиков связь с ПСБ нарушение синтеза пептидогликана клеточной стенки бактерий

ОБЩИЕ СВОЙСТВА ПЕНИЦИЛЛИНОВ Достоинства • Бактерицидное действие в отношении многих клинически значимых возбудителей • Низкая токсичность • Широкий диапазон дозировок • Многолетний опыт клинического применения • Относительно невысокая стоимость Недостатки • Перекрестные аллергические реакции внутри группы, с ЦС и карбапенемами • Растущая резистентность ключевых возбудителей

КЛАССИФИКАЦИЯ ПЕНИЦИЛЛИНОВ I. Природные: Ø Бензилпенициллин (натриевая и калиевая соли) Ø Феноксиметилпенициллин Ø Прокаин бензилпенициллин (новокаиновая соль пенициллина) Ø Бензатин бензилпенициллин

КЛАССИФИКАЦИЯ ПЕНИЦИЛЛИНОВ II. Полусинтетические: Ø Антистафилококковые пенициллины - оксациллин Ø Аминопенициллины - ампициллин - амоксициллин (Флемоксин Солютаб®) Ø Антисинегнойные пенициллины: Карбоксипенициллины Уреидопенициллины - карбенициллин - тикарциллин - пиперациллин - азлоциллин

ПРЕИМУЩЕСТВА АМОКСИЦИЛЛИНА/КЛАВУЛАНАТА ПЕРЕД АМИНОПЕНИЦИЛЛИНАМИ Расширение спектра активности в отношении: - -Стафилококков (PRSA) - H. influenzae, M. catarrhalis (штаммов, вырабатывающих -лактамазы) - Некоторых штаммов E. coli, K. pneumoniae, Proteus spp. (P. vulgaris), N. gonorrhoeae - Анаэробов, включая B. fragilis

ИНГИБИТОРЫ -ЛАКТАМАЗ Сульбактам Клавулановая кислота Тазобактам Ø амоксициллин/клавуланат Ø пиперациллин/тазобактам

Амоксициллин/клавуланат • • Активен в отношении: аэробных грамположительных бактерий (включая штаммы, продуцирующие бета лактамазы): Staphylococcus aureus; Staphylococcus epidermidis, Streptococcus pyogenes, Streptococcus anthracis, Streptococcus pneumoniae, Streptococcus viridans, Enterococcus faecalis, Corynebacterium spp. , Listeria monocytogenes; аэробных грамотрицательных бактерий: Enterobacter spp. , Escherichia coli, Haemophilus influenzae, Klebsiella spp. , Moraxella catarrhalis. анаэробных грамположительных бактерий: Clostridium spp. , Peptococcus spp. , Peptostreptococcus spp. ; анаэробных Clostridium spp. , Peptococcus spp. , Peptostreptococcus spp. , аэробных грамотрицательных бактерий (включая штаммы, продуцирующие бета лактамазы): Proteus mirabilis, Proteus vulgaris, Salmonella spp. , Shigella spp. , Bordetella pertussis, Yersinia enterocolitica, Gardnerella vaginalis, Neisseria meningitidis, Neisseria gonorrhoeae, Haemophilus ducreyi, Yersinia multocida (ранее Pasteurella), Campylobacter jejuni; анаэробных грамотрицательных бактерий (включая штаммы, продуцирующие бета лактамазы): Bacteroides spp. , включая Bacteroides fragilis.

Амоксициллин/клавуланат Показания для использования: • Внебольничные инфекции дыхательных путей (пневмония, включая деструктивную, абсцедирующую; острый средний отит; обострение хронического бронхита; острый и хронический синусит, стрептококковый тонзиллит (ангина). • Инфекции мочевыводящих путей (острый цистит; острый и хронический пиелонефрит и бессимптомная бактериурия). • Инфекции кожи и мягких тканей. • Внебольничные интраабдоминальные инфекции. • Внебольничные гинекологические инфекции. • Раны после укусов животных. • Профилактика в хирургии.

Показания к применению защищенных уреидопенициллинов • Тяжелые преимущественно нозокомиальные (аэробно анаэробные) инфекции различной локализации: • дыхательные пути (нозокомиальная пневмония, включая вентиляционную; эмпиема, абсцесс легкого) • кожи и мягких тканей (включая диабетическую стопу) • интраабдоминальные и малого таза • послеродовые гнойно септические осложнения • желчевыводящие пути, желчный перитонит, абсцессы печени • мочевыводящие пути (осложненные, на фоне постоянных катетеров) • инфекции на фоне нейтропении и других форм иммунодефицита

Классификация бета лактамных антибиотиков Цефалоспорины I поколение III поколение IV поколение Парентеральные Цефуроксим Цефотаксим Цефазолин Цефамандол Цефтриаксон Цефепим Цефокситин* Цефоперазон** Цефтобипрол (зефтер) Цефотетан* Цефтазидим** Цефметазол* Оральные Цефалексин Цефаклор Цефиксим Цефуроксим ак Цефтибутен * выраженная атианаэробная активность (цефамицины) ** выраженная активность в отношении P. aeruginosa

Показания для применения цефалоспоринов IV поколения • Тяжелые госпитальные инфекции, вызванные полирезистентной микрофлорой: · инфекции нижних отделов дыхательных путей (пневмония, абсцесс легкого, эмпиема); · осложненные инфекции мочевыводящих путей; · инфекции кожи, мягких тканей, костей, суставов; · интраабдоминальные инфекции; · сепсис. • Инфекции на фоне нейтропении и других иммунодефицитных состояний

Цефтобипрол • Цефалоспорин с анти MRSA активностью – По эффективности равен ванкомицину • (Note: Clin Microbiol Infect 2007; 13 Suppl 2: 25– 29) • Широкий спектр – Грам отрицательные бактерии • Кроме P. aeruginosa, Proteus,

Фармакокинетика пероральных цефалоспоринов 25

Классификация бета лактамных антибиотиков III. Карбапенемы Имипенем Меропенем Эртапенем Дорипенем IV. Монобактамы Азтреонам

Различия в антимикробной активности меропенема и имипенема • Грамположительные бактерии – Имипенем более активен против энтерококков и пневмококков • Клинического значения не имеет • Грамотрицательные бактерии – Меропенем более активен • Клинически значимое преимущество при инфекциях, вызванных P. aeruginosa • Анаэробные бактерии – Активность и эффективность одинаковая (>клиндамицина и метронидазола)

Больничный формуляр антибиотиков - карбапенемы Имипенем • Госпитальные инфекции Меропенем • Госпитальные инфекции Особые показания: • Менингит • P. aeruginosa

Имипенем/Циластатин (бета-лактамный антибиотик широкого спектра действия) Активен в отношении: • грамположительных аэробных бактерий: Bacillus spp. , Enterococcus faecalis, Erysipelothrix rhusiopathiae, Listeria monocytogenes, Nocardia spp. , Pediococcus spp. , Staphylococcus aureus (включая штаммы, образующие пенициллиназу), Staphylococcus epidermidis (включая штаммы, образующие пенициллиназу), Staphylococcus saprophyticus, Streptococcus agalactiae, Streptococcus pneumoniae, Streptococcus pyogenes, Streptococcus группа C, Streptococcus группа G, зеленящие стрептококки включая альфа и гамма гемолитические штаммы). • грамположительных анаэробных бактерий: Actinomyces spp. , Bifidobacterium spp. , Clostridium spp. (в т. ч. Clostridium perfringens), Eubacter spp. , Lactobacillus spp. , Microaerophilic streptococcus, Mobiluncus spp. , Peptococcus spp. , Peptostreptococcus spp. , Propionibacterium spp. (включая Propionibacterium acne);

Имипенем/Циластатин • Активен в отношении: грамотрицательных аэробных бактерий: Achromobacter spp. , Acinetobacter spp. , Aeromonas hydrophila, Alcaligenes spp. , Bordetella bronchicanis, Bordetella bronchiseptica, Bordetella pertussis, Brucella melitensis, Campylobacter spp. , Capnocytophaga spp. , Citrobacter spp. (в т. ч. Citrobacter diversus, Citrobacter freundii), Eikenella corrodens, Enterobacter spp. (в т. ч. Enterobacter aerogenes, Enterobacter agglomerans, Enterobacter cloacae), Escherichia coli, Gardnerella vaginalis, Haemophilus ducreyi, Haemophilus influenzae (включая штаммы, образующие бета лактамазу), Haemophilus parainfluenzae, Hafnia alvei, Klebsiella spp. (в т. ч. Klebsiella oxytoca, Klebsiella ozaenae, Klebsiella pneumoniae), Moraxella spp. , Morganella morganii (ранее Proteus morganii), Neisseria gonorrhoeae (включая штаммы, образующие пенициллиназу), Neisseria meningitidis, Yersinia spp. , в т. ч. Yersinia multocida, Yersinia enterocolitica, Yersinia pseudotuberculosis; Plesiomonas shigelloides, Proteus spp. (в т. ч. Proteus mirabilis, Proteus vulgaris), Providencia spp. (в т. ч. Providencia alcalifaciens, Providencia rettgeri (ранее Proteus rettgeri), Providencia stuartii), Pseudomonas spp. (в т. ч. Pseudomonas aeruginosa, Pseudomonas fluorescens, Pseudomonas pseudomallei, Pseudomonas putida, Pseudomonas stutzeri), Salmonella spp. (в т. ч. Salmonella typhi), Serratia spp. (в т. ч. Serratia marcescens, Serratia proteamaculans), Shigella spp.

Имипенем/Циластатин • • Активен в отношении: грамотрицательных анаэробных бактерий: Bacteroides spp. (в т. ч. Bacteroides distasonis, Bacteroides fragilis, Prevotella melaninogenica (ранее Bacteroides melaninogenicus), Bacteroides ovatus, Bacteroides thetaiotaomicron, Bacteroides uniformis, Bacteroides vulgatus), Bilophila wadsworthia, Fusobacterium spp. в т. ч. (Fusobacterium necrophorum, Fusobacterium nucleatum), Porphyromonas asaccharolytica (ранее Bacteroides asaccharolyticus), Prevotella bivia (ранее Bacteroides bivius), Prevotella disiens (ранее Bacteroides disiens), Prevotella intermedia (ранее Bacteroides intermedius), Veillonella spp. других микроорганизмов: Mycobacterium fortuitum, Mycobacterium smegmatis. Некоторые Staphylococcus spp. (устойчивые к метициллину), Streptococcus spp. (группа D), Stenotrophomonas maltophilia, Enterococcus faecium и некоторые штаммы Pseudomonas cepacia нечувствительны к имипенему.

МАКРОЛИДЫ 14 - ЧЛЕННЫЕ ЭРИТРОМИЦИН 15 - ЧЛЕННЫЕ (АЗАЛИДЫ) АЗИТРОМИЦИН* 16 - ЧЛЕННЫЕ СПИРАМИЦИН РОКСИТРОМИЦИН* ДЖОЗАМИЦИН КЛАРИТРОМИЦИН* МИДЕКАМИЦИН * - ПОЛУСИНТЕТИЧЕСКИЕ

ОБЩИЕ СВОЙСТВА МАКРОЛИДОВ · · Преимущественно бактериостатическое действие (бактерицидное – против ряда микроорганизмов при высоких концентрациях и низкой микробной плотности) Сходный спектр активности (преимущественно кокки, грам(+) палочки и атипичные возбудители) · Высокие концентрации в органах и тканях · Благоприятный профиль безопасности · Отсутствие перекрестной аллергии с -лактамами · Наличие противовоспалительной, иммуномодулирующей и мукорегулирующей активности

макролиды • • • Активны в отношении: грамположительных бактерий: Streptococcus spp. , Staphylococcus spp. , Listeria monocytogenes, Corynebacterium spp. ; грамотрицательных бактерий: Helicobacter pylori, Haemophilus influenzae, Haemophilus ducreyi, Moraxella catarrhalis, Bordetella pertussis, Neisseria gonorrhoeae, Neisseria meningitidis, Borrelia burgdorferi; анаэробных бактерий: Eubacterium spp. , Peptococcus spp. , Propionibacterium spp. , Clostridium perfringens, Bacteroides melaninogenicus; внутриклеточных микроорганизмов: Legionella pneumophila, Chlamydia trachomatis, Chlamydophila pneumoniae, Ureaplasma urealyticum, Mycoplasma pneumoniae; активен также в отношении: Toxoplasma gondii, не туберкулезных микобактерий (M. avium, M. intracellulare, M. chelonae, , M. fortuitum, M. kensasii).
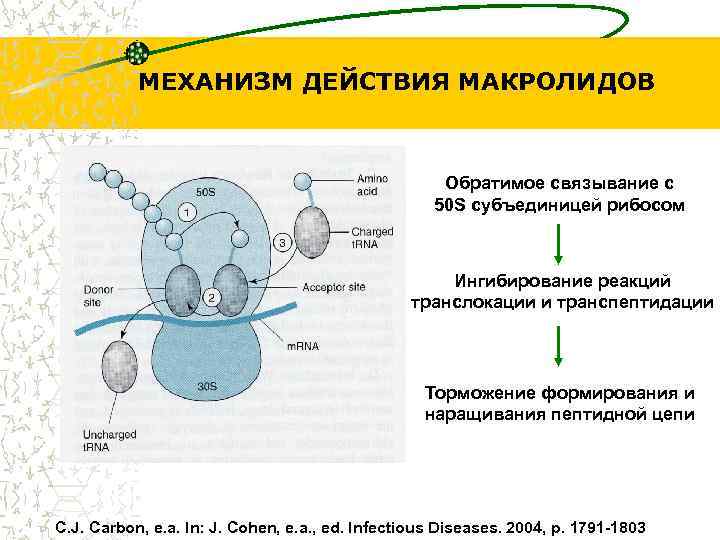
МЕХАНИЗМ ДЕЙСТВИЯ МАКРОЛИДОВ Обратимое связывание с 50 S субъединицей рибосом Ингибирование реакций транслокации и транспептидации Торможение формирования и наращивания пептидной цепи C. J. Carbon, e. a. In: J. Cohen, e. a. , ed. Infectious Diseases. 2004, p. 1791 -1803

ЛЕКАРСТВЕННЫЕ ВЗАИМОДЕЙСТВИЯ МАКРОЛИДОВ Ø Макролиды относятся к ингибиторам микросомальных ферментов печени Ø Наиболее выраженным ингибирующим действием обладают 14 -членные макролиды (эритромицин, кларитро-мицин), наименьшим – 16 -членные) Ø “Последствия” лекарственного взаимодействия концентрации в крови непрямых антикоагулянтов, теофиллина, карбамазепина, вальпроата, дизопирамида, циклоспорина, алкалоидов спорыньи, дигоксина -

Клиническое применение макролидов Основные показания Внебольничная пневмония Урогенитальный хламидиоз и микоплазмоз Легионеллез Эрадикация H. pylori (Клар) Токсоплазмоз (Спир, Клар, Рокс, Азитро) Периодонтит (Спирамицин) Профилактика эндокардита Дифтерия, коклюш

Линкозамиды Линкомицин Клиндамицин

ЛИНКОЗАМИДЫ Линкомицин • преимущественно активен в отношении Гр+ аэробных (стафиллококки, стрептококки, пневмококки) и анаэробных бактерий Клиндамицин проявляет более высокую активность в отношении C. diphtheria, S. Pneumonia, G. vaginalis, U. urealiticum. • В качестве дополнительного ЛС в комбинированной терапии актиномикоза, малярии, токсоплазмоза, дифтерии.

Аминогликозиды Waksmann и Schatz – открытие стрептомицина (1944 г. ) Нобелевская премия за 1949 год

Стрептомицин (Sm) • Антибиотик широкого спектра действия, продуцируемый Actinomyces globisporus streptomycini (griseus), открытый Waksmann, Schatz, Bugie в 1944 г. • Стрептомицин угнетает синтез белков посредством нарушения рибосомной функции в результате связывания со специфическими белками 30 S-субъединицы р. РНК. • Активен в отношении быстро и медленно размножающихся МБТ, расположенных внеклеточно, быстро проникает во внеклеточные компоненты тканей и достигает бактерицидной концентрации в участках туберкулезного воспаления, но крайне слабо проникает через биологические барьеры (клеточную мембрану, ГЭБ, плевру и т. п. ). • Выводится почками за 24 -48 часов.

Аминогликозиды I поколение Стрептомицин - 1944 Применяются по узким Неомицин - 1949 показаниям Канамицин - 1957 II поколение 60 -е годы Гентамицин Тобрамицин 80 -е годы Амикацин Нетилмицин

Аминогликозиды - спектр активности Активны, Активны Эффективны Не активны только in vitro ------------------------------------------Энтеробактерии Микоплазмы Стрептококки P. aeruginosa Haemophilus spp. Энтерококки Стафилококки Легионеллы Анаэробы Микобактерии Сальмонеллы Псевдомонады Шигеллы (кроме P. aeruginosa)

Ото- и вестибулотоксичность аминогликозидов (3% - 15%) • Гентамицин - преобладание вестибулярных расстройств • Канамицин, амикацин, тобрамицин - слуховые расстройства • Предрасполагающие факторы – Концентрация гента, тобра, нетил > 6 - 10 мкг/мл, амика > 16 - 20 мкг/мл – Длительное применение – Наличие ХПН

Нефротоксичность аминогликозидов (12% - 15%) Предрасполагающие факторы • Превышение безопасных концентраций • Дегидратация, гиповолемия, возраст

Аминогликозиды - нейромышечная блокада • Частота усиливается при одновременном применении с анестетиками и миорелаксантами, большим количеством цитратной крови • Усиливают проявления паркинсонизма, миастении.

Особенности аминогликозидов • • • Ограниченная терапевтическая широта Мало предсказуемая индивидуальная фармакокинетика Значимая ото- и нефротоксичность Необходимость контроля функции почек и слуха на фоне лечения Желательность индивидуального мониторинга уровня в крови Показана возможность однократного введения в сутки

Место аминогликозидов в клинике • Как средства монотерапии значение утратили • Кроме зоонозных инфекций • Компоненты комбинированной терапии при – туберкулезе – эндокардитах – инфекциях, вызванные P. aeruginosa – инфекциях при нейтропенических состояниях

Показания для применения аминогликозидов • При амбулаторных инфекциях не показаны • Госпитальные инфекции различной локализации, вызванные энтеробактериями или псевдомонадами в комбинации с бета-лактамами, антианаэробными препаратами или фторхинолонами

РИФАМИЦИНЫ

Рифампицин (R) • Полусинтетический антибиотик широкого спектра действия, синтезирован в 1965 г. , относится к группе рифамицинов, образуемых лучистым грибком Streptomyces mediterranei. • Рифампицин подавляет активность ДНК-зависимой РНК-полимеразы, при этом он не подавляет активность фермента у млекопитающих. • Обладает бактерицидным действием, активен в отношении быстро и медленно размножающихся МБТ, расположенных вне- и внутриклеточно, слабо действует на персиститующие МБТ. • Метаболизируется в печени. • Длительность лечения: не ограничена.

Рифабутин (Rb) • Синтетический аналог рифампицина. • Свойства такие же, как у рифампицина. • Имеется практически полная перекрестная устойчивость с рифампицином (до 95%), связанная с одним и тем же геном – rpo. B. • Длительность лечения: не ограничена. • Препарат выбора при лечении туберкулёза, сочетанного с ВИЧ-инфекцией, при одновременном назначении с АРВП.

Гликопептидные антибиотики • Ванкомицин • Тейкопланин

Показания к применению • Подтвержденные генерализованные инфекции, вызванные метициллинрезистентными Staphylococcus aureus, Staphylocccus spp. • Подтвержденные генерализованные инфекции, вызванные Enterococcus spp. устойчивыми к пенициллину, аминогликозидам (высокий уровень) и ципрофлоксацину • Предполагаемые инфекции, вызванные перечисленными выше микроорганизмами • Дозы – Взрослые 1. 0 каждые 12 ч, или 0. 5 каждые 6 ч – Дети 0 -1 мес. - 15 мг/кг + 10 мг/кг каждые 8 ч >1 мес. - 40 мг/кг/сут через 6 ч.

Побочные эффекты • • • Red neck/red man syndrome (синдром красной шеи ) Гипотония Анафилаксия Псевдомембранозный колит Кожные реакции (от незначительной сыпи до синдрома Стивена Джонса) Лекарственная лихорадка Флебиты Нефротоксичность Ототоксичность

Оксазолидиноны • Линезолид – первый за 20 лет препарат с принципиально новым механизмом действия – Ингибирует биосинтез белка на наиболее ранних стадиях – Отсутствует перекрестная резистентность с актибиотиками других групп

Линезолид (зивокс)

Характеристика антибактериального действия • In vitro – бактериостатик • In vivo – бактерицидное действие – Подавление продукции бактериями факторов вирулентности

Спектр активности линезолида Основное значение • Staphylococcus spp. – Включая оксациллин- и ванкомицинрезистентные штаммы • Enterococcus spp. – Включая ванкомицинрезистентные штаммы Другие бактерии • Streptococcus pneumoniae • Bacillus spp • Corynebacterium spp • Listeria monocytogenes • Mycobacterium tuberculosis • Haemophilus influenzae • Moraxella catarrhalis • Legionella spp. • Bordetella pertussis • Neisseria gonorrhoeae • Анаэробы

Фармакокинетика и дозирование • Максимальные концентрации в сыворотке • • – 12 – 13 мкг/мл Период полувыведения – 4. 5 – 5. 5 ч Биодоступность – 100% Эффективно проникает в ткани Рекомендуемые дозы – 600 мг (в/в или внутрь) – Интревал 12 ч

R ЗИВОКС – ПОКАЗАНИЯ К ПРИМЕНЕНИЮ • • Внебольничная пневмония Госпитальная пневмония Инфекции кожи и мягких тканей Энтерококковые инфекции различных локализаций, включая вызванные резистентными к ванкомицину штаммами Enterococcus faecalis и faecium

Ванкомицин или ленезолид? • Ванкомицин • Линезолид – Обладает лучшей фармакокинетикой и переносимостью – Доступен для приема внутрь

R Зивокс – форма выпуска • • Таблетки, 600 мг № 10 Пакеты для ВВ инфузии, 2 мг/мл, 300 мл Пакеты для ВВ инфузии, 2 мг/мл, 100 мл • Гранулы для приготовления суспензии 20 мг/мл, 150 мл

R ЗИВОКС – ДОЗИРОВКА • Взрослые: ü Внебольничная и госпитальная пневмония – 600 мг в/в или внутрь, каждые 12 часов (10 -14 дней) ü Инфекции кожи и мягких тканей – 600 мг в/в или внутрь, каждые 12 часов (10 -14 дней) ü Энтерококковые инфекции - 600 мг в/в или внутрь, каждые 12 часов (14 -28 дней) • Дети (0 - 12) – 10 мг/кг, каждые 8 часов Инструкция по медицинскому применению препарата Зивокс-таблетки, одобрена Росздравнадзором 13. 01. 2006, инфузионный раствор и суспензия – одобрена ФЛК МЗ РФ 29. 04, пр. № 2 П

Бедаквилин ► Бедаквилин – нитроимидазол, синтезирован в компании Janssen Therapeutics ► Впервые доложен в 2004 году на конференции Американского микробиологического общества. ► Бедаквилин уничтожает МБТ путём воздействия на фермент АТФ-синтазу, который необходим для энергообеспечения клеток. С 14 Н 12 F 3 N 3 O 5 ► 31. 12. 2012 г. FDA (US Food and Drug Administration) одобрила бедаквилин в качестве ПТП, только после проведения 2=х рандомизированных плацебо контролируемых клинических исследованиях бедаквилина с участием 440 (по 220 пациентов) больных туберкулёзом лёгких с ЛЧ и ЛУ МБТ.

Проблемы связанные с P. aeruginosa • • • Актуальный нозокомиальный патоген Вариабельность тяжести течения инфекций – Колонизация – Нозокомиальная пневмония – до 40% летальности Природная и приобретенная устойчивость

Антибиотики, применяемы для лечения инфекций, вызванных P. aeruginosa • Бета-лактамы – Полусинтетические пенициллины • Карбоксипенициллины • Уреидопенициллины • • • Цефалоспорины III – IV поколений Карбапенемы Аминогликозиды Фторхинолоны Полимиксин

I II III IV Пероральные ФХ с ограниченными показаниями (инфекция МВП) Норфлоксацин Пефлоксацин Системные ФХ с широкими показаниями Офлоксацин Ципрофлоксацин ФХ с улучшенной активностью против Левофлоксацин грам(+) и атипичных возбудителей Спарфлоксацин ФХ с улучшенной активностью против Моксифлоксацин (Авелокс) грам(+), атипичных возбудителей и анаэробов * в порядке увеличения активности in vitro

Механизм действия фторхинолонов Топоизомераза IV (par. C, par. E) Фторхинолоны блокируют 2 фермента со строго определенными функциями, блокируя ДНК репликацию. ДНК - гираза (gyr A, gyr B)

Пути оптимизации антибиотикотерапии • • • Ротация антибиотиков Деэскалационная терапия Деконтаминация ЖКТ (аминогликозиды, ко-тримоксазол, фузидин, полимиксин) • Пролонгированная инфузия антибиотиков (карбапенемы, цефтазидим, цефепим)

СТУПЕНЧАТАЯ ТЕРАПИЯ Госпитализация переход на прием препарата внутрь выписка из стационара в/в введение Лечение в стационаре прием внутрь излечение Лечение на дому Ramirez J. , 1995

СТУПЕНЧАТАЯ ТЕРАПИЯ. ЭКОНОМИЧЕСКИЕ ПРЕИМУЩЕСТВА § Сокращение сроков пребывания в стационаре § Меньшая стоимость пероральной лекарственной формы § Уменьшение затрат на парентеральное введение (расходные материалы) § Уменьшение затрат рабочего времени средним медицинским персоналом § Минимизация риска развития постинъекционных осложнений и нозокомиальных инфекций, т. е. снижение затрат на их лечение

Безопасность антимикробных средств § Нежелательные реакции на антимикробные средства у взрослых и детей превышают по количеству НР на все другие ЛС 1 У госпитализированных больных НР антибиотиков сопоставляют примерно 25 -30% `всех НР 2 § Лечение одной нефротоксической реакции, развивающейся применении аминогликозидов и ванкомицина, обходится в США в 2500 долларов (в ценах 1990 г. )2 Leape LL, et al. N Engl J Med. 1991; 324: 377– 384. Weiss J, et al. Pediatrics 2002; 110: 254 -7 2 Beranger PM, et al. Pharmacoeconomics 1998, 13, (1), 35 -49 1

Фармакотерапевтические группы, о НР которых наиболее часто сообщали российские специалисты здравоохранения в 2008 г.

НР, требующие медицинской помощи применении различных лекарственных средств (США, 2004– 2005 гг. ) Группа или ЛС Число случаев за год Частота НР, % Инсулины 1577 8, 0 Варфарин 1234 6, 2 Амоксициллин Аспирин 1022 473 4, 3 2, 5 N Триметоприм/сульфаме 447 токсазол Цефалексин 293 2, 2 Пенициллин 293 1, 5 Амоксициллин/клавула нат 274 1, 3 Азитромицин 255 1, 3 1, 5 Левофлоксацин 230 1, 2 Стецюк О. У. и соавт. КМАХ 2011, Том 13, № 1, Budnitz D. S. , 2006; 296: 1858

Факторы риска нежелательных реакций лекарственных средств § Доза: ü большинство нежелательных эффектов ЛС § § • относятся к реакциям типа A и являются предотвратимыми Изменения фармакокинетики (генетические, возрастные, обусловленные сопутствующими патологическими и физиологическими состояниями) Взаимодействия с другими ЛС, пищей и алкоголем заболеванием Женский пол Пожилой и детский возраст Лекарственная форма и путь введения

Основные виды НР антибактериальных препаратов § § § § Аллергические Желудочно кишечные Гепатотоксические Нефротоксические Нейротоксические Гематотоксические Кардиотоксические Поражения опорно двигательного аппарата

Аллергические реакции § Наиболее часто, в том числе серьезные, - пенициллины (гиперчувствительность примерно у 10% населения), другие бета-лактамные антибиотики § частота анафилактических реакций– 0, 004– 0, 015% Shehab N, et al. Clin Infect Dis. 2008; 47: 735 -743

Аллергические реакции на цефалоспорины § Ннаиболее часто проявляется эозинофилией (3 § § § – 8%) макулопапулезными высыпаниями (1– 3%) лекарственной лихорадкой (2%) положительной реакцией Кумбса (1– 2%). Реже: крапивница, сывороточноподобные реакции и анафилаксия (0, 0001– 0, 1%). цефтриаксон > цефоперазон > цефокситин> цефтазидим > цефотаксим > цефуроксим Вероятность развития перекрестных реакций на цефалоспорины у пациентов с аллергией на пенициллин наиболее высока для цефалоспоринов I поколения (10– 15%) и минимальна (1– 2%) для препаратов III–IV поколения. Стецюк О. У. и соавт. КМАХ 2011, Том 13, № 1, с. 67 -84. Thompson J. W. , Jacobs R. F. Drug Saf. 1993; 9: 132 -42.

Аллергические реакции (Ко тримоксазол) § Часто реакции со стороны кожи § § (фиксированная эритема, крапивница, отек Квинке, узловатая эритема, аллергический васкулит) – до 3, 5% пациентов По способности вызывать серьезные кожные реакции (многоформная экссудативная эритема, синдром Стивенса–Джонсона, токсический эпидермальный некролиз) превосходит все применяемые в настоящее время антибактериальные средства. По частоте обращаемости в расчете на 1000 назначений антибактериальных средств превосходил пенициллины как по частоте в целом, так и по частоте серьезных р-ций (2, 8 / 8, 4 % против 2, 2 / 7, 6 %) Относительный риск развития синдрома Стивенса–Джонсона и токсического эпидермального некролиза применении К. в 12 раз выше, чем при использовании цефалоспоринов и в 16 раз - фторхинолонов Дискразии крови Стецюк О. У. и соавт. КМАХ 2011, № 1, с. 67 -84 .

Аллергические реакции на фторхинолоны § Преимущественно кожные у 0, 5– 3% пациентов § Реакции фотосенсибилизации – наиболее часто спарфлоксацин (в 11 раз чаще чем ципрофлоксацин) и ломефлоксацин Henry DC, et al. Clin Ther 1999; 21: 966 81. Lipsky B. A. , Baker C. A. Clin Infect Dis. 1999; 28: 352 64.

Аллергические реакции на макролиды § Аллергические реакции применении макролидов отмечаются очень редко (обычно крапивница и макулопапулезные экзантемы) § Перекрестная аллергия к нескольким макролидам не описана. Demoly P, et al. Presse Med. 2000; 29(6): 321 6.

ПРИМЕНЕНИЕ ЛС ВО ВРЕМЯ БЕРЕМЕННОСТИ § По данным зарубежных исследований, антибактериальные средства принимают от 17 до 50% женщин. . Pharmacoepidemiol Drug Saf. 2006 May; 15(5): 327 -37

ПРИМЕНЕНИЕ ЛС ВО ВРЕМЯ БЕРЕМЕННОСТИ (РОССИЯ) § Многоцентровое ретроспективное § § § § исследование (18 консультаций в 6 городах) с участием 543 беременных женщин: Среднее число ЛС - 11 ± 5, 3 (от 1 до 26), В I триместре 72% женщин - 3, 2± 1, 9 ЛС (от 1 до 16) Системные антибактериальные ЛС – 21, 5%, местные антибактериальные ЛС – 50, 3% Макролиды -14, 4% Пенициллины – 7, 6% Нитрофураны – 4, 1% Нитроимидазолы – 3, 1% Е. А. Стриженок, и соавт. КМАХ, 2007; 9(2): 162

Современная фармакотерапия грибковых заболеваний

В настоящее время в мире используется более 50 различных противогрибковых средств для местного и системного применения • Полиеновые антигрибковые препараты – детергенты: нистатин, амфотерицин B, натамицин (5) • Азолы и триазолы – ингибиторы деметилазы: миконазол, клотримазол, кетоконазол, итраконазол, флуконазол, вориконазаол, эконазол (19) • Аллиламины – ингибиторы сквален эпоксидазы: тербенафин, нафтифин, бутенафин (5) • Эхинокандины – ингибиторы глюкан-синтазы: микафунгин, капсофунгин, анидулафунгин (3) • Прочие: флуцитозин, гризеофульвин, циклопирокс (18)

Эволюция противогрибковых средств 1950 – 1960 Нистатин Амфотерицин В Гризеофульвин 1950 – 1960 Флуцитозин 1970 … Азолы и триазолы Азольные антимикотики наименее токсичны, характеризуются широким спектром действия, к ним редко формируется резистентность, большинство препаратов может использоваться и для местного и для системного применения

Лечение глубоких микозов Аспергиллез Бластомикоз Кокцидиомикоз Криптококкоз Гистоплазмоз Сист. Канд. Итраконазол + +- + + Дифлюкан +- +- + ++ Вориконазол + Амфотерицин B + ++ + +

Лечение поверхностных микозов Дерматомикозы Местно Кандидамикозы Системно Местно Миконазол + + Клотримазол + + Кетоконазол + + Системно + Итраконазол + + Дифлюкан + + Бутоконазол + Тиоконазол + Эконазорл + + Нистатин + Натамицин + Тербинафин + Гризеофульвин + +

Спустя много лет Дифлюкан остается препаратом 1 линии при лечении микозов, вызываемых инвазивными Candida spp. Включая пациентов с нейтропенией и иммуносупрессией 129 World Health Organization. Guidelines for the management of sexually transmitted infections.

(мг/л) Средняя концентрация в плазме Пища не влияет на всасывание Дифлюкан Прием 50 мг флуконазола Натощак После еды 1, 00 0, 75 0, 50 0, 25 0 10 20 30 40 50 60 70 Время после приема (час)

Фармакокинетика Дифлюкана q Высокая биодоступность (>90 %) q Низкое связывание с белками плазмы (<12 %) q Хорошо проникает в различные ткани и жидкости тела, в т. ч. слизистую влагалища и вульвы q Выводится в основном с мочой (80 %) в неизменном виде q Длительный период полувыведения из плазмы (около 30 часов) q Однократный прием Дифлюкана в дозе 150 мг для лечения острого вагинального кандидоза

Кандидоз: Дифлюкан VS Нистатин Параметры Нистатин Дифлюкан (флуконазол) Способ применения Местно, приеме внутрь 150 мг (1 капс. ) внутрь – не всасывается Показания Кандидоз кишечника Любые грибковые поражения Биодоступность При приёме внутрь – менее 30% Более 90%, не зависит от приёма пищи

Открытие ацикловира – новая эпоха в терапии герпетической инфекции – Создание ацикловира (Зовиракс) в 1974 г. (Глаксо Вэлком) – новая эпоха противовирусной терапии – Нобелевская премия по медицине – Гертруда Элион (1988 г. ) – 1987 г. – создание валацикловира (Валтрекс)

Лечение герпетической инфекции 1. Аномальные нуклеозиды Ацикловир 200 мг 5 раз/сутки Валацикловир 500 мг 2 раза/сутки Фамцикловир 250 мг 3 раза/сутки Панавир 5 мл в/в № 5 (интервал между инъекциями 48 ч) 2. Интерфероны Гиаферон суппозит. 500. 000 МЕ на ночь 10 дней Виферон суппоз. 1. 500. 000 МЕ ректально или вагинально 3. Индукторы интерфероногенеза Циклоферон 12, 5% 2 мл в/м № 10 Аллокин альфа 1 мг п/к № 6 Ридостин 8 мг п/к или в/м через день Иммунофан 0, 005% п/к или в/м через день 4. Специфические иммуноглобулины Имууноглобулин нормальный человеческий 3 мл в/м № 5 10 Интраглобин 25 50 мл в/в № 3 10 Цитотек 5 мл в/в № 3 6 5. Наружные противовирусные препараты ацикловир, панавир, тромонтадин, фенистил пенцивир, виферон, эпиген спрей, алпизарин

Что день грядущий нам готовит? Новые возможности антибактериальной терапии


Этапы создания новых ЛС Потерянные годы патентной защиты Эффективный срок патентной защиты ФАЗА IV Клин. иссл-ия Пост-Маркетинг FDA Регистр-ия 1 -2 года ФАЗА III Клин. иссл-ия 1 -2 года ФАЗА II Клин. иссл-ия 3 -4 года ФАЗА I Клин. иссл-ия 2 -3 года Доклинические исследования 3 -5 лет Разработка Препарат может длиться десятилетиями • 1 000– 3 000 пациентов-добровольцев для изучения безопасности и эффективности • Отсев: 13. 2%* • 100 – 500 пациентов-добровольцев для изучения эффективности и краткосрочных рисков • Отсев: 38. 8%* • 20 – 100 здоровых добровольцев для исследования безопасности • Отсев: 25%* • Поиск нового действующего вещества • Химический синтез и начальные исследования для выявления активного фармакологического компонента • Выбор лекарственной формы и тестирование на стабильность * - разработка 77% ЛС прекращается на стадии клинических исследований Reichert IM, Milne CP; 2002

Количество новых АБП, одобренных FDA Общее количество АБП

Новые анти-MRSA антибиотики: зачем нам столько? § Линезолид § Даптомицин § Тигециклин § Цефтаролин §…

Проблемы ванкомицина § Большая вариабельность фармакокинетики (доля свободного ванкомицина может составлять от 12 до 100% от введенной дозы) Berthoin K. , et al. Int J Antimicrob Agents, 2009. 34 (6): p. 555 -60 § Повышение дозы ванкомицина не приводит к повышению эффективности § Jeffres M. N. et al. Chest, 2006, 130 (4): p. 947 -955 ?

Линезолид: за и против § Лучше проникновение в ткани по сравнению с ванкомицином (особенно в легочную) Stein G. E. et al. Curr. Med. Res. Opin. , 2010. 26 (3): p. 571 -588 § Устойчивость фармакокинетики у пациентов с тяжелым сепсисом и септическим шоком Buerger C. et al. Antimicrob. Agents Chemother. , 2006. 50(7): p. 2455 -63 § Замедление собственного метаболизма в результате ингибирования синтеза белка в в митохондриях повышение плазменной концентрации и риска токсичности Di Paolo A. , et al. Clin Pharmacokinet. , 2010. 49 (7): p. 439 -47

Тигециклин § Широкий спектр § Большой объем распределения (7 10 л/кг) и хорошее проникновение в ткани, в т. ч. внутрь клетки Ong C. T. et al. J Antimicrob. Chemother. , 2005. 56 (3): p. 498 -501

Даптомицин: за и против § Низкий объем распределения § Связывание с белками – 92% § НО!!! Тканевая концентрация составляет от 70 до 90% от плазменной (С> MIC для стафилококка и стрептококка в течение 24 часов), не изменяется у пациентов с диабетом Kim A. et al. Antimicrob Agents Chemother. , 2008. 52(11): p. 3941 -6

Цефтаролин: новый цефалоспорин с расширенной Гр+ активностью § § § No cases of CAP due to MRSA were enrolled in the CAP studies. There is no clinical evidence to support the activity of ceftaroline against MRSA CAP Zhanel GG et al. Drugs 2009; 69: 809– 831. MRSA, methicillin resistant Staphylococcus aureus

Сравнительные характеристики новых анти-MRSA препаратов Препарат 1 Цефтаролин Ванкомицин Линезолид Даптомицин Тигециклин Класс антибиотика Бета лактам Гликопептид Оксазолидион Циклический липопептид глицилциклин Показание о. ИКМТ + +/ (ИКМТ)* + + + Бактерицидное действие + + / (медленное 2) бактериостатик ++ ( включая ацинетобактер) + Грамотрицатель (кроме ная активность неферментеров) +++ ++ нефро , (свойственная миелосупрессия, гепатотокичночно гепатотоксичность, Переносимость нефротоксичность цефалоспоринам) тромбоцитопения сть панкреатит Данные по ран. клин. ответу + * - Клиническая эффективность ванкомицина при инфекциях, вызванных MRSA, достоверно связана с МПК возбудителя в пределах зоны чувствительности (S. J. van Hal. Clinical Infectious Diseases 2012; 54(6): 755– 71. ) 1. Инструкции по медицинскому применению препаратов Зинфоро, Эдицин, Зивокс, Кубицин, Тигацил. Электронный ресурс МЗ РФ http: //grls. rosminzdrav. ru/GRLS. aspx (по данным на 08/2013) 2. Catherine Liu. Clinical Infectious Diseases 2011; 1– 38
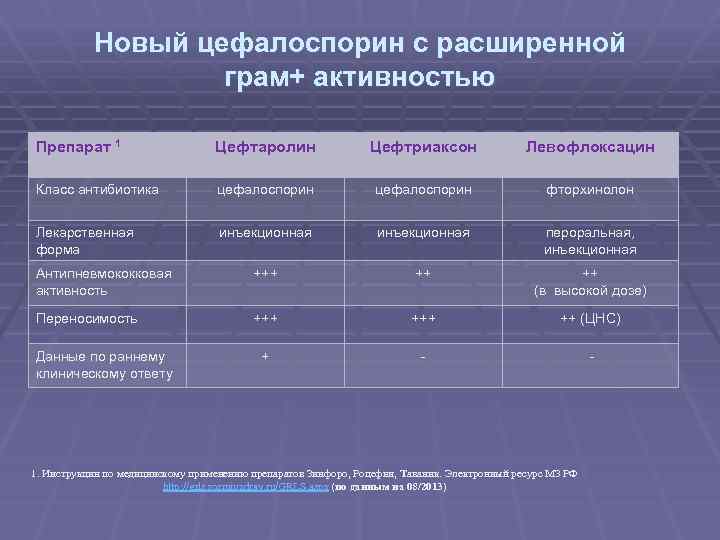
Новый цефалоспорин с расширенной грам+ активностью Препарат 1 Цефтаролин Цефтриаксон Левофлоксацин Класс антибиотика цефалоспорин фторхинолон Лекарственная форма инъекционная пероральная, инъекционная Антипневмококковая активность +++ ++ ++ (в высокой дозе) Переносимость +++ ++ (ЦНС) + Данные по раннему клиническому ответу 1. Инструкции по медицинскому применению препаратов Зинфоро, Роцефин, Таваник. Электронный ресурс МЗ РФ http: //grls. rosminzdrav. ru/GRLS. aspx (по данным на 08/2013)

Что на горизонте? § Макроциклические антибиотики § Неогликозиды § Хинолоны § Оксазолидиноны § Кетолиды § Тетрациклины § Новые гликопептиды §…

Фидаксомицин § первый представитель класса макроциклических антибиотиков § узкий спектр активности, действует только на патогенные бактерии, обладает мощной бактерицидной активностью в отношении C. difficile § фидаксомицин превосходит ванкомицин в лечении рецидивов инфекции ЖКТ, вызванной Clostridium difficile 50 th Interscience Conference on Antimicrobial Agents and Chemotherapy (ICAAC): Abstract L 1 -1305. Presented September 13, 2010.

Неогликозиды § Плазмомицин – устойчив к действию бактериальных § § § энзимов, разрушающих гентамицин 1 Синергизм в отношении MRSA при сочетании с даптомицином и цефтобипролом, в отношении Ps. аeruginosa при сочетании с цефепимом, дорипенемом и пиперациллином/тазобактамом 2 Наименьшая МПК в отношении Acinetobacter среди всех аминогликозидов 3 У здоровых добровольцев не было отмечено ото и нефротоксичности 4 1. Bush K. et al. Biochem Pharmacol. 2011, 82: 1528 -1539 2. Zhanel G. G et al. Anti Infect Ther. 2012; 10: 459 -73 3. Landman D. et al. J Antimicrob Chemother. 2011; 66: 332 -4 4. Cass R. T. et al. Antimicrob Agents Chemother. 2011; 55: 5874 -80

Хинолоны Делафлоксацин – фторхинолон с активностью в отношении MRSA § Сохраняет активность в средах с кислой p. H (мочевые пути, фагосомы) § Аффинность в отношении бактериальной ДНК гиразы, в 50 раз выше, чем по отношению к топоизомеразе II человека § Низкая способность к селекции резистентных MRSA 1 Немоноксацин – нефторированный хинолон с гр+ активностью (≈ левофлоксацин при лечении ВП)2 § Антибактериальная активность немофлоксацина in vitro выше чем у ципрофлоксацина и левофлоксацина против различных штаммов стафилококков, стрептококков, энтерококков, Neisseria gonorrhoeae, Haemophilus influenzae. Активность TG 875649 сопоставима или выше чем у моксифлоксацина в отношении MRSA и левофлоксацин резистентных S. pneumoniae. ACH 702 – топический изотиазолхинолон с активностью в отношении MRSA (в т. ч. в биопленках), а также M. tuberculosis 1. Lemaire S. et al. Antimicrob Agents Chemother 2011; 55: 649 -58 2. Van Rensburg D. J. et al. Antimicrob Agents Chemother 2010; 54: 4098 -106

Оксазолидиноны Тедизолид и радезолид – MIC в отношении стафилококков, стрептококков и энтерококков ниже, чем у линезолида § Преодолевают резистентность к линезолиду § Тедизолид активен в отношении S. aureus, продуцирующих ген cfr § Клиническая эффективность 95% в РКИ II фазы (о. ИКМТ), режим введения per os § Радезолид создает высокие концентрации в макрофагах и нейтрофилах1, 2 Сутезолид – высокая антимикобактериальная активность3 1. Lemaire S. et al. Antimicrob Agents Chemother. 2010; 54: 2549 -59 2. Lemaire S. et al. Antimicrob Agents Chemother. 2010; 54: 2540 -8 3. Williams K. M. et al. Antimicrob Agents Chemother. 2009; 53: 1314 -19

Новые ингибиторы β-лактамаз Авибактам (NXL 104) – широкий спектр ингибирующей активности, включая KPC § Перспективные комбинации – цефтазидим/авибактам и цефтаролин/авибактам § В исследованиях in vitro установлено, что комбинация NXL 104 и цефалоспоринов снижает МПК Enterobacter spp. и Klebsiella spp. с 4 до < 1 мг/л. Комбинация NXL 104 + цефтазидим была эффективна против инфекции, вызванной K. pneumoniae, в том числе и штаммами, продуцирующими бета лактамазы Amp. C и карбапенемазы. Gould I. M. et al. Virulence 2013; 4: 2, 185–

Кетолиды § Цетромицин – 16 членный макролид, одобрен FDA как средство для лечения сибирской язвы и чумы § Солитромицин – препарат с гр+ и гр активностью, клинически эффективен в лечении ИКМТ и ВП Gould I. M. et al. Virulence 2013; 4: 2, 185– 191

Гликопептиды Телаванцин и оритаванцин – эффективны в отношении VRE и VRSA § Оритаванцин назначается 1 раз в сутки Gould I. M. et al. Virulence 2013; 4: 2, 185– 191

Антимикробные пептиды § Маленькие амфифильные молекулы, состоящие из 12 50 § § § аминокислотных остатков Вещества с плейотропной активностью, сочетающей антимикробную активностью с действием на ангиогенез, иммуномодуляцию и обладающие противовоспалительной активностью У млекопитающих идентифицировано более 500 АМП Продукция АМП может быть как конститутивной, так и индуцибельной. Синтез АМП индуцируется преимущественно патоген ассоциированными молекулярными структурами (РАМР) инфекционных агентов и цитокинами (IL 1 b, IL 8/CXCL 8, TNF a и другими) http: //aps. unmc. edu/AP/database/anti. F.

Классификация АМП Oyston P. C. et al. J. Med Microbiol. 2009, 58: 977 -987

Динамика количества публикаций по дефензинам

Антивирулентные факторы § Действуют только на повреждающие факторы § Не оказывают влияние на колонии микроорганизмов, не продуцирующих факторы вирулентности (нормальная микрофлора) § Не оказывают влияние на патогенные штаммы в покое (индукция собственного иммунного ответа)

Ингибиторы адгезии Адгезия E. coli на уротелии: § 70 100% пиелонефрит, бактериемия § 50 60% цистит § 22 30% бессимптомная бактериурия Снижение способности UPEC к адгезии – пилициды (FN 075 и Bib. C 6) Cegefski L. et al. Nat. Chem. Biol. 2009, 5: 913 -919

Антибиотики и эссенциальные масла Yap P. S. X. et al. Open Microbiol J. , 2014; 8: 6 -14

Потенциальные мишени воздействия Yap P. S. X. et al. Open Microbiol J. , 2014; 8: 6 -14


БЛАГОДАРЮ ЗА ВНИМАНИЕ!
лекция АБ.ppt