КЛАСТЕРЫ И КЛАТРАТЫ!!2003.ppt
- Количество слайдов: 17

Кластеры и Клатраты Выполнила работу: Асланян Ирина 4 курс, 43 -хим. Преподаватель: Шалыгин Сергей Петрович

Кластеры На стыке ряда областей науки (неорг. химии, катализа, коллоидной химии, физикохимии ультрадисперсных систем) сложилось новое научное направление - химия кластеров. Понятие "кластеры" пока не имеет четкой определенности и иногда используется для обозначения совершенно разных систем. Кластеры- группы близко расположенных, тесно связанных друг с другом атомов, молекул, ионов, иногда ультрадисперсные частицы. Кластеры- многоядерные комплексные соединения с металлическим каркасом в лигандных оболочках. Материалы, содержащие кластеры, наз. кластерными материалами. Кластерные соединения наиболее изучены, как кластерные соединения металлов. Их молекулы содержат окруженный лигандами остов (ячейку) из атомов металлов, находящихся на расстояниях (не более 0, 35 нм), допускающих прямое взаимодействие металл-металл.
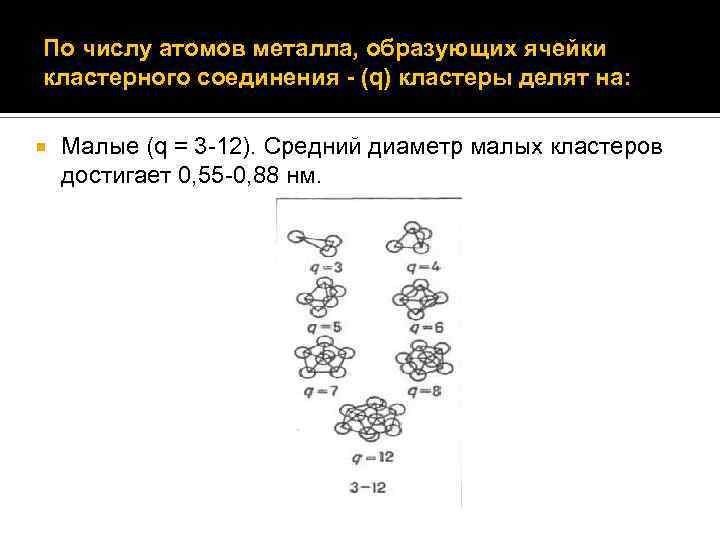
По числу атомов металла, образующих ячейки кластерного соединения - (q) кластеры делят на: Малые (q = 3 -12). Средний диаметр малых кластеров достигает 0, 55 -0, 88 нм.

Средние (q = 13 - 40) и Крупные (q = 41 – 100 ) Диметр этих кластеров достигает 0, 8 -2, 0 нм.
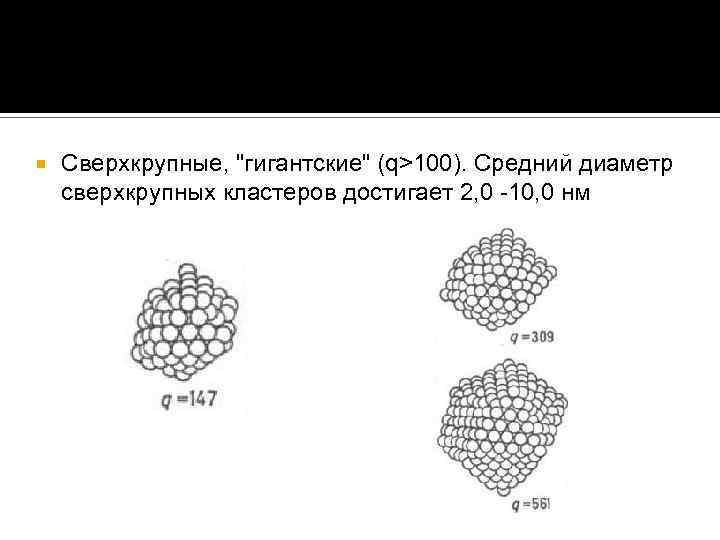
Сверхкрупные, "гигантские" (q>100). Средний диаметр сверхкрупных кластеров достигает 2, 0 -10, 0 нм

Кластерные соединения характерны как для переходных металлов, так и для многих непереходных. Известны гомометаллические кластеры, остов которых состоит из атомов одного металла, и гетерометаллические кластеры, содержащие в остове атомы двух, трех и более металлов.

Название простейших кластеров строятся в соответствии с номенклатурными правилами ИЮПАК для координационных соединений, напр. : [Со 6 С(СО)14]- - карбидогекса-m-карбонил-октакарбонил-полиэдрогексакобальт(1 -)-ион; Ru 4 CO 12(C 2 Ph 2)-дифенилацетилен-клозо-тетракис(тикарбонилрутений). Однако в связи с большой сложностью таких названий и трудностями, возникающими при использовании тех же правил для кластеров с большей нуклеарностью, кластеры обычно обозначают структурными формулами. Электронное строение, теория хим. связи в кластерных соед. находится в стадии разработки.

Типичное кластерное соединение Фуллерен- молекулярное соединение, принадлежащее классу аллотропных форм углерода и представляющее собой выпуклые замкнутые многогранники, составленные из чётного числа трёхкоординированных атомов углерода. Своим названием фуллерены обязаны инженеру и дизайнеру Ричарду Бакминстеру Фуллеру
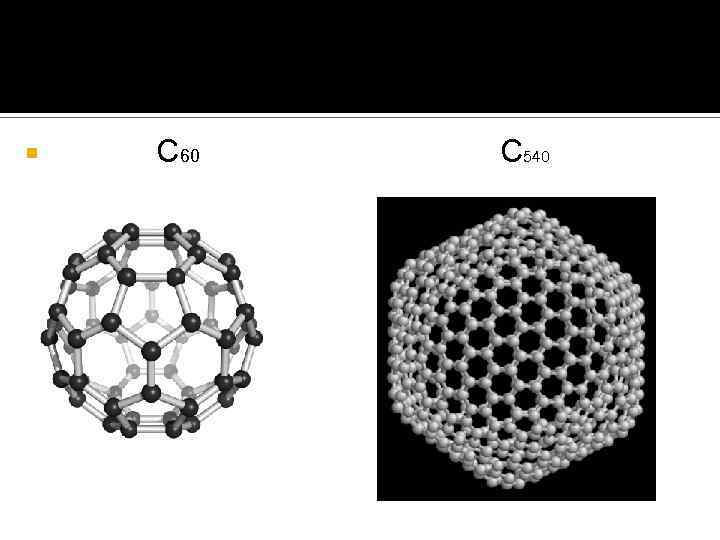
С 60 С 540

Клатраты Клатраты- это соединение, в котором молекулы одного сорта ( «гости» ) заключены в полости, образованные молекулами другого сорта ( «хозяевами» ).
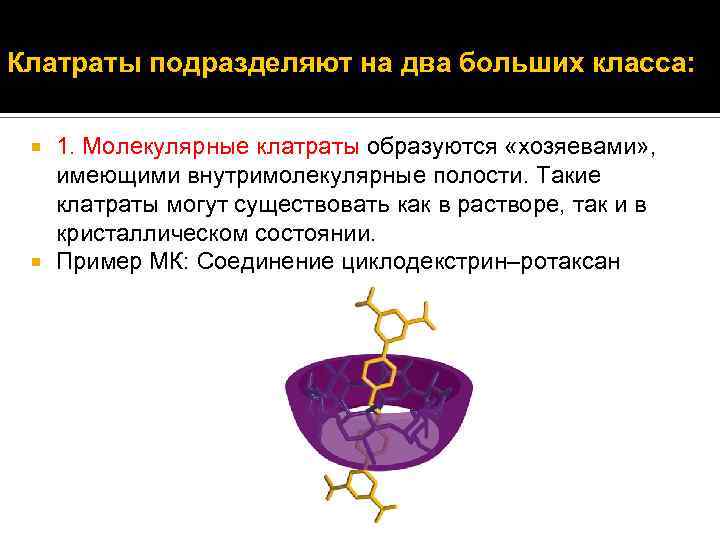
Клатраты подразделяют на два больших класса: 1. Молекулярные клатраты образуются «хозяевами» , имеющими внутримолекулярные полости. Такие клатраты могут существовать как в растворе, так и в кристаллическом состоянии. Пример МК: Соединение циклодекстрин–ротаксан

Молекулярные клатраты подразделяются на: 1) кавитаты, имеющие полость в виде канала или клетки. например: амилаза с I 2 2) адикулаты, у которых полость напоминает корзину.
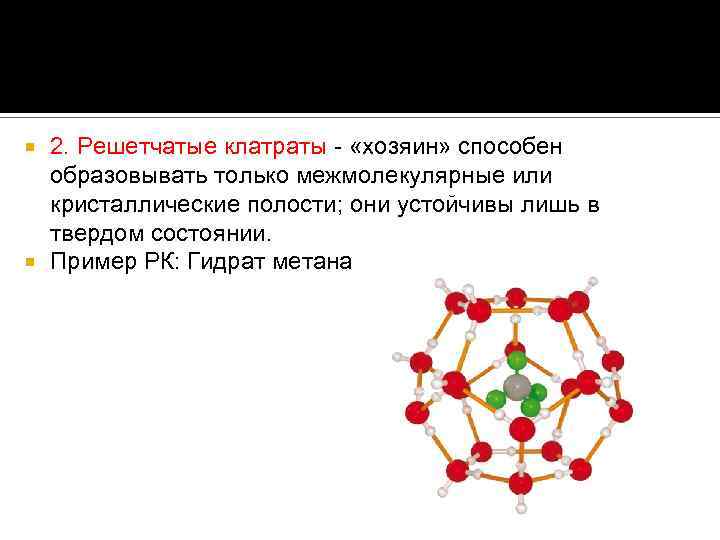
2. Решетчатые клатраты - «хозяин» способен образовывать только межмолекулярные или кристаллические полости; они устойчивы лишь в твердом состоянии. Пример РК: Гидрат метана
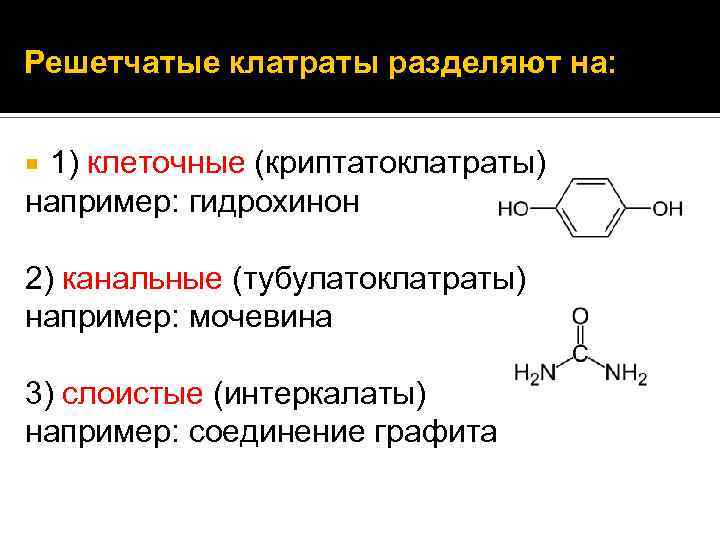
Решетчатые клатраты разделяют на: 1) клеточные (криптатоклатраты) например: гидрохинон 2) канальные (тубулатоклатраты) например: мочевина 3) слоистые (интеркалаты) например: соединение графита

В любых клатратах между «хозяевами» и «гостями» образуются слабые межмолекулярные связи - водородные. Клатраты — нестехиометрические соединения, в которых соотношение между числом молекул «гостя» и «хозяина» не обязательно целое. например: Cl 2· 5, 75 H 2 O.

Важный пример решетчатого клатрата — гидрат метана, в котором молекулы метана заключены в пустоты кристаллической решетки льда. Это соединение широко распространено в природе; запасы метана на дне океанов, вероятно, значительно превышают запасы газа в свободном состоянии.

Образование клатратов используется в хроматографии, для хранения газов и высокотоксичных веществ, опреснения морской воды и разделения соединений, близких по свойствам, но отличающихся геометрией молекул, например, цистранс-углеводородов. В последнее время активно исследуется возможность применения клатратов на основе воды и металлоорганических каркасов для аккумулирования и хранения водорода.
КЛАСТЕРЫ И КЛАТРАТЫ!!2003.ppt