презент КЛАССЫ ( ВСЕ!!!!).ppt
- Количество слайдов: 70
 Классы неорганических соединений
Классы неорганических соединений
 Степень окисления элемента • Степень окисления (ст. ок. ) – условный заряд атома элемента в соединении. • Степень окисления может быть нулевой, положительной и отрицательной. • Степень окисления атомов в простых веществах всегда равна 0. • Обозначение С 0, О 20
Степень окисления элемента • Степень окисления (ст. ок. ) – условный заряд атома элемента в соединении. • Степень окисления может быть нулевой, положительной и отрицательной. • Степень окисления атомов в простых веществах всегда равна 0. • Обозначение С 0, О 20
 Степень окисления атомов элементов в сложных веществах • может быть постоянной и переменной. • Постоянная степень окисления атомов элементов • Катионы: Li+; Na+; K+; Rb+; Cs+; Ag+; Be 2+; Mg 2+; Ca 2+; Sr 2+; Ba 2+; Zn 2+; Cd 2+; Al 3+ • Анионы: F-; S 2 -
Степень окисления атомов элементов в сложных веществах • может быть постоянной и переменной. • Постоянная степень окисления атомов элементов • Катионы: Li+; Na+; K+; Rb+; Cs+; Ag+; Be 2+; Mg 2+; Ca 2+; Sr 2+; Ba 2+; Zn 2+; Cd 2+; Al 3+ • Анионы: F-; S 2 -
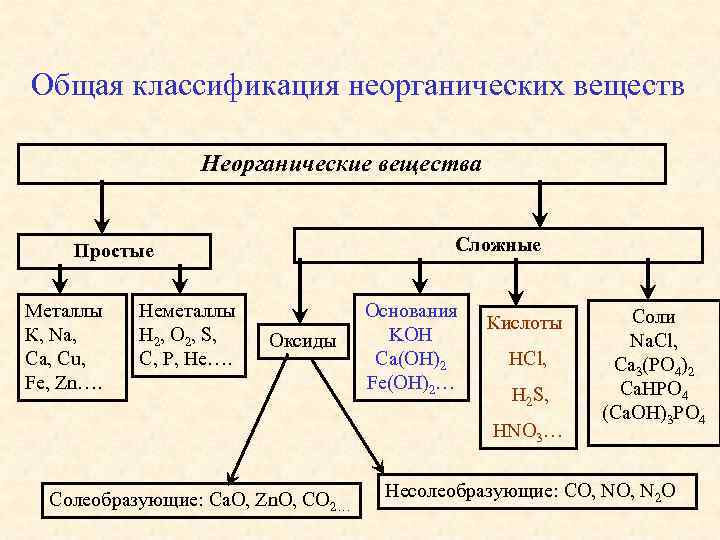 Общая классификация неорганических веществ Неорганические вещества Сложные Простые Металлы К, Na, Cu, Fe, Zn…. Неметаллы H 2, O 2, S, C, P, He…. Оксиды Основания KOH Ca(OH)2 Fe(OH)2… Кислоты HCl, H 2 S, HNO 3… Солеобразующие: Са. О, Zn. O, CО 2… Cоли Na. Cl, Ca 3(PO 4)2 Ca. HPO 4 (Ca. OH)3 PO 4 Несолеобразующие: CO, N 2 O
Общая классификация неорганических веществ Неорганические вещества Сложные Простые Металлы К, Na, Cu, Fe, Zn…. Неметаллы H 2, O 2, S, C, P, He…. Оксиды Основания KOH Ca(OH)2 Fe(OH)2… Кислоты HCl, H 2 S, HNO 3… Солеобразующие: Са. О, Zn. O, CО 2… Cоли Na. Cl, Ca 3(PO 4)2 Ca. HPO 4 (Ca. OH)3 PO 4 Несолеобразующие: CO, N 2 O
 Оксиды. Определение. Оксиды – это сложные вещества, состоящие из атомов двух элементов, один из которых кислород в степени окисления «-2»
Оксиды. Определение. Оксиды – это сложные вещества, состоящие из атомов двух элементов, один из которых кислород в степени окисления «-2»
 общая формула оксида • Э 2+х. Ох-2 • «+х» – степень окисления элемента • «-2» – степень окисления кислорода
общая формула оксида • Э 2+х. Ох-2 • «+х» – степень окисления элемента • «-2» – степень окисления кислорода
 Оксиды. Номенклатура. «Оксид» + название элемента, образующего оксид в родительном падеже + в скобках римскими цифрами валентность, если для элемента она может быть переменной:
Оксиды. Номенклатура. «Оксид» + название элемента, образующего оксид в родительном падеже + в скобках римскими цифрами валентность, если для элемента она может быть переменной:
 Например Са. О – оксид кальция, СО – оксид углерода (II), CO 2 – оксид углерода (IV).
Например Са. О – оксид кальция, СО – оксид углерода (II), CO 2 – оксид углерода (IV).
 Примеры. • Запишите формулы оксидов : оксид железа (II), оксид серы (VI), оксид бора. • 2. Назовите оксиды: K 2 O, Al 2 O 3, Mn. O, Mn 2 O 7, Si. O 2, Si. O
Примеры. • Запишите формулы оксидов : оксид железа (II), оксид серы (VI), оксид бора. • 2. Назовите оксиды: K 2 O, Al 2 O 3, Mn. O, Mn 2 O 7, Si. O 2, Si. O
 Оксиды. Классификация. 1. Несолеобразующие. Не могут образовать солей. 2. Солеобразующие. Образуют соли.
Оксиды. Классификация. 1. Несолеобразующие. Не могут образовать солей. 2. Солеобразующие. Образуют соли.
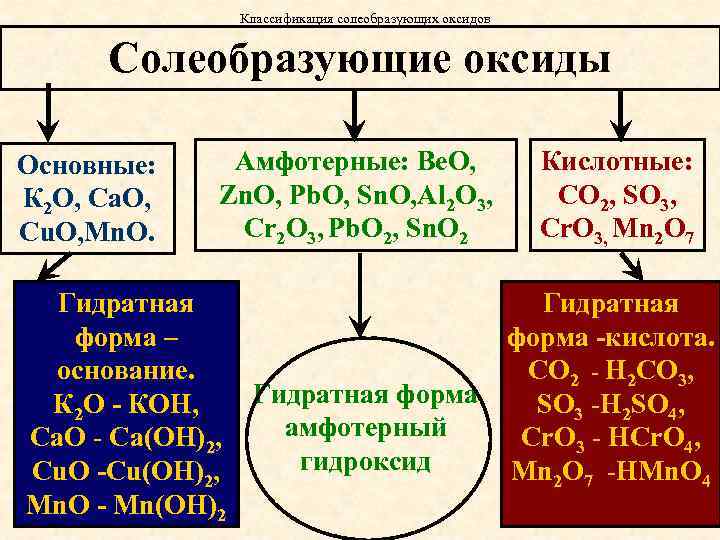 Классификация солеобразующих оксидов Солеобразующие оксиды Основные: К 2 О, Са. О, Cu. O, Mn. O. Амфотерные: Be. O, Zn. O, Pb. O, Sn. O, Al 2 O 3, Cr 2 O 3, Pb. O 2, Sn. O 2 Гидратная форма – основание. Гидратная форма К 2 О - КОН, амфотерный Са. О - Са(ОН)2, гидроксид Cu. O -Cu(OH)2, Mn. O - Mn(OH)2 Кислотные: СО 2, SO 3, Cr. O 3, Mn 2 O 7 Гидратная форма -кислота. СО 2 - H 2 CO 3, SO 3 -H 2 SO 4, Cr. O 3 - HCr. O 4, Mn 2 O 7 -HMn. O 4
Классификация солеобразующих оксидов Солеобразующие оксиды Основные: К 2 О, Са. О, Cu. O, Mn. O. Амфотерные: Be. O, Zn. O, Pb. O, Sn. O, Al 2 O 3, Cr 2 O 3, Pb. O 2, Sn. O 2 Гидратная форма – основание. Гидратная форма К 2 О - КОН, амфотерный Са. О - Са(ОН)2, гидроксид Cu. O -Cu(OH)2, Mn. O - Mn(OH)2 Кислотные: СО 2, SO 3, Cr. O 3, Mn 2 O 7 Гидратная форма -кислота. СО 2 - H 2 CO 3, SO 3 -H 2 SO 4, Cr. O 3 - HCr. O 4, Mn 2 O 7 -HMn. O 4
 Химические свойства оксидов Основные оксиды. • Оксид + вода=основание (щелочь). Растворимы в воде только оксиды щелочных и щелочноземельных металлов. • K 2 O+H 2 O= 2 KOH • Ba. O+H 2 O= Ba(OH)2
Химические свойства оксидов Основные оксиды. • Оксид + вода=основание (щелочь). Растворимы в воде только оксиды щелочных и щелочноземельных металлов. • K 2 O+H 2 O= 2 KOH • Ba. O+H 2 O= Ba(OH)2
 2. Основной оксид+ кислотный оксид= соль • Mg. O+CO 2 =Mg. CO 3 • Li 2 O+N 2 O 5=2 Li. NO 3
2. Основной оксид+ кислотный оксид= соль • Mg. O+CO 2 =Mg. CO 3 • Li 2 O+N 2 O 5=2 Li. NO 3
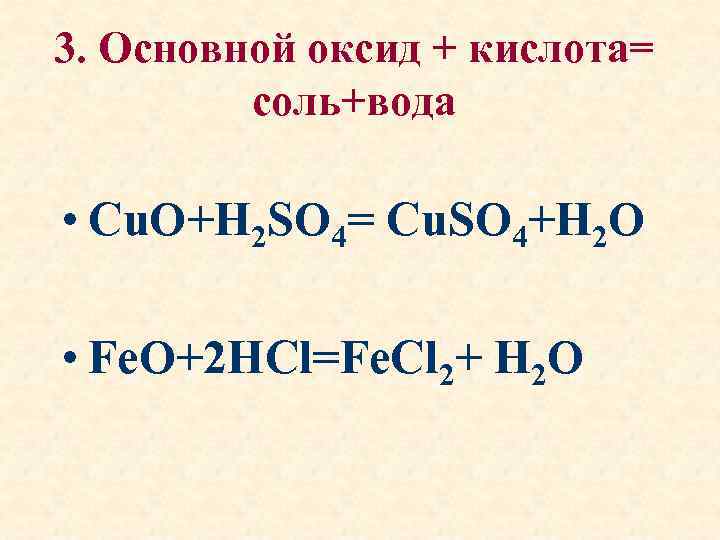 3. Основной оксид + кислота= соль+вода • Cu. O+H 2 SO 4= Cu. SO 4+H 2 O • Fe. O+2 HCl=Fe. Cl 2+ H 2 O
3. Основной оксид + кислота= соль+вода • Cu. O+H 2 SO 4= Cu. SO 4+H 2 O • Fe. O+2 HCl=Fe. Cl 2+ H 2 O
 Кислотные оксиды. Это оксиды неметаллов и металлов в высшей степени окисления.
Кислотные оксиды. Это оксиды неметаллов и металлов в высшей степени окисления.
 1. Кислотный оксид+вода = кислота. • В воде растворяются все кислотные оксиды кроме Si. O 2. • SO 3+H 2 O=H 2 SO 4, • N 2 O 5 +H 2 O=2 HNO 3 • Cr. O 3 +H 2 O= H 2 Cr. O 4, • Mn 2 O 7 +H 2 O=2 HMn. O 4
1. Кислотный оксид+вода = кислота. • В воде растворяются все кислотные оксиды кроме Si. O 2. • SO 3+H 2 O=H 2 SO 4, • N 2 O 5 +H 2 O=2 HNO 3 • Cr. O 3 +H 2 O= H 2 Cr. O 4, • Mn 2 O 7 +H 2 O=2 HMn. O 4
 2. Кислотный оксид+основной=соль • Приведите примеры.
2. Кислотный оксид+основной=соль • Приведите примеры.
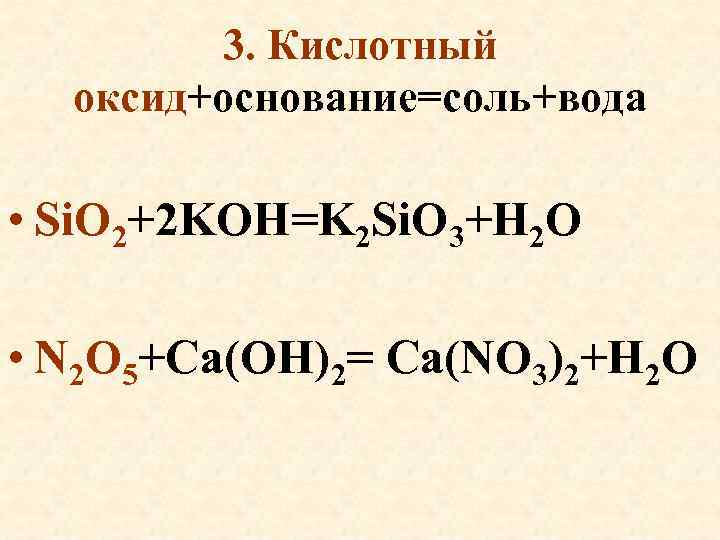 3. Кислотный оксид+основание=соль+вода • Si. O 2+2 KOH=K 2 Si. O 3+H 2 O • N 2 O 5+Ca(OH)2= Ca(NO 3)2+H 2 O
3. Кислотный оксид+основание=соль+вода • Si. O 2+2 KOH=K 2 Si. O 3+H 2 O • N 2 O 5+Ca(OH)2= Ca(NO 3)2+H 2 O
 Амфотерные оксиды. Оксиды металлов, которые в зависимости от условий могут проявлять свойства либо кислотных, либо основных оксидов. Ве. О, Zn. O, Pb. O, Sn. O, Al 2 O 3, Cr 2 O 3, Pb. O 2, Sn. O 2
Амфотерные оксиды. Оксиды металлов, которые в зависимости от условий могут проявлять свойства либо кислотных, либо основных оксидов. Ве. О, Zn. O, Pb. O, Sn. O, Al 2 O 3, Cr 2 O 3, Pb. O 2, Sn. O 2
 Свойства • В воде нерастворимы. • могут растворяться как в кислотах (проявляют основные свойства), так и в щелочах (проявляют кислотные свойства).
Свойства • В воде нерастворимы. • могут растворяться как в кислотах (проявляют основные свойства), так и в щелочах (проявляют кислотные свойства).
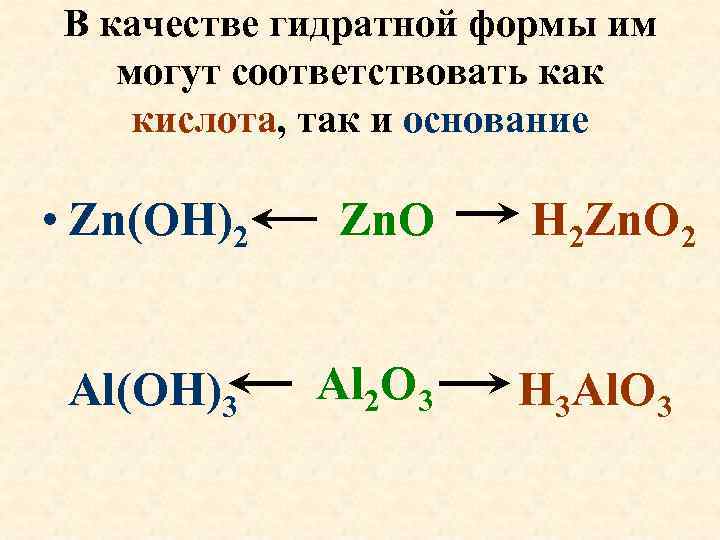 В качестве гидратной формы им могут соответствовать как кислота, так и основание • Zn(OH)2 Zn. O Al(OH)3 Al 2 O 3 H 2 Zn. O 2 H 3 Al. O 3
В качестве гидратной формы им могут соответствовать как кислота, так и основание • Zn(OH)2 Zn. O Al(OH)3 Al 2 O 3 H 2 Zn. O 2 H 3 Al. O 3
 Свойства амфотерных оксидов. Амфотерный оксид + Основной оксид = соль • Be. O+K 2 O=K 2 Be. O 2 сплавление
Свойства амфотерных оксидов. Амфотерный оксид + Основной оксид = соль • Be. O+K 2 O=K 2 Be. O 2 сплавление
 2. Амфотерный оксид+щелочь= соль + вода • Al 2 O 3+Na. OH(тв. )=Na. Al. O 2+H 2 O сплавление • Cr 2 O 3+6 Na. OH(р-р)+3 H 2 O = 2 Na 3[Cr(OH)6] Na. Al. O 2 - метаалюминат натрия Na 3[Al(OH)6]-гексагидроксоалюминат натрия
2. Амфотерный оксид+щелочь= соль + вода • Al 2 O 3+Na. OH(тв. )=Na. Al. O 2+H 2 O сплавление • Cr 2 O 3+6 Na. OH(р-р)+3 H 2 O = 2 Na 3[Cr(OH)6] Na. Al. O 2 - метаалюминат натрия Na 3[Al(OH)6]-гексагидроксоалюминат натрия
 3. Амфотерный оксид+кислотный оксид=соль • Zn. O+SO 3=Zn. SO 4 4. Амфотерный оксид+кислота=соль+вода • Al 2 O 3+6 HCl=2 Al. Cl 3+3 H 2 O
3. Амфотерный оксид+кислотный оксид=соль • Zn. O+SO 3=Zn. SO 4 4. Амфотерный оксид+кислота=соль+вода • Al 2 O 3+6 HCl=2 Al. Cl 3+3 H 2 O
 Получение оксидов Взаимодействие простых веществ с кислородом. • S+O 2=SO 2 , • Mg+O 2=2 Mg. O ( нагревание)
Получение оксидов Взаимодействие простых веществ с кислородом. • S+O 2=SO 2 , • Mg+O 2=2 Mg. O ( нагревание)
 2. Горение сложных веществ в кислороде. • CH 4+O 2=CO 2+2 H 2 O • 4 NH 3+O 2=4 NO+6 H 2 O • 2 H 2 S+3 O 2=2 SO 2+2 H 2 O
2. Горение сложных веществ в кислороде. • CH 4+O 2=CO 2+2 H 2 O • 4 NH 3+O 2=4 NO+6 H 2 O • 2 H 2 S+3 O 2=2 SO 2+2 H 2 O
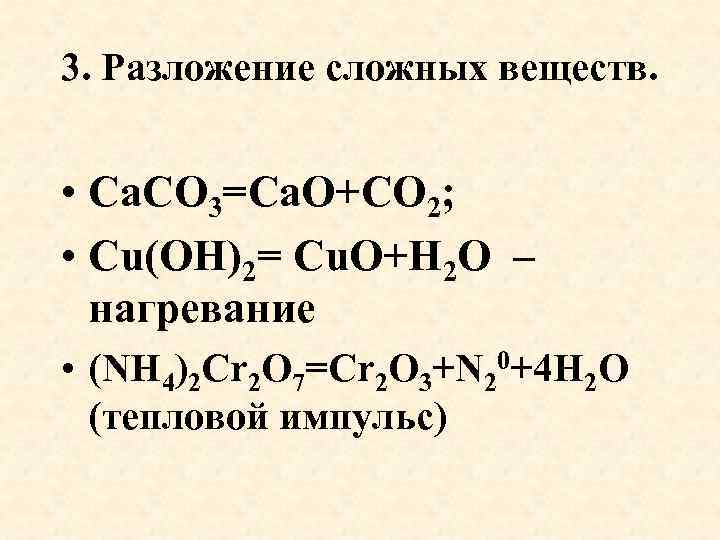 3. Разложение сложных веществ. • Са. СО 3=Са. О+СО 2; • Cu(OH)2= Cu. O+H 2 O – нагревание • (NH 4)2 Cr 2 O 7=Cr 2 O 3+N 20+4 H 2 O (тепловой импульс)
3. Разложение сложных веществ. • Са. СО 3=Са. О+СО 2; • Cu(OH)2= Cu. O+H 2 O – нагревание • (NH 4)2 Cr 2 O 7=Cr 2 O 3+N 20+4 H 2 O (тепловой импульс)
 4. Взаимодействие оксида металла с другим металлом. • Al + Cr 2 O 3=Cr +Al 2 O 3 (нагревание)
4. Взаимодействие оксида металла с другим металлом. • Al + Cr 2 O 3=Cr +Al 2 O 3 (нагревание)
 Основания – сложные вещества, в состав которых входят атомы металла и гидроксогруппы OHИсключением является основание NH 4 OH (гидроксид аммония), которое не содержит атомов металла)
Основания – сложные вещества, в состав которых входят атомы металла и гидроксогруппы OHИсключением является основание NH 4 OH (гидроксид аммония), которое не содержит атомов металла)
 Общая формула • Me+n(OH)n-1 • Me – металл • n – степень окисления металла
Общая формула • Me+n(OH)n-1 • Me – металл • n – степень окисления металла
 Номенклатура оснований Название оснований составляют из слова «гидроксид» и названия металла в родительном падеже: KOH – гидроксид калия; Mg(OH)2 - гидроксид магния; Ca(OH)2 - гидроксид кальция; Al(OH)3 - гидроксид алюминия.
Номенклатура оснований Название оснований составляют из слова «гидроксид» и названия металла в родительном падеже: KOH – гидроксид калия; Mg(OH)2 - гидроксид магния; Ca(OH)2 - гидроксид кальция; Al(OH)3 - гидроксид алюминия.
 Пример Если металл образует несколько оснований, то после названия металла в скобках римской цифрой указывается степень его окисления: Fe(OH)2 – гидроксид железа (II); Fe(OH)3 – гидроксид железа (III); Cr(OH)2 – гидроксид хрома (II); Cr(OH)3 – гидроксид хрома (III).
Пример Если металл образует несколько оснований, то после названия металла в скобках римской цифрой указывается степень его окисления: Fe(OH)2 – гидроксид железа (II); Fe(OH)3 – гидроксид железа (III); Cr(OH)2 – гидроксид хрома (II); Cr(OH)3 – гидроксид хрома (III).
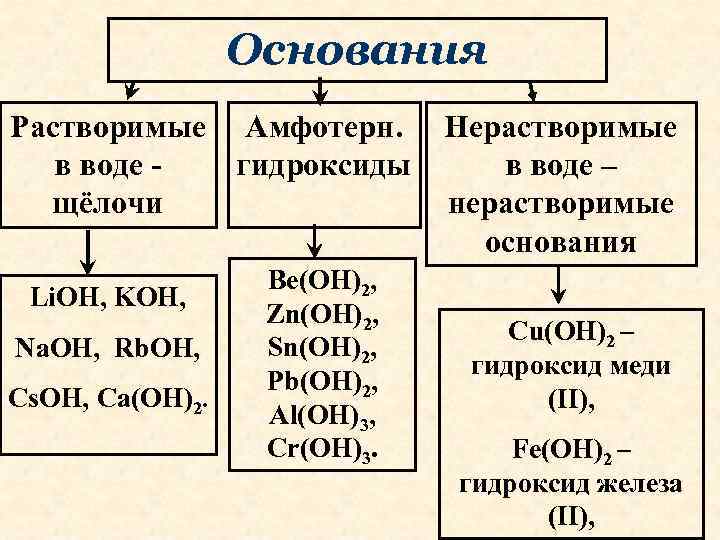 Основания Растворимые Амфотерн. в воде гидроксиды щёлочи Li. OH, KOH, Na. OH, Rb. OH, Cs. OH, Ca(OH)2. Be(OH)2, Zn(OH)2, Sn(OH)2, Pb(OH)2, Al(OH)3, Cr(OH)3. Нерастворимые в воде – нерастворимые основания Cu(OH)2 – гидроксид меди (II), Fe(OH)2 – гидроксид железа (II),
Основания Растворимые Амфотерн. в воде гидроксиды щёлочи Li. OH, KOH, Na. OH, Rb. OH, Cs. OH, Ca(OH)2. Be(OH)2, Zn(OH)2, Sn(OH)2, Pb(OH)2, Al(OH)3, Cr(OH)3. Нерастворимые в воде – нерастворимые основания Cu(OH)2 – гидроксид меди (II), Fe(OH)2 – гидроксид железа (II),
 Химические свойства оснований Амфотерные гидроксиды • Амфотерные гидроксид + кислота → соль + вода Zn(OH)2 + 2 HCl → Zn. Cl 2 +2 H 2 O
Химические свойства оснований Амфотерные гидроксиды • Амфотерные гидроксид + кислота → соль + вода Zn(OH)2 + 2 HCl → Zn. Cl 2 +2 H 2 O
 Амфотерные гидроксид + щелочь → соль + вода • (при сплавлении) Zn(OH)2 + 2 Na. OH(тв. ) → Na 2 Zn. O 2 +2 H 2 O • в растворе: Zn(OH)2 + 2 Na. OH(р-р) → Na 2[Zn(OH)4]
Амфотерные гидроксид + щелочь → соль + вода • (при сплавлении) Zn(OH)2 + 2 Na. OH(тв. ) → Na 2 Zn. O 2 +2 H 2 O • в растворе: Zn(OH)2 + 2 Na. OH(р-р) → Na 2[Zn(OH)4]
 Щелочи 1. Действие на индикаторы: фенолфталеин – малиновый, метилоранж – желтый, лакмус – синий Нерастворимые основания _ 2. Основание + кислота =соль 1. Основание + кислота = + вода соль + вода 2 Fe(OH)3+3 H 2 SO 4= Fe 2(SO 4)3 2 KOH +2 HCl =2 KCl + H 2 O + 6 H 2 O 3. Основание + кислотный 2. Основание-t= оксид + вода оксид = соль + вода 2 Fe(OH)3 t= Fe 2 O 3 + 3 H 2 O Ba(OH)2 +CO 2 = Ba. CO 3 + H 2 O Cu(OH)2 t=Сu. O + H 2 O 4. Щелочь + соль 1 = соль 2 + основание 2 KOH+Cu. SO 4=…. K 2 SO 4+Cu(OH)2 =
Щелочи 1. Действие на индикаторы: фенолфталеин – малиновый, метилоранж – желтый, лакмус – синий Нерастворимые основания _ 2. Основание + кислота =соль 1. Основание + кислота = + вода соль + вода 2 Fe(OH)3+3 H 2 SO 4= Fe 2(SO 4)3 2 KOH +2 HCl =2 KCl + H 2 O + 6 H 2 O 3. Основание + кислотный 2. Основание-t= оксид + вода оксид = соль + вода 2 Fe(OH)3 t= Fe 2 O 3 + 3 H 2 O Ba(OH)2 +CO 2 = Ba. CO 3 + H 2 O Cu(OH)2 t=Сu. O + H 2 O 4. Щелочь + соль 1 = соль 2 + основание 2 KOH+Cu. SO 4=…. K 2 SO 4+Cu(OH)2 =
 Получение оснований • Активный металл+вода → щелочь+водород • только щелочные( Li, Na, K, Rb, Cs), 2 Na+2 H 2 O → 2 Na. OH+H 2 щелочноземельные (Ca, Sr, Ba) Ba +2 H 2 O → Ba(OH)2+H 2
Получение оснований • Активный металл+вода → щелочь+водород • только щелочные( Li, Na, K, Rb, Cs), 2 Na+2 H 2 O → 2 Na. OH+H 2 щелочноземельные (Ca, Sr, Ba) Ba +2 H 2 O → Ba(OH)2+H 2
 2. Основной оксид+вода → щелочь • только оксиды щелочных и щелочноземельных металлов K 2 O+H 2 O → 2 KOH; Sr. O+H 2 O → Sr(OH)2
2. Основной оксид+вода → щелочь • только оксиды щелочных и щелочноземельных металлов K 2 O+H 2 O → 2 KOH; Sr. O+H 2 O → Sr(OH)2
 3. Соль 1(р-р)+основание 1(р-р) → соль2(р-р)+нерастворимое основание 2 • Fe. Cl 3(р)+ 3 KOH(р) → 3 KCl(р)+Fe(OH)3↓ цвет ржавчины • Zn. SO 4(р)+NH 4 OH(р) → (NH 4)2 SO 4(р)+Zn (OH)2 ↓ белый
3. Соль 1(р-р)+основание 1(р-р) → соль2(р-р)+нерастворимое основание 2 • Fe. Cl 3(р)+ 3 KOH(р) → 3 KCl(р)+Fe(OH)3↓ цвет ржавчины • Zn. SO 4(р)+NH 4 OH(р) → (NH 4)2 SO 4(р)+Zn (OH)2 ↓ белый
 Кислоты. Определение Кислоты - это сложные вещества, в состав которых входят ионы водорода Н+, способные замещаться на металл, и кислотный остаток
Кислоты. Определение Кислоты - это сложные вещества, в состав которых входят ионы водорода Н+, способные замещаться на металл, и кислотный остаток
 Общая формула кислот • Нn+ Х-n - Х - кислотный остаток • n – заряд кислотного остатка
Общая формула кислот • Нn+ Х-n - Х - кислотный остаток • n – заряд кислотного остатка
 Классификация кислот. По наличию атомов кислорода в составе молекулы : • Бескислородные • Кислородосодержащие (оксокислоты) – гидраты кислотных оксидов (ангидридов)
Классификация кислот. По наличию атомов кислорода в составе молекулы : • Бескислородные • Кислородосодержащие (оксокислоты) – гидраты кислотных оксидов (ангидридов)
 По числу атомов водорода в кислоте , способных замещаться на металл различают кислоты • одноосновные • многоосновные.
По числу атомов водорода в кислоте , способных замещаться на металл различают кислоты • одноосновные • многоосновные.
 Кислородосодержащие • одноосновные – HNO 3, HNO 2, HMn. O 4 • двухосновные – H 2 SO 4, H 2 Si. O 3 • трехосновные – H 3 PO 4, H 3 As. O 4
Кислородосодержащие • одноосновные – HNO 3, HNO 2, HMn. O 4 • двухосновные – H 2 SO 4, H 2 Si. O 3 • трехосновные – H 3 PO 4, H 3 As. O 4
 Бескиcлородные • одноосновные HF, HCl, HBr, HI • двухосновные H 2 S, H 2 Se, H 2 Te,
Бескиcлородные • одноосновные HF, HCl, HBr, HI • двухосновные H 2 S, H 2 Se, H 2 Te,
 Номенклатура Бескиcлородные кислоты – название неметалла + «О» +слово водородная. Примеры: HCl -хлороводородная; HF - фтороводородная; H 2 Se –селеноводородная. Запишите формулы кислот: сероводородной , иодоводородной, бромоводородной
Номенклатура Бескиcлородные кислоты – название неметалла + «О» +слово водородная. Примеры: HCl -хлороводородная; HF - фтороводородная; H 2 Se –селеноводородная. Запишите формулы кислот: сероводородной , иодоводородной, бромоводородной
 Кислородосодержащие По степени окисления кислотообразующего элемента • • • H 2+S+6 O 4 -2 – cерная кислота H+N+5 O 3 -2 -- азотная кислота H 2+S+4 O 3 -2 – сернистая кислота H+N+3 O 2 -2 – азотистая кислота H 2+Cr+6 O 4 -2 – хромовая кислота H+Cr+3 O 2 -2 – хромистая кислота
Кислородосодержащие По степени окисления кислотообразующего элемента • • • H 2+S+6 O 4 -2 – cерная кислота H+N+5 O 3 -2 -- азотная кислота H 2+S+4 O 3 -2 – сернистая кислота H+N+3 O 2 -2 – азотистая кислота H 2+Cr+6 O 4 -2 – хромовая кислота H+Cr+3 O 2 -2 – хромистая кислота
 По количеству молекул воды, присоединенных одной молекулой ангидрида • P 2 O 5 + 3 H 2 O →H 3 PO 4 - ортофосфорная кислота • P 2 O 5 + 2 H 2 O → H 4 P 2 O 7 – пирофосфорная кислота • P 2 O 5 + H 2 O → 2 HPO 3 – метафосфорная кислота
По количеству молекул воды, присоединенных одной молекулой ангидрида • P 2 O 5 + 3 H 2 O →H 3 PO 4 - ортофосфорная кислота • P 2 O 5 + 2 H 2 O → H 4 P 2 O 7 – пирофосфорная кислота • P 2 O 5 + H 2 O → 2 HPO 3 – метафосфорная кислота
 • H 3 Al. O 3 – ортоалюминиевая кислота (более богатая водой) • HAl. O 2 – метаалюминиевая кислота (H 3 Al. O 3 – Н 2 О → HAl. O 2)
• H 3 Al. O 3 – ортоалюминиевая кислота (более богатая водой) • HAl. O 2 – метаалюминиевая кислота (H 3 Al. O 3 – Н 2 О → HAl. O 2)
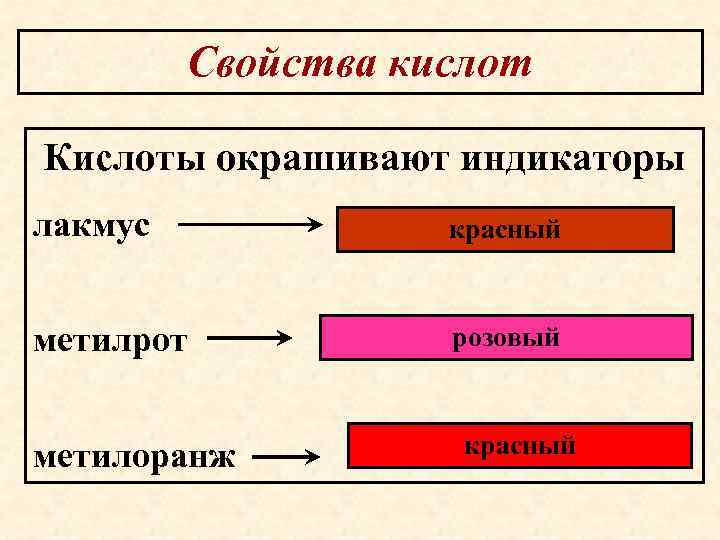 Свойства кислот Кислоты окрашивают индикаторы лакмус красный метилрот розовый метилоранж красный
Свойства кислот Кислоты окрашивают индикаторы лакмус красный метилрот розовый метилоранж красный
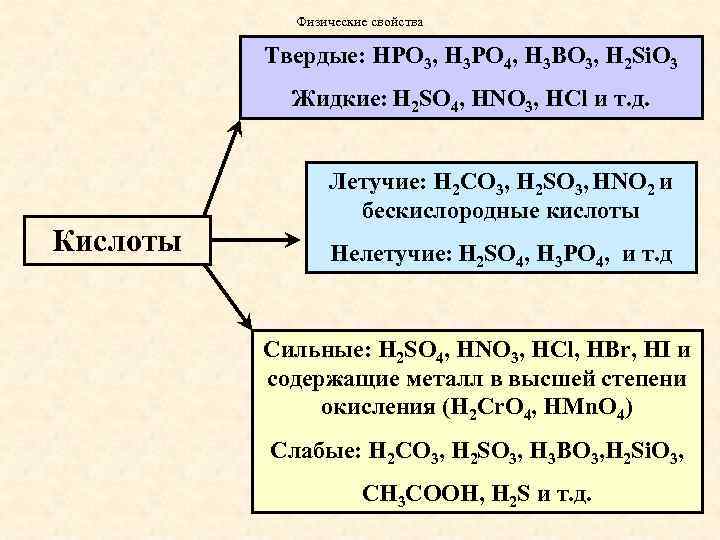 Физические свойства Твердые: HPO 3, H 3 PO 4, H 3 BO 3, H 2 Si. O 3 Жидкие: H 2 SO 4, HNO 3, HCl и т. д. Кислоты Летучие: H 2 СO 3, H 2 SO 3, HNO 2 и бескислородные кислоты Нелетучие: H 2 SO 4, H 3 PO 4, и т. д Сильные: H 2 SO 4, HNO 3, HCl, HBr, HI и содержащие металл в высшей степени окисления (H 2 Cr. O 4, HMn. O 4) Слабые: H 2 СO 3, H 2 SO 3, H 3 BO 3, H 2 Si. O 3, СН 3 СООН, H 2 S и т. д.
Физические свойства Твердые: HPO 3, H 3 PO 4, H 3 BO 3, H 2 Si. O 3 Жидкие: H 2 SO 4, HNO 3, HCl и т. д. Кислоты Летучие: H 2 СO 3, H 2 SO 3, HNO 2 и бескислородные кислоты Нелетучие: H 2 SO 4, H 3 PO 4, и т. д Сильные: H 2 SO 4, HNO 3, HCl, HBr, HI и содержащие металл в высшей степени окисления (H 2 Cr. O 4, HMn. O 4) Слабые: H 2 СO 3, H 2 SO 3, H 3 BO 3, H 2 Si. O 3, СН 3 СООН, H 2 S и т. д.
 Химические свойства кислот 1. Кислота+ основной оксид → соль + вода • 2 HNO 3+Na 2 O → 2 Na. NO 3+H 2 O
Химические свойства кислот 1. Кислота+ основной оксид → соль + вода • 2 HNO 3+Na 2 O → 2 Na. NO 3+H 2 O
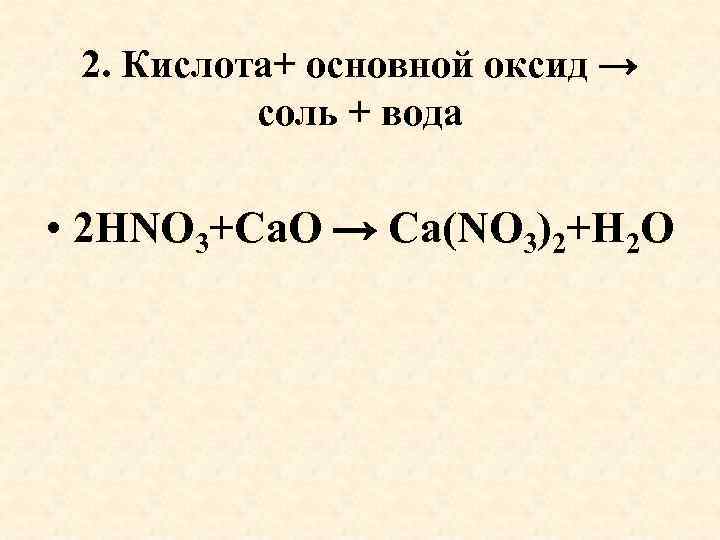 2. Кислота+ основной оксид → соль + вода • 2 HNO 3+Са. O → Са(NO 3)2+H 2 O
2. Кислота+ основной оксид → соль + вода • 2 HNO 3+Са. O → Са(NO 3)2+H 2 O
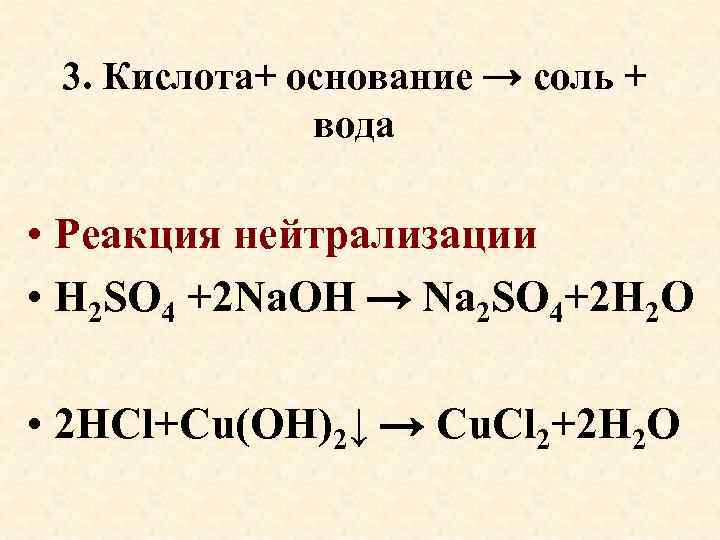 3. Кислота+ основание → соль + вода • Реакция нейтрализации • H 2 SO 4 +2 Na. OH → Na 2 SO 4+2 H 2 O • 2 HCl+Cu(OH)2↓ → Cu. Cl 2+2 H 2 O
3. Кислота+ основание → соль + вода • Реакция нейтрализации • H 2 SO 4 +2 Na. OH → Na 2 SO 4+2 H 2 O • 2 HCl+Cu(OH)2↓ → Cu. Cl 2+2 H 2 O
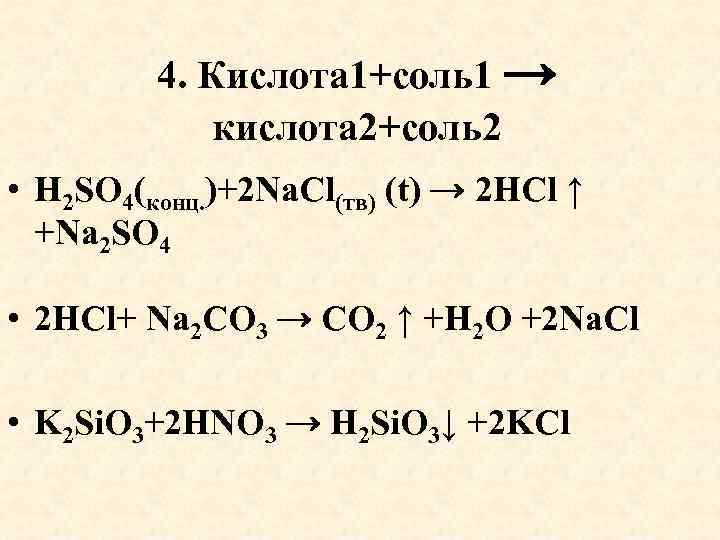 4. Кислота 1+соль1 → кислота 2+соль2 • H 2 SO 4(конц. )+2 Na. Cl(тв) (t) → 2 HCl ↑ +Na 2 SO 4 • 2 HCl+ Na 2 СO 3 → CO 2 ↑ +H 2 O +2 Na. Сl • K 2 Si. O 3+2 HNO 3 → H 2 Si. O 3↓ +2 KCl
4. Кислота 1+соль1 → кислота 2+соль2 • H 2 SO 4(конц. )+2 Na. Cl(тв) (t) → 2 HCl ↑ +Na 2 SO 4 • 2 HCl+ Na 2 СO 3 → CO 2 ↑ +H 2 O +2 Na. Сl • K 2 Si. O 3+2 HNO 3 → H 2 Si. O 3↓ +2 KCl
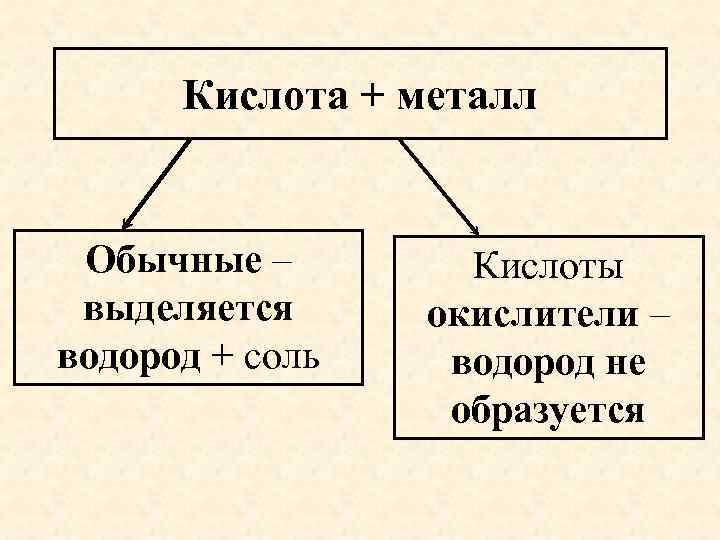 Кислота + металл Обычные – выделяется водород + соль Кислоты окислители – водород не образуется
Кислота + металл Обычные – выделяется водород + соль Кислоты окислители – водород не образуется
 Кислоты окислители • H 2 SO 4 концентрированная, • HNO 3 любой концентрации • при нагревании реагируют со всеми металлами кроме благородных (Au, Pt) и неметаллами. • Холодные концентрированные кислоты пассивируют Fe, Cr, Al.
Кислоты окислители • H 2 SO 4 концентрированная, • HNO 3 любой концентрации • при нагревании реагируют со всеми металлами кроме благородных (Au, Pt) и неметаллами. • Холодные концентрированные кислоты пассивируют Fe, Cr, Al.
 Водород из этих кислот не выделяется ! Продукты восстановления кислотообразующего элемента зависят от концентрации кислоты и активности металла
Водород из этих кислот не выделяется ! Продукты восстановления кислотообразующего элемента зависят от концентрации кислоты и активности металла
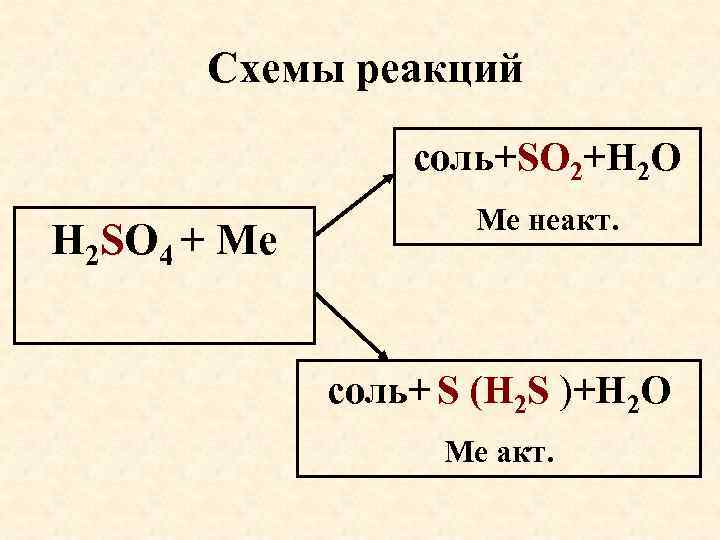 Схемы реакций соль+SО 2+Н 2 О Н 2 SO 4 + Ме Ме неакт. соль+ S (Н 2 S )+Н 2 О Ме акт.
Схемы реакций соль+SО 2+Н 2 О Н 2 SO 4 + Ме Ме неакт. соль+ S (Н 2 S )+Н 2 О Ме акт.
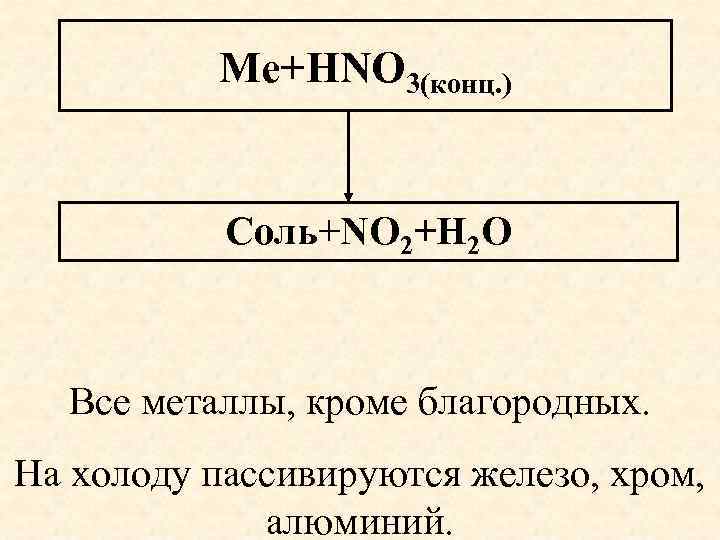 Ме+HNO 3(конц. ) Соль+NO 2+Н 2 О Все металлы, кроме благородных. На холоду пассивируются железо, хром, алюминий.
Ме+HNO 3(конц. ) Соль+NO 2+Н 2 О Все металлы, кроме благородных. На холоду пассивируются железо, хром, алюминий.
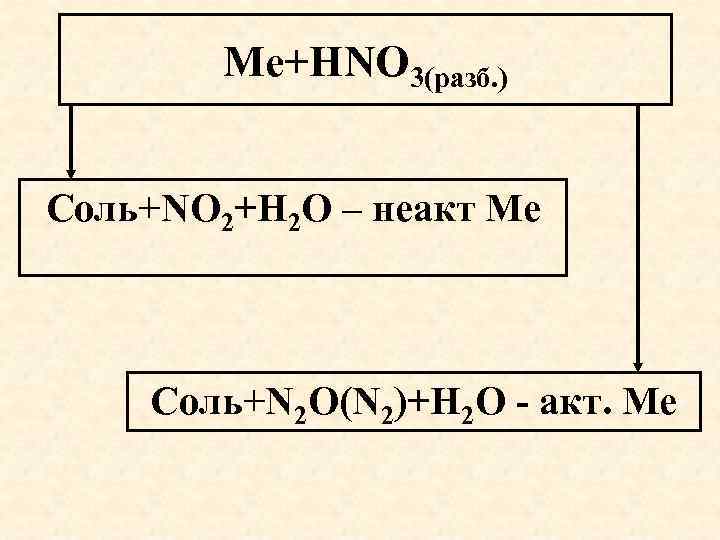 Ме+HNO 3(разб. ) Соль+NO 2+Н 2 О – неакт Ме Соль+N 2 O(N 2)+Н 2 О - акт. Ме
Ме+HNO 3(разб. ) Соль+NO 2+Н 2 О – неакт Ме Соль+N 2 O(N 2)+Н 2 О - акт. Ме
 б) обычные кислоты • все кроме HNO 3, H 2 SO 4 концентрированной • (H 2 SO 4 разбавленная, H 3 РO 4, HСl…). Реагируют со всеми металлами (кроме свинца), стоящимими в ряду напряжений до водорода. • Образуются соль и ВОДОРОД! • Fe+H 2 SO 4= Fe. SO 4+H 2
б) обычные кислоты • все кроме HNO 3, H 2 SO 4 концентрированной • (H 2 SO 4 разбавленная, H 3 РO 4, HСl…). Реагируют со всеми металлами (кроме свинца), стоящимими в ряду напряжений до водорода. • Образуются соль и ВОДОРОД! • Fe+H 2 SO 4= Fe. SO 4+H 2
 К слайду 70 Взаимодействие металлов с концентрированной серной кислотой • неактивный металл – (SO 4)2 - S+4 О 2 Cu+2 H 2 SO 4(к) Cu. SO 4+SO 2 +2 H 2 O • активный металл - (SO 4)2 - S 0 или до H 2 S-2 • Zn+2 H 2 SO 4 (к) Zn. SO 4+S +2 H 2 O • 4 Mg +5 H 2 SO 4 (к) 4 Mg. SO 4+H 2 S +4 H 2 O
К слайду 70 Взаимодействие металлов с концентрированной серной кислотой • неактивный металл – (SO 4)2 - S+4 О 2 Cu+2 H 2 SO 4(к) Cu. SO 4+SO 2 +2 H 2 O • активный металл - (SO 4)2 - S 0 или до H 2 S-2 • Zn+2 H 2 SO 4 (к) Zn. SO 4+S +2 H 2 O • 4 Mg +5 H 2 SO 4 (к) 4 Mg. SO 4+H 2 S +4 H 2 O
 Взаимодействие азотной кислоты с металлами Концентрированная азотная кислота. Продукт восстановления N+5 не зависит от активности металла. Неактивный металл Cu+4 HNO 3(к) Cu(NO 3)2+NO 2 +2 H 2 O Активный металл Mg+4 HNO 3 (к) Mg(NO 3)2+NO 2 +2 H 2 O
Взаимодействие азотной кислоты с металлами Концентрированная азотная кислота. Продукт восстановления N+5 не зависит от активности металла. Неактивный металл Cu+4 HNO 3(к) Cu(NO 3)2+NO 2 +2 H 2 O Активный металл Mg+4 HNO 3 (к) Mg(NO 3)2+NO 2 +2 H 2 O
 Разбавленная азотная кислота. Неактивный металл восстанавливает N+5 до NO 3 Cu+8 HNO 3(р) 3 Cu(NO 3)2+2 NO +4 H 2 O Неактивный металл восстанавливает N+5 до N 2 O или N 2 4 Zn+10 HNO 3 (р) 4 Zn(NO 3)2+N 2 O +5 H 2 O 5 Mg+12 HNO 3 (р) 5 Mg(NO 3)2+N 2 0 +6 H 2 O Очень разбавленная азотная кислота. Активный металл восстанавливает N+5 до N-3 4 Ca+10 HNO 3(оч. р) 4 Ca(NO 3)2+NH 4 NO 3+3 H 2 O
Разбавленная азотная кислота. Неактивный металл восстанавливает N+5 до NO 3 Cu+8 HNO 3(р) 3 Cu(NO 3)2+2 NO +4 H 2 O Неактивный металл восстанавливает N+5 до N 2 O или N 2 4 Zn+10 HNO 3 (р) 4 Zn(NO 3)2+N 2 O +5 H 2 O 5 Mg+12 HNO 3 (р) 5 Mg(NO 3)2+N 2 0 +6 H 2 O Очень разбавленная азотная кислота. Активный металл восстанавливает N+5 до N-3 4 Ca+10 HNO 3(оч. р) 4 Ca(NO 3)2+NH 4 NO 3+3 H 2 O
 Получение кислот 1. Кислотный оксид + вода кислота. SO 3+H 2 O H 2 SO 4 – серная кислота P 2 O 5 + 3 H 2 O 2 H 3 PO 4 – ортофосфорная кислота Mn 2 O 7 + H 2 O 2 HMn. O 4 – марганцовая кислота В воде растворимы все кислотные оксиды кроме оксида кремния (IV).
Получение кислот 1. Кислотный оксид + вода кислота. SO 3+H 2 O H 2 SO 4 – серная кислота P 2 O 5 + 3 H 2 O 2 H 3 PO 4 – ортофосфорная кислота Mn 2 O 7 + H 2 O 2 HMn. O 4 – марганцовая кислота В воде растворимы все кислотные оксиды кроме оксида кремния (IV).
 2. Соль1+кислота 1 соль2+кислота 2 Кислородосодержащие: Ca. Cl 2+3 H 2 SO 4 Ca. SO 4 +2 HCl Na 2 Si. O 3+2 HCl 2 Na. Cl+ H 2 Si. O 3 Бескислородные 2 Na. Cl(тв. )+H 2 SO 4(конц. ) 2 Na 2 SO 4+2 HCl↑ Fe. S(тв. )+2 HCl (конц. ) Fe. Cl 2+H 2 S ↑
2. Соль1+кислота 1 соль2+кислота 2 Кислородосодержащие: Ca. Cl 2+3 H 2 SO 4 Ca. SO 4 +2 HCl Na 2 Si. O 3+2 HCl 2 Na. Cl+ H 2 Si. O 3 Бескислородные 2 Na. Cl(тв. )+H 2 SO 4(конц. ) 2 Na 2 SO 4+2 HCl↑ Fe. S(тв. )+2 HCl (конц. ) Fe. Cl 2+H 2 S ↑
 3. Синтез из простых веществ Водород+неметалл газ Газ пропускают в воду раствор бескислородной кислоты H 2+Cl 2 2 HCl (газ хлороводород); H 2+S H 2 S (газ сероводород);
3. Синтез из простых веществ Водород+неметалл газ Газ пропускают в воду раствор бескислородной кислоты H 2+Cl 2 2 HCl (газ хлороводород); H 2+S H 2 S (газ сероводород);
 4. Неметалл+HNO 3(конц. ) или H 2 SO 4(конц. ) кислота+оксиды+вода 2 P+5 H 2 SO 4(конц. ) 2 H 3 PO 4+5 SO 2 +2 H 2 O S+6 HNO 3 (конц. ) H 2 SO 4+6 NO 2 +2 H 2 O
4. Неметалл+HNO 3(конц. ) или H 2 SO 4(конц. ) кислота+оксиды+вода 2 P+5 H 2 SO 4(конц. ) 2 H 3 PO 4+5 SO 2 +2 H 2 O S+6 HNO 3 (конц. ) H 2 SO 4+6 NO 2 +2 H 2 O
 Кислоты, особенно концентрированные, разрушают кожу и ткани! Кислоты требуют осторожного обращения! При попадании на кожу или одежду нейтрализовать раствором соды, а затем обильно смыть водой.
Кислоты, особенно концентрированные, разрушают кожу и ткани! Кислоты требуют осторожного обращения! При попадании на кожу или одежду нейтрализовать раствором соды, а затем обильно смыть водой.


