лекции по гидрогеологии 1 1.pptx
- Количество слайдов: 20
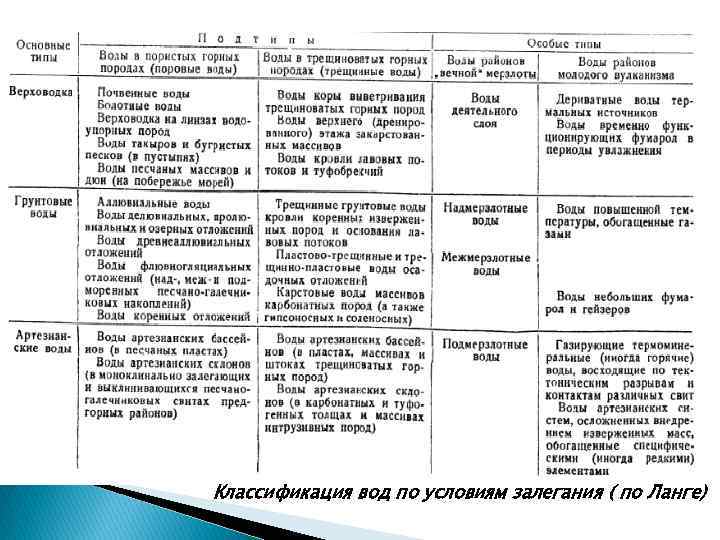 Классификация вод по условиям залегания ( по Ланге)
Классификация вод по условиям залегания ( по Ланге)
 Окислительно-восстановительный потенциал характеризует способность природного водного раствора к окислительным или восстановительным реакциям. Измеряется концентрацией свободных электронов (pe=-lg. Сe-) или величиной напряжения тока Величину pe раствоопределяют расчетным путем по значению Eh [В, м. В], Величины Eh и pe связаны между собой уравнением: где F - постоянная Фарадея (96484, 56 Кл/моль или 23, 6 ккал/В г экв); R - газовая постоянная (1, 987 10 -3 ккал/град моль), T- абсолютная температура, градусы Кельвина. При 250 С pe = 16, 9 Eh и Eh = 0, 059 pe.
Окислительно-восстановительный потенциал характеризует способность природного водного раствора к окислительным или восстановительным реакциям. Измеряется концентрацией свободных электронов (pe=-lg. Сe-) или величиной напряжения тока Величину pe раствоопределяют расчетным путем по значению Eh [В, м. В], Величины Eh и pe связаны между собой уравнением: где F - постоянная Фарадея (96484, 56 Кл/моль или 23, 6 ккал/В г экв); R - газовая постоянная (1, 987 10 -3 ккал/град моль), T- абсолютная температура, градусы Кельвина. При 250 С pe = 16, 9 Eh и Eh = 0, 059 pe.
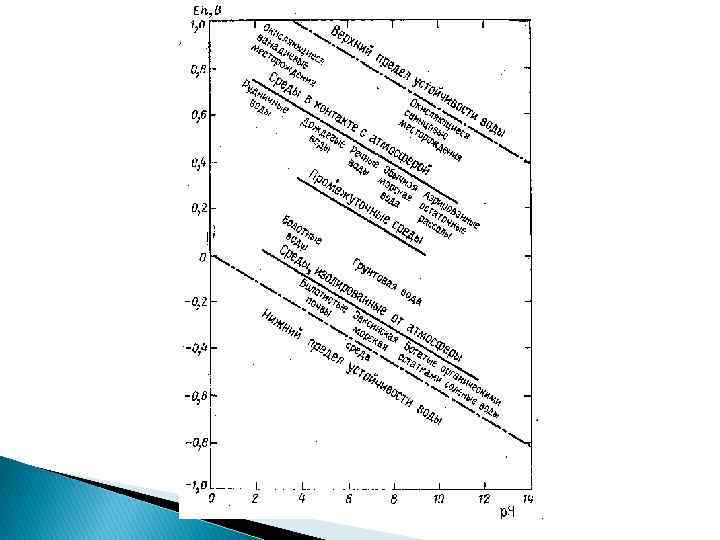
 Eh в природных водах: интервал от +800 до -400 м. В. Три основных типа обстановки в подземных водах: 1). Окислительная - Eh более +250 м. В и содержании О 2 более 3, 5 мг/л (2, 45 мл/л); 2). Eh от -150 до +250 м. В, с содержанием O 2 менее 3, 5 мг/л (2, 45 мл/л) и H 2 S менее 50 мг/л (32, 5 мл/л); 3). Восстановительная - Eh менее -150 м. В и содержании H 2 S более 50 мг/л (32, 5 мл/л)
Eh в природных водах: интервал от +800 до -400 м. В. Три основных типа обстановки в подземных водах: 1). Окислительная - Eh более +250 м. В и содержании О 2 более 3, 5 мг/л (2, 45 мл/л); 2). Eh от -150 до +250 м. В, с содержанием O 2 менее 3, 5 мг/л (2, 45 мл/л) и H 2 S менее 50 мг/л (32, 5 мл/л); 3). Восстановительная - Eh менее -150 м. В и содержании H 2 S более 50 мг/л (32, 5 мл/л)
 Агрессивность - способность вод растворять и разрушать породы и строительные материалы вследствие химического воздействия. В зависимости от главного агрессивного агента различают агрессивности: 1) общекислотную; 2) кислородную; 3) углекислотную; 4) сульфатную; 5) магнезиальную;
Агрессивность - способность вод растворять и разрушать породы и строительные материалы вследствие химического воздействия. В зависимости от главного агрессивного агента различают агрессивности: 1) общекислотную; 2) кислородную; 3) углекислотную; 4) сульфатную; 5) магнезиальную;
 1. Общекислотная агрессивность - повышенная кислотность вод. при p. H ниже 5, 0 (опасные условия), и 6, 8 — при наименее опасных условиях. 2. Кислородная агрессивность – присутствие раствор. O 2 и (проявляется к металлическим конструкциям) 3. Углекислотная агрессивность - избыток свободной CO 2 в или дефицит НСО 3 - и СО 32 - (растворение Ca. CO 3, и Ca(OH)2. max. содерж. агр. СО 2, для опасных условиях - 3 мг/л, при менее опасных — 8, 3 мг/л. 4. Сульфатная агрессия - большое содерж. SO 42 - (250 - >4000 мг/л) Способствует образованию гипса, Са. SO 4 • 2 Н 2 О. 5. Магнезиальная агрессивность возникает при высоких содержаниях Mg 2+: 750 мг/л и более.
1. Общекислотная агрессивность - повышенная кислотность вод. при p. H ниже 5, 0 (опасные условия), и 6, 8 — при наименее опасных условиях. 2. Кислородная агрессивность – присутствие раствор. O 2 и (проявляется к металлическим конструкциям) 3. Углекислотная агрессивность - избыток свободной CO 2 в или дефицит НСО 3 - и СО 32 - (растворение Ca. CO 3, и Ca(OH)2. max. содерж. агр. СО 2, для опасных условиях - 3 мг/л, при менее опасных — 8, 3 мг/л. 4. Сульфатная агрессия - большое содерж. SO 42 - (250 - >4000 мг/л) Способствует образованию гипса, Са. SO 4 • 2 Н 2 О. 5. Магнезиальная агрессивность возникает при высоких содержаниях Mg 2+: 750 мг/л и более.
 Признаки агрессивности жидких сред 1. Общекислотная агрессивность, водородный показатель р. Н Степень агрессивного воздействия сред на конструкции средне- и сильнонеагрессивная слабоагрессивная >4 1 -4 <1 2. Содержание магнезиальных солей (магнезиальная агрессивность), концентрация ионов Mg 2+, г/м 3 < 300 - 500 > 500 3. Содержание свободной (агрессивной) углекислоты (углекислотная агрессивность) СО 2 , г/м 3 < 20 20 - 50 > 50 4. Щелочная агрессивность, концентрация едких щелочей в расчете на Na+ + K+ , кг/м 3 5. Содержание сульфатов (сульфатная агрессивность) в пересчете на ионы SO 42 -, кг/м 3 < 100 - 150 > 150 До 10 От 10 до 20 Св. 20
Признаки агрессивности жидких сред 1. Общекислотная агрессивность, водородный показатель р. Н Степень агрессивного воздействия сред на конструкции средне- и сильнонеагрессивная слабоагрессивная >4 1 -4 <1 2. Содержание магнезиальных солей (магнезиальная агрессивность), концентрация ионов Mg 2+, г/м 3 < 300 - 500 > 500 3. Содержание свободной (агрессивной) углекислоты (углекислотная агрессивность) СО 2 , г/м 3 < 20 20 - 50 > 50 4. Щелочная агрессивность, концентрация едких щелочей в расчете на Na+ + K+ , кг/м 3 5. Содержание сульфатов (сульфатная агрессивность) в пересчете на ионы SO 42 -, кг/м 3 < 100 - 150 > 150 До 10 От 10 до 20 Св. 20
 Радиоактивность подземных вод заключается в их способности испускать частицы , и гамма-лучи растворенных в них нестабильных, радиоактивных изотопов. - активность представляет собой поток тяжелых положительно заряженных частиц из протонов и нейтронов (ядра гелия). Этот поток обладает наименьшей проникающей способностью и не способен преодолеть даже через наружный слой кожи. - активность представляет собой поток электронов, который обладают несколько большей проникающей способностью и способен пройти в ткань организма на 1 -2 см. Гамма-активность представляет собой электромагнитное излучения с длиной волн менее 10 -8 см и обладающее огромной проникающей способностью. -излучение способны задержать лишь толстая свинцовая или бетонная плита.
Радиоактивность подземных вод заключается в их способности испускать частицы , и гамма-лучи растворенных в них нестабильных, радиоактивных изотопов. - активность представляет собой поток тяжелых положительно заряженных частиц из протонов и нейтронов (ядра гелия). Этот поток обладает наименьшей проникающей способностью и не способен преодолеть даже через наружный слой кожи. - активность представляет собой поток электронов, который обладают несколько большей проникающей способностью и способен пройти в ткань организма на 1 -2 см. Гамма-активность представляет собой электромагнитное излучения с длиной волн менее 10 -8 см и обладающее огромной проникающей способностью. -излучение способны задержать лишь толстая свинцовая или бетонная плита.
 Источники радиоактивности в воде: калий-40, рубидий-87 уран-238, торий-232 и продукты их распада, радиоактивный йод, плутоний, стронций, цезий, тритий, радон. Удельная радиоактивность - количество распадов в единице объема воды в секунду. 1 распад*с/ м 3 воды = 1 беккерель/м 3 (Бк/м 3). По Е. С. Бурксеру, Бк/м 3 очень слабо радиоактивные сильно радиоактивные очень сильно радиоактивные По А. М. Овчинникову для минеральных вод слабо радоновые средне радоновые сильно радоновые Радиоактивность, Бк/м 3 <104 - 105 - 106 - 107 > 107
Источники радиоактивности в воде: калий-40, рубидий-87 уран-238, торий-232 и продукты их распада, радиоактивный йод, плутоний, стронций, цезий, тритий, радон. Удельная радиоактивность - количество распадов в единице объема воды в секунду. 1 распад*с/ м 3 воды = 1 беккерель/м 3 (Бк/м 3). По Е. С. Бурксеру, Бк/м 3 очень слабо радиоактивные сильно радиоактивные очень сильно радиоактивные По А. М. Овчинникову для минеральных вод слабо радоновые средне радоновые сильно радоновые Радиоактивность, Бк/м 3 <104 - 105 - 106 - 107 > 107
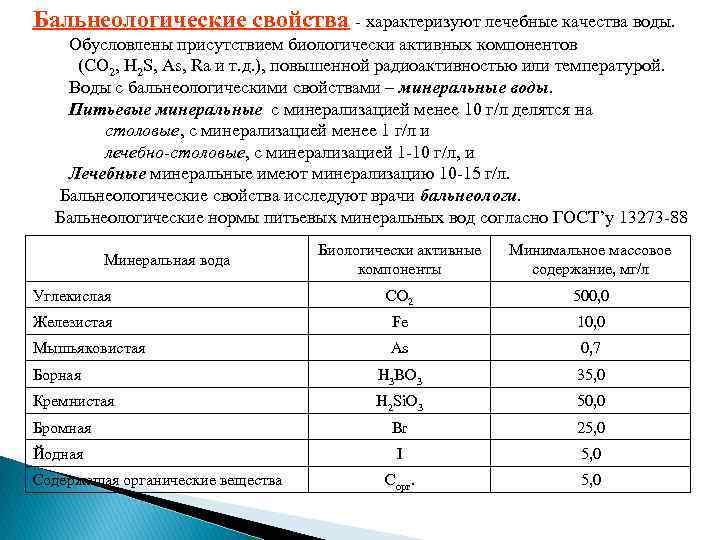 Бальнеологические свойства - характеризуют лечебные качества воды. Обусловлены присутствием биологически активных компонентов (CO 2, H 2 S, As, Ra и т. д. ), повышенной радиоактивностью или температурой. Воды с бальнеологическими свойствами – минеральные воды. Питьевые минеральные с минерализацией менее 10 г/л делятся на столовые, с минерализацией менее 1 г/л и лечебно-столовые, с минерализацией 1 -10 г/л, и лечебно-столовые Лечебные минеральные имеют минерализацию 10 -15 г/л. Бальнеологические свойства исследуют врачи бальнеологи. Бальнеологические нормы питьевых минеральных вод согласно ГОСТ’у 13273 -88 Биологически активные компоненты Минимальное массовое содержание, мг/л Углекислая CO 2 500, 0 Железистая Fe 10, 0 Мышьяковистая As 0, 7 Борная H 3 BO 3 35, 0 Кремнистая H 2 Si. O 3 50, 0 Бромная Br 25, 0 Йодная I 5, 0 Cорг. 5, 0 Минеральная вода Содержащая органические вещества
Бальнеологические свойства - характеризуют лечебные качества воды. Обусловлены присутствием биологически активных компонентов (CO 2, H 2 S, As, Ra и т. д. ), повышенной радиоактивностью или температурой. Воды с бальнеологическими свойствами – минеральные воды. Питьевые минеральные с минерализацией менее 10 г/л делятся на столовые, с минерализацией менее 1 г/л и лечебно-столовые, с минерализацией 1 -10 г/л, и лечебно-столовые Лечебные минеральные имеют минерализацию 10 -15 г/л. Бальнеологические свойства исследуют врачи бальнеологи. Бальнеологические нормы питьевых минеральных вод согласно ГОСТ’у 13273 -88 Биологически активные компоненты Минимальное массовое содержание, мг/л Углекислая CO 2 500, 0 Железистая Fe 10, 0 Мышьяковистая As 0, 7 Борная H 3 BO 3 35, 0 Кремнистая H 2 Si. O 3 50, 0 Бромная Br 25, 0 Йодная I 5, 0 Cорг. 5, 0 Минеральная вода Содержащая органические вещества
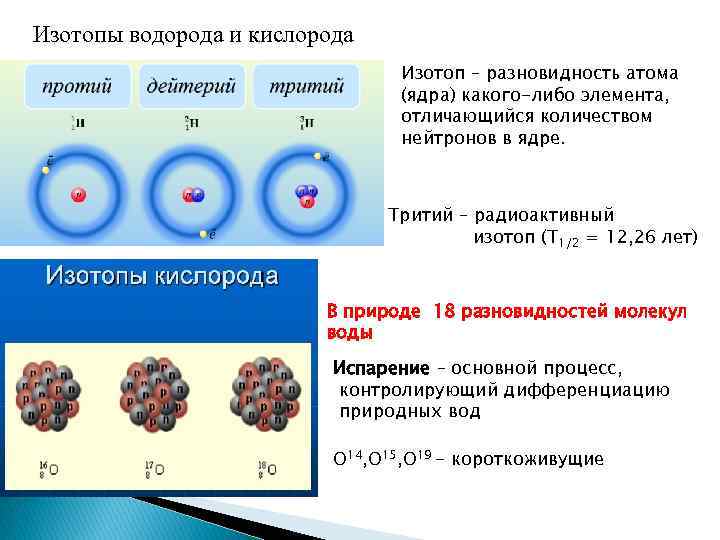 Изотопы водорода и кислорода Изотоп – разновидность атома (ядра) какого-либо элемента, отличающийся количеством нейтронов в ядре. Тритий – радиоактивный изотоп (Т 1/2 = 12, 26 лет) В природе 18 разновидностей молекул воды Испарение – основной процесс, контролирующий дифференциацию природных вод О 14, О 15, О 19 - короткоживущие
Изотопы водорода и кислорода Изотоп – разновидность атома (ядра) какого-либо элемента, отличающийся количеством нейтронов в ядре. Тритий – радиоактивный изотоп (Т 1/2 = 12, 26 лет) В природе 18 разновидностей молекул воды Испарение – основной процесс, контролирующий дифференциацию природных вод О 14, О 15, О 19 - короткоживущие
 Изотопное равновесие воды Распределение изотопов: H 1 - 99, 9844% Н (D)2 – 0, 0156% Н 3 – 3, 10 -16% H 1 / Н 2 = 6400 O 16 – 99, 759% O 17 – 0, 037% O 16/O 18 = 2000 O 18 – 0, 2039% (ρH 2 O 18= 1, 1134 при НУ) Standard Mean Ocean Water (SMOW) Н 2 / H 1= 0, 000158 или в атомных % - 0, 0158 O 18 / O 16 = 0, 001993 или 0, 1993 ат. %
Изотопное равновесие воды Распределение изотопов: H 1 - 99, 9844% Н (D)2 – 0, 0156% Н 3 – 3, 10 -16% H 1 / Н 2 = 6400 O 16 – 99, 759% O 17 – 0, 037% O 16/O 18 = 2000 O 18 – 0, 2039% (ρH 2 O 18= 1, 1134 при НУ) Standard Mean Ocean Water (SMOW) Н 2 / H 1= 0, 000158 или в атомных % - 0, 0158 O 18 / O 16 = 0, 001993 или 0, 1993 ат. %
 Процессы, влияющие на изотопный состав элементов: радиоактивный фракционирование и смешивание. 1. Радиоактивный распад: α-распад: β-распад: γ-излучение: Радиоактивный ряд включает: родоначальники – радиоактивные нуклиды промежуточные -радиогенные и радиоактивные нуклиды конечные - стабильные нуклиды а. Родоначальниками являются: , , и . распад,
Процессы, влияющие на изотопный состав элементов: радиоактивный фракционирование и смешивание. 1. Радиоактивный распад: α-распад: β-распад: γ-излучение: Радиоактивный ряд включает: родоначальники – радиоактивные нуклиды промежуточные -радиогенные и радиоактивные нуклиды конечные - стабильные нуклиды а. Родоначальниками являются: , , и . распад,
 б. Промежуточные - радиогенные и радиоактивные. Концентрация - результат векового равновесия за период около 10 T 0, 5 более долгоживущего Ni и Ti - содержание и полураспад дочернего изотопа i, N 0 и T 0 - содержание и полураспад родителя. в. Конечные – радиогенные стабильные. 232 Th, 235 U 238 U образуют 6, 7 и 8 атомов 4 He 40 K образует 1 атом 40 Ar 232 Th, 235 U 238 U 40 K образуют 6, 7 и 8 атомов 4 He образует 1 атом 40 Ar г. Космогенные радиоактивные: 14 C, T, 3 H, 36 Cl и другие
б. Промежуточные - радиогенные и радиоактивные. Концентрация - результат векового равновесия за период около 10 T 0, 5 более долгоживущего Ni и Ti - содержание и полураспад дочернего изотопа i, N 0 и T 0 - содержание и полураспад родителя. в. Конечные – радиогенные стабильные. 232 Th, 235 U 238 U образуют 6, 7 и 8 атомов 4 He 40 K образует 1 атом 40 Ar 232 Th, 235 U 238 U 40 K образуют 6, 7 и 8 атомов 4 He образует 1 атом 40 Ar г. Космогенные радиоактивные: 14 C, T, 3 H, 36 Cl и другие
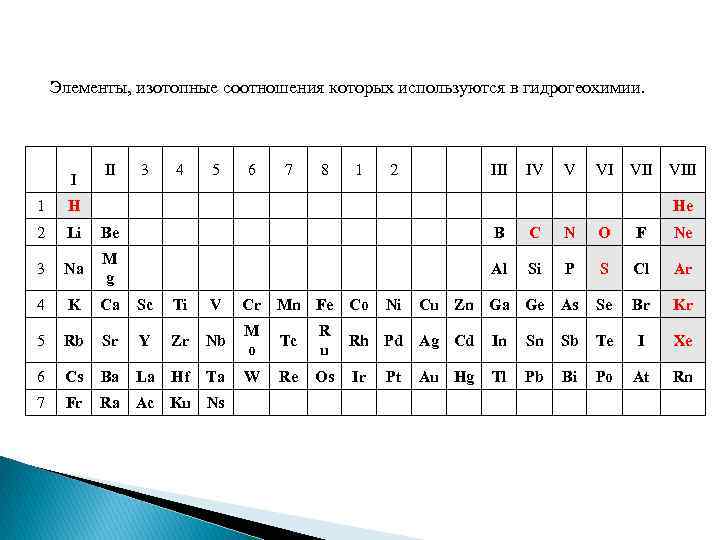 Элементы, изотопные соотношения которых используются в гидрогеохимии. I II 3 4 5 6 7 8 1 2 III IV V VI VIII 1 H He 2 Li Be B C N O F Ne 3 Na M g Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Zr Nb M o Tc R u Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba La Hf Ta W Re Os Ir Tl Pb Bi Po At Rn 7 Fr Ra Ac Ku Ns Ni Pt Au Hg
Элементы, изотопные соотношения которых используются в гидрогеохимии. I II 3 4 5 6 7 8 1 2 III IV V VI VIII 1 H He 2 Li Be B C N O F Ne 3 Na M g Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Zr Nb M o Tc R u Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba La Hf Ta W Re Os Ir Tl Pb Bi Po At Rn 7 Fr Ra Ac Ku Ns Ni Pt Au Hg
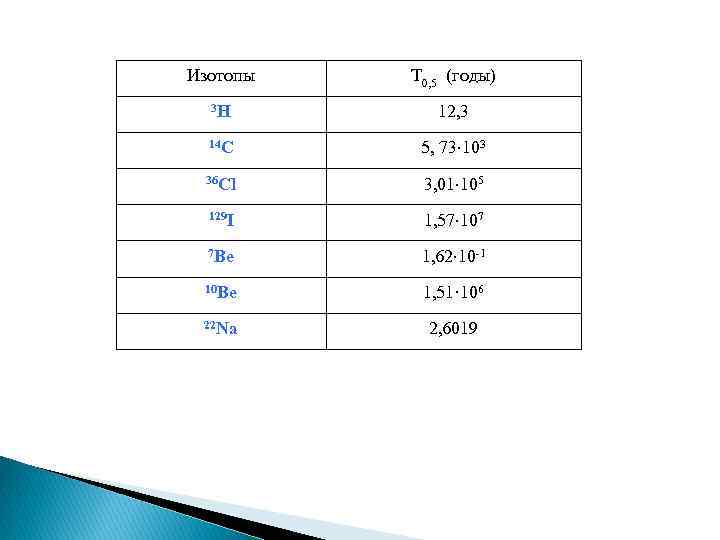 Изотопы T 0, 5 (годы) 3 H 12, 3 14 C 5, 73 103 36 Cl 3, 01 105 129 I 1, 57 107 7 Be 1, 62 10 -1 10 Be 1, 51· 106 22 Na 2, 6019
Изотопы T 0, 5 (годы) 3 H 12, 3 14 C 5, 73 103 36 Cl 3, 01 105 129 I 1, 57 107 7 Be 1, 62 10 -1 10 Be 1, 51· 106 22 Na 2, 6019
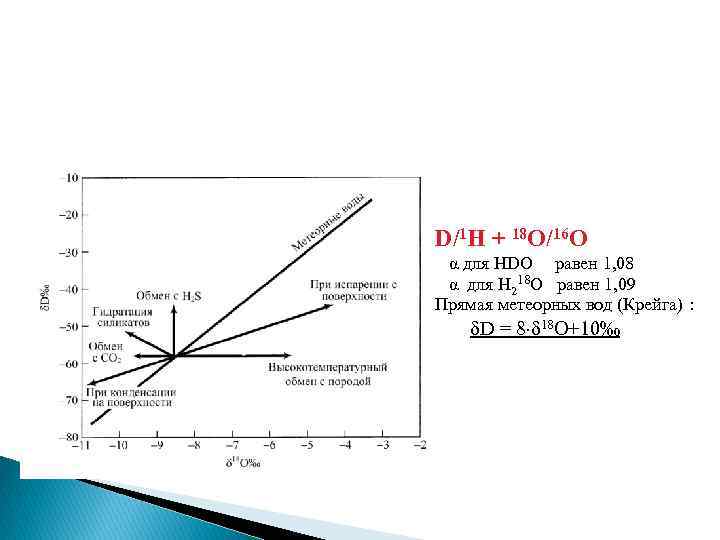 D/1 H + 18 O/16 O α для HDO равен 1, 08 α для H 218 O равен 1, 09 Прямая метеорных вод (Крейга) : D = 8 18 O+10‰
D/1 H + 18 O/16 O α для HDO равен 1, 08 α для H 218 O равен 1, 09 Прямая метеорных вод (Крейга) : D = 8 18 O+10‰
 2. Фракционирование стабильных изотопов Коэффициент фракционирования: Примеры: , , = Nбыло Nстало. Причины: а. Фазовые превращения (твердое вещество → жидкость → пар) б. Диффузия (при абсорбции, адсорбции и смешивании). . в. Химические реакции.
2. Фракционирование стабильных изотопов Коэффициент фракционирования: Примеры: , , = Nбыло Nстало. Причины: а. Фазовые превращения (твердое вещество → жидкость → пар) б. Диффузия (при абсорбции, адсорбции и смешивании). . в. Химические реакции.
 Тритий: T или 3 H, T 0, 5 =12, 3 лет, возраст вод до 40 лет. Измеряют в тритиевых единица: 1 TE = 1 атом 3 H на 1018 атомов 2 H. 1 TE =7, 088 распадам мин-1 кг-1 воды В атмосферных осадках обычно менее 20 ТЕ. Подземные воды с 0, 5 ТЕ старше 2006 -1952 лет. Подземные воды с выше 10 ТЕ моложе 2006 -1952 лет. Подземные воды с от 0, 5 и 10 ТЕ смесь тех и других вод. Радиоактиыный хлор: 36 Cl, T 0, 5 =3, 01 105 лет, возраст вод до 2 млн. лет Измеряется величиной отношения 36 Cl/Cl. В метеорных водах от 100 10 -15 до 500 10 -15.
Тритий: T или 3 H, T 0, 5 =12, 3 лет, возраст вод до 40 лет. Измеряют в тритиевых единица: 1 TE = 1 атом 3 H на 1018 атомов 2 H. 1 TE =7, 088 распадам мин-1 кг-1 воды В атмосферных осадках обычно менее 20 ТЕ. Подземные воды с 0, 5 ТЕ старше 2006 -1952 лет. Подземные воды с выше 10 ТЕ моложе 2006 -1952 лет. Подземные воды с от 0, 5 и 10 ТЕ смесь тех и других вод. Радиоактиыный хлор: 36 Cl, T 0, 5 =3, 01 105 лет, возраст вод до 2 млн. лет Измеряется величиной отношения 36 Cl/Cl. В метеорных водах от 100 10 -15 до 500 10 -15.
 Радиоуглерод: n+14 N→ 14 C+p , тыс. лет Измеряется в Бк/м 3 β-распада: Апр, T 0, 5 =5730 лет, возраст до 50 Стандарты: 1 - стандарта NBS (активности щавелевой кислоты, т. е. 13, 6 распад. /мин на 1 г углерода) 2 - стандарта современного радиоуглерода (активность на 1950 г. , т. е. 95% NBS с учетом изотопный состава углерода δ 13 C)
Радиоуглерод: n+14 N→ 14 C+p , тыс. лет Измеряется в Бк/м 3 β-распада: Апр, T 0, 5 =5730 лет, возраст до 50 Стандарты: 1 - стандарта NBS (активности щавелевой кислоты, т. е. 13, 6 распад. /мин на 1 г углерода) 2 - стандарта современного радиоуглерода (активность на 1950 г. , т. е. 95% NBS с учетом изотопный состава углерода δ 13 C)


