Lektsii_Gidrosfera.ppt
- Количество слайдов: 57
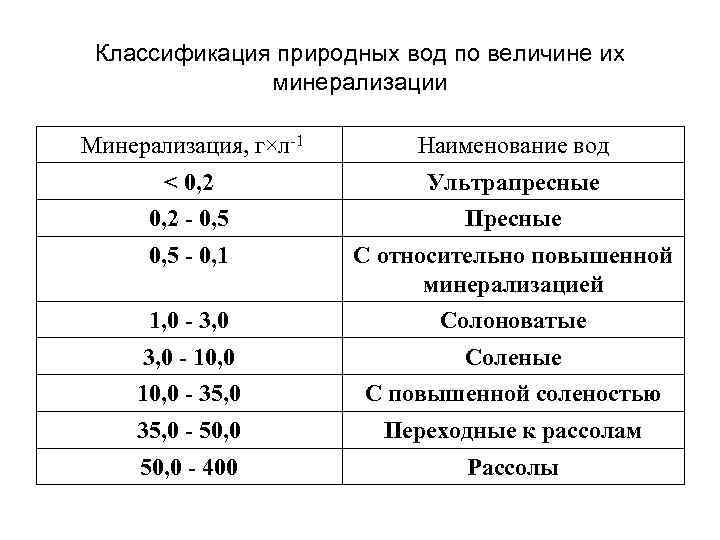 Классификация природных вод по величине их минерализации Минерализация, г×л-1 Наименование вод < 0, 2 Ультрапресные 0, 2 - 0, 5 Пресные 0, 5 - 0, 1 С относительно повышенной минерализацией 1, 0 - 3, 0 Солоноватые 3, 0 - 10, 0 Соленые 10, 0 - 35, 0 С повышенной соленостью 35, 0 - 50, 0 Переходные к рассолам 50, 0 - 400 Рассолы
Классификация природных вод по величине их минерализации Минерализация, г×л-1 Наименование вод < 0, 2 Ультрапресные 0, 2 - 0, 5 Пресные 0, 5 - 0, 1 С относительно повышенной минерализацией 1, 0 - 3, 0 Солоноватые 3, 0 - 10, 0 Соленые 10, 0 - 35, 0 С повышенной соленостью 35, 0 - 50, 0 Переходные к рассолам 50, 0 - 400 Рассолы
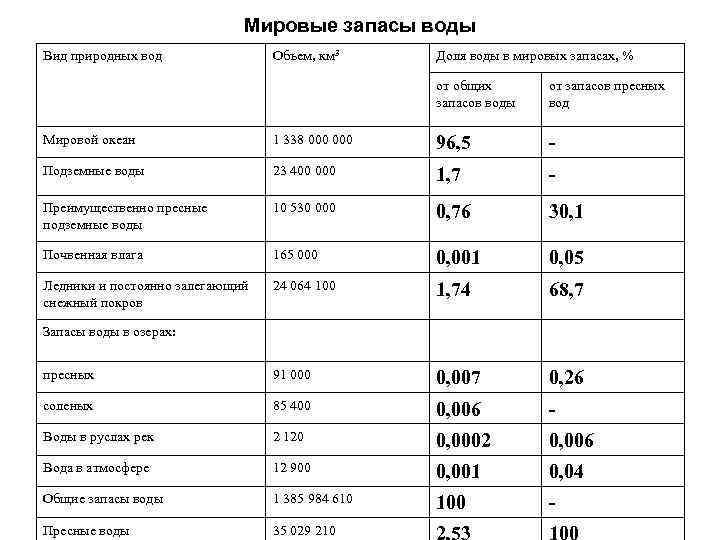 Мировые запасы воды Вид природных вод Объем, км 3 Доля воды в мировых запасах, % от общих от запасов пресных запасов воды вод Мировой океан 1 338 000 96, 5 - Подземные воды 23 400 000 1, 7 - Преимущественно пресные 10 530 000 0, 76 30, 1 подземные воды Почвенная влага 165 000 0, 001 0, 05 Ледники и постоянно залегающий 24 064 100 1, 74 68, 7 снежный покров Запасы воды в озерах: пресных 91 000 0, 007 0, 26 соленых 85 400 0, 006 - Воды в руслах рек 2 120 0, 0002 0, 006 Вода в атмосфере 12 900 0, 001 0, 04 Общие запасы воды 1 385 984 610 100 - Пресные воды 35 029 210
Мировые запасы воды Вид природных вод Объем, км 3 Доля воды в мировых запасах, % от общих от запасов пресных запасов воды вод Мировой океан 1 338 000 96, 5 - Подземные воды 23 400 000 1, 7 - Преимущественно пресные 10 530 000 0, 76 30, 1 подземные воды Почвенная влага 165 000 0, 001 0, 05 Ледники и постоянно залегающий 24 064 100 1, 74 68, 7 снежный покров Запасы воды в озерах: пресных 91 000 0, 007 0, 26 соленых 85 400 0, 006 - Воды в руслах рек 2 120 0, 0002 0, 006 Вода в атмосфере 12 900 0, 001 0, 04 Общие запасы воды 1 385 984 610 100 - Пресные воды 35 029 210
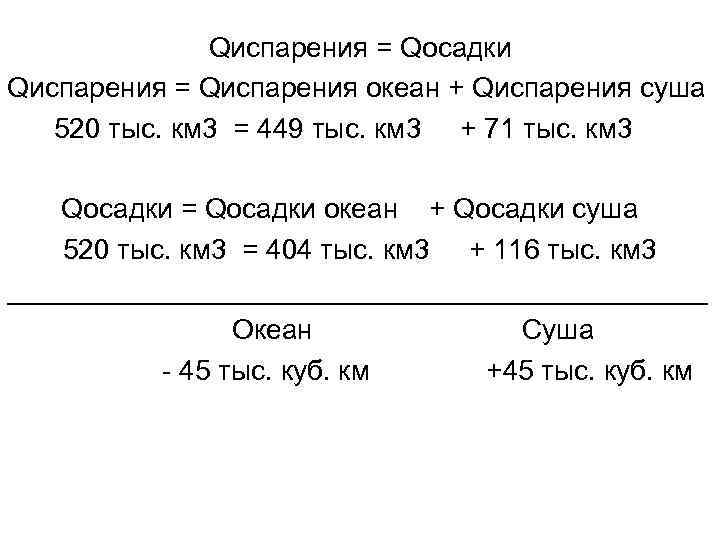 Qиспарения = Qосадки Qиспарения = Qиспарения океан + Qиспарения суша 520 тыс. км 3 = 449 тыс. км 3 + 71 тыс. км 3 Qосадки = Qосадки океан + Qосадки суша 520 тыс. км 3 = 404 тыс. км 3 + 116 тыс. км 3 _______________________ Океан Суша - 45 тыс. куб. км +45 тыс. куб. км
Qиспарения = Qосадки Qиспарения = Qиспарения океан + Qиспарения суша 520 тыс. км 3 = 449 тыс. км 3 + 71 тыс. км 3 Qосадки = Qосадки океан + Qосадки суша 520 тыс. км 3 = 404 тыс. км 3 + 116 тыс. км 3 _______________________ Океан Суша - 45 тыс. куб. км +45 тыс. куб. км
 • Примерный расход воды в мире • (тыс. км 3) • Сельское хозяйство 7 • Промышленность 1, 7 • Разбавление сточных вод 9 • В быту 0, 6 • Прочие 0, 4 • Подземный сток 13 • Итого 31, 7 • Остаток 13, 3
• Примерный расход воды в мире • (тыс. км 3) • Сельское хозяйство 7 • Промышленность 1, 7 • Разбавление сточных вод 9 • В быту 0, 6 • Прочие 0, 4 • Подземный сток 13 • Итого 31, 7 • Остаток 13, 3
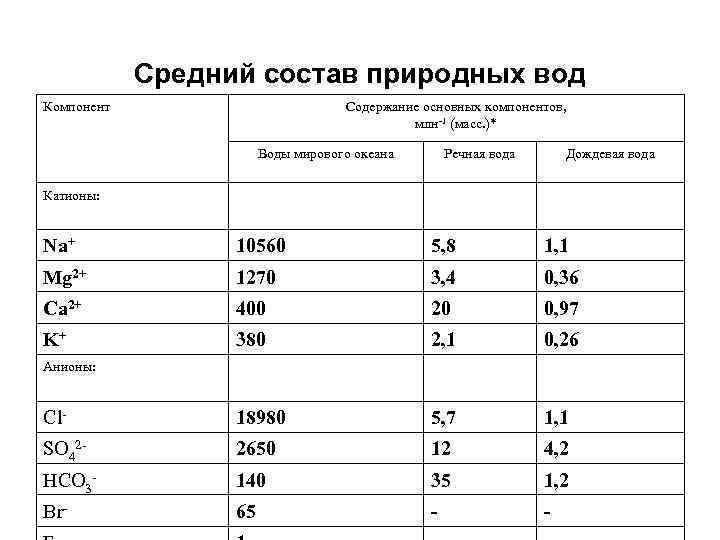 Средний состав природных вод Компонент Содержание основных компонентов, млн-1 (масс. )* Воды мирового океана Речная вода Дождевая вода Катионы: Na+ 10560 5, 8 1, 1 Mg 2+ 1270 3, 4 0, 36 Ca 2+ 400 20 0, 97 K+ 380 2, 1 0, 26 Анионы: Cl- 18980 5, 7 1, 1 SO 42 - 2650 12 4, 2 HCO 3 - 140 35 1, 2 Br- 65 -
Средний состав природных вод Компонент Содержание основных компонентов, млн-1 (масс. )* Воды мирового океана Речная вода Дождевая вода Катионы: Na+ 10560 5, 8 1, 1 Mg 2+ 1270 3, 4 0, 36 Ca 2+ 400 20 0, 97 K+ 380 2, 1 0, 26 Анионы: Cl- 18980 5, 7 1, 1 SO 42 - 2650 12 4, 2 HCO 3 - 140 35 1, 2 Br- 65 -
 Основные процессы формирования химического состава природных вод При формировании химического состава природных вод принято выделять прямые и косвенные, а также главные и второстепенные факторы, влияющие на содержание в них растворенных компонентов. По характеру воздействия на формирования состава природных вод все факторы делят на 5 групп: Физико-географические (рельеф, климат и т. п. ); Геологические (вид горных пород, гидрогеологические условия и т. п. ); Биологические (деятельность живых организмов); Антропогенные (состав сточных вод, состав твердых отходов и т. п. ) Физико- химические (химические свойства соединений, кислотно- основные и окислительно-восстановительные условия и др. ).
Основные процессы формирования химического состава природных вод При формировании химического состава природных вод принято выделять прямые и косвенные, а также главные и второстепенные факторы, влияющие на содержание в них растворенных компонентов. По характеру воздействия на формирования состава природных вод все факторы делят на 5 групп: Физико-географические (рельеф, климат и т. п. ); Геологические (вид горных пород, гидрогеологические условия и т. п. ); Биологические (деятельность живых организмов); Антропогенные (состав сточных вод, состав твердых отходов и т. п. ) Физико- химические (химические свойства соединений, кислотно- основные и окислительно-восстановительные условия и др. ).
 Жесткость природных вод Жесткостью воды называется свойство воды, обусловленное содержанием в ней ионов кальция и магния. Ж = [Са 2+]*f (Ca) /M (Ca) + [Mg 2+]*f (Mg) /M (Mg) Ж = [Са 2+]/ 20, 04 + [Mg 2+]/ 12, 156 [Са 2+] и [Mg 2+] в мг/л Ж – моль/куб. м
Жесткость природных вод Жесткостью воды называется свойство воды, обусловленное содержанием в ней ионов кальция и магния. Ж = [Са 2+]*f (Ca) /M (Ca) + [Mg 2+]*f (Mg) /M (Mg) Ж = [Са 2+]/ 20, 04 + [Mg 2+]/ 12, 156 [Са 2+] и [Mg 2+] в мг/л Ж – моль/куб. м
 По величине общей жесткости природные воды принято делить на ряд групп: вода очень мягкая - Ж < 1, 5 моль/куб. м; вода мягкая - 1, 5 моль/куб. м < Ж < 3, 0 моль/куб. м; вода средней жесткости - моль/куб. м < Ж < 5, 4 моль/куб. м; вода жесткая - 5, 4 моль/куб. м < Ж < 10, 7 моль/куб. м; вода очень жесткая - 10, 7 моль/куб. м < Ж.
По величине общей жесткости природные воды принято делить на ряд групп: вода очень мягкая - Ж < 1, 5 моль/куб. м; вода мягкая - 1, 5 моль/куб. м < Ж < 3, 0 моль/куб. м; вода средней жесткости - моль/куб. м < Ж < 5, 4 моль/куб. м; вода жесткая - 5, 4 моль/куб. м < Ж < 10, 7 моль/куб. м; вода очень жесткая - 10, 7 моль/куб. м < Ж.
 Немецкий градус жесткости соответствует содержанию в воде 10, 0 мг/л Са. О. Один Французкий градус жесткости соответствует содержанию в воде 10 мг/л Са. СО 3. Один американский градус жесткости соответствует содержанию в воде 1 мг/л Са. СО 3. 1 моль/куб. м = 2, 804 Немецких градуса жесткости; 1 моль/куб. м = 5, 005 Французских градуса жесткости; 1 моль/куб. м = 50, 050 Американских градусов жесткости.
Немецкий градус жесткости соответствует содержанию в воде 10, 0 мг/л Са. О. Один Французкий градус жесткости соответствует содержанию в воде 10 мг/л Са. СО 3. Один американский градус жесткости соответствует содержанию в воде 1 мг/л Са. СО 3. 1 моль/куб. м = 2, 804 Немецких градуса жесткости; 1 моль/куб. м = 5, 005 Французских градуса жесткости; 1 моль/куб. м = 50, 050 Американских градусов жесткости.
 Растворимость карбонатов и р. Н подземных и поверхностных природных вод Процесс непосредственного растворения карбоната кальция по уравнению: Ca. CO 3 = Ca 2+ + CO 32 - Ca. CO 3 + CO 2 (р-р) = Ca 2+ + 2 НCO 3 - При равновесии с карбонатными породами р. Н поверхностных вод должен составлять 7, 3 -8, 4
Растворимость карбонатов и р. Н подземных и поверхностных природных вод Процесс непосредственного растворения карбоната кальция по уравнению: Ca. CO 3 = Ca 2+ + CO 32 - Ca. CO 3 + CO 2 (р-р) = Ca 2+ + 2 НCO 3 - При равновесии с карбонатными породами р. Н поверхностных вод должен составлять 7, 3 -8, 4
 Щелочность природных вод Одной из важнейших особенностей большинства природных вод является способность нейтрализовать ионы водорода. Эта способность называется щелочностью воды и определяется экспериментально при титровании пробы воды сильной кислотой, обычно HCl, в присутствии фенолфталеина (р. Н перехода окраски 8, 3) и затем метилоранжа (р. Н перехода ) краски 4, 5 Щ = [HCO 3 - ] +2 [CO 32 - ] +[OH-] (моль/л) Основными компонентами, ответственными за процессы связывания ионов водорода, в большинстве природных вод являются ионы HCO 3 -
Щелочность природных вод Одной из важнейших особенностей большинства природных вод является способность нейтрализовать ионы водорода. Эта способность называется щелочностью воды и определяется экспериментально при титровании пробы воды сильной кислотой, обычно HCl, в присутствии фенолфталеина (р. Н перехода окраски 8, 3) и затем метилоранжа (р. Н перехода ) краски 4, 5 Щ = [HCO 3 - ] +2 [CO 32 - ] +[OH-] (моль/л) Основными компонентами, ответственными за процессы связывания ионов водорода, в большинстве природных вод являются ионы HCO 3 -
 Процессы закисления поверхностных водоемов В нормальном водоеме, Щ =1 ммоль/л р. Н =7, 8 -8, 3 Несмотря на поступление кислых осадков, р. Н практически не меняется. Ионы гидрокарбоната, присутствующие в поверхностных водоемах, успевают полностью нейтрализовать поступающие ионы Н+: НСО 3 - + Н+ = Н 2 О + СО 2
Процессы закисления поверхностных водоемов В нормальном водоеме, Щ =1 ммоль/л р. Н =7, 8 -8, 3 Несмотря на поступление кислых осадков, р. Н практически не меняется. Ионы гидрокарбоната, присутствующие в поверхностных водоемах, успевают полностью нейтрализовать поступающие ионы Н+: НСО 3 - + Н+ = Н 2 О + СО 2
 Процессы закисления поверхностных водоемов Первый этап. Щ=0, 1 ммоль/л Обычно р. Н =7 -8. В период интесивного поступления кислых дождей р. Н снижается до р. Н = 5, 5 С прекращением интенсивного поступления кислых осадков водоем переходит в обычное состояние, р. Н поднимается до первоначальных значений. Второй этап Щ – менее 0, 1 ммоль/л р. Н воды обычно не поднимается выше 5, 5 в течение всего года (отсутствует контакт с карбонатными породами); О таких водоемах обычно говорят как об умеренно кислых.
Процессы закисления поверхностных водоемов Первый этап. Щ=0, 1 ммоль/л Обычно р. Н =7 -8. В период интесивного поступления кислых дождей р. Н снижается до р. Н = 5, 5 С прекращением интенсивного поступления кислых осадков водоем переходит в обычное состояние, р. Н поднимается до первоначальных значений. Второй этап Щ – менее 0, 1 ммоль/л р. Н воды обычно не поднимается выше 5, 5 в течение всего года (отсутствует контакт с карбонатными породами); О таких водоемах обычно говорят как об умеренно кислых.
 Процессы закисления поверхностных водоемов Третий этап закисления Щ = 0; р. Н водоемов стабилизируется на значениях р. Н<5 (обычно р. Н=4, 5), даже если атмосферные осадки имеют более высокие значения р. Н. Это связано с присутствием гумусовых веществ и соединений алюминия в водоемах и почвенном слое. Гумусовые соединения в основном представлены в водоемах растворами слабых органических кислот, имеющими р. Н<5. Связывая или выделяя ионы Н+, эти кислоты стабилизируют значение р. Н в водоеме.
Процессы закисления поверхностных водоемов Третий этап закисления Щ = 0; р. Н водоемов стабилизируется на значениях р. Н<5 (обычно р. Н=4, 5), даже если атмосферные осадки имеют более высокие значения р. Н. Это связано с присутствием гумусовых веществ и соединений алюминия в водоемах и почвенном слое. Гумусовые соединения в основном представлены в водоемах растворами слабых органических кислот, имеющими р. Н<5. Связывая или выделяя ионы Н+, эти кислоты стабилизируют значение р. Н в водоеме.
 Окислительно-восстановительные процессы в гидросфере Окислительно-восстановительные реакции исключительно важную роль в описании процессов протекающих в природных водоемах. Предыстория и качество природных вод в значительной степени зависят от вида окислительно-восстановительных реакций, их кинетических характеристик и величины окислительно-восстановительного потенциала, который соответствовал бы данной системе при установлении равновесия.
Окислительно-восстановительные процессы в гидросфере Окислительно-восстановительные реакции исключительно важную роль в описании процессов протекающих в природных водоемах. Предыстория и качество природных вод в значительной степени зависят от вида окислительно-восстановительных реакций, их кинетических характеристик и величины окислительно-восстановительного потенциала, который соответствовал бы данной системе при установлении равновесия.
 Процесс окисления органического вещества общей формулой {CH 2 О} можно представить следующим уравнением реакции: {CH 2 О} + О 2 = СО 2 + Н 2 О • В связи с отсутствием, по условию примера, дополнительного поступления кислорода, максимальное количество органического вещества, которое может быть окисленно в воде будет определяться содержанием кислорода в воде, которое будет соответствовать условиям равновесия с воздухом, устанавливающимся до начала процесса окисления. При равновесии приземным воздухом это количество составит [С(кисл. )] = К Г(кисл. ) * Р (кисл. )= 8, 3 мг/л
Процесс окисления органического вещества общей формулой {CH 2 О} можно представить следующим уравнением реакции: {CH 2 О} + О 2 = СО 2 + Н 2 О • В связи с отсутствием, по условию примера, дополнительного поступления кислорода, максимальное количество органического вещества, которое может быть окисленно в воде будет определяться содержанием кислорода в воде, которое будет соответствовать условиям равновесия с воздухом, устанавливающимся до начала процесса окисления. При равновесии приземным воздухом это количество составит [С(кисл. )] = К Г(кисл. ) * Р (кисл. )= 8, 3 мг/л
 СТРАТИФИКАЦИЯ ВОДОЕМОВ • Разделение водоема на слои при температурной стратификации • Верхний слой ЭПИЛИМНИОН Средний слой Зона термоклина Нижний слой гиполимнион
СТРАТИФИКАЦИЯ ВОДОЕМОВ • Разделение водоема на слои при температурной стратификации • Верхний слой ЭПИЛИМНИОН Средний слой Зона термоклина Нижний слой гиполимнион
 Эфтрофикация (эвтрофикация)водоемов. • повышение биологической продуктивности водных экосистем в результате накопления в воде биогенных элементов естественного или антропогенного происхождения. Обогащение водоема биогенными элементами (N, Р и др. ), поступающими со сточными водами, а также с поверхностным стоком с удобряемых полей, приводит к “цветению” воды и к резкому ухудшению ее качества.
Эфтрофикация (эвтрофикация)водоемов. • повышение биологической продуктивности водных экосистем в результате накопления в воде биогенных элементов естественного или антропогенного происхождения. Обогащение водоема биогенными элементами (N, Р и др. ), поступающими со сточными водами, а также с поверхностным стоком с удобряемых полей, приводит к “цветению” воды и к резкому ухудшению ее качества.
 БИОГЕНЫ - нитрат, фосфат, калий - ионы: • Удобрения • Отходы животноводства • Отходы человека • Фосфат- содержащие моющие средства.
БИОГЕНЫ - нитрат, фосфат, калий - ионы: • Удобрения • Отходы животноводства • Отходы человека • Фосфат- содержащие моющие средства.
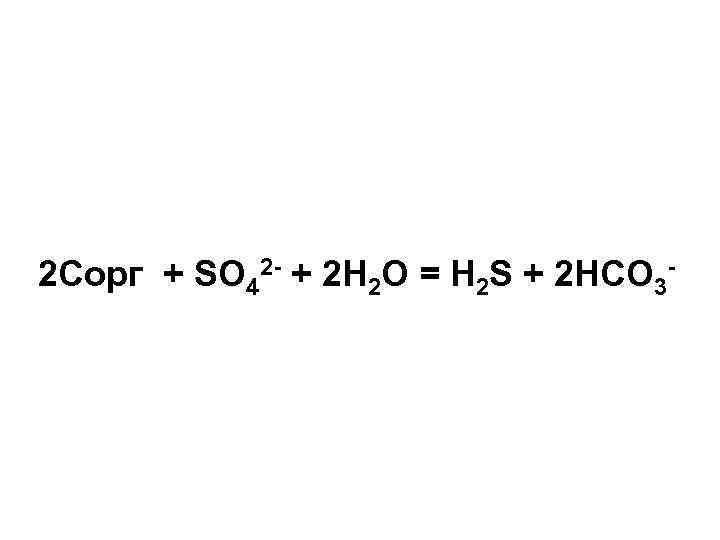 2 Cорг + SO 42 - + 2 H 2 O = H 2 S + 2 HCO 3 -
2 Cорг + SO 42 - + 2 H 2 O = H 2 S + 2 HCO 3 -
 ФОТОСИНТЕЗ в ВОДОЕМЕ C 106 H 263 O 110 N 16 P + 138 О 2 ОКИСЛЕНИЕ МЕРТВОЙ ОРГАНИКИ 1 молекула фитопланктона -138 О 2
ФОТОСИНТЕЗ в ВОДОЕМЕ C 106 H 263 O 110 N 16 P + 138 О 2 ОКИСЛЕНИЕ МЕРТВОЙ ОРГАНИКИ 1 молекула фитопланктона -138 О 2

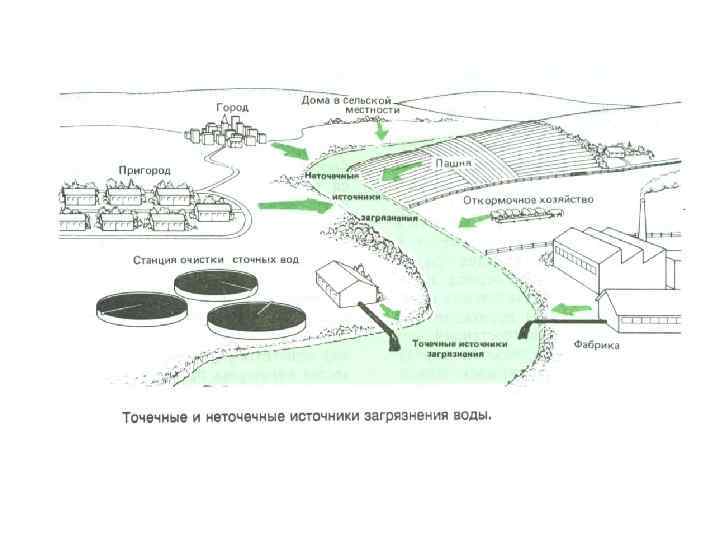
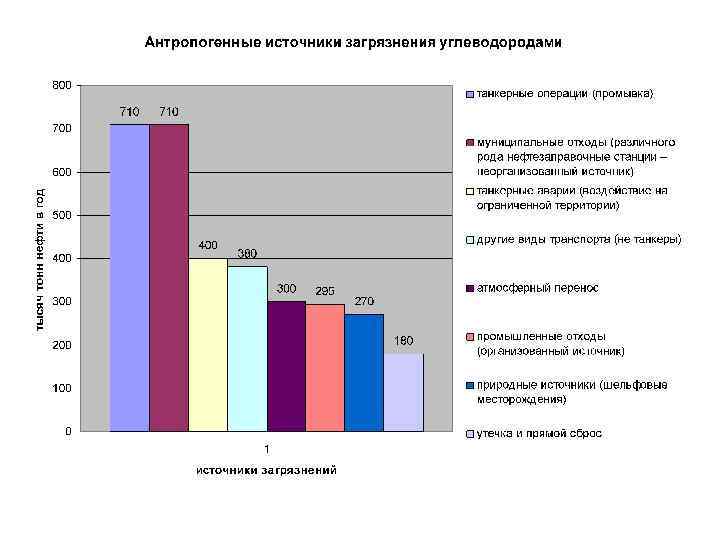
 Антропогенное загрязнение воды. • Для природных вод характерны следующие катионы: Са 2+, Mg 2+, и анионы: СО 32 -, НСО 3 -, SO 42 -, Cl-, Br- (для морской воды). В результате антропогенной деятельности в водоемы поступают ионы тяжелых металлов. Источники: гальванические и металлургические производства, химические средства защиты растений (пестициды, гербициды и др. ).
Антропогенное загрязнение воды. • Для природных вод характерны следующие катионы: Са 2+, Mg 2+, и анионы: СО 32 -, НСО 3 -, SO 42 -, Cl-, Br- (для морской воды). В результате антропогенной деятельности в водоемы поступают ионы тяжелых металлов. Источники: гальванические и металлургические производства, химические средства защиты растений (пестициды, гербициды и др. ).
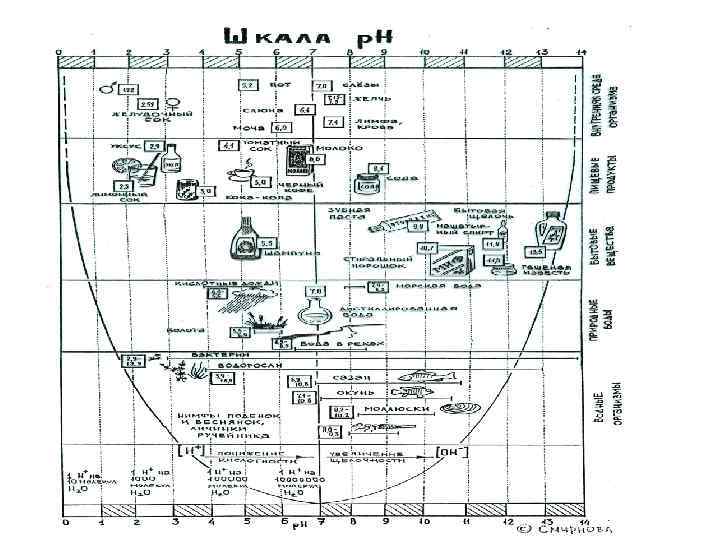
 Питьевая вода. параметры качества. • Соленость • Цветность • Запах • Сoli –титр • Интегральная характеристика загрязненности 1. химическая потребность в кислороде 2. биологическая потребность в кислороде.
Питьевая вода. параметры качества. • Соленость • Цветность • Запах • Сoli –титр • Интегральная характеристика загрязненности 1. химическая потребность в кислороде 2. биологическая потребность в кислороде.
 Соленость, или общая минерализация • Общая минерализация представляет собой суммарный количественный показатель содержания растворенных в воде веществ. , которые находятся именно в виде солей. К числу наиболее распространенных относятся неорганические соли • бикарбонаты • хлориды • сульфаты кальция, магния, калия и натрия • небольшое количество органических веществ, растворимых в воде
Соленость, или общая минерализация • Общая минерализация представляет собой суммарный количественный показатель содержания растворенных в воде веществ. , которые находятся именно в виде солей. К числу наиболее распространенных относятся неорганические соли • бикарбонаты • хлориды • сульфаты кальция, магния, калия и натрия • небольшое количество органических веществ, растворимых в воде
 Классификация по солесодержанию • 0, 2 г/л ультрапресная • 0, 2 -0, 5 пресная • 0, 5 -1 с относительно повышенной минерализацией • 1 -3 солоноватая • 3 -10 соленая • 10 -35 с повышенной соленостью • 35 -50 переходная к рассолам • 50 -400 рассолы • 400 в природе не встречаются
Классификация по солесодержанию • 0, 2 г/л ультрапресная • 0, 2 -0, 5 пресная • 0, 5 -1 с относительно повышенной минерализацией • 1 -3 солоноватая • 3 -10 соленая • 10 -35 с повышенной соленостью • 35 -50 переходная к рассолам • 50 -400 рассолы • 400 в природе не встречаются
 Цветность. • Определяется по отношению к эталону и измеряется в градусах цветности. Эталоном является раствор соли платины (K 2 Pt. Cl 6) такой концентрации, когда в 1 мл воды содержится 0, 1 мг платины. • Максимальная цветность питьевой воды составляет 20 градусов, цветность средней природной воды 35 - 55 градусов, но есть вода и с цветностью 200 градусов (болото). Цветность природной воды связана с растворенным органическим веществом – гуминовыми веществами и с железом Fe 2+/Fe 3+. • Практически любую природную воду, перед тем, как пить, нужно обесцвечивать – очищать. Одно из самых эффективных средств очистки – Al 2(SO 4)3, который при диссоциации образует гидроксид алюминия Al(OH)3 – объемный осадок, на который сорбируются соединения железо и гуминовые вещества.
Цветность. • Определяется по отношению к эталону и измеряется в градусах цветности. Эталоном является раствор соли платины (K 2 Pt. Cl 6) такой концентрации, когда в 1 мл воды содержится 0, 1 мг платины. • Максимальная цветность питьевой воды составляет 20 градусов, цветность средней природной воды 35 - 55 градусов, но есть вода и с цветностью 200 градусов (болото). Цветность природной воды связана с растворенным органическим веществом – гуминовыми веществами и с железом Fe 2+/Fe 3+. • Практически любую природную воду, перед тем, как пить, нужно обесцвечивать – очищать. Одно из самых эффективных средств очистки – Al 2(SO 4)3, который при диссоциации образует гидроксид алюминия Al(OH)3 – объемный осадок, на который сорбируются соединения железо и гуминовые вещества.
 Запах • Определяется органолептически, специального прибора нет. Измеряется в градусах.
Запах • Определяется органолептически, специального прибора нет. Измеряется в градусах.
 Coli-титр • Кишечная палочка – один из простейших живых организмов, находится в кишечнике любого человека. • Количество кишечных палочек в 1 мл воды – показатель бактериальной загрязненности. В норме их количество не должно превышать 4 шт/л
Coli-титр • Кишечная палочка – один из простейших живых организмов, находится в кишечнике любого человека. • Количество кишечных палочек в 1 мл воды – показатель бактериальной загрязненности. В норме их количество не должно превышать 4 шт/л
 Интегральная характеристика загрязненности • а) Химическая потребность в кислороде Это количество кислорода, необходимое для окисления примесей в 1 литре сточной воды, когда окисление происходит химическим путем. Для определения ХПК проводят окисление примесей перманганатом калия (KMn. O 4) при нагревании, затем количество перманганата, израсходованного на окисление, пересчитывают на количество кислорода. В соответствии с требованиями к составу и свойствам воды водоемов у пунктов питьевого водопользования величина ХПК не должна превышать 15 мг. О 2/дм 3.
Интегральная характеристика загрязненности • а) Химическая потребность в кислороде Это количество кислорода, необходимое для окисления примесей в 1 литре сточной воды, когда окисление происходит химическим путем. Для определения ХПК проводят окисление примесей перманганатом калия (KMn. O 4) при нагревании, затем количество перманганата, израсходованного на окисление, пересчитывают на количество кислорода. В соответствии с требованиями к составу и свойствам воды водоемов у пунктов питьевого водопользования величина ХПК не должна превышать 15 мг. О 2/дм 3.
 Интегральная характеристика загрязненности • б) Биологическая потребность в кислороде Это количество кислорода, необходимое для окисления примесей в 1 литре сточной воды, когда окисление происходит биологическим путем, за счет деятельности микроорганизмов.
Интегральная характеристика загрязненности • б) Биологическая потребность в кислороде Это количество кислорода, необходимое для окисления примесей в 1 литре сточной воды, когда окисление происходит биологическим путем, за счет деятельности микроорганизмов.
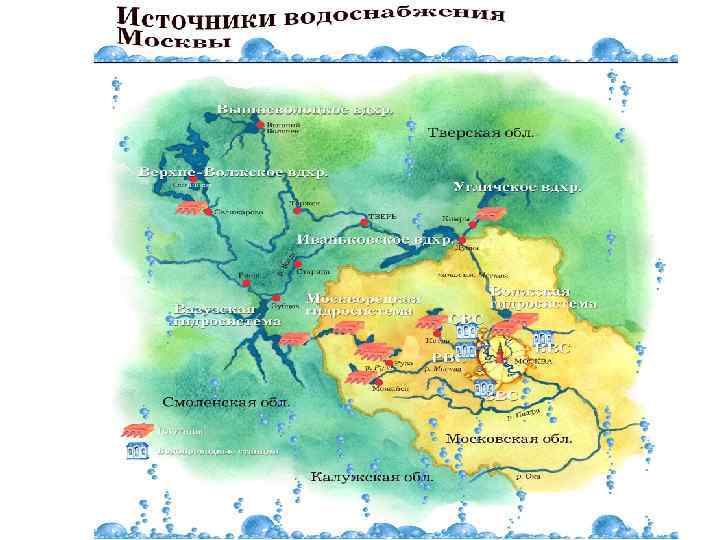
 Водоснабжение города Москвы • Источники водоснабжения: Москва-река и Волга • 13 водохранилищ • 4 гидротехнических узла • 4 станции водоподготовки: Рублевская, Восточная, Северная, Западная суммарной мощностью 6, 7 млн. куб. м воды в сутки • 18 насосных станций и регулирующих узлов • Более 10 тыс. км сетей • Качество питьевой воды контролируется по 180 показателям и соответствует российским нормативам • Количество обслуживаемого населения 11 млн. жителей Москвы и Московской области
Водоснабжение города Москвы • Источники водоснабжения: Москва-река и Волга • 13 водохранилищ • 4 гидротехнических узла • 4 станции водоподготовки: Рублевская, Восточная, Северная, Западная суммарной мощностью 6, 7 млн. куб. м воды в сутки • 18 насосных станций и регулирующих узлов • Более 10 тыс. км сетей • Качество питьевой воды контролируется по 180 показателям и соответствует российским нормативам • Количество обслуживаемого населения 11 млн. жителей Москвы и Московской области
 Москва использует два независимых источника водоснабжения Ø Волжский(71%) Ø Москворецкий(26%), Ø подземные воды(3%) Ø т. е. практически полностью снабжается водой из поверхностных источников, расположенных на территории Московской, Смоленской и Тверской областей. Общее водопотребление 3 км 3/год на одного человека
Москва использует два независимых источника водоснабжения Ø Волжский(71%) Ø Москворецкий(26%), Ø подземные воды(3%) Ø т. е. практически полностью снабжается водой из поверхностных источников, расположенных на территории Московской, Смоленской и Тверской областей. Общее водопотребление 3 км 3/год на одного человека
 Источники водоснабжения • Волжский источник включает в себя Иваньковское водохранилище, • канал им. Москвы и водохранилища : Икшинское, Пестовское, Пяловское, Клязьминское, Учинское. • Волжская вода поступает на Северную и Восточную водопроводные станции
Источники водоснабжения • Волжский источник включает в себя Иваньковское водохранилище, • канал им. Москвы и водохранилища : Икшинское, Пестовское, Пяловское, Клязьминское, Учинское. • Волжская вода поступает на Северную и Восточную водопроводные станции
 Источники водоснабжения • В состав Москворецкого источника входят Можайское, Рузское, Озернинское, Истринское водохранилища и • реки Москва, Руза, Озерна, Истра как тракты водоподачи. • • Москворецкая вода поступает на Рублевскую и Западную водопроводные станции.
Источники водоснабжения • В состав Москворецкого источника входят Можайское, Рузское, Озернинское, Истринское водохранилища и • реки Москва, Руза, Озерна, Истра как тракты водоподачи. • • Москворецкая вода поступает на Рублевскую и Западную водопроводные станции.
 Источники водоснабжения • Объединяет эти источники Вазузская гидротехническая система, состоящая из Вазузского, Яузского, Верхне- Рузского водохранилищ и каналов Гжать-Яуза, Яуза-Руза. • Переброска воды может осуществляться как в р. Москву через р. Рузу, так и непосредственно в р. Волгу через Зубцовский гидроузел
Источники водоснабжения • Объединяет эти источники Вазузская гидротехническая система, состоящая из Вазузского, Яузского, Верхне- Рузского водохранилищ и каналов Гжать-Яуза, Яуза-Руза. • Переброска воды может осуществляться как в р. Москву через р. Рузу, так и непосредственно в р. Волгу через Зубцовский гидроузел
 Источники водоснабжения • Площадь водосбора Москворецко- Вазузской водной системы равна 15 тыс. км 2, • Волжской - 40 тыс. км 2.
Источники водоснабжения • Площадь водосбора Москворецко- Вазузской водной системы равна 15 тыс. км 2, • Волжской - 40 тыс. км 2.
 Особенности водного хозяйства Московского региона • ограниченность водных ресурсов, что влечет за собой привлечение дополнительных источников водоснабжения, находящихся на расстоянии 150– 200 км от Москвы; • сложное водопользование в условиях зарегулированных водоемов, которые одновременно используются для хозяйственно- бытовых и культурно-бытовых целей, судоходства, выработки электроэнергии, сельскохозяйственного орошения, приема возрастающего количества недостаточно очищенных сточных вод; • стабилизация загрязнения водоемов, в том числе источников питьевого водоснабжения; • рост численности населения и растущие потребности москвичей в использовании водоемов для отдыха
Особенности водного хозяйства Московского региона • ограниченность водных ресурсов, что влечет за собой привлечение дополнительных источников водоснабжения, находящихся на расстоянии 150– 200 км от Москвы; • сложное водопользование в условиях зарегулированных водоемов, которые одновременно используются для хозяйственно- бытовых и культурно-бытовых целей, судоходства, выработки электроэнергии, сельскохозяйственного орошения, приема возрастающего количества недостаточно очищенных сточных вод; • стабилизация загрязнения водоемов, в том числе источников питьевого водоснабжения; • рост численности населения и растущие потребности москвичей в использовании водоемов для отдыха
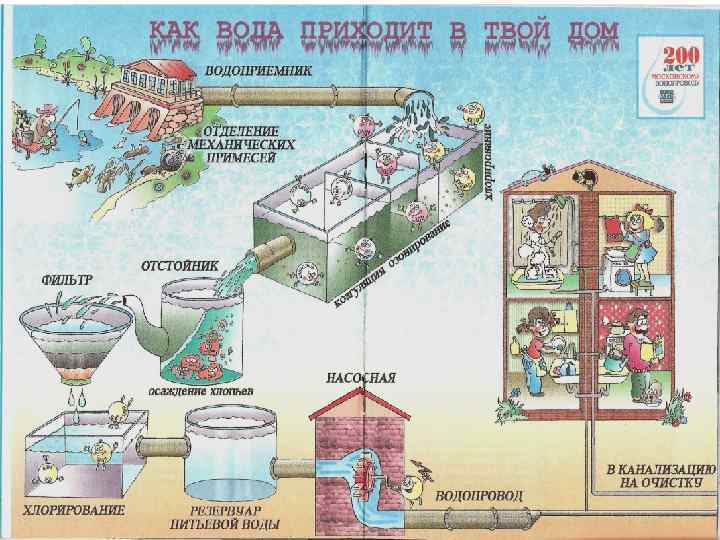
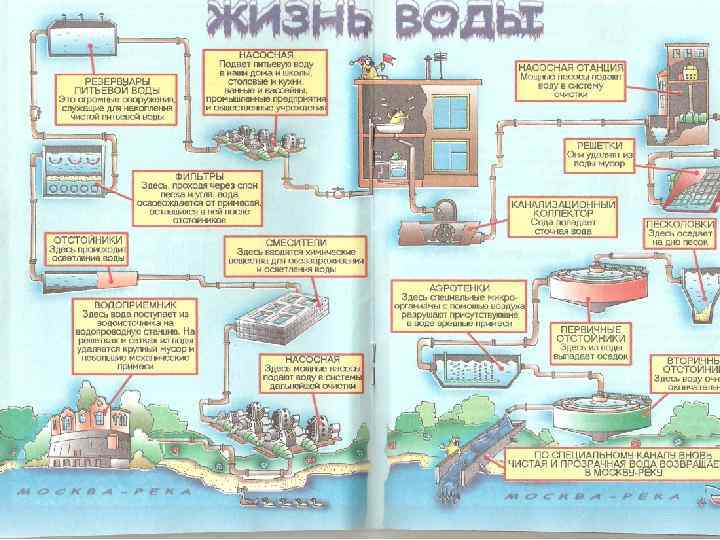
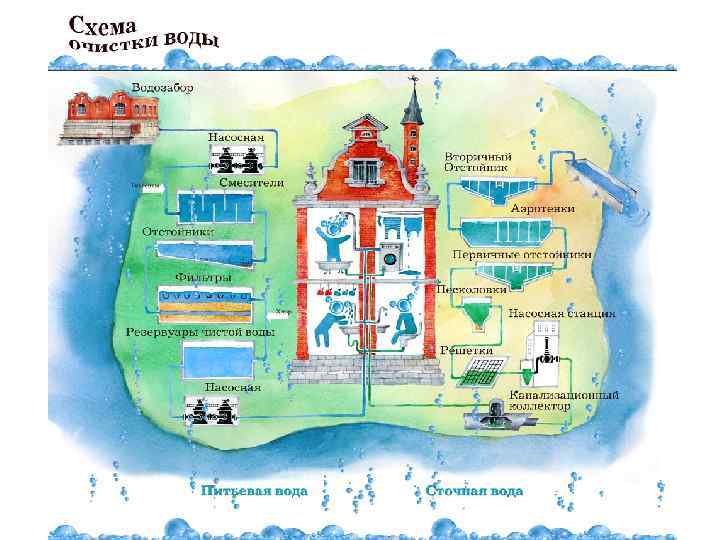
 Технология подготовки питьевой воды • Все водопроводные станции работают по классической двухступенной схеме очистки воды, • 1 стадия: коагулирование и осветление воды в отстойниках и фильтровании через кварцевый песок. • 2 стадия: Обеззараживание хлором с добавлением аммиаксодержащего реагента для обеспечения надлежащего санитарного состояния протяженной распределительной сети, независимо от наличия в технологической схеме озонирования воды. • Такая практика типична не только для Москвы, но и для многих крупных городов мира (Париж, Лондон и др. ), имеющих протяженную водопроводную сеть. • Это связано с сильными бактерицидными свойствами связанного хлора, длительное действие которого позволяет поддерживать городскую водопроводную сеть в надлежащем санитарном состоянии.
Технология подготовки питьевой воды • Все водопроводные станции работают по классической двухступенной схеме очистки воды, • 1 стадия: коагулирование и осветление воды в отстойниках и фильтровании через кварцевый песок. • 2 стадия: Обеззараживание хлором с добавлением аммиаксодержащего реагента для обеспечения надлежащего санитарного состояния протяженной распределительной сети, независимо от наличия в технологической схеме озонирования воды. • Такая практика типична не только для Москвы, но и для многих крупных городов мира (Париж, Лондон и др. ), имеющих протяженную водопроводную сеть. • Это связано с сильными бактерицидными свойствами связанного хлора, длительное действие которого позволяет поддерживать городскую водопроводную сеть в надлежащем санитарном состоянии.
 Рублевская станция водоподготовки • Станция пущена в эксплуатацию в 1903 году • . За более чем 100 -летний период работы сооружения станции неоднократно реконструировались. • На одном из новых блоков внедрена современная технология подготовки питьевой воды с применением озонирования и сорбции на активном угле • В настоящее время ее мощность составляет 1, 68 млн. куб. м в сутки. • Станция подает питьевую воду в западную и северо- западную части города.
Рублевская станция водоподготовки • Станция пущена в эксплуатацию в 1903 году • . За более чем 100 -летний период работы сооружения станции неоднократно реконструировались. • На одном из новых блоков внедрена современная технология подготовки питьевой воды с применением озонирования и сорбции на активном угле • В настоящее время ее мощность составляет 1, 68 млн. куб. м в сутки. • Станция подает питьевую воду в западную и северо- западную части города.
 Восточная станция водоподготовки Станция введена в эксплуатацию в 1937 году одновременно с каналом им. Москвы. • В 1975 году на станции построена установка по озонированию воды, которая позволяет, при необходимости, озонировать весь объем воды, обрабатываемый на станции. • Производительность станции – 1, 4 млн. куб. м в сутки. • Вода подается, в основном, в восточные и юго-восточные районы города.
Восточная станция водоподготовки Станция введена в эксплуатацию в 1937 году одновременно с каналом им. Москвы. • В 1975 году на станции построена установка по озонированию воды, которая позволяет, при необходимости, озонировать весь объем воды, обрабатываемый на станции. • Производительность станции – 1, 4 млн. куб. м в сутки. • Вода подается, в основном, в восточные и юго-восточные районы города.
 Северная станция водоподготовки • Станция начала работать в 1952 году. Ее мощность составляет 1, 92 млн. куб. м в сутки. Станция обеспечивает питьевой водой северную часть столицы и Зеленоград. •
Северная станция водоподготовки • Станция начала работать в 1952 году. Ее мощность составляет 1, 92 млн. куб. м в сутки. Станция обеспечивает питьевой водой северную часть столицы и Зеленоград. •
 Западная станция водоподготовки • Станция начала подавать в город воду в 1964 году, обеспечивая водоснабжение южных и юго-западных районов. • Производительность станции – 1, 7 млн. куб. м в сутки.
Западная станция водоподготовки • Станция начала подавать в город воду в 1964 году, обеспечивая водоснабжение южных и юго-западных районов. • Производительность станции – 1, 7 млн. куб. м в сутки.
 Юго-Западная водопроводная станция • введена в эксплуатацию в декабре 2006 года • Новая станция мощностью 250 тысяч кубометров воды в сутки создана не для увеличения объемов подачи воды, а, прежде всего, для получения воды нового качества. • Технологическая схема очистки воды ЮЗВС, кроме традиционных стадий осветления и обеззараживания, включает двухступенчатое озонирование с использованием активированного угля и впервые в Москве, да и во всей России - мембранное фильтрование. • Такая ультрасовременная технология исключит попадание в питьевую воду токсичных органических соединений, болезнетворных микроорганизмов паразитарной, бактериальной и вирусной природы, а также обеспечит ее полную дезодорацию (удаление запаха).
Юго-Западная водопроводная станция • введена в эксплуатацию в декабре 2006 года • Новая станция мощностью 250 тысяч кубометров воды в сутки создана не для увеличения объемов подачи воды, а, прежде всего, для получения воды нового качества. • Технологическая схема очистки воды ЮЗВС, кроме традиционных стадий осветления и обеззараживания, включает двухступенчатое озонирование с использованием активированного угля и впервые в Москве, да и во всей России - мембранное фильтрование. • Такая ультрасовременная технология исключит попадание в питьевую воду токсичных органических соединений, болезнетворных микроорганизмов паразитарной, бактериальной и вирусной природы, а также обеспечит ее полную дезодорацию (удаление запаха).
 • Зал мембранных фильтров ЮЗВС
• Зал мембранных фильтров ЮЗВС
 Водоснабжение г. Зеленограда • обеспечивается из двух водоисточников: артезианских скважин и водовода от Северной станции водоподготовки. Общая мощность водопровода г. Зеленограда – 120 тыс. куб. м в сутки, в том числе: мощность артскважин – 30 тыс. куб. м в сутки, мощность водовода – 90 тыс. куб. м в сутки.
Водоснабжение г. Зеленограда • обеспечивается из двух водоисточников: артезианских скважин и водовода от Северной станции водоподготовки. Общая мощность водопровода г. Зеленограда – 120 тыс. куб. м в сутки, в том числе: мощность артскважин – 30 тыс. куб. м в сутки, мощность водовода – 90 тыс. куб. м в сутки.
 Контроль качества питьевой воды • в системе централизованного водоснабжения Москвы осуществляется по всему пути движения воды от верховий источников водоснабжения до кранов потребителей. В контроле качества задействованы 10 лабораторий Мосводоканала, которые ежесуточно выполняют около 5 тысяч анализов. • Определение основных показателей качества воды производится в постоянном режиме автоматическими анализаторами. • Всего выполняется определение около 150 физико-химических и 20 биологических показателей качества воды. Результаты анализов автоматически передаются в систему социально- гигиенического мониторинга города. Территориальные управления Роспотребнадзора, как государственные надзорные организации, также осуществляют регулярный контроль качества питьевой воды как на выходе водопроводных станций, так и в городской распределительной сети.
Контроль качества питьевой воды • в системе централизованного водоснабжения Москвы осуществляется по всему пути движения воды от верховий источников водоснабжения до кранов потребителей. В контроле качества задействованы 10 лабораторий Мосводоканала, которые ежесуточно выполняют около 5 тысяч анализов. • Определение основных показателей качества воды производится в постоянном режиме автоматическими анализаторами. • Всего выполняется определение около 150 физико-химических и 20 биологических показателей качества воды. Результаты анализов автоматически передаются в систему социально- гигиенического мониторинга города. Территориальные управления Роспотребнадзора, как государственные надзорные организации, также осуществляют регулярный контроль качества питьевой воды как на выходе водопроводных станций, так и в городской распределительной сети.
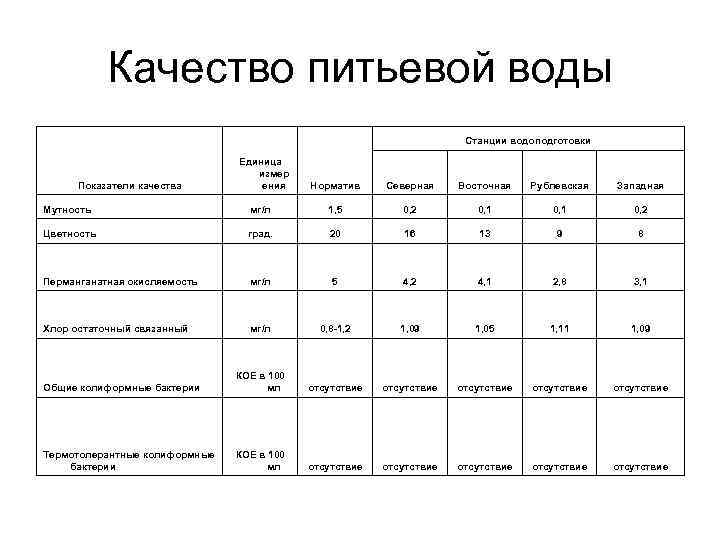 Качество питьевой воды Станции водоподготовки Единица измер Показатели качества ения Норматив Северная Восточная Рублевская Западная Мутность мг/л 1, 5 0, 2 0, 1 0, 2 Цветность град. 20 16 13 9 8 Перманганатная окисляемость мг/л 5 4, 2 4, 1 2, 8 3, 1 Хлор остаточный связанный мг/л 0, 8 -1, 2 1, 09 1, 05 1, 11 1, 09 КОЕ в 100 Общие колиформные бактерии мл отсутствие отсутствие Термотолерантные колиформные КОЕ в 100 бактерии мл отсутствие отсутствие
Качество питьевой воды Станции водоподготовки Единица измер Показатели качества ения Норматив Северная Восточная Рублевская Западная Мутность мг/л 1, 5 0, 2 0, 1 0, 2 Цветность град. 20 16 13 9 8 Перманганатная окисляемость мг/л 5 4, 2 4, 1 2, 8 3, 1 Хлор остаточный связанный мг/л 0, 8 -1, 2 1, 09 1, 05 1, 11 1, 09 КОЕ в 100 Общие колиформные бактерии мл отсутствие отсутствие Термотолерантные колиформные КОЕ в 100 бактерии мл отсутствие отсутствие
 • РЕМОНТОМ И ЭКСПЛУАТАЦИЕЙ ВНУТРЕННИХ САНИТАРНО-ТЕХНИЧЕСКИХ УСТРОЙСТВ ЗАНИМАЮТСЯ ЖИЛИЩНО-ЭКСПЛУАТАЦИОННЫЕ ОРГАНИЗАЦИИ МИКРОРАЙОНА МОСВОДОКАНАЛ ОТВЕЧАЕТ: За эксплуатацию и исправное состояние всех наружных систем водоснабжения и канализации. СООБЩАЙТЕ О ПОВРЕЖДЕНИЯХ НАРУЖНЫХ СИСТЕМ ВОДОПРОВОДА И КАНАЛИЗАЦИИ ПО ТЕЛЕФОНУ 742 96 96
• РЕМОНТОМ И ЭКСПЛУАТАЦИЕЙ ВНУТРЕННИХ САНИТАРНО-ТЕХНИЧЕСКИХ УСТРОЙСТВ ЗАНИМАЮТСЯ ЖИЛИЩНО-ЭКСПЛУАТАЦИОННЫЕ ОРГАНИЗАЦИИ МИКРОРАЙОНА МОСВОДОКАНАЛ ОТВЕЧАЕТ: За эксплуатацию и исправное состояние всех наружных систем водоснабжения и канализации. СООБЩАЙТЕ О ПОВРЕЖДЕНИЯХ НАРУЖНЫХ СИСТЕМ ВОДОПРОВОДА И КАНАЛИЗАЦИИ ПО ТЕЛЕФОНУ 742 96 96