Лекция 7_Механизмы.ppt
- Количество слайдов: 27
 Классификация органических реакций. Методы установления механизмов.
Классификация органических реакций. Методы установления механизмов.
 Механизмы органических реакций и методы их установления Механизм реакции – детальное описание реагирующей системы, как она изменяется при переходе от реактантов к продуктам. Позразумевает: * идентификацию всех интермедиатов, * выявление характеристик переходных состояний, * распознавание факторов, определяющих реакционную способность
Механизмы органических реакций и методы их установления Механизм реакции – детальное описание реагирующей системы, как она изменяется при переходе от реактантов к продуктам. Позразумевает: * идентификацию всех интермедиатов, * выявление характеристик переходных состояний, * распознавание факторов, определяющих реакционную способность
 Понятие «механизм реакции» эволюционирует во времени. Мезанизм реакции включает: • обнаружение всех элементарных стадий • развитие детальной стереохимической картины этих стадий. Знание механизма определяет определение 3 -х параметров реагирующей системы в каждую единицу времени: Геометрии, Заряда, Энергии
Понятие «механизм реакции» эволюционирует во времени. Мезанизм реакции включает: • обнаружение всех элементарных стадий • развитие детальной стереохимической картины этих стадий. Знание механизма определяет определение 3 -х параметров реагирующей системы в каждую единицу времени: Геометрии, Заряда, Энергии
 Зачем нужно изучать механизм реакции ? 1. Предсказание пути неизвестной реакции 2. Оптимизация процесса и определение параметров реакции (увеличение выхода, качественно – ускорение или замедление реакции при смене растворителя, давления, температуры и др. , смещение равновесия и т. п. ) 3. Познавательная сторона – сущность предмета химии (Льюис) 4. Систематизация реакций (число реакций безгранично, число типов реакций ограничено)
Зачем нужно изучать механизм реакции ? 1. Предсказание пути неизвестной реакции 2. Оптимизация процесса и определение параметров реакции (увеличение выхода, качественно – ускорение или замедление реакции при смене растворителя, давления, температуры и др. , смещение равновесия и т. п. ) 3. Познавательная сторона – сущность предмета химии (Льюис) 4. Систематизация реакций (число реакций безгранично, число типов реакций ограничено)
 Классификация органических реакций Наиболее важный тип связи, претерпевающий изменение в ходе реакции – ковалентная связь коллигация А. + B. гомолиз A-B По типу разрыва ковалентной связи реакции делятся на гомолитические и гетеролитические Гомолитические реакции – реакции осуществляющиеся с образованием или разрывом ковалентных связей путем коллигации или гомолиза
Классификация органических реакций Наиболее важный тип связи, претерпевающий изменение в ходе реакции – ковалентная связь коллигация А. + B. гомолиз A-B По типу разрыва ковалентной связи реакции делятся на гомолитические и гетеролитические Гомолитические реакции – реакции осуществляющиеся с образованием или разрывом ковалентных связей путем коллигации или гомолиза
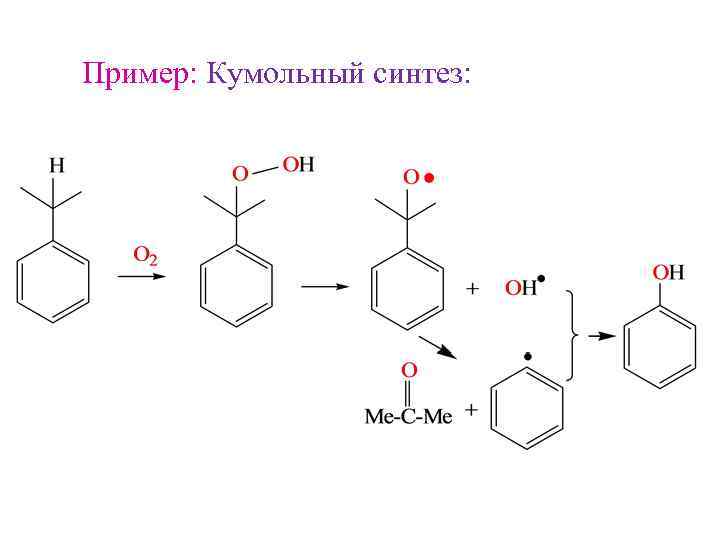 Пример: Кумольный синтез:
Пример: Кумольный синтез:
 Гетеролитические реакции А: + B координация гетеролиз A-B Гетеролитические реакции – реакции, в которых образуются или разрываются ковалентные связи путем координации или гетеролиза Пример: нуклеофильное замещение SN 1 H 2 O Me 3 C-Cl Me 3 C+ + Cl- Me 3 COH + HCl
Гетеролитические реакции А: + B координация гетеролиз A-B Гетеролитические реакции – реакции, в которых образуются или разрываются ковалентные связи путем координации или гетеролиза Пример: нуклеофильное замещение SN 1 H 2 O Me 3 C-Cl Me 3 C+ + Cl- Me 3 COH + HCl
 SN EN AN SE EE AE S – substitution E – elimination A – addition N- nucleophilic, E – electrophilic
SN EN AN SE EE AE S – substitution E – elimination A – addition N- nucleophilic, E – electrophilic
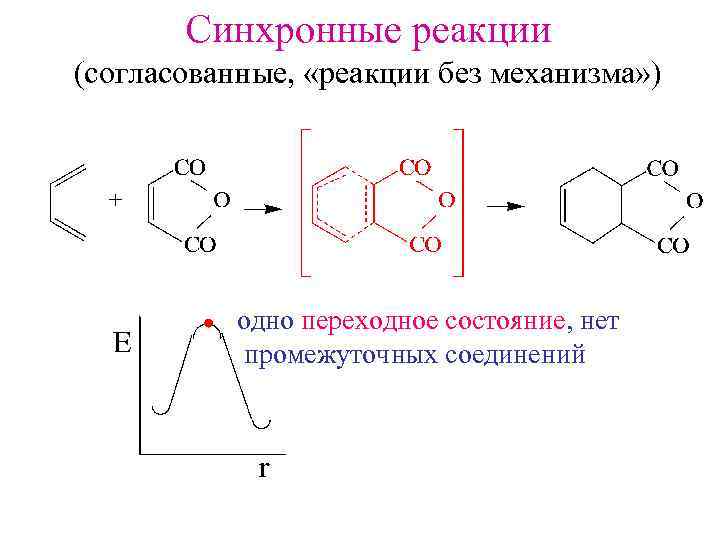 Синхронные реакции (согласованные, «реакции без механизма» ) одно переходное состояние, нет промежуточных соединений
Синхронные реакции (согласованные, «реакции без механизма» ) одно переходное состояние, нет промежуточных соединений
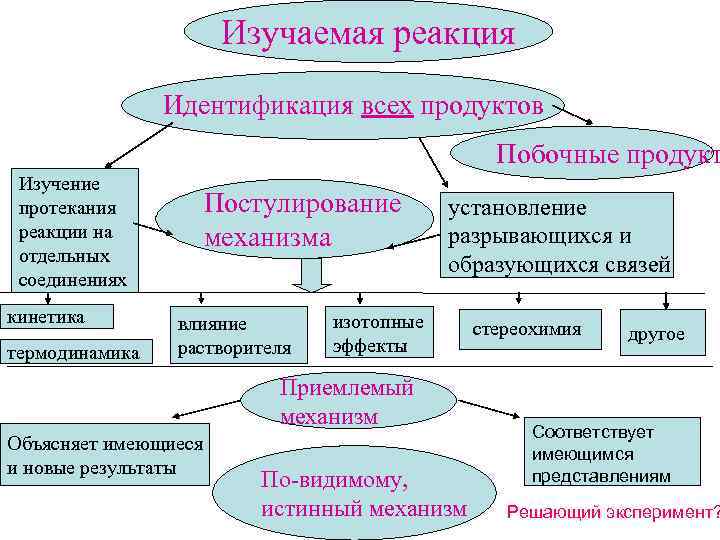 Изучаемая реакция Идентификация всех продуктов Побочные продукт Изучение протекания реакции на отдельных соединениях кинетика термодинамика Постулирование механизма влияние растворителя установление разрывающихся и образующихся связей изотопные эффекты Приемлемый механизм Объясняет имеющиеся и новые результаты По-видимому, истинный механизм стереохимия другое Соответствует имеющимся представлениям Решающий эксперимент?
Изучаемая реакция Идентификация всех продуктов Побочные продукт Изучение протекания реакции на отдельных соединениях кинетика термодинамика Постулирование механизма влияние растворителя установление разрывающихся и образующихся связей изотопные эффекты Приемлемый механизм Объясняет имеющиеся и новые результаты По-видимому, истинный механизм стереохимия другое Соответствует имеющимся представлениям Решающий эксперимент?
 Требования к механизму: 1) Выдвигаемый механизм по возможности должен быть простым RX + OH- ROH + X- V=k[RX][OH-] n=1+1=2 (SN 2) Молекулярность реакции – 2 (по механизму) Порядок реакции – от 1 до 2 (Может быть дробным. Определяется экспериментально. Общий порядок может быть 1 - в случае многократного избытка одного из участников реакции, когда изменение его концентрации никак не сказывается на общей скорости процесса и поэтому его концентрация не входит в выражение для скорости, т. е. порядок по нему будет 0. ) Метод исследования: исходя из модели механизма рассчитывают возможное кинетическое уравнение, соответствующее эксперименту
Требования к механизму: 1) Выдвигаемый механизм по возможности должен быть простым RX + OH- ROH + X- V=k[RX][OH-] n=1+1=2 (SN 2) Молекулярность реакции – 2 (по механизму) Порядок реакции – от 1 до 2 (Может быть дробным. Определяется экспериментально. Общий порядок может быть 1 - в случае многократного избытка одного из участников реакции, когда изменение его концентрации никак не сказывается на общей скорости процесса и поэтому его концентрация не входит в выражение для скорости, т. е. порядок по нему будет 0. ) Метод исследования: исходя из модели механизма рассчитывают возможное кинетическое уравнение, соответствующее эксперименту
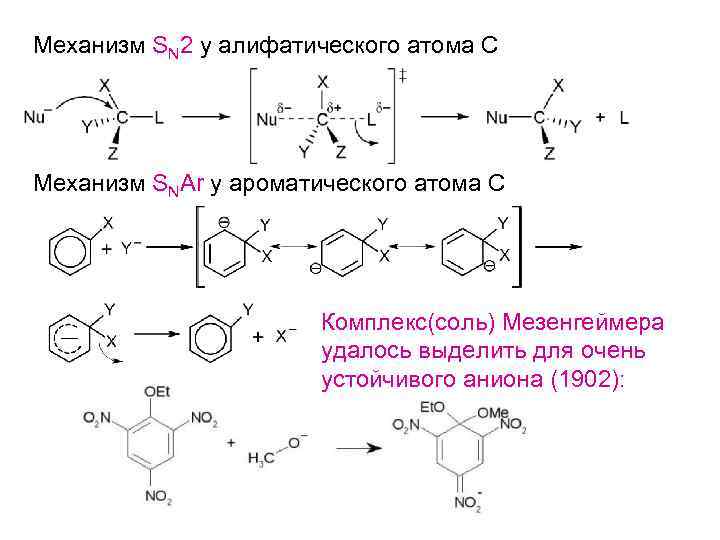 Механизм SN 2 у алифатического атома С Механизм SNAr у ароматического атома С Комплекс(соль) Мезенгеймера удалось выделить для очень устойчивого аниона (1902):
Механизм SN 2 у алифатического атома С Механизм SNAr у ароматического атома С Комплекс(соль) Мезенгеймера удалось выделить для очень устойчивого аниона (1902):
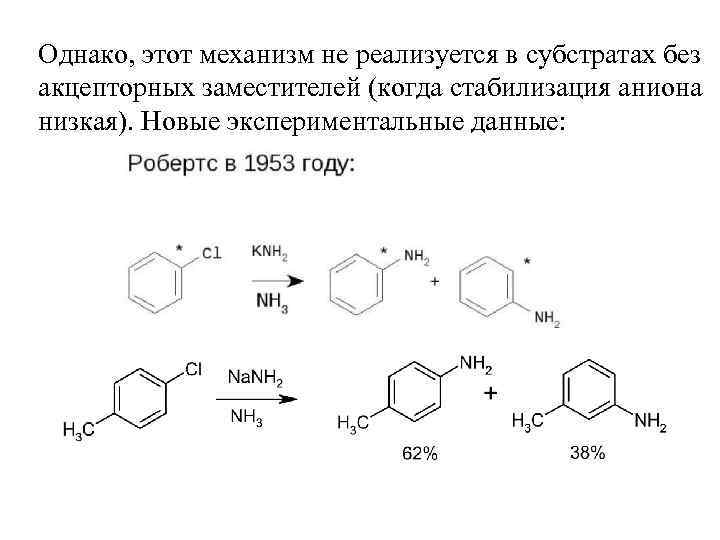 Однако, этот механизм не реализуется в субстратах без акцепторных заместителей (когда стабилизация аниона низкая). Новые экспериментальные данные:
Однако, этот механизм не реализуется в субстратах без акцепторных заместителей (когда стабилизация аниона низкая). Новые экспериментальные данные:
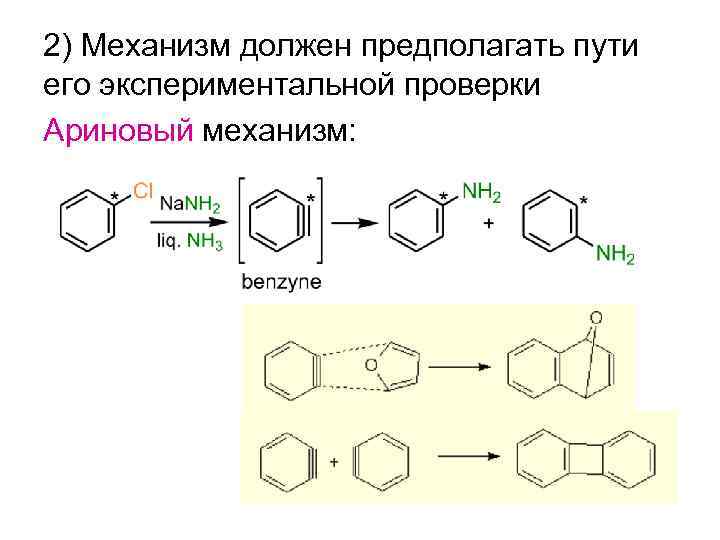 2) Механизм должен предполагать пути его экспериментальной проверки Ариновый механизм:
2) Механизм должен предполагать пути его экспериментальной проверки Ариновый механизм:
 3) Элементарные стадии должны быть либо І, либо ІІ порядка 4) Механизм не должен нарушать принципа микроскопической обратимости: в элементарных стадиях все (и прямой, и обратный) процессы обратимы Реакция этерификации протекает через те же интермедиаты, что и обратная реакция – кислотный гидролиз сложного эфира 5) Индивидуальные реакции должны согласовываться с существующими теоретическими представлениями в химии (фундаментальными)
3) Элементарные стадии должны быть либо І, либо ІІ порядка 4) Механизм не должен нарушать принципа микроскопической обратимости: в элементарных стадиях все (и прямой, и обратный) процессы обратимы Реакция этерификации протекает через те же интермедиаты, что и обратная реакция – кислотный гидролиз сложного эфира 5) Индивидуальные реакции должны согласовываться с существующими теоретическими представлениями в химии (фундаментальными)
 6) Элементарные стадии должны иметь приемлемую энергетику А. СH 4 + Cl’ CH 3’ + HCl ΔH=+12 к. Дж/моль СH 3. + Cl 2 CH 3 Cl + Cl’ ΔH=-106 к. Дж/моль ΔHр-ции=-94 к. Дж/моль Альтернативный вариант имеет слишком высокоэндотермическую стадию Б. СH 4 + Cl’ CH 3 Cl + H’ ΔH=+85 к. Дж/моль H’ + Cl 2 HCl + Cl’ ΔH=-189 к. Дж/моль ΔHр-ции=-94 к. Дж/моль
6) Элементарные стадии должны иметь приемлемую энергетику А. СH 4 + Cl’ CH 3’ + HCl ΔH=+12 к. Дж/моль СH 3. + Cl 2 CH 3 Cl + Cl’ ΔH=-106 к. Дж/моль ΔHр-ции=-94 к. Дж/моль Альтернативный вариант имеет слишком высокоэндотермическую стадию Б. СH 4 + Cl’ CH 3 Cl + H’ ΔH=+85 к. Дж/моль H’ + Cl 2 HCl + Cl’ ΔH=-189 к. Дж/моль ΔHр-ции=-94 к. Дж/моль
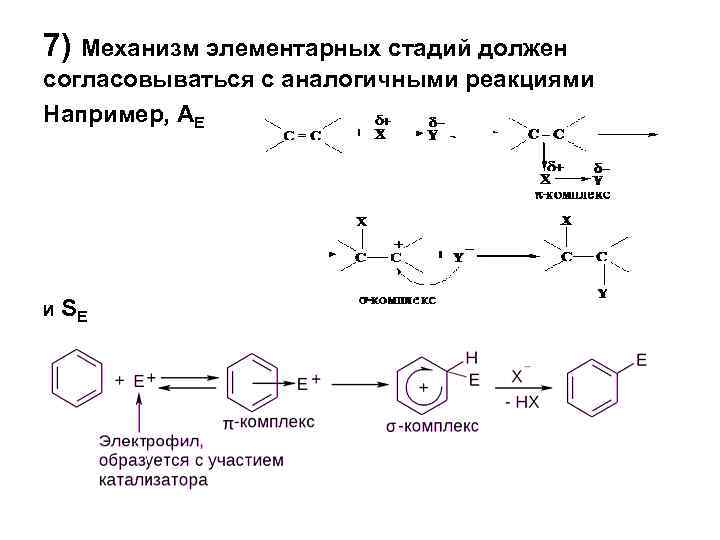 7) Механизм элементарных стадий должен согласовываться с аналогичными реакциями Например, АЕ И SE
7) Механизм элементарных стадий должен согласовываться с аналогичными реакциями Например, АЕ И SE
 План исследования механизма реакции 1) Идентификация всех продуктов. 2) Установление стереохимии реакции (в случае с оптически активными веществами – сохранение, обращение конфигурации или рацемизация). 3) Изучение кинетики реакции (скорость при разных температурах, уcтановление E≠, Н≠, S ≠, Vакт. ) 4) Подтверждение образования интермедиата (либо физ-хим. методами, либо поймав его в «ловушку» , либо косвенным путем, по примесным продуктам в случае использования добавок). Радикалы: ЭПР или О 2 ( «ловушка» ): 2 R’ + О 2 2 RO’ Карбокатионы: продукты элиминирования, перегруппировки или СН 2=СН 2 + Br 2 (Li. Cl) CH 2 Вr-CH 2 Br + CH 2 Br-CH 2 Cl (не CH 2 Cl-CH 2 Cl) или C 6 H 6 + I-Cl C 6 H 5 I + HCl (не C 6 H 5 Cl)
План исследования механизма реакции 1) Идентификация всех продуктов. 2) Установление стереохимии реакции (в случае с оптически активными веществами – сохранение, обращение конфигурации или рацемизация). 3) Изучение кинетики реакции (скорость при разных температурах, уcтановление E≠, Н≠, S ≠, Vакт. ) 4) Подтверждение образования интермедиата (либо физ-хим. методами, либо поймав его в «ловушку» , либо косвенным путем, по примесным продуктам в случае использования добавок). Радикалы: ЭПР или О 2 ( «ловушка» ): 2 R’ + О 2 2 RO’ Карбокатионы: продукты элиминирования, перегруппировки или СН 2=СН 2 + Br 2 (Li. Cl) CH 2 Вr-CH 2 Br + CH 2 Br-CH 2 Cl (не CH 2 Cl-CH 2 Cl) или C 6 H 6 + I-Cl C 6 H 5 I + HCl (не C 6 H 5 Cl)
 5) Изотопное изучение Хим. природа 12 С и 13 С (1 Н и 2 Н) не отличается, но изменяется прочность связи: более тяжелый атом связывается более прочной связью Кинетический изотопный эффект – отношение константы скорости реакции с участием частицы, содержащей легкий изотоп, к константе скорости реакции с участием частицы, содержащей тяжелый изотоп: k. H/k. D=1 -10, k. H/k. T=7 -12. В случае участия разрыва связи с более тяжелым изотопом в скоростьопределяющей стадии реакции скорость обычно снижается (в случае дейтерия 2 Н - до 7 раз, в случае углерода 13 С – до 1, 1), если эта связь рвется на другой стадии, то k. H/k. D=1 (нет эффекта)
5) Изотопное изучение Хим. природа 12 С и 13 С (1 Н и 2 Н) не отличается, но изменяется прочность связи: более тяжелый атом связывается более прочной связью Кинетический изотопный эффект – отношение константы скорости реакции с участием частицы, содержащей легкий изотоп, к константе скорости реакции с участием частицы, содержащей тяжелый изотоп: k. H/k. D=1 -10, k. H/k. T=7 -12. В случае участия разрыва связи с более тяжелым изотопом в скоростьопределяющей стадии реакции скорость обычно снижается (в случае дейтерия 2 Н - до 7 раз, в случае углерода 13 С – до 1, 1), если эта связь рвется на другой стадии, то k. H/k. D=1 (нет эффекта)
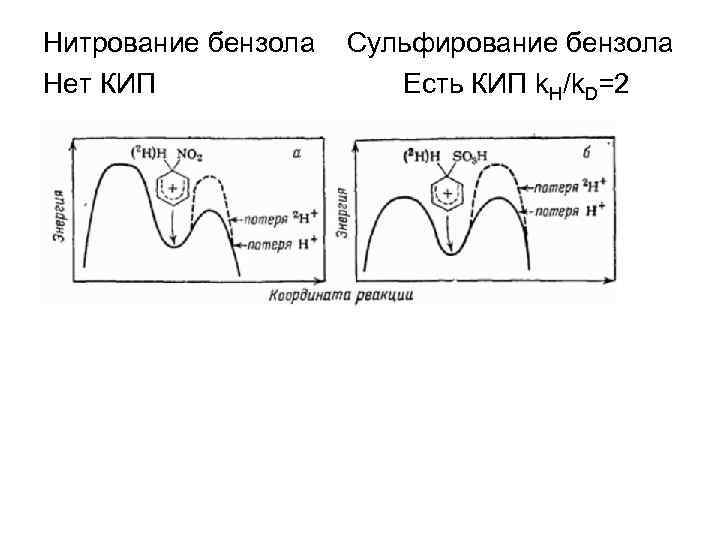 Нитрование бензола Нет КИП Сульфирование бензола Есть КИП k. H/k. D=2
Нитрование бензола Нет КИП Сульфирование бензола Есть КИП k. H/k. D=2
 6) Эффекты растворителей Стабилизируют или дестабилизируют ПС, т. е. ускоряют или замедляют процесс В воде SN реакции проходят медленно, в DMSO - быстро 7) Эффекты заместителей (полярные и пространственные) Оказывают стабилизирующее или дестабилизирующее влияние на интермедиат, т. е. могут ускорять или замедлять реакцию. Пример: Замещение в ароматическое кольцо
6) Эффекты растворителей Стабилизируют или дестабилизируют ПС, т. е. ускоряют или замедляют процесс В воде SN реакции проходят медленно, в DMSO - быстро 7) Эффекты заместителей (полярные и пространственные) Оказывают стабилизирующее или дестабилизирующее влияние на интермедиат, т. е. могут ускорять или замедлять реакцию. Пример: Замещение в ароматическое кольцо
 8) Другие методы (Специфические или инструментальные, такие как регистрация спектров промежуточных комплексов) Если механизм согласуется с результатами проверки, он должен: 1. Объяснять другие результаты (аналогичные превращения) 2. Соответствовать существующим теоретическим представлениям 3. Предполагать новые эксперименты, которые могут его подтвердить
8) Другие методы (Специфические или инструментальные, такие как регистрация спектров промежуточных комплексов) Если механизм согласуется с результатами проверки, он должен: 1. Объяснять другие результаты (аналогичные превращения) 2. Соответствовать существующим теоретическим представлениям 3. Предполагать новые эксперименты, которые могут его подтвердить
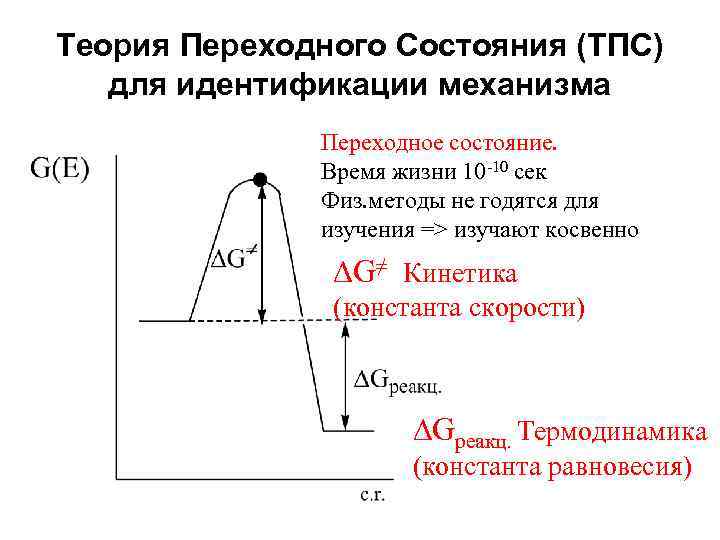 Теория Переходного Состояния (ТПС) для идентификации механизма Переходное состояние. Время жизни 10 -10 сек Физ. методы не годятся для изучения => изучают косвенно DG≠ Кинетика (константа скорости) DGреакц. Термодинамика (константа равновесия)
Теория Переходного Состояния (ТПС) для идентификации механизма Переходное состояние. Время жизни 10 -10 сек Физ. методы не годятся для изучения => изучают косвенно DG≠ Кинетика (константа скорости) DGреакц. Термодинамика (константа равновесия)
 Эйринг и Поляни
Эйринг и Поляни
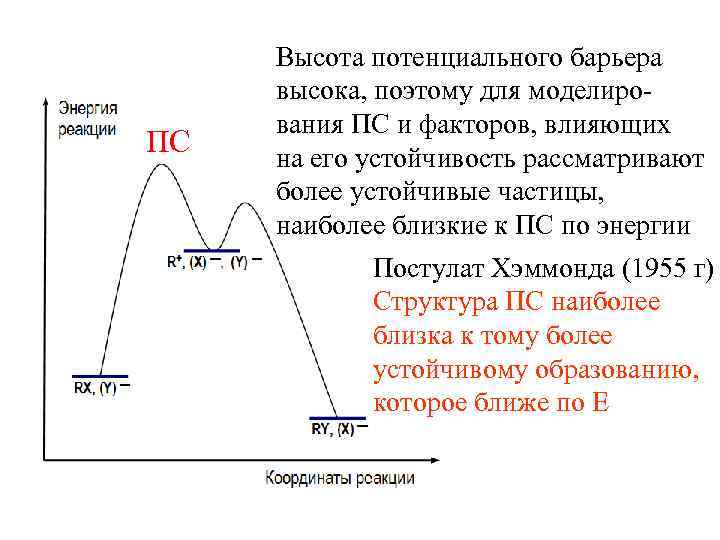 ПС Высота потенциального барьера высока, поэтому для моделирования ПС и факторов, влияющих на его устойчивость рассматривают более устойчивые частицы, наиболее близкие к ПС по энергии Постулат Хэммонда (1955 г) Структура ПС наиболее близка к тому более устойчивому образованию, которое ближе по Е
ПС Высота потенциального барьера высока, поэтому для моделирования ПС и факторов, влияющих на его устойчивость рассматривают более устойчивые частицы, наиболее близкие к ПС по энергии Постулат Хэммонда (1955 г) Структура ПС наиболее близка к тому более устойчивому образованию, которое ближе по Е
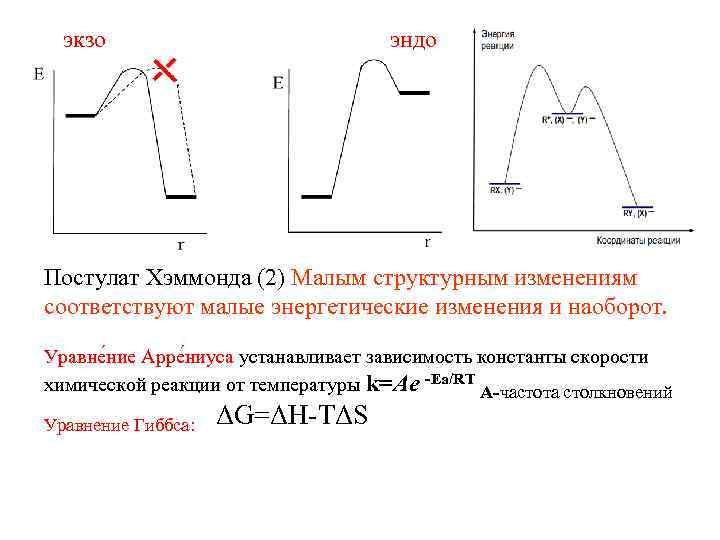 экзо эндо Постулат Хэммонда (2) Малым структурным изменениям соответствуют малые энергетические изменения и наоборот. Уравне ние Арре ниуса устанавливает зависимость константы скорости химической реакции от температуры k=Ae -Ea/RT А-частота столкновений Уравнение Гиббса: ΔG=ΔH-ТΔS
экзо эндо Постулат Хэммонда (2) Малым структурным изменениям соответствуют малые энергетические изменения и наоборот. Уравне ние Арре ниуса устанавливает зависимость константы скорости химической реакции от температуры k=Ae -Ea/RT А-частота столкновений Уравнение Гиббса: ΔG=ΔH-ТΔS
 • Чем выше потенциальный барьер ΔG≠ , тем скорость реакции ниже • Величина ΔS≠ отвечает за пространственное строение ПС, степень его упорядоченности и на диаграмме реакции выражает ширину барьера. Если ПС компактное, высокоупорядоченное, то следует ожидать высокоотрицательные значения ΔS≠ Уравнение Эйринга:
• Чем выше потенциальный барьер ΔG≠ , тем скорость реакции ниже • Величина ΔS≠ отвечает за пространственное строение ПС, степень его упорядоченности и на диаграмме реакции выражает ширину барьера. Если ПС компактное, высокоупорядоченное, то следует ожидать высокоотрицательные значения ΔS≠ Уравнение Эйринга:


