5_Кл-я_р-ций.ppt
- Количество слайдов: 23
 Классификация органических реакций Алёхина Е. А.
Классификация органических реакций Алёхина Е. А.
 I. По направлению (результату) реакции II. По типу разрыва связи III. По характеру реагирующих частиц IV. По молекулярности реакции Алёхина Е. А.
I. По направлению (результату) реакции II. По типу разрыва связи III. По характеру реагирующих частиц IV. По молекулярности реакции Алёхина Е. А.
 • Замещение (substitution – S); • Присоединение (addition – A); Элиминирование (elimination – E) или отщепление • Алёхина Е. А.
• Замещение (substitution – S); • Присоединение (addition – A); Элиминирование (elimination – E) или отщепление • Алёхина Е. А.
 Замещение (substitution – S) Общий вид: Примеры: А + В–С А–В + С или А-В + С-D A-D + С-В RH +Cl 2 RCl + HCl CH 3–CH 2–OH + HCl (водн. р-р) CH 3–CH 2–Cl + H 2 O Алёхина Е. А.
Замещение (substitution – S) Общий вид: Примеры: А + В–С А–В + С или А-В + С-D A-D + С-В RH +Cl 2 RCl + HCl CH 3–CH 2–OH + HCl (водн. р-р) CH 3–CH 2–Cl + H 2 O Алёхина Е. А.
 Присоединение (addition – A) Общий вид: А–В + С=С АС–СВ Примеры: R–СH=CH 2 +HBr R–CHBr–CH 3 (по пр-лу Марковникова) Алёхина Е. А.
Присоединение (addition – A) Общий вид: А–В + С=С АС–СВ Примеры: R–СH=CH 2 +HBr R–CHBr–CH 3 (по пр-лу Марковникова) Алёхина Е. А.
 Полимеризация Соединения исходных веществ (мономеров) без выделения побочных продуктов, что приводит к образованию веществ , имеющих состав, тождественный составу мономеров. Алёхина Е. А.
Полимеризация Соединения исходных веществ (мономеров) без выделения побочных продуктов, что приводит к образованию веществ , имеющих состав, тождественный составу мономеров. Алёхина Е. А.
 Отщепление или элиминирование (elimination – E) Общий вид: АС–СВ А–В + С=С Примеры: СН 3–СH 2–ОН Na. OH (спирт. р-р) Алёхина Е. А. CH 2 =CH 2 + Н 2 О
Отщепление или элиминирование (elimination – E) Общий вид: АС–СВ А–В + С=С Примеры: СН 3–СH 2–ОН Na. OH (спирт. р-р) Алёхина Е. А. CH 2 =CH 2 + Н 2 О
 Разложение СН 3–СН 2–СН 3 СН 3 -СН 3 + СН 2=СН 2 Декарбоксилирование CООH–CООH (t C) HCOOH + СO 2 Алёхина Е. А.
Разложение СН 3–СН 2–СН 3 СН 3 -СН 3 + СН 2=СН 2 Декарбоксилирование CООH–CООH (t C) HCOOH + СO 2 Алёхина Е. А.
 Перегруппировка (изомеризация) Общий вид: А–В–С А–С–В Примеры: CH 3–CH 2–C CH НC CH + Н 2 О (Hg 2+) (изомеризация) CH 3–C С–СH 3 [CH 2=CH–OH] Алёхина Е. А. СH 3–CH=O
Перегруппировка (изомеризация) Общий вид: А–В–С А–С–В Примеры: CH 3–CH 2–C CH НC CH + Н 2 О (Hg 2+) (изомеризация) CH 3–C С–СH 3 [CH 2=CH–OH] Алёхина Е. А. СH 3–CH=O
 Окислительно-восстановительные реакции Окисление 3 СН 3–СH 2–ОН + K 2 Cr 2 O 7 + 4 H 2 SO 4 3 CH 3–CH=O + Cr 2(SO 4)3 + К 2 SO 4 + 7 H 2 O Восстановление СH 2=CH 2 +H 2 CH 3–CH 3 Алёхина Е. А.
Окислительно-восстановительные реакции Окисление 3 СН 3–СH 2–ОН + K 2 Cr 2 O 7 + 4 H 2 SO 4 3 CH 3–CH=O + Cr 2(SO 4)3 + К 2 SO 4 + 7 H 2 O Восстановление СH 2=CH 2 +H 2 CH 3–CH 3 Алёхина Е. А.
 Полное окисление СН 4 + 2 О 2 СО 2 + 2 Н 2 О Неполное окисление СН 4 + О 2 Н-СН=О + Н 2 О Алёхина Е. А.
Полное окисление СН 4 + 2 О 2 СО 2 + 2 Н 2 О Неполное окисление СН 4 + О 2 Н-СН=О + Н 2 О Алёхина Е. А.
 гомолитический (равнополовинный) R R R– –R гетеролитический (неравнополовинный) → R + R или → R + R E Nu → Е + Nu или E –Nu → Е+ + Nu– Радикал (R ) – частица с неспаренным электроном Катион (электрофил) Е+ Алёхина Е. А. Анион (нуклеофил) Nu–
гомолитический (равнополовинный) R R R– –R гетеролитический (неравнополовинный) → R + R или → R + R E Nu → Е + Nu или E –Nu → Е+ + Nu– Радикал (R ) – частица с неспаренным электроном Катион (электрофил) Е+ Алёхина Е. А. Анион (нуклеофил) Nu–
 а) гомолитический (равнополовинный) разрыв связи Cl 2 3 НС (h ) : СH 3 Cl : Cl (t C, p, kat) 2 Cl 2 СН 3 б) гетеролитический (неравнополовинный) разрыв связи карбкатион H [: Cl (t C) Алёхина Е. А. карбанион H+ + Cl–
а) гомолитический (равнополовинный) разрыв связи Cl 2 3 НС (h ) : СH 3 Cl : Cl (t C, p, kat) 2 Cl 2 СН 3 б) гетеролитический (неравнополовинный) разрыв связи карбкатион H [: Cl (t C) Алёхина Е. А. карбанион H+ + Cl–
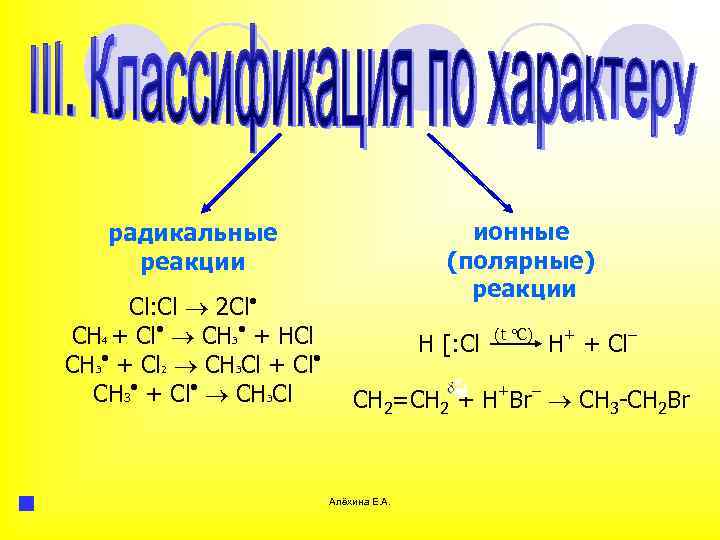 ионные (полярные) реакции радикальные реакции Cl: Cl 2 Cl СH 4 + Cl CH 3 + HCl СH 3 + Cl 2 CH 3 Cl + Cl СH 3 + Cl CH 3 Cl H [: Cl (t C) H+ + Cl– СН 2=СН 2 + H+Br– CH 3 -CH 2 Br Алёхина Е. А.
ионные (полярные) реакции радикальные реакции Cl: Cl 2 Cl СH 4 + Cl CH 3 + HCl СH 3 + Cl 2 CH 3 Cl + Cl СH 3 + Cl CH 3 Cl H [: Cl (t C) H+ + Cl– СН 2=СН 2 + H+Br– CH 3 -CH 2 Br Алёхина Е. А.
 Ионные (полярные) реакции S + Субстрат (атакуемая частица) R Реагент (атакующая частица) N (нуклеофил) Алёхина Е. А. E (электрофил)
Ионные (полярные) реакции S + Субстрат (атакуемая частица) R Реагент (атакующая частица) N (нуклеофил) Алёхина Е. А. E (электрофил)
 Нуклеофильные реагенты (N) НУКЛЕОФИЛЬН ЫЕ сила ОН– ОR– SR– RCОO– Hal– CN– слабость Алёхина Е. А. ЧАСТИ ЦЫ: NH 2– : NH 3 RŐH
Нуклеофильные реагенты (N) НУКЛЕОФИЛЬН ЫЕ сила ОН– ОR– SR– RCОO– Hal– CN– слабость Алёхина Е. А. ЧАСТИ ЦЫ: NH 2– : NH 3 RŐH
 Электрофильные реагенты (Е) ЭЛЕКТРОФИЛЬН ЫЕ H+ H 3 О+ ЧАСТИ ЦЫ: сила C 6 H 5 N 2+ HNO 2 (OH–NO+) cлабость Алёхина Е. А.
Электрофильные реагенты (Е) ЭЛЕКТРОФИЛЬН ЫЕ H+ H 3 О+ ЧАСТИ ЦЫ: сила C 6 H 5 N 2+ HNO 2 (OH–NO+) cлабость Алёхина Е. А.
 Различают реакции S N , S E, S R , A N , A E, A R Алёхина Е. А.
Различают реакции S N , S E, S R , A N , A E, A R Алёхина Е. А.
 Реакции характерные для алканов | | | -С–С–С–С| Н | Н | Н SR Галогенирование (радикальное замещение)Сульфирование Нитрование Алёхина Е. А.
Реакции характерные для алканов | | | -С–С–С–С| Н | Н | Н SR Галогенирование (радикальное замещение)Сульфирование Нитрование Алёхина Е. А.
 Реакции характерные для алкенов AE (электрофильное присоединение, полимеризация) R – C = CH 2 SR Н (радикальное замещение) Алёхина Е. А.
Реакции характерные для алкенов AE (электрофильное присоединение, полимеризация) R – C = CH 2 SR Н (радикальное замещение) Алёхина Е. А.
 Реакции характерные для алкинов SR (радикальное замещение) R-CΞC-H A E, A N (электрофильное и нуклеофильное присоединение) Различают реакции SN, SE, SR, AN, AE, AR Алёхина Е. А.
Реакции характерные для алкинов SR (радикальное замещение) R-CΞC-H A E, A N (электрофильное и нуклеофильное присоединение) Различают реакции SN, SE, SR, AN, AE, AR Алёхина Е. А.
 Мономолекулярные реакции Например, SN 1; Е 1 Бимолекулярные реакции Например, SN 2; Е 2 Полимолекулярные реакции Алёхина Е. А.
Мономолекулярные реакции Например, SN 1; Е 1 Бимолекулярные реакции Например, SN 2; Е 2 Полимолекулярные реакции Алёхина Е. А.
 1. 2. 3. 4. 5. Ким А. М. Органическая химия. – Новосибирск: Сиб. унив. изд-во, 2004. – 842 с. Перекалин В. В. и др. Органическая химия. – М. : Просвещение, – М. , 1982. – 560 с. Степаненко Б. Н. Курс органической химии. В 2 -х т. – М. : Высшая школа, 1981. Травень В. Ф. Органическая химия. В 2 -х т. – М. : ИКЦ «Академкнига» , 2005. Шабаров Ю. С. Органическая химия. В 2 -х т. – М. : Химия, 1996. Алёхина Е. А.
1. 2. 3. 4. 5. Ким А. М. Органическая химия. – Новосибирск: Сиб. унив. изд-во, 2004. – 842 с. Перекалин В. В. и др. Органическая химия. – М. : Просвещение, – М. , 1982. – 560 с. Степаненко Б. Н. Курс органической химии. В 2 -х т. – М. : Высшая школа, 1981. Травень В. Ф. Органическая химия. В 2 -х т. – М. : ИКЦ «Академкнига» , 2005. Шабаров Ю. С. Органическая химия. В 2 -х т. – М. : Химия, 1996. Алёхина Е. А.


