Классификация, изготовление и применение диагностических препаратов 15.02.10.ppt
- Количество слайдов: 84
 Классификация, изготовление и применение диагностических препаратов 1
Классификация, изготовление и применение диагностических препаратов 1
 Введение. 1. Приготовление диагностических сывороток. 2. Технология приготовления антигенов. 3. Технология приготовления аллер генов: туберкулина, маллеина, бруцеллина. 4. Получение бактериофагов. 5. Современные диагностические препараты. Заключение. 2
Введение. 1. Приготовление диагностических сывороток. 2. Технология приготовления антигенов. 3. Технология приготовления аллер генов: туберкулина, маллеина, бруцеллина. 4. Получение бактериофагов. 5. Современные диагностические препараты. Заключение. 2
 1. Аксенов М. Ю. , Гинцбург А. Л. Диагностика инфекци онных заболеваний методом ПЦР //Молекулярная генетика, микробиология и вирусология. 1993. 2. Глик Б. , Пастернак Дж. Молекулярная биотех нология: принципы и применение. М. : Мир. 2002. 3. Самуйленко А. Я. , Рубан Е. А. Основы биотехно логии производства биологических препаратов. Т 1, Т 2. – М. , 2000. 4. Сюрин В. Н. , Белоусова Р. В. , Фомина Н. В. Ветеринарная вирусология. М. : Колос, 1984. 5. Тихонов И. В. , Рубан Е. А. , Грязнева Т. Н. и др. Биотехнология. Спб. Гиорд. 2005. 790 с. 6. Тутов И. К. , Ситьков В. И. Основы биотехнологии ветеринарных препаратов. Ст. ГСХА, 1997. 3
1. Аксенов М. Ю. , Гинцбург А. Л. Диагностика инфекци онных заболеваний методом ПЦР //Молекулярная генетика, микробиология и вирусология. 1993. 2. Глик Б. , Пастернак Дж. Молекулярная биотех нология: принципы и применение. М. : Мир. 2002. 3. Самуйленко А. Я. , Рубан Е. А. Основы биотехно логии производства биологических препаратов. Т 1, Т 2. – М. , 2000. 4. Сюрин В. Н. , Белоусова Р. В. , Фомина Н. В. Ветеринарная вирусология. М. : Колос, 1984. 5. Тихонов И. В. , Рубан Е. А. , Грязнева Т. Н. и др. Биотехнология. Спб. Гиорд. 2005. 790 с. 6. Тутов И. К. , Ситьков В. И. Основы биотехнологии ветеринарных препаратов. Ст. ГСХА, 1997. 3
 Классификация диагностических препаратов 1. Диагностические сыворотки. 2. Диагностические антигены (антигены диагностикумы). 3. Аллергены. 4. Бактериофаги. 5. Диагностические препараты высо ких технологий – микрочипы (генные, клеточные, белковые), биосенсоры, праймеры, наночастицы и др. 4
Классификация диагностических препаратов 1. Диагностические сыворотки. 2. Диагностические антигены (антигены диагностикумы). 3. Аллергены. 4. Бактериофаги. 5. Диагностические препараты высо ких технологий – микрочипы (генные, клеточные, белковые), биосенсоры, праймеры, наночастицы и др. 4
 Диагностические сыворотки 5
Диагностические сыворотки 5
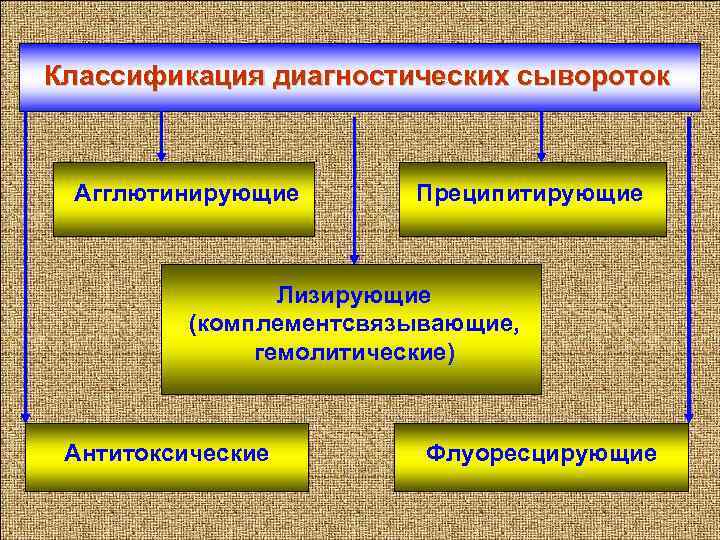 Классификация диагностических сывороток Агглютинирующие Преципитирующие Лизирующие (комплементсвязывающие, гемолитические) Антитоксические Флуоресцирующие 6
Классификация диагностических сывороток Агглютинирующие Преципитирующие Лизирующие (комплементсвязывающие, гемолитические) Антитоксические Флуоресцирующие 6
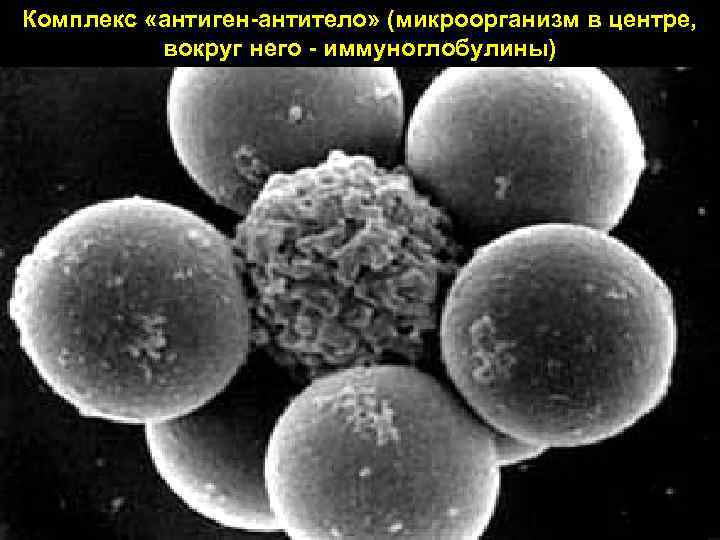 Комплекс «антиген антитело» (микроорганизм в центре, вокруг него иммуноглобулины) 7
Комплекс «антиген антитело» (микроорганизм в центре, вокруг него иммуноглобулины) 7
 Приготовление агглютинирующих О колисывороток Продуценты кролики породы шиншилла, весом 3 4 кг, в возрасте 6 12 месяцев 1. Кроликов выдерживают в карантине не менее 3 4 недель. 2. Антигены суспензия 18 20 часовых культур соответствую щих серовариантов эшерихий, инактивированных кипячением 2 час. 3. Антиген в концентрации 2 млрд м. к. в 1 мл вводится кроликам в краевую ушную вену с интервалом в 3 5 суток в дозах 0, 3; 0, 6; 1, 0; 2, 0; 3, 0 мл. 4. Через 5 6 суток последнего введения антигена у каждого кролика определяют титры антител. 5. От кроликов берут тотальным способом кровь и получают сыворотку. 6. Сыворотку фильтруют через стерилизующие фильтры, прове ряют на стерильность, активность и специфичность. 8 7. Лиофильно высушивают в ампулах.
Приготовление агглютинирующих О колисывороток Продуценты кролики породы шиншилла, весом 3 4 кг, в возрасте 6 12 месяцев 1. Кроликов выдерживают в карантине не менее 3 4 недель. 2. Антигены суспензия 18 20 часовых культур соответствую щих серовариантов эшерихий, инактивированных кипячением 2 час. 3. Антиген в концентрации 2 млрд м. к. в 1 мл вводится кроликам в краевую ушную вену с интервалом в 3 5 суток в дозах 0, 3; 0, 6; 1, 0; 2, 0; 3, 0 мл. 4. Через 5 6 суток последнего введения антигена у каждого кролика определяют титры антител. 5. От кроликов берут тотальным способом кровь и получают сыворотку. 6. Сыворотку фильтруют через стерилизующие фильтры, прове ряют на стерильность, активность и специфичность. 8 7. Лиофильно высушивают в ампулах.
 Стерилизующая фильтрация диагностических сывороток 9
Стерилизующая фильтрация диагностических сывороток 9
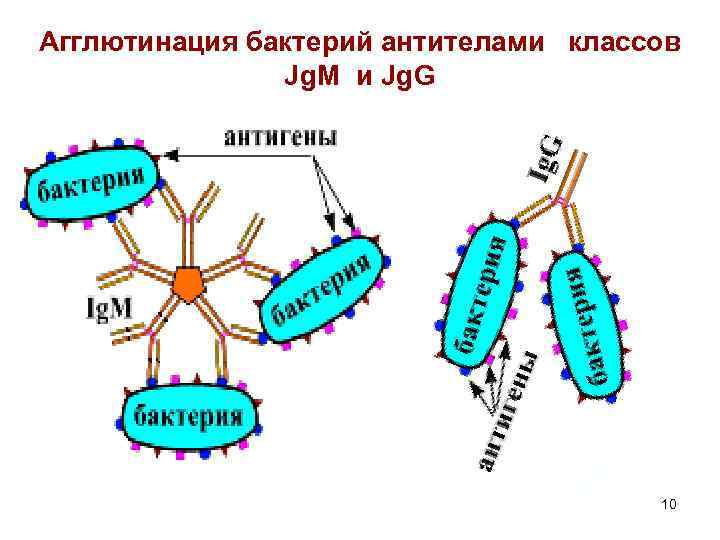 Агглютинация бактерий антителами классов Jg. M и Jg. G 10
Агглютинация бактерий антителами классов Jg. M и Jg. G 10
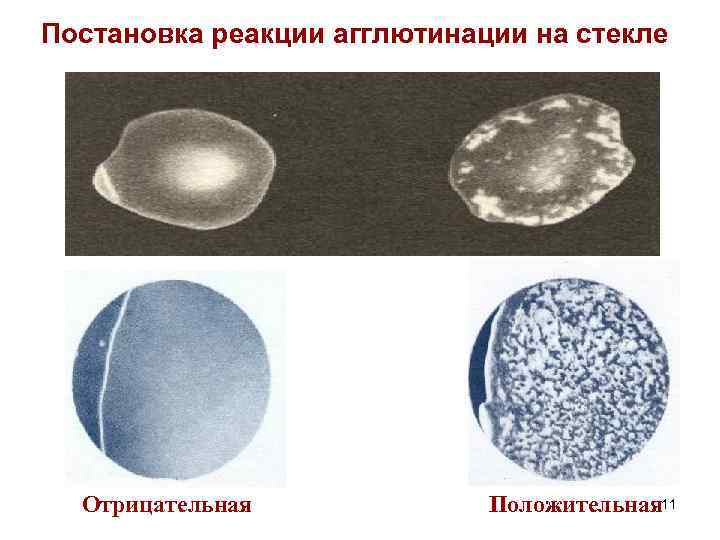 Постановка реакции агглютинации на стекле Отрицательная Положительная 11
Постановка реакции агглютинации на стекле Отрицательная Положительная 11
 Реакция агглютинации + 12
Реакция агглютинации + 12
 Постановка развернутой реакции агглютинации в пробирках а) б) в) а) – агглютинация, б) – контроль сыворотки, в) – контроль антигена 13
Постановка развернутой реакции агглютинации в пробирках а) б) в) а) – агглютинация, б) – контроль сыворотки, в) – контроль антигена 13
 Приготовление преципитирующих диагностических сывороток 1. Лошадей гипериммунизируют внутривенно поочерёдным введением слабовирулентных штаммов возбудителя сибирской язвы 916 1, Ш 15, 94 и второй вакцины Ценковского. 2. Делают 16 17 инъекций антигена, увеличивая дозу с 5 до 70 мл. 3. По окончании гипериммунизации кровь берут через 9 16 суток последнего введения антигена из расчёта 800 мл на 50 кг массы животного. 4. Из крови получают сыворотку методом цитрирования с последующим сепарированием и дефибринизацией плазмы. 5. Сыворотку консервируют 0, 5% раствором фенола, затем отстаивают 2 месяца , после чего подвергают стерилизующей фильтрации. 6. Разливают сыворотку во флаконы ёмкостью 50 100 мл. 14 7. Проводят контроль качества препарата.
Приготовление преципитирующих диагностических сывороток 1. Лошадей гипериммунизируют внутривенно поочерёдным введением слабовирулентных штаммов возбудителя сибирской язвы 916 1, Ш 15, 94 и второй вакцины Ценковского. 2. Делают 16 17 инъекций антигена, увеличивая дозу с 5 до 70 мл. 3. По окончании гипериммунизации кровь берут через 9 16 суток последнего введения антигена из расчёта 800 мл на 50 кг массы животного. 4. Из крови получают сыворотку методом цитрирования с последующим сепарированием и дефибринизацией плазмы. 5. Сыворотку консервируют 0, 5% раствором фенола, затем отстаивают 2 месяца , после чего подвергают стерилизующей фильтрации. 6. Разливают сыворотку во флаконы ёмкостью 50 100 мл. 14 7. Проводят контроль качества препарата.
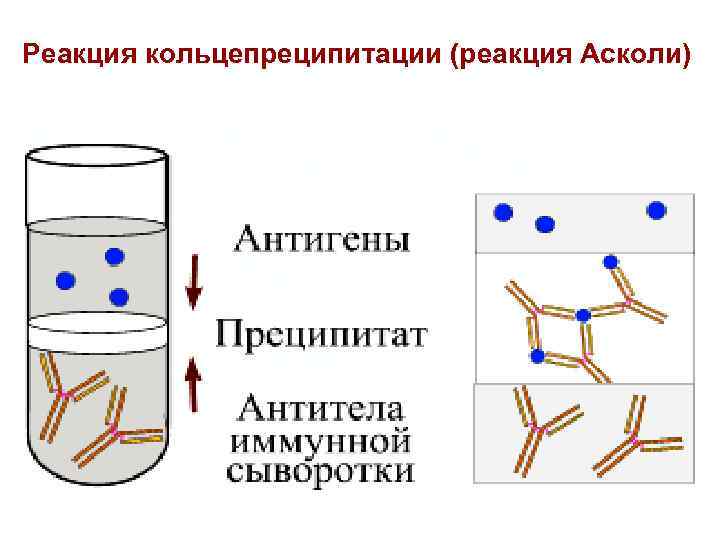 Реакция кольцепреципитации (реакция Асколи) 15
Реакция кольцепреципитации (реакция Асколи) 15
 Реакция диффузной преципитации (РДП, РИД) 16
Реакция диффузной преципитации (РДП, РИД) 16
 Получение диагностических сывороток для постановки реакции связывания комплемента Комплементсвязывающая сыворотка для диагностики бруцеллеза Получают от морских свинок, которым вводят слабовирулентный штамм B. bovis и спустя 30 40 суток гиперимму низируют тем же матери алом путём 2 4 внутри мышечных инъекций. Через 7 10 суток последней инъекции морских свинок обес кровливают и из крови готовят инактивирован ную сыворотку. Гемолитическая сыворотка (гемолизин) Гипериммунизируют кроликов эритро цитами баранов. При титре антител гемолиза 1: 6000 гипериммунизацию прекращают. Через 7 10 суток последней инъекции кроликов обескров ливают, сыворотку консервируют фе нолом. Комплемент В качестве комплемента используют кровь морс ких свинок. 17
Получение диагностических сывороток для постановки реакции связывания комплемента Комплементсвязывающая сыворотка для диагностики бруцеллеза Получают от морских свинок, которым вводят слабовирулентный штамм B. bovis и спустя 30 40 суток гиперимму низируют тем же матери алом путём 2 4 внутри мышечных инъекций. Через 7 10 суток последней инъекции морских свинок обес кровливают и из крови готовят инактивирован ную сыворотку. Гемолитическая сыворотка (гемолизин) Гипериммунизируют кроликов эритро цитами баранов. При титре антител гемолиза 1: 6000 гипериммунизацию прекращают. Через 7 10 суток последней инъекции кроликов обескров ливают, сыворотку консервируют фе нолом. Комплемент В качестве комплемента используют кровь морс ких свинок. 17
 Реакция связывания комплемента (РСК) с сывороткой крови больного животного (положительная реакция) 18
Реакция связывания комплемента (РСК) с сывороткой крови больного животного (положительная реакция) 18
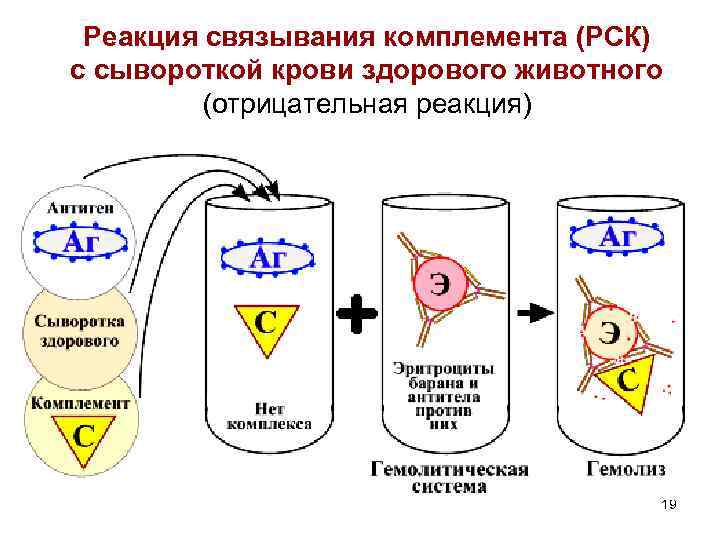 Реакция связывания комплемента (РСК) с сывороткой крови здорового животного (отрицательная реакция) 19
Реакция связывания комплемента (РСК) с сывороткой крови здорового животного (отрицательная реакция) 19
 УЧЕТ РСК 1. ОТСУТСТВИЕ ГЕМОЛИЗА ( ++++ ) 2. ГЕМОЛИЗ 25% ЭРИТРОЦИТОВ – (+++) 3. ГЕМОЛИЗ 50% ЭРИТРОЦИТОВ – (++) 4. ГЕМОЛИЗ 75% ЭРИТРОЦИТОВ (+) 20
УЧЕТ РСК 1. ОТСУТСТВИЕ ГЕМОЛИЗА ( ++++ ) 2. ГЕМОЛИЗ 25% ЭРИТРОЦИТОВ – (+++) 3. ГЕМОЛИЗ 50% ЭРИТРОЦИТОВ – (++) 4. ГЕМОЛИЗ 75% ЭРИТРОЦИТОВ (+) 20
 Получение антитоксических диагностических сывороток Технологическим примером является изготовление антитоксических сывороток против C. perfringens типов А, С, D, Е и F. В качестве продуцентов используют валухов тонкорунных пород в возрасте 2 лет. 1. Антигенами являются очищенные и концентрированные анатоксины (обезвреженные токсины) полученные с помощью соответствующих типов C. perfringens. 2. Антигены овцам вводят подкожно в возрастающих дозах с интервалом 4 6 суток между инъекциями. 3. Гипериммунизацию животных прекращают после получения сывороток с высоким титром антитоксинов. 4. Активность каждого типа антитоксических сывороток устанавливают в реакции нейтрализации специфических токсинов при введении их смесей белым мышам или крысам и выражают её количеством антитоксических единиц. 21
Получение антитоксических диагностических сывороток Технологическим примером является изготовление антитоксических сывороток против C. perfringens типов А, С, D, Е и F. В качестве продуцентов используют валухов тонкорунных пород в возрасте 2 лет. 1. Антигенами являются очищенные и концентрированные анатоксины (обезвреженные токсины) полученные с помощью соответствующих типов C. perfringens. 2. Антигены овцам вводят подкожно в возрастающих дозах с интервалом 4 6 суток между инъекциями. 3. Гипериммунизацию животных прекращают после получения сывороток с высоким титром антитоксинов. 4. Активность каждого типа антитоксических сывороток устанавливают в реакции нейтрализации специфических токсинов при введении их смесей белым мышам или крысам и выражают её количеством антитоксических единиц. 21
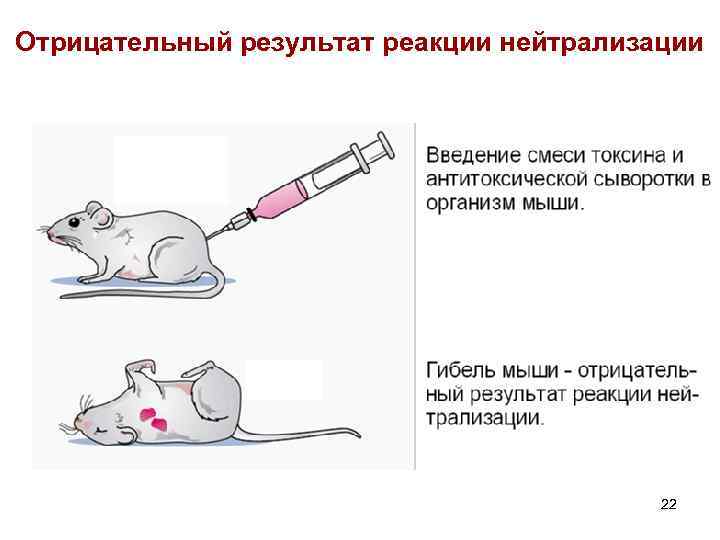 Отрицательный результат реакции нейтрализации 22
Отрицательный результат реакции нейтрализации 22
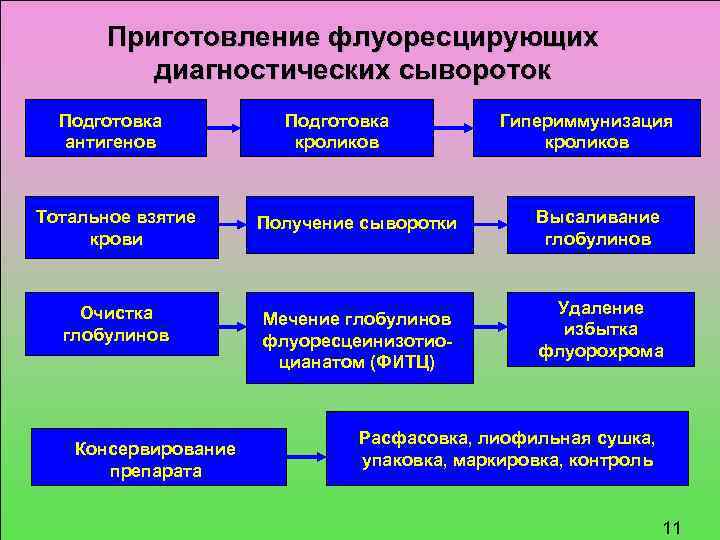 Приготовление флуоресцирующих диагностических сывороток Подготовка антигенов Подготовка кроликов Тотальное взятие крови Получение сыворотки Очистка глобулинов Мечение глобулинов флуоресцеинизотио цианатом (ФИТЦ) Консервирование препарата Гипериммунизация кроликов Высаливание глобулинов Удаление избытка флуорохрома Расфасовка, лиофильная сушка, упаковка, маркировка, контроль 23 11
Приготовление флуоресцирующих диагностических сывороток Подготовка антигенов Подготовка кроликов Тотальное взятие крови Получение сыворотки Очистка глобулинов Мечение глобулинов флуоресцеинизотио цианатом (ФИТЦ) Консервирование препарата Гипериммунизация кроликов Высаливание глобулинов Удаление избытка флуорохрома Расфасовка, лиофильная сушка, упаковка, маркировка, контроль 23 11
 24
24
 Люминесцентный микроскоп 25
Люминесцентный микроскоп 25
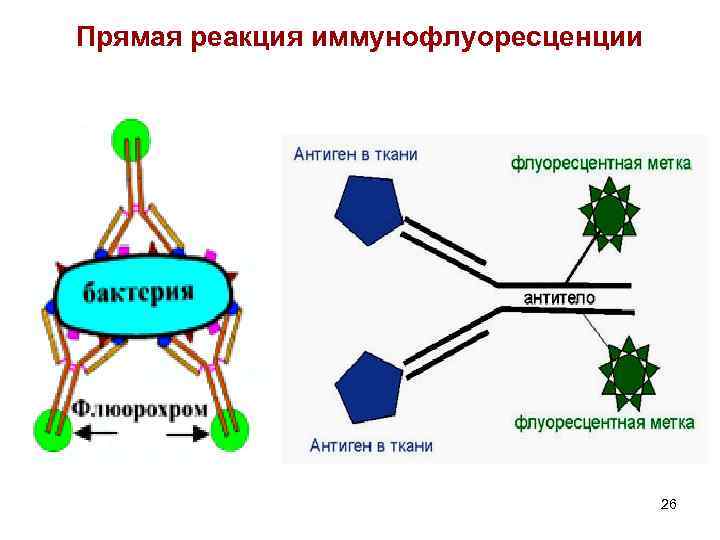 Прямая реакция иммунофлуоресценции 26
Прямая реакция иммунофлуоресценции 26
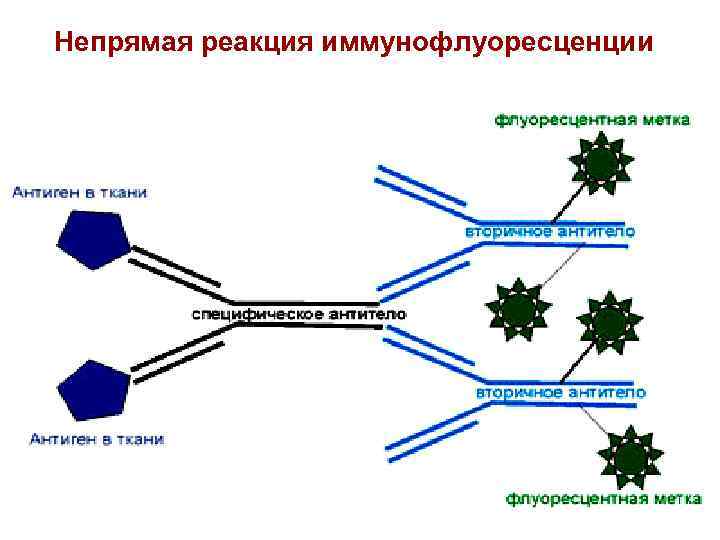 Непрямая реакция иммунофлуоресценции 27
Непрямая реакция иммунофлуоресценции 27
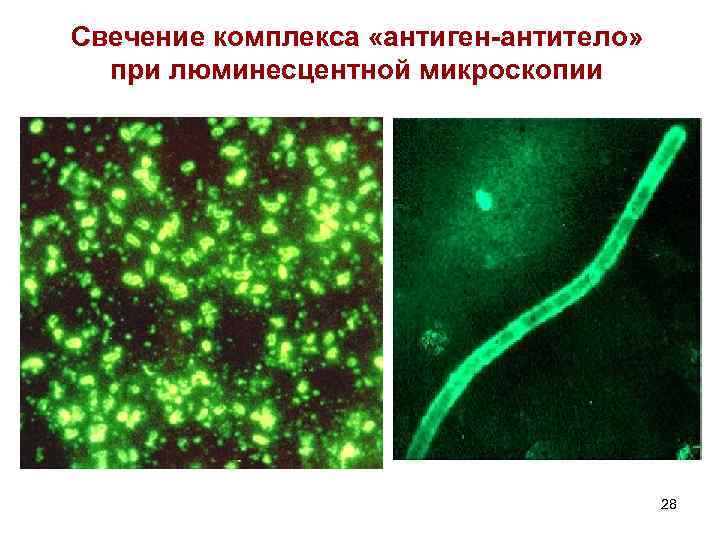 Свечение комплекса «антиген антитело» при люминесцентной микроскопии 28
Свечение комплекса «антиген антитело» при люминесцентной микроскопии 28
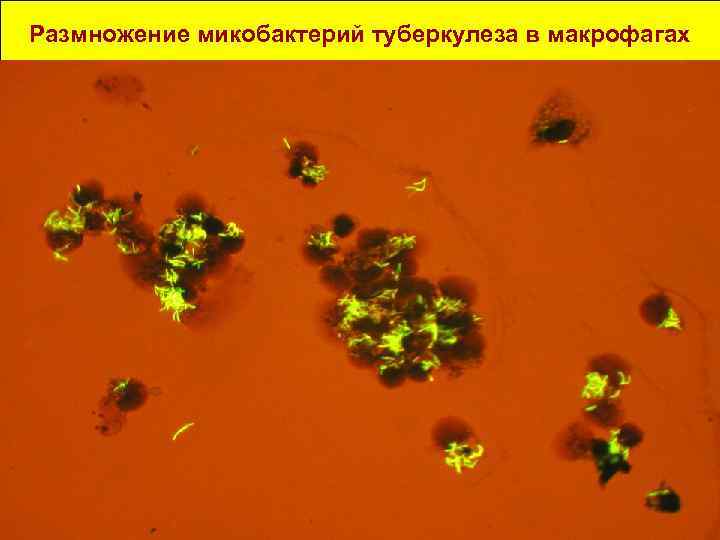 Размножение микобактерий туберкулеза в макрофагах 29
Размножение микобактерий туберкулеза в макрофагах 29
 30
30
 Набор для ИФА 31
Набор для ИФА 31
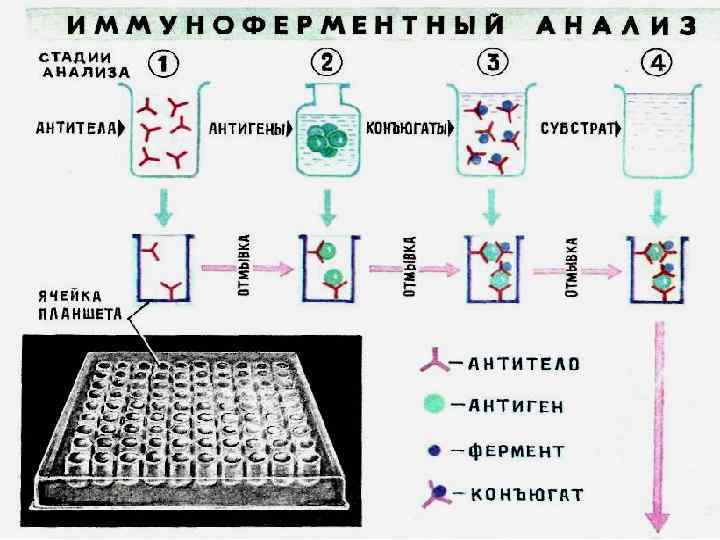
 Схема реакции, характеризующая принцип работы тест системы ИФА 32
Схема реакции, характеризующая принцип работы тест системы ИФА 32
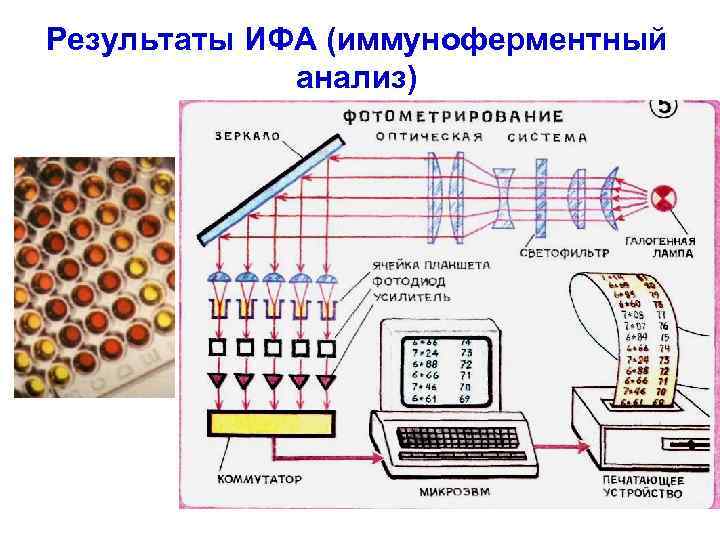 Результаты ИФА (иммуноферментный анализ) 33
Результаты ИФА (иммуноферментный анализ) 33
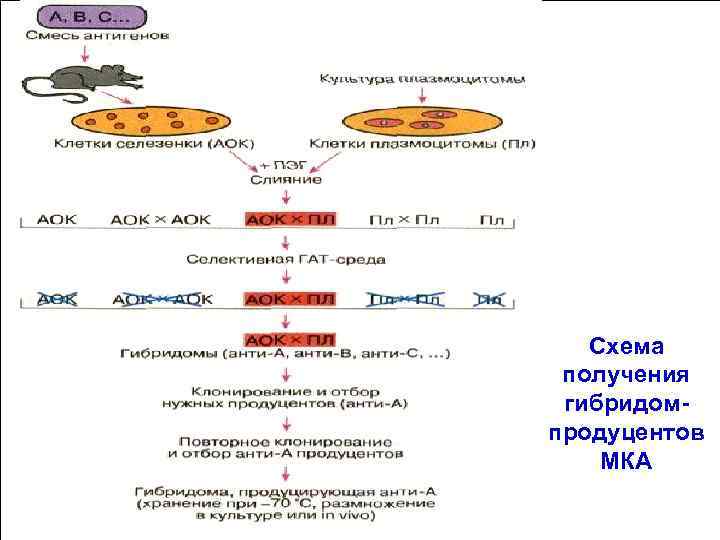 Схема получения гибридом продуцентов МКА 34
Схема получения гибридом продуцентов МКА 34
 Клетки, полученные после слияния На фотографии представлены: гибридные клетки; w плазмоциты; w плазмоцитомы w 35 28
Клетки, полученные после слияния На фотографии представлены: гибридные клетки; w плазмоциты; w плазмоцитомы w 35 28
 36 27
36 27
 Единичный клон гибридных клеток, 31 продуцирующих моноклональные антитела 37
Единичный клон гибридных клеток, 31 продуцирующих моноклональные антитела 37
 Клоны гибридом 38
Клоны гибридом 38
 Монослой гибридом 32 39
Монослой гибридом 32 39
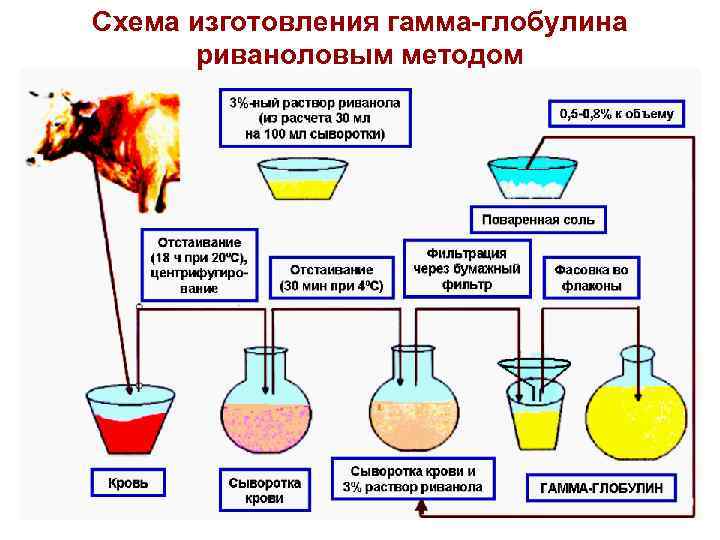 Схема изготовления гамма глобулина риваноловым методом 40
Схема изготовления гамма глобулина риваноловым методом 40
 Антигены 41
Антигены 41
 Антиген – это чужеродное вещество, на которое организмом животных и человека вырабатываются специфические защитные белки антитела, которые способны соединяться с антигеном как in vivo, так и in vitro. 42
Антиген – это чужеродное вещество, на которое организмом животных и человека вырабатываются специфические защитные белки антитела, которые способны соединяться с антигеном как in vivo, так и in vitro. 42
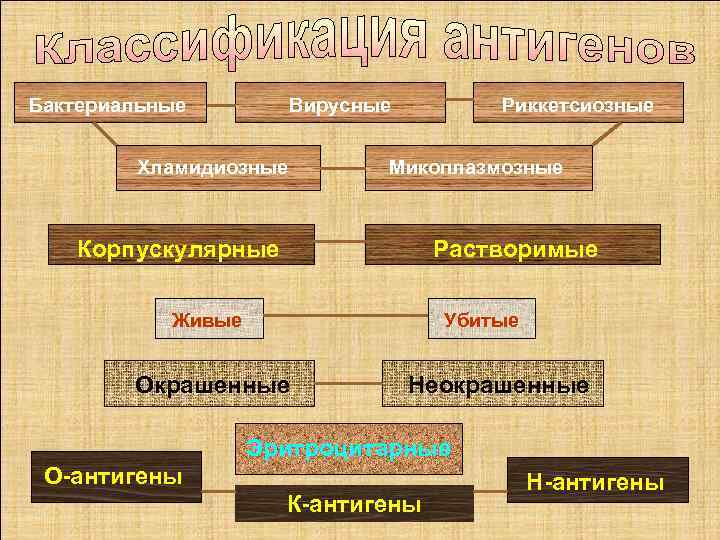 Бактериальные Вирусные Хламидиозные Риккетсиозные Микоплазмозные Корпускулярные Растворимые Живые Убитые Окрашенные Неокрашенные Эритроцитарные О антигены К антигены Н антигены 43
Бактериальные Вирусные Хламидиозные Риккетсиозные Микоплазмозные Корпускулярные Растворимые Живые Убитые Окрашенные Неокрашенные Эритроцитарные О антигены К антигены Н антигены 43
 Диагностикум эритроцитарный – это взвесь эритроцитов, на поверхности которых адсорбированы антитела или растворимые антиге ны, который используется в реакции непрямой гемагглютинации с целью серологической диагностики инфекционных болезней 44
Диагностикум эритроцитарный – это взвесь эритроцитов, на поверхности которых адсорбированы антитела или растворимые антиге ны, который используется в реакции непрямой гемагглютинации с целью серологической диагностики инфекционных болезней 44
 45
45
 46
46
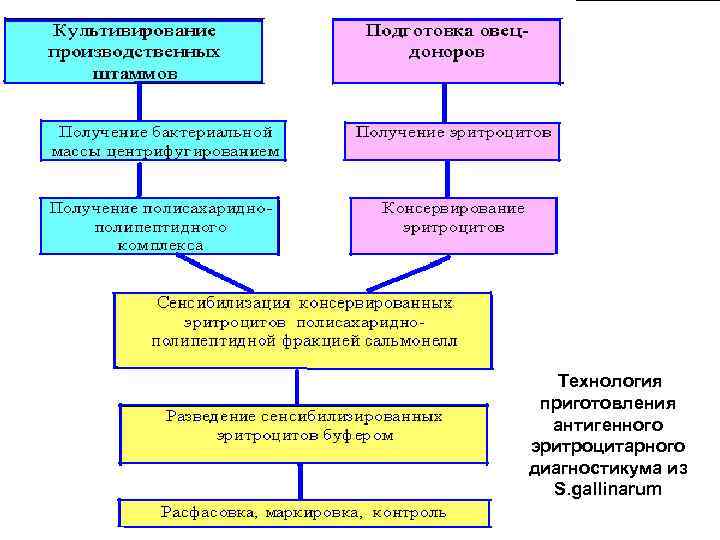 Технология приготовления антигенного эритроцитарного диагностикума из S. gallinarum 47
Технология приготовления антигенного эритроцитарного диагностикума из S. gallinarum 47
 Аллергены 48
Аллергены 48
 Аллергическая диагностика – это метод диагностики некоторых инфекционных (чаще хронических) болезней животных и человека, основанный на феномене сохранения повышенной чувствительности организма к повторному введению того же антигена, в основе которой лежат реакции гиперчувствительности замедленного типа (ГЗТ), которые появляются через несколько часов, иногда суток после введения аллергена в зараженный организм. 49
Аллергическая диагностика – это метод диагностики некоторых инфекционных (чаще хронических) болезней животных и человека, основанный на феномене сохранения повышенной чувствительности организма к повторному введению того же антигена, в основе которой лежат реакции гиперчувствительности замедленного типа (ГЗТ), которые появляются через несколько часов, иногда суток после введения аллергена в зараженный организм. 49
 Туберкулин – это биопрепарат, получаемый путем выращивания микобактерий туберкулеза в модифицированной среде Соттона с аспарагином и лимонной кислотой в течение двух месяцев, инактивированный автоклавированием и содержащий продукты жизнедеятельности микобактерий и специфические вещества белковой природы, извлеченные из них и применяемый для аллергической диагностики туберкулеза. 50
Туберкулин – это биопрепарат, получаемый путем выращивания микобактерий туберкулеза в модифицированной среде Соттона с аспарагином и лимонной кислотой в течение двух месяцев, инактивированный автоклавированием и содержащий продукты жизнедеятельности микобактерий и специфические вещества белковой природы, извлеченные из них и применяемый для аллергической диагностики туберкулеза. 50
 Технология приготовления туберкулина 1. Производственные штаммы возбудителя туберкулеза бычьего вида выращивают в модифицированной среде Сот тона с аспарагином и лимонной кислотой в течение 2 месяцев. 2. Автоклавируют взвесь микобактерий. 3. Белок культуральной жидкости осаждают трихлоруксус ной кислотой. 4. Центрифугируют и повторно осаждают белок сернокис лым аммонием. 5. Надосадочную жидкость удаляют, а преципитат раство ряют в воде и подвергают диализу для удаления остатков сернокислого аммония. 6. Раствор туберкулина подщелачивают и фильтруют. 7. Расфасовывают во флаконы объемом 10 20 мл и лиофильно высушивают. 8. Проводят контроль туберкулинов на растворимость, стерильность, р. Н, безвредность, специфичность и содержание туберкулиновых единиц (ТЕ). Активность выпускаемых серий 51 ППД должна составлять 50000 ТЕ/мл. 17
Технология приготовления туберкулина 1. Производственные штаммы возбудителя туберкулеза бычьего вида выращивают в модифицированной среде Сот тона с аспарагином и лимонной кислотой в течение 2 месяцев. 2. Автоклавируют взвесь микобактерий. 3. Белок культуральной жидкости осаждают трихлоруксус ной кислотой. 4. Центрифугируют и повторно осаждают белок сернокис лым аммонием. 5. Надосадочную жидкость удаляют, а преципитат раство ряют в воде и подвергают диализу для удаления остатков сернокислого аммония. 6. Раствор туберкулина подщелачивают и фильтруют. 7. Расфасовывают во флаконы объемом 10 20 мл и лиофильно высушивают. 8. Проводят контроль туберкулинов на растворимость, стерильность, р. Н, безвредность, специфичность и содержание туберкулиновых единиц (ТЕ). Активность выпускаемых серий 51 ППД должна составлять 50000 ТЕ/мл. 17
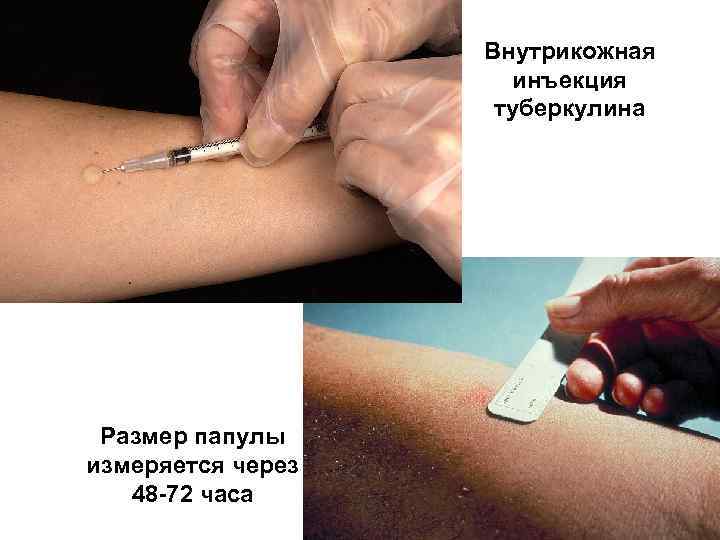 Внутрикожная инъекция туберкулина Размер папулы измеряется через 48 72 часа 52
Внутрикожная инъекция туберкулина Размер папулы измеряется через 48 72 часа 52
 Безъигольный инъектор для туберкулинизации крупного рогатого скота 53
Безъигольный инъектор для туберкулинизации крупного рогатого скота 53
 Бруцеллин – это биопрепарат, представляющий собой стерильную, прозрачную жидкость желтого цвета, содержащий продукты жизнедеятельности бруцелл и специфические вещества белковой природы, извлеченные из них и применяемый для аллергической диагностики бруцеллеза. 54
Бруцеллин – это биопрепарат, представляющий собой стерильную, прозрачную жидкость желтого цвета, содержащий продукты жизнедеятельности бруцелл и специфические вещества белковой природы, извлеченные из них и применяемый для аллергической диагностики бруцеллеза. 54
 Технология приготовления бруцеллина 1. Производственный штамм В. abortus B 1 в S форме и не вызывающий образования агглютининов при подкожном введении морским свинкам выращивают в биореакторе в питательной среде с 0, 5% глюкозы при 37°С в течение 4 5 суток. 2. Культуру бруцелл прогревают до 105 110°С при работающей мешалке, затем охлаждают и центрифугируют. 3. Надосадочную жидкость (конденсат бруцеллина) фильтруют через стерилизующие пластины и собирают в стерильную емкость. 4. Бактерийную массу разбавляют физраствором 1: 50 и стери лизуют при 105 110°С. 5. Надосадочную жидкость (экстракт бруцеллина) после стери лизующей фильтрации смешивают с ранее полученным концент ратом бруцеллина, смесь разводят стерильным физраствором до необходимой концентрации бактериального белка, доводят р. Н до 7, 2 7, 4. 6. Приготовленную серию бруцеллина разливают во флаконы, закрывают пробками, обкатывают алюминиевыми колпачками. 7. Флаконы стерилизуют в автоклаве при 105 110°С и выдержи вают 3 суток в термостате при 37°С. 55
Технология приготовления бруцеллина 1. Производственный штамм В. abortus B 1 в S форме и не вызывающий образования агглютининов при подкожном введении морским свинкам выращивают в биореакторе в питательной среде с 0, 5% глюкозы при 37°С в течение 4 5 суток. 2. Культуру бруцелл прогревают до 105 110°С при работающей мешалке, затем охлаждают и центрифугируют. 3. Надосадочную жидкость (конденсат бруцеллина) фильтруют через стерилизующие пластины и собирают в стерильную емкость. 4. Бактерийную массу разбавляют физраствором 1: 50 и стери лизуют при 105 110°С. 5. Надосадочную жидкость (экстракт бруцеллина) после стери лизующей фильтрации смешивают с ранее полученным концент ратом бруцеллина, смесь разводят стерильным физраствором до необходимой концентрации бактериального белка, доводят р. Н до 7, 2 7, 4. 6. Приготовленную серию бруцеллина разливают во флаконы, закрывают пробками, обкатывают алюминиевыми колпачками. 7. Флаконы стерилизуют в автоклаве при 105 110°С и выдержи вают 3 суток в термостате при 37°С. 55
 Маллеин – это биопрепарат, представляющий собой стерильную, прозрачную жидкость желтого цвета, содержащий продукты жизнедеятельности и специфические вещества белковой природы четырехмесячной культуры В. mallei, штамм № 5584, выращенной в бутылях в мясо пептонном глицериновом бульоне, и применяемый для аллергической диагностики сапа лошадей. 56
Маллеин – это биопрепарат, представляющий собой стерильную, прозрачную жидкость желтого цвета, содержащий продукты жизнедеятельности и специфические вещества белковой природы четырехмесячной культуры В. mallei, штамм № 5584, выращенной в бутылях в мясо пептонном глицериновом бульоне, и применяемый для аллергической диагностики сапа лошадей. 56
 Технология приготовления маллеина 1. Actinobacillus mallei № 5584 выращивают в мясо пептонном глицериновом бульоне (МПГБ) в бутылях в течение 4 месяцев при 37°С. 2. Культуральную суспензию автоклавируют и отстаивают в течение 4 месяцев при 20°С. 3. Надосадочную жидкость фильтруют через стерилизующие пластины. 4. Разливают в ампулы или флаконы, которые после закупорки стерилизуют автоклавированием. 5. Готовый препарат контролируют на стерильность, безвредность и специфичность. 57
Технология приготовления маллеина 1. Actinobacillus mallei № 5584 выращивают в мясо пептонном глицериновом бульоне (МПГБ) в бутылях в течение 4 месяцев при 37°С. 2. Культуральную суспензию автоклавируют и отстаивают в течение 4 месяцев при 20°С. 3. Надосадочную жидкость фильтруют через стерилизующие пластины. 4. Разливают в ампулы или флаконы, которые после закупорки стерилизуют автоклавированием. 5. Готовый препарат контролируют на стерильность, безвредность и специфичность. 57
 Бактериофаги 58
Бактериофаги 58
 Бактериофаги – это специфические лечебно диагностические препараты, содержащие вирусы, губительно действующие на определенные виды бактерий. 59
Бактериофаги – это специфические лечебно диагностические препараты, содержащие вирусы, губительно действующие на определенные виды бактерий. 59
 60
60
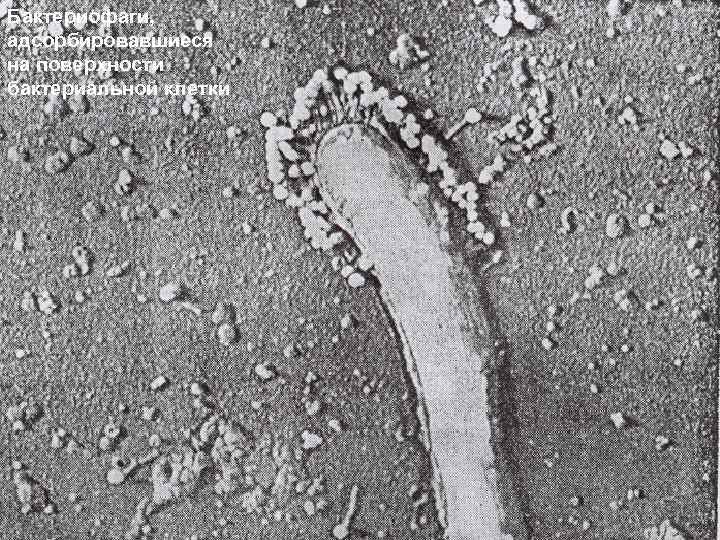 Бактериофаги, адсорбировавшиеся на поверхности бактериальной клетки 61
Бактериофаги, адсорбировавшиеся на поверхности бактериальной клетки 61
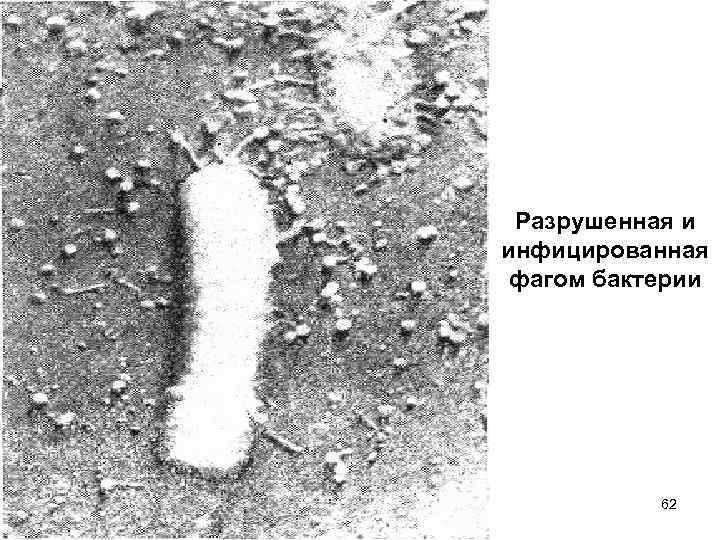 Разрушенная и инфицированная фагом бактерии 62
Разрушенная и инфицированная фагом бактерии 62
 Разрушенная фагом бактериальная клетка 63
Разрушенная фагом бактериальная клетка 63
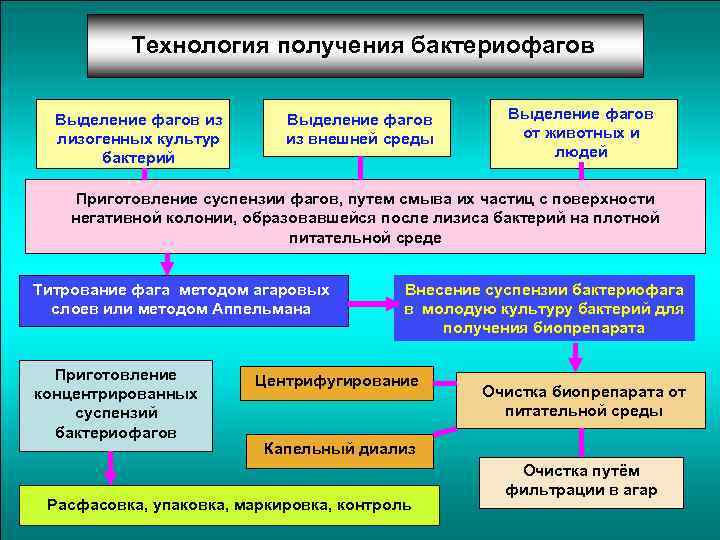 Технология получения бактериофагов Выделение фагов из лизогенных культур бактерий Выделение фагов из внешней среды Выделение фагов от животных и людей Приготовление суспензии фагов, путем смыва их частиц с поверхности негативной колонии, образовавшейся после лизиса бактерий на плотной питательной среде Титрование фага методом агаровых слоев или методом Аппельмана Приготовление концентрированных суспензий бактериофагов Внесение суспензии бактериофага в молодую культуру бактерий для получения биопрепарата Центрифугирование Очистка биопрепарата от питательной среды Капельный диализ Расфасовка, упаковка, маркировка, контроль Очистка путём фильтрации в агар 64
Технология получения бактериофагов Выделение фагов из лизогенных культур бактерий Выделение фагов из внешней среды Выделение фагов от животных и людей Приготовление суспензии фагов, путем смыва их частиц с поверхности негативной колонии, образовавшейся после лизиса бактерий на плотной питательной среде Титрование фага методом агаровых слоев или методом Аппельмана Приготовление концентрированных суспензий бактериофагов Внесение суспензии бактериофага в молодую культуру бактерий для получения биопрепарата Центрифугирование Очистка биопрепарата от питательной среды Капельный диализ Расфасовка, упаковка, маркировка, контроль Очистка путём фильтрации в агар 64
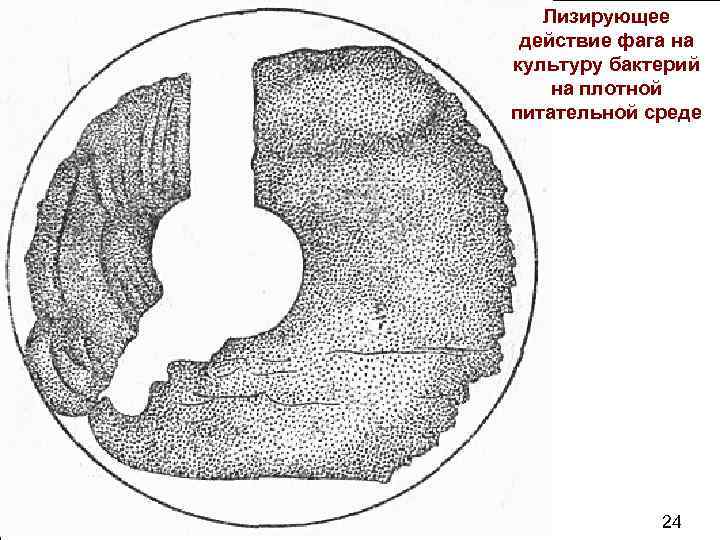 Лизирующее действие фага на культуру бактерий на плотной питательной среде . 65 24
Лизирующее действие фага на культуру бактерий на плотной питательной среде . 65 24
 Диагностические средства высоких технологий 66
Диагностические средства высоких технологий 66
 25 67
25 67
 68
68
 Набор реактивов для ПЦР 69
Набор реактивов для ПЦР 69
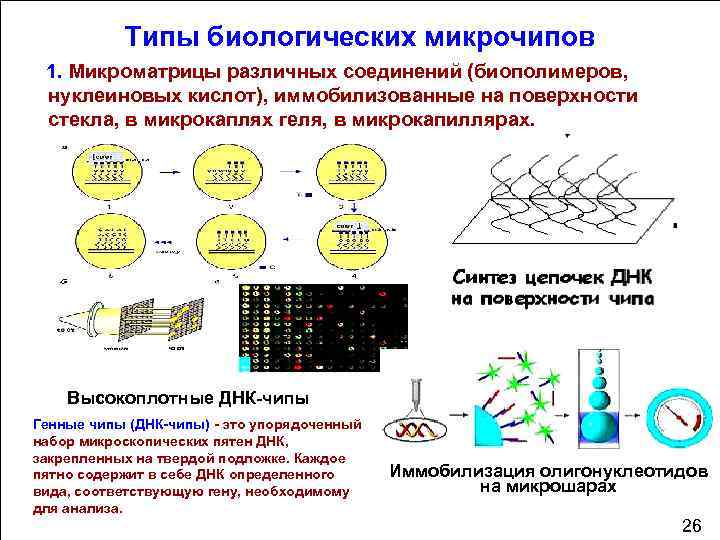 Типы биологических микрочипов 1. Микроматрицы различных соединений (биополимеров, нуклеиновых кислот), иммобилизованные на поверхности стекла, в микрокаплях геля, в микрокапиллярах. Высокоплотные ДНК чипы Генные чипы (ДНК чипы) это упорядоченный набор микроскопических пятен ДНК, закрепленных на твердой подложке. Каждое пятно содержит в себе ДНК определенного вида, соответствующую гену, необходимому для анализа. Иммобилизация олигонуклеотидов на микрошарах 70 26
Типы биологических микрочипов 1. Микроматрицы различных соединений (биополимеров, нуклеиновых кислот), иммобилизованные на поверхности стекла, в микрокаплях геля, в микрокапиллярах. Высокоплотные ДНК чипы Генные чипы (ДНК чипы) это упорядоченный набор микроскопических пятен ДНК, закрепленных на твердой подложке. Каждое пятно содержит в себе ДНК определенного вида, соответствующую гену, необходимому для анализа. Иммобилизация олигонуклеотидов на микрошарах 70 26
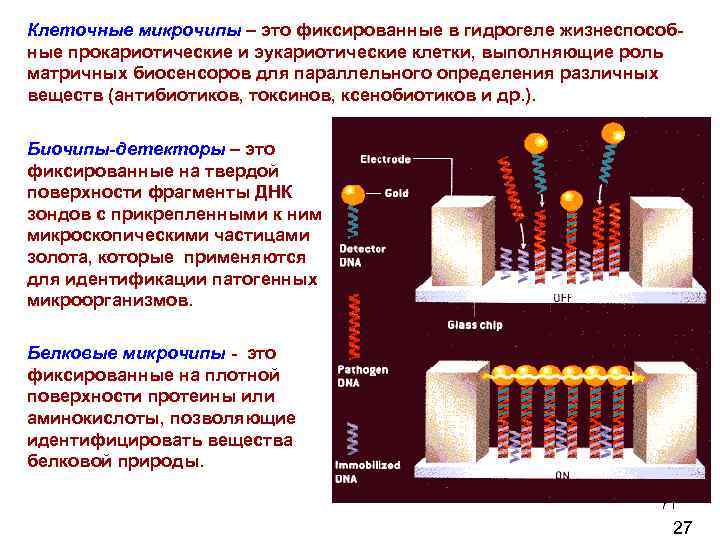 Клеточные микрочипы – это фиксированные в гидрогеле жизнеспособ ные прокариотические и эукариотические клетки, выполняющие роль матричных биосенсоров для параллельного определения различных веществ (антибиотиков, токсинов, ксенобиотиков и др. ). Биочипы-детекторы – это фиксированные на твердой поверхности фрагменты ДНК зондов с прикрепленными к ним микроскопическими частицами золота, которые применяются для идентификации патогенных микроорганизмов. Белковые микрочипы - это фиксированные на плотной поверхности протеины или аминокислоты, позволяющие идентифицировать вещества белковой природы. 71 27
Клеточные микрочипы – это фиксированные в гидрогеле жизнеспособ ные прокариотические и эукариотические клетки, выполняющие роль матричных биосенсоров для параллельного определения различных веществ (антибиотиков, токсинов, ксенобиотиков и др. ). Биочипы-детекторы – это фиксированные на твердой поверхности фрагменты ДНК зондов с прикрепленными к ним микроскопическими частицами золота, которые применяются для идентификации патогенных микроорганизмов. Белковые микрочипы - это фиксированные на плотной поверхности протеины или аминокислоты, позволяющие идентифицировать вещества белковой природы. 71 27
 БИОЧИПЫ 72
БИОЧИПЫ 72
 2. Миниатюризованные микролаборатории объединяют в себе свойства микроматриц и микролабораторий. Микрочиповый ПЦР анализатор Постановка ПЦР в режиме Real-Time (ПЦР-РВ) в микрореакторах стеклянно-кремниевых ПЦРмикрочипов Анализ продуктов амплификации в агарозном геле (просмотр геля в люминесцентном трансиллюминаторе) 73 28
2. Миниатюризованные микролаборатории объединяют в себе свойства микроматриц и микролабораторий. Микрочиповый ПЦР анализатор Постановка ПЦР в режиме Real-Time (ПЦР-РВ) в микрореакторах стеклянно-кремниевых ПЦРмикрочипов Анализ продуктов амплификации в агарозном геле (просмотр геля в люминесцентном трансиллюминаторе) 73 28
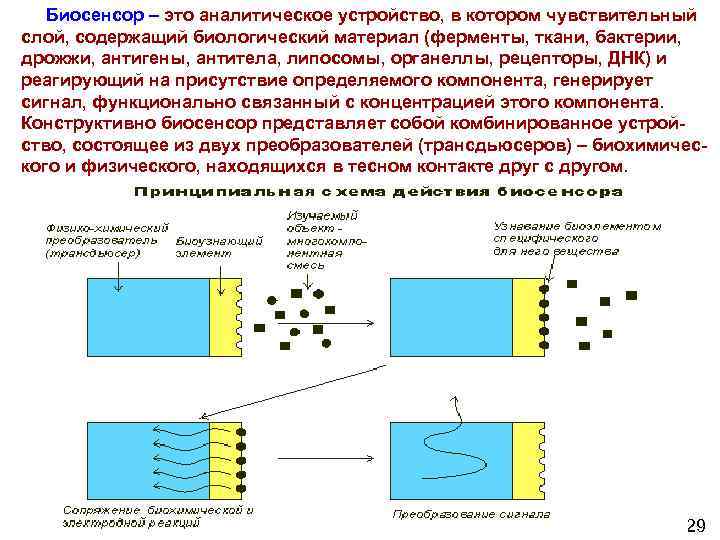 Биосенсор – это аналитическое устройство, в котором чувствительный слой, содержащий биологический материал (ферменты, ткани, бактерии, дрожжи, антигены, антитела, липосомы, органеллы, рецепторы, ДНК) и реагирующий на присутствие определяемого компонента, генерирует сигнал, функционально связанный с концентрацией этого компонента. Конструктивно биосенсор представляет собой комбинированное устрой ство, состоящее из двух преобразователей (трансдьюсеров) – биохимичес кого и физического, находящихся в тесном контакте друг с другом. 74 29
Биосенсор – это аналитическое устройство, в котором чувствительный слой, содержащий биологический материал (ферменты, ткани, бактерии, дрожжи, антигены, антитела, липосомы, органеллы, рецепторы, ДНК) и реагирующий на присутствие определяемого компонента, генерирует сигнал, функционально связанный с концентрацией этого компонента. Конструктивно биосенсор представляет собой комбинированное устрой ство, состоящее из двух преобразователей (трансдьюсеров) – биохимичес кого и физического, находящихся в тесном контакте друг с другом. 74 29
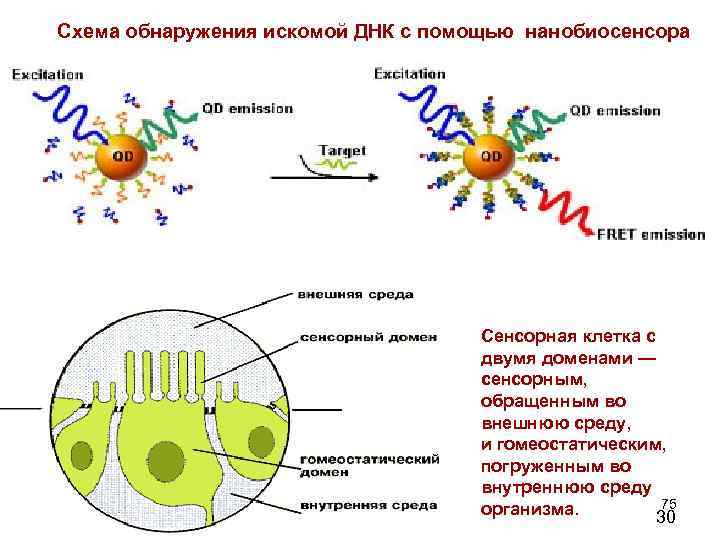 Схема обнаружения искомой ДНК с помощью нанобиосенсора Сенсорная клетка с двумя доменами — сенсорным, обращенным во внешнюю среду, и гомеостатическим, погруженным во внутреннюю среду 75 организма. 30
Схема обнаружения искомой ДНК с помощью нанобиосенсора Сенсорная клетка с двумя доменами — сенсорным, обращенным во внешнюю среду, и гомеостатическим, погруженным во внутреннюю среду 75 организма. 30
 Нанотехнология – это технология производства объектов, веществ, молекул, изделий размером от 1 до 100 нм и этот размер существен для функций квалифицируемого изделия. Области применения нанотехнологий в медицине и ветеринарии: §лазеры, фотодетекторы, различные сенсоры; §устройства сверхплотной записи информации; §молекулярные электронные устройства; §молекулярные моторы и наномоторы, нанороботы; §нанохимия и катализ, в т. ч. , электрохимия и фармацевтика; §устройства контроля состояния окружающей среды; §целевая доставка лекарств и протеинов; §биополимеры и заживление биологических тканей; §клиническая и медицинская диагностика; § создание искусственных мускулов, костей, имплантация живых органов; §биомеханика, биоинформатика; §геномика; §биоинструментарий; §регистрация и идентификация канцерогенных тканей, патогенов и биологически вредных агентов; §безопасность в сельском хозяйстве и производстве пищевых продуктов. 76
Нанотехнология – это технология производства объектов, веществ, молекул, изделий размером от 1 до 100 нм и этот размер существен для функций квалифицируемого изделия. Области применения нанотехнологий в медицине и ветеринарии: §лазеры, фотодетекторы, различные сенсоры; §устройства сверхплотной записи информации; §молекулярные электронные устройства; §молекулярные моторы и наномоторы, нанороботы; §нанохимия и катализ, в т. ч. , электрохимия и фармацевтика; §устройства контроля состояния окружающей среды; §целевая доставка лекарств и протеинов; §биополимеры и заживление биологических тканей; §клиническая и медицинская диагностика; § создание искусственных мускулов, костей, имплантация живых органов; §биомеханика, биоинформатика; §геномика; §биоинструментарий; §регистрация и идентификация канцерогенных тканей, патогенов и биологически вредных агентов; §безопасность в сельском хозяйстве и производстве пищевых продуктов. 76
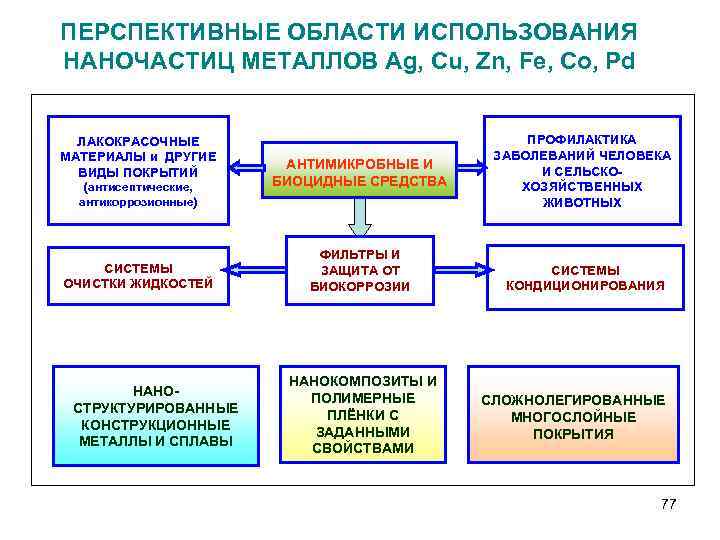 ПЕРСПЕКТИВНЫЕ ОБЛАСТИ ИСПОЛЬЗОВАНИЯ НАНОЧАСТИЦ МЕТАЛЛОВ Ag, Cu, Zn, Fe, Co, Pd ЛАКОКРАСОЧНЫЕ МАТЕРИАЛЫ и ДРУГИЕ ВИДЫ ПОКРЫТИЙ (антисептические, антикоррозионные) СИСТЕМЫ ОЧИСТКИ ЖИДКОСТЕЙ НАНО СТРУКТУРИРОВАННЫЕ КОНСТРУКЦИОННЫЕ МЕТАЛЛЫ И СПЛАВЫ АНТИМИКРОБНЫЕ И БИОЦИДНЫЕ СРЕДСТВА ФИЛЬТРЫ И ЗАЩИТА ОТ БИОКОРРОЗИИ НАНОКОМПОЗИТЫ И ПОЛИМЕРНЫЕ ПЛЁНКИ С ЗАДАННЫМИ СВОЙСТВАМИ ПРОФИЛАКТИКА ЗАБОЛЕВАНИЙ ЧЕЛОВЕКА И СЕЛЬСКО ХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ СИСТЕМЫ КОНДИЦИОНИРОВАНИЯ СЛОЖНОЛЕГИРОВАННЫЕ МНОГОСЛОЙНЫЕ ПОКРЫТИЯ 77
ПЕРСПЕКТИВНЫЕ ОБЛАСТИ ИСПОЛЬЗОВАНИЯ НАНОЧАСТИЦ МЕТАЛЛОВ Ag, Cu, Zn, Fe, Co, Pd ЛАКОКРАСОЧНЫЕ МАТЕРИАЛЫ и ДРУГИЕ ВИДЫ ПОКРЫТИЙ (антисептические, антикоррозионные) СИСТЕМЫ ОЧИСТКИ ЖИДКОСТЕЙ НАНО СТРУКТУРИРОВАННЫЕ КОНСТРУКЦИОННЫЕ МЕТАЛЛЫ И СПЛАВЫ АНТИМИКРОБНЫЕ И БИОЦИДНЫЕ СРЕДСТВА ФИЛЬТРЫ И ЗАЩИТА ОТ БИОКОРРОЗИИ НАНОКОМПОЗИТЫ И ПОЛИМЕРНЫЕ ПЛЁНКИ С ЗАДАННЫМИ СВОЙСТВАМИ ПРОФИЛАКТИКА ЗАБОЛЕВАНИЙ ЧЕЛОВЕКА И СЕЛЬСКО ХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ СИСТЕМЫ КОНДИЦИОНИРОВАНИЯ СЛОЖНОЛЕГИРОВАННЫЕ МНОГОСЛОЙНЫЕ ПОКРЫТИЯ 77
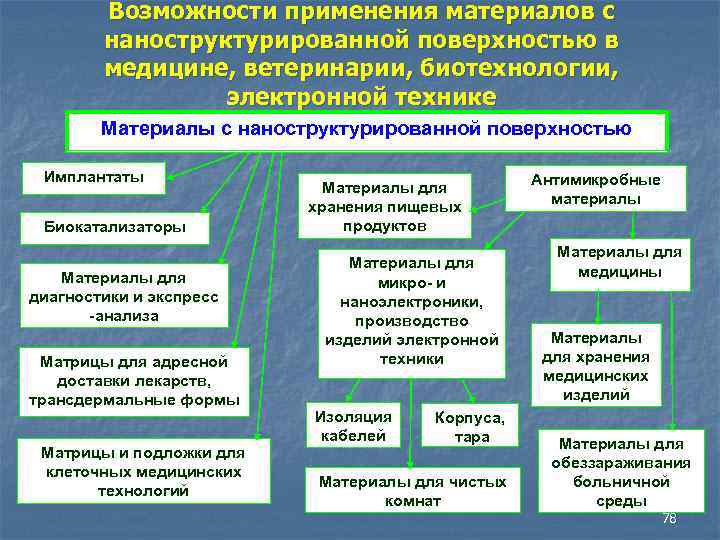 Возможности применения материалов с наноструктурированной поверхностью в медицине, ветеринарии, биотехнологии, электронной технике Материалы с наноструктурированной поверхностью Имплантаты Биокатализаторы Maтериалы для диагностики и экспресс анализа Maтрицы для адресной доставки лекарств, трансдермальные формы Maтрицы и подложки для клеточных медицинских технологий Maтериалы для хранения пищевых продуктов Материалы для микро и наноэлектроники, производство изделий электронной техники Изоляция кабелей Корпуса, тара Материалы для чистых комнат Антимикробные материалы Материалы для медицины Maтериалы для хранения медицинских изделий Материалы для обеззараживания больничной среды 78
Возможности применения материалов с наноструктурированной поверхностью в медицине, ветеринарии, биотехнологии, электронной технике Материалы с наноструктурированной поверхностью Имплантаты Биокатализаторы Maтериалы для диагностики и экспресс анализа Maтрицы для адресной доставки лекарств, трансдермальные формы Maтрицы и подложки для клеточных медицинских технологий Maтериалы для хранения пищевых продуктов Материалы для микро и наноэлектроники, производство изделий электронной техники Изоляция кабелей Корпуса, тара Материалы для чистых комнат Антимикробные материалы Материалы для медицины Maтериалы для хранения медицинских изделий Материалы для обеззараживания больничной среды 78
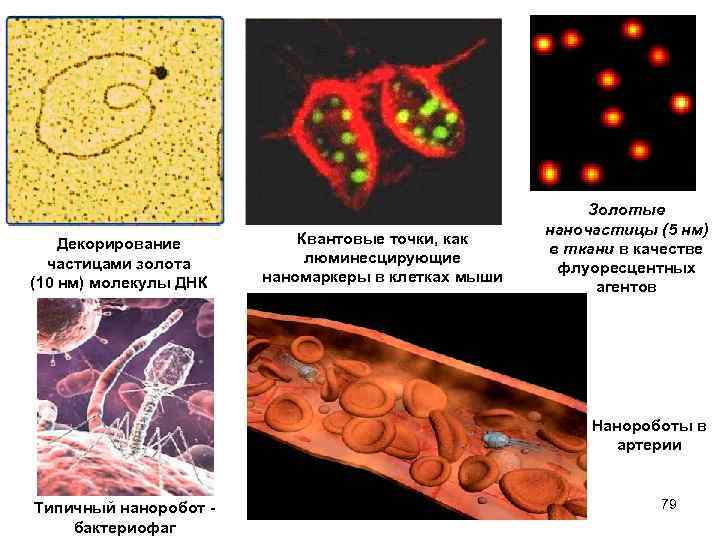 Декорирование частицами золота (10 нм) молекулы ДНК Квантовые точки, как люминесцирующие наномаркеры в клетках мыши Золотые наночастицы (5 нм) в ткани в качестве флуоресцентных агентов Нанороботы в артерии Типичный наноробот бактериофаг 79
Декорирование частицами золота (10 нм) молекулы ДНК Квантовые точки, как люминесцирующие наномаркеры в клетках мыши Золотые наночастицы (5 нм) в ткани в качестве флуоресцентных агентов Нанороботы в артерии Типичный наноробот бактериофаг 79
 Наноробот 80
Наноробот 80
 Наночастицы в биологических системах ГАП (5, 5%) + бактерии рода Streptococcus (25 о. С) 81
Наночастицы в биологических системах ГАП (5, 5%) + бактерии рода Streptococcus (25 о. С) 81
 Нанокомпозиты на основе бактериальной целлюлозы для медицины и ветеринарии Биосовместимость, прочность, способность абсорбировать 1: 100 Раневые и ожоговые покрытия, искусственный хрящ. 82
Нанокомпозиты на основе бактериальной целлюлозы для медицины и ветеринарии Биосовместимость, прочность, способность абсорбировать 1: 100 Раневые и ожоговые покрытия, искусственный хрящ. 82
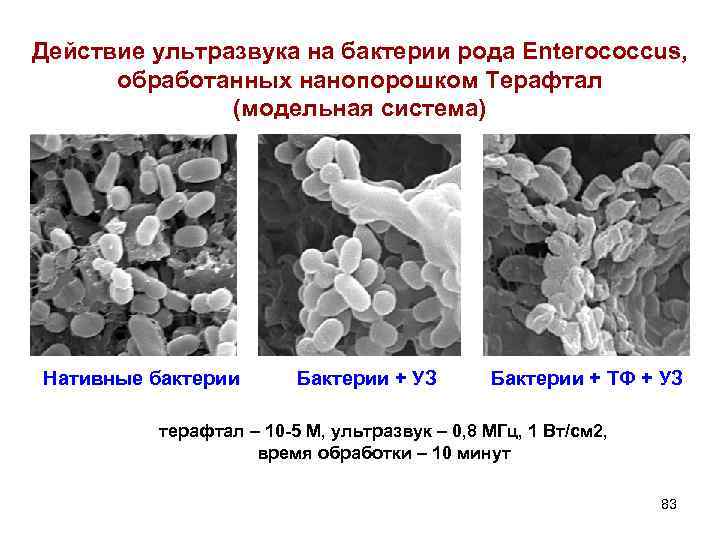 Действие ультразвука на бактерии рода Enterococcus, обработанных нанопорошком Терафтал (модельная система) Нативные бактерии Бактерии + УЗ Бактерии + ТФ + УЗ терафтал – 10 5 М, ультразвук – 0, 8 МГц, 1 Вт/см 2, время обработки – 10 минут 83
Действие ультразвука на бактерии рода Enterococcus, обработанных нанопорошком Терафтал (модельная система) Нативные бактерии Бактерии + УЗ Бактерии + ТФ + УЗ терафтал – 10 5 М, ультразвук – 0, 8 МГц, 1 Вт/см 2, время обработки – 10 минут 83
 Внедренные в биологическое производство за последние 15 20 лет препараты позволили на минимальном уровне решать проблему лабораторной диагностики инфекционных болезней животных. Однако в новых условиях, при возросших запросах практики имеющийся набор и качество диагностических препаратов не могут удовлетворить ветеринарную службу. Решение проблемы, наметившейся в миро вой практике и в нашей стране, видится в создании диагностикумов нового поколения, которые позволят быстро обнаруживать и точно типировать возбудителей инфекций или специфические антитела в организме 84 животных.
Внедренные в биологическое производство за последние 15 20 лет препараты позволили на минимальном уровне решать проблему лабораторной диагностики инфекционных болезней животных. Однако в новых условиях, при возросших запросах практики имеющийся набор и качество диагностических препаратов не могут удовлетворить ветеринарную службу. Решение проблемы, наметившейся в миро вой практике и в нашей стране, видится в создании диагностикумов нового поколения, которые позволят быстро обнаруживать и точно типировать возбудителей инфекций или специфические антитела в организме 84 животных.


